El tumor filoide (TF) es una neoplasia fibroepitelial con una baja incidencia a nivel mundial, lo que limita el poder contar con estudios prospectivos acerca de su abordaje diagnóstico y terapéutico. Se hace una revisión actualizada de su presentación, diagnóstico y tratamiento. Con las características histopatológicas disponibles actualmente se puede subdividir el TF en: de histología benigna, limítrofe y maligna. Esta subclasificación permite establecer el abordaje quirúrgico, que es la base del manejo terapéutico, la indicación de terapias adyuvantes, y finalmente establecer el pronóstico de la paciente.
Phyllodes tumour is a fibroepithelial neoplasm of the breast, with a low world incidence, and with few prospective trials on its diagnosis and treatment. A review is presented of the available world medical literature on this topic. Phyllodes tumours can currently be classified as benign, borderline and malign. This classification helps to determine the surgical treatment, which is the cornerstone of the treatment of Phyllodes tumour, as well as the adjuvant treatment, and finally it helps to determine the patient's prognosis.
La primera descripción fue hecha por Johannes Müller en 1838, quien lo denominó Cystosarcoma Phyllodes. Inicialmente fue considerado un tumor benigno, hasta que fueron reportados casos de metástasis en 19311. Recibió múltiples denominaciones, hasta que en 1981 la OMS las acuñó con el nombre de tumor filoide (TF), término que se debe acompañar del adjetivo que denota su comportamiento, basado en sus características histológicas: benigno, limítrofe (“borderline”) o maligno1–4; siendo el de histología benigna, el más frecuente y de mejor curso clínico y pronóstico4.
El término “Phyllodes” (derivado de la palabra griega phullon, que significa hoja) le fue dado por la apariencia que típicamente muestran sus proyecciones papilares al estudio histopatológico, lo que explica su apariencia agrietada3–5. Al igual que el fibroadenoma, es un tumor fibroepitelial de la mama, con características bifásicas, por la presencia de un componente epitelial y un componente estromal, de predominio fusocelular5, diferenciándose entre sí por algunas características histopatológicas4,5. Asimismo, el componente epitelial del TF permite diferenciarlo de los sarcomas estromales6.
Tiene un comportamiento biológico amplio, pudiendo comportarse de forma poco agresiva cuando sus características histopatológicas son benignas; hasta llegar a comportarse como un tumor capaz de hacer metástasis a distancia cuando posee rasgos de sarcoma en su histopatología3.
Estrategia de búsquedaSe realizó una búsqueda en la bases de datos de Pubmed y Lilacs con los términos MeSH y DeCS anotados previamente. Aceptando artículos de revisión, reportes de caso, series de casos y ensayos clínicos, la búsqueda se limitó a artículos publicados en idioma inglés, español y portugués. No se incluyeron artículos que solo tenían reporte del abstract, sea un poster o estudios en desarrollo. No hubo restricción en cuanto al año de publicación de los artículos.
EpidemiologíaLa frecuencia del TF es rara, representando el 0,3 al 1,0% de todos los tumores primarios de la mama5,7, y el 2,5% de los tumores fibroepiteliales de la misma1,4. La incidencia del TF de histología maligna es de 2,1 por 1 millón de mujeres6.
En Colombia, Rodríguez y Gutiérrez describieron la experiencia con 146 pacientes con diagnóstico de TF en el Instituto Nacional de Cancerología durante 10 años, correspondiendo al 3,6% de todos los tumores de la mama tratados en este centro de remisión nacional; presentándose con más frecuencia en la quinta década de la vida. Con una tasa de recurrencia del 13%, la supervivencia libre de enfermedad a 5 años dependió del tipo histológico, siendo del 94% en los tumores de histología benigna, 80% en los tumores de histología limítrofe y del 70% en tumores de histología maligna1.
Existe un riesgo 3 a 4 veces mayor de desarrollar un TF entre mujeres asiáticas y latinas6,8. La edad promedio, al momento del diagnóstico es de 40 años, con un rango entre los 14 y 82 años, y reportes de casos desde los 11 años de edad9,10. En general el TF de histología maligna es diagnosticado en pacientes de mayor edad1,6 siendo raro en menores de 40 años11.
En relación con la etiología, se han planteado varias hipótesis, algunas explicando su origen en factores higiénicos, otras en el contagio con agentes infecciosos6 y otras en asociación con la mutación del MED12, una subunidad del complejo mediador de la transcripción12. Sin embargo, no se ha podido comprobar ninguna de ellas. Actualmente se considera que no existen factores etiológicos predisponentes, con excepción del síndrome de Li-Fraumeni, que se asocia al desarrollo de múltiples tumores, entre ellos los tumores de la mama13,14.
Presentación clínicaClásicamente, el TF se presenta como una gran masa mamaria, de superficie suave, macrolobulada, bien definida, de consistencia firme móvil, y no dolorosa, mostrando frecuentemente una piel suprayacente, brillante, estirada y con vasos venosos dilatados. El patrón de crecimiento es lento al inicio, y luego acelerado, lo que usualmente motiva la consulta. Puede alcanzar tamaños de hasta 41cm, con un promedio de 4 a 7cm, momento en el cual se percibe a la palpación y a la observación. Es poco frecuente la retracción del pezón, la multifocalidad, la ulceración, la fijación a la pared torácica, el compromiso axilar y el compromiso de la mama contralateral3,15,16. Las adenopatías palpables se encuentran en el 44% de las pacientes con TF, siendo todas ellas inflamatorias, pues no se detectan metástasis a los ganglios axilares en la patología1.
DiagnósticoEn el abordaje diagnóstico inicial con mamografía, el TF aparece como una masa de contornos bien definidos, macrolobulada, que semeja a un fibroadenoma. Así mismo, presenta características similares en la evaluación con ecografía mamaria, apareciendo como un nódulo o masa sólida e hipoecoica3. Los TF de histología limítrofe y maligna, no tienen características patognomónicas en la mamografía ni en la ecografía, que permitan su diferenciación, por medio de estas técnicas17. En series de casos publicadas, se ha encontrado que la evaluación con resonancia magnética podría distinguir los TF de histología limítrofe y maligna, identificando en ellas septos con baja señal interna y patrones similares a un sedimento, en las secuencias T2 perfeccionadas18.
La resonancia magnética permite distinguir algunas características que diferencian un fibroadenoma de un TF, tales como la presencia de un componente quístico, lobulaciones marcadas y la heterogeneidad en la fase tardía en las secuencias T1WI contrastadas perfeccionadas19.
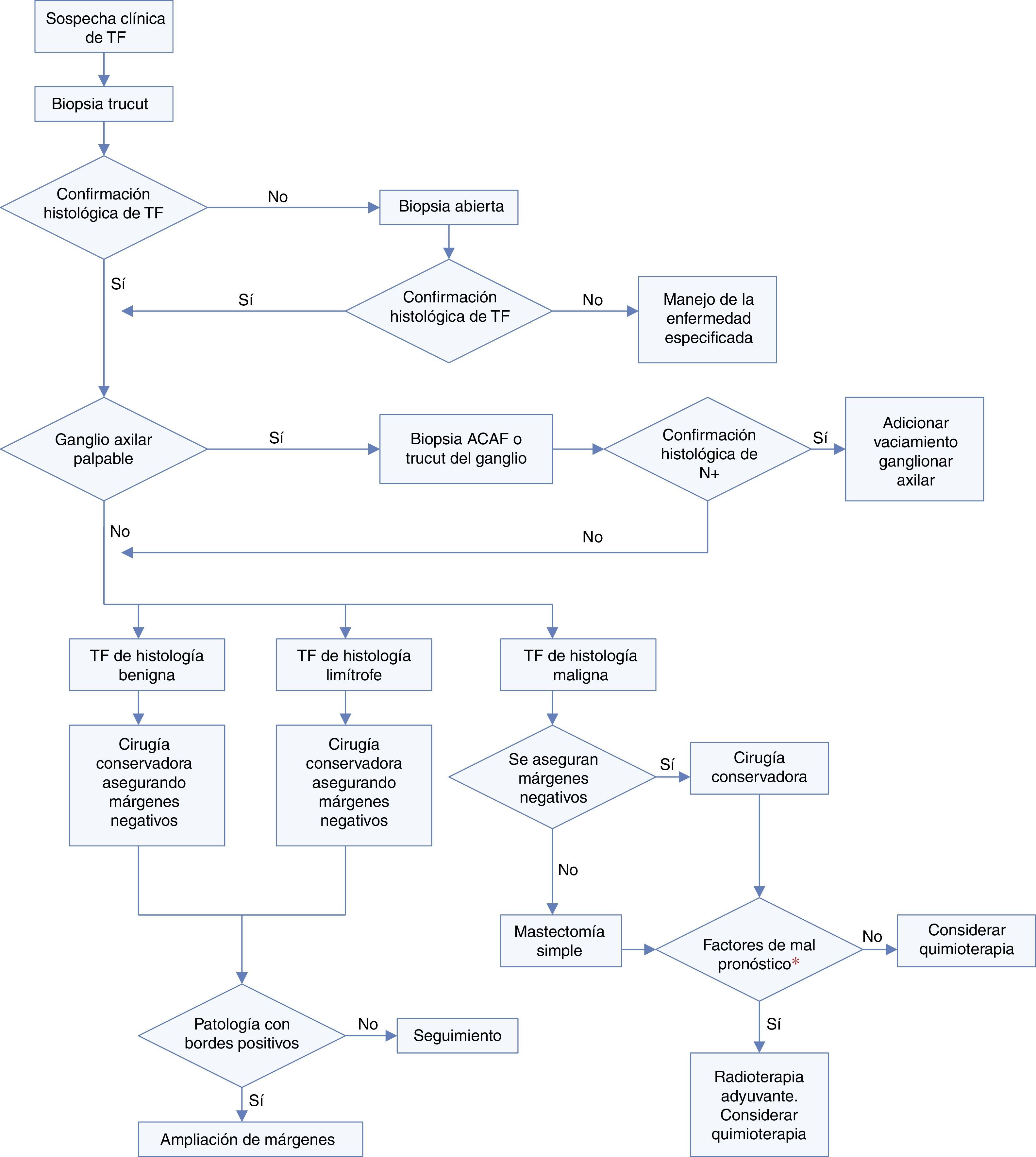
El diagnóstico se confirma por medio de la biopsia con aguja gruesa (trucut), la cual tiene una sensibilidad del 63%20, con falsos negativos reportados hasta en un 39% de los casos21; obteniendo una mejoría en la sensibilidad hasta del 76% al combinar estudios citohistológicos e imaginológicos7,20,22. Ocasionalmente en las muestras obtenidas en la biopsia por trucut, no se observa el patrón bifásico característico de la lesión, lo que puede plantear la posibilidad de un carcinoma pobremente diferenciado u otros sarcomas. En estos casos, la inmunohistoquímica sería parcialmente útil, como con el uso de citoqueratinas que se esperan sean positivas en el carcinoma sarcomatoide, o la positividad específica para cada uno de los sarcomas como en el caso de la desmina y la miogenina en los rabdomiosarcomas, del EMA, BCL-2 y CD99 en el sarcoma sinovial, y del S100 y p16 en los liposarcomas.
Cuando persiste la sospecha clínica, a pesar de una biopsia que muestra un fibroadenoma o con patología equívoca para TF, se recomienda una biopsia escisional para el estudio completo del espécimen21.
Las características macroscópicas del espécimen quirúrgico corresponden a una masa protuberante, bien circunscrita, lobulada, de color blanco-grisáceo, con una pseudocápsula, a través de la cual pueden protruir lengüetas de estroma hacia el tejido mamario adyacente. Al corte se aprecia una superficie de color rosado grisáceo, de aspecto mucoide y con áreas de hemorragia y necrosis, especialmente en los tumores de gran tamaño3,4.
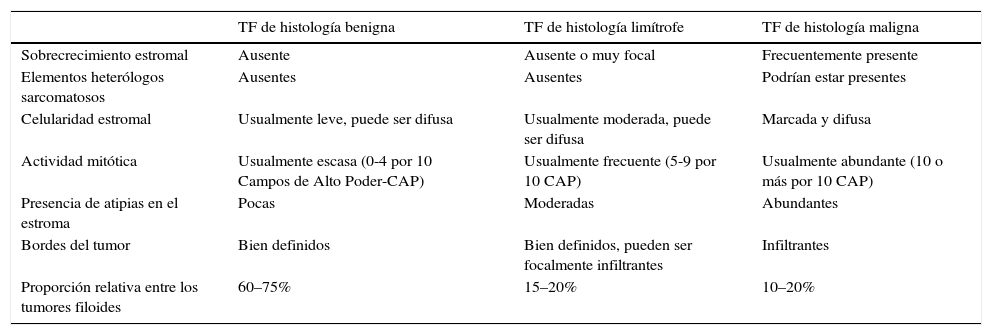
Histológicamente, su morfología corresponde a un tumor bifásico (epitelial y estromal) que plantea la posibilidad de un fibroadenoma versus un TF. El fibroadenoma es una lesión circunscrita, hipocelular en su estroma y sin elementos heterólogos, que una vez se descarta histológicamente, se puede proceder a subclasificar el TF en 3 subgrupos: TF de histologías Benigna, Limítrofe y Maligna4. La asignación a cada uno de estos subgrupos se basa en la evaluación semicuantitativa de las características histológicas del componente estromal, tales como el sobrecrecimiento estromal, presencia de elementos histológicos heterólogos sarcomatosos, hipercelularidad estromal, conteo mitótico, presencia de atipias en el estroma y regularidad de los bordes del tumor23,24. De los anteriores, el sobrecrecimiento estromal difuso o la presencia de elementos heterólogos (sarcomatosos), son características que de forma independiente hacen el diagnóstico de TF de histología maligna24. Si bien la suma de estos criterios ayuda a subdividir estas neoplasias, es claro que es casi imposible predecir con certeza el comportamiento biológico de estas neoplasias con base exclusivamente en la histopatología, de allí que se utilicen los términos de “Tumor filoide de histología benigna, limítrofe y maligna” (tabla 1).
Principales características histológicas de los 3 subgrupos del (TF)
| TF de histología benigna | TF de histología limítrofe | TF de histología maligna | |
|---|---|---|---|
| Sobrecrecimiento estromal | Ausente | Ausente o muy focal | Frecuentemente presente |
| Elementos heterólogos sarcomatosos | Ausentes | Ausentes | Podrían estar presentes |
| Celularidad estromal | Usualmente leve, puede ser difusa | Usualmente moderada, puede ser difusa | Marcada y difusa |
| Actividad mitótica | Usualmente escasa (0-4 por 10 Campos de Alto Poder-CAP) | Usualmente frecuente (5-9 por 10 CAP) | Usualmente abundante (10 o más por 10 CAP) |
| Presencia de atipias en el estroma | Pocas | Moderadas | Abundantes |
| Bordes del tumor | Bien definidos | Bien definidos, pueden ser focalmente infiltrantes | Infiltrantes |
| Proporción relativa entre los tumores filoides | 60–75% | 15–20% | 10–20% |
Fuente: Modificado de Tan P.H., Tse G., Lee A., Simpon J.F. y Hanby A.M. Fibroepithelial Tumours en Lakhani S.R, Ellis I.O., Schnitt S.J., Tan P.H., van de Vijver M.J. WHO Classification of tumors of the Breast. IARC: Lyon 2012.
Existen marcadores de inmunohistoquímica relacionados con el pronóstico, dentro de los cuales se destacan el p53, Ki67, CD117, EGFR, VEGF, p16, pRb, HOXB13 y los marcadores de densidad microvascular; sin embargo, ninguno ha probado su utilidad clínica aún24.
La coexistencia de carcinoma ductal dentro de un TF es infrecuente. Existen pocos reportes de casos, en los que incidentalmente se encuentran focos de carcinoma ductal in situ o invasivo dentro del TF resecado, con el potencial de comprometer los ganglios linfáticos de la axila25,26.
El TF de histología limítrofe y maligna presentan compromiso pulmonar con mayor frecuencia, por lo que se recomienda su estudio con TAC torácico, que además es útil en la planeación quirúrgica; el compromiso hepático es poco frecuente, por lo que no se recomienda su estudio de manera rutinaria.
Tratamiento quirúrgicoTumor filoide benignoEl principal objetivo del tratamiento quirúrgico es aumentar el control local de la enfermedad, la supervivencia libre de recaída, libre de enfermedad y la supervivencia global27–31.
El pilar del tratamiento del TF de histología benigna es la cirugía conservadora, con una media de tasa de recurrencia local a 5 años del 4,5%. Se reporta en la revisión retrospectiva de 83 artículos que incluyó 5.530 pacientes hecha por el Instituto Oncológico de Milán, en donde a un 95% de las pacientes se les realizó cirugía conservadora con garantía de márgenes quirúrgicos negativos, una tasa de recaída local a 5 años del 8%; siendo menor que el 21% reportado para escisiones locales marginales, sin embargo, en el análisis multivariado no se encontró que el margen quirúrgico fuese predictor de recurrencia en el TF de histología benigna27. La tasa de recurrencia a distancia en esta revisión fue menor al 0,5%27, que discrepa con los resultados de series pequeñas (algunas de 1 a 2 casos, sin criterios claros de benignidad y malignidad) donde reportan porcentajes de recurrencia de un 8% hasta un 33%, y de grandes series como la de Zurrida cuyos reportes no alcanzan el 4% a 7,9%32.
Los periodos libres de enfermedad para este tipo histológico son en promedio de 32 meses27,31,32. Finalmente dada la baja tasa de recurrencia y progresión posterior a un tratamiento conservador, Zurrida recomienda la política de “esperar y mirar”, para tomar mejores decisiones terapéuticas32.
Tumor filoide limítrofeEn este tipo de tumor el tratamiento es quirúrgico29. Ha sido controvertido el tipo de procedimiento ideal, algunos autores planteaban procedimientos radicales, como mastectomías totales. Barth concluyó que procedimientos conservadores (escisiones locales amplias) en tumores con histología limítrofe y maligna confiere un riesgo de recurrencia local tres veces mayor que realizar una mastectomía; sin embargo, no reporta que el tipo de procedimiento quirúrgico impacte significativamente en la supervivencia global33,34. El concepto conservador ha evolucionado; Asoglu reportó que el tipo de cirugía no es marcador pronóstico para recurrencia local, a distancia ni para supervivencia global en TF (con una p=0,599), en su seguimiento a 91 meses, de un grupo de tumores de histología limítrofe35.
Igualmente el Mayo Clinic reportó una serie de casos de 67 pacientes con TF sometidos a tratamiento quirúrgico (15 de histología limítrofe y 52 de histología maligna), a 27 se les realizó escisión local amplia con margen >1cm, a 5 similar procedimiento con márgenes <1cm, y los restantes mastectomía (11% con histología limítrofe). La tasa de recurrencia local a 5 años fue del 25% para escisión local amplia y 23% para mastectomía (p=0,84). La tasa de recurrencia local en escisión local amplia con margen >1cm fue 22% vs. 40% con margen <1cm (p=0,41). La supervivencia libre de enfermedad a 5 años no mostró diferencia significativa entre escisión local amplia vs. mastectomía. La supervivencia específica por cáncer es significativamente peor en pacientes con mastectomía que en cirugía conservadora (HR=3,86), debido a las características de mal pronóstico de los tumores llevados a mastectomía. La amplitud del margen en procedimientos conservadores no impacta significativamente la supervivencia libre de enfermedad ni la supervivencia específica por cáncer a 5 años33.
Está descrita la seguridad de llevar a cabo tratamientos conservadores mediante escisiones locales. Actualmente no es clara la amplitud del margen quirúrgico en cirugía conservadora en este tipo de tumores.
Tumor filoide malignoEl tratamiento estándar de los tumores con histología maligna es la cirugía29. Anteriormente el manejo consistía en cirugías radicales como mastectomía simple o radical modificada, logrando tasas libres de enfermedad a 5 años de hasta 95,5% y periodos libres de recurrencia local del 96,3%36,37; sin embargo, con el paso del tiempo se han contemplado los tratamientos conservadores, con resultados equivalentes a la cirugía radical.
Series de casos comparan cirugía conservadora versus mastectomía en TF maligno; el Centro Oncológico de Krakow reportó 70 casos de TF maligno, 51,4% tratados con cirugía conservadora (adicionando radioterapia sí margen negativo <1cm) y 48,6% con mastectomía. La tasa de supervivencia libre de enfermedad a 5 años fue del 82,3% en mastectomía versus 83,3% en cirugía conservadora con radioterapia o sin esta38. En el Instituto Oncológico de Milán, las pacientes con TF maligno manejadas con cirugía conservadora tuvieron una tasa de recurrencia local del 13%, a distancia del 6,5% y una supervivencia global específica a 10 años del 92%27. De forma similar, Macdonald et al. reportó 821 mujeres con TF maligno del programa SEER manejadas con mastectomía versus cirugía conservadora, encontrando mejores resultados con el tratamiento conservador, con tasas de supervivencia específica por cáncer a 5 años del 91%39.
Actualmente, la cirugía conservadora con márgenes negativos garantiza el control local, algunos autores sugieren márgenes negativos de 1cm, basados en la gran capacidad de recaída local y el potencial de transformación maligna y sobrecrecimiento sarcomatoso de estos tumores27,40. Con márgenes de 1cm la tasa de recaída a 5 años se reporta en 36%, que contrastan con el 69% en escisiones locales sin márgenes negativos27. Sin embargo, Krakow propone la radioterapia adyuvante al no garantizar márgenes negativos de 1cm, con mejoría en las tasas de recurrencia local40.
En tumores >10cm, con mala relación seno–tumor y sin garantía de márgenes negativos, se indica la mastectomía simple sin vaciamiento axilar; con tasas de recurrencia local reportadas entre 5% al 12%40,41.
El compromiso axilar en el TF es menor al 5%, por tanto la estadificación axilar de manera electiva no es recomendada de rutina27. Si existen adenopatías al examen clínico, se recomienda estudio histopatológico previo al tratamiento quirúrgico axilar con biopsia ACAF o trucut, donde un alto porcentaje de estas adenopatías son por procesos inflamatorios42.
RadioterapiaEl uso y el beneficio de la radioterapia dentro del manejo convencional del TF es incierto debido a las pequeñas cohortes utilizadas para los estudios42. Reportes de casos muestran uso de la radioterapia en recurrencias locales, en pared torácica, metástasis sintomáticas y en la adyuvancia del TF maligno, pero con resultados heterogéneos con periodos libres de enfermedad que oscilan entre 5 a 84 meses27. Su uso se basa en los resultados obtenidos en pacientes con sarcomas de tejidos blandos42. Chaney et al. reportan el uso de radioterapia adyuvante (dosis de 50-60Gy) en tumores malignos con márgenes negativos <0,5 cm, en tumores >10cm y posterior a resecciones de recaídas locales43. Barth reporta tasas de recurrencia del 0% en tumores limítrofes y malignos que recibieron radioterapia adyuvante34. Chaney et al. reportan tasas de recurrencia local del 9-13%, siendo mayor en márgenes positivos o desconocidos, demostrando la utilidad de la radioterapia solo en márgenes quirúrgicos negativos43. La Universidad de Chicago analizó 3.120 pacientes con TF maligno, tratadas con cirugía conservadora (57%) o mastectomía (42%), con radioterapia adyuvante en el 14,3% de las pacientes, mostrando tasas de recurrencia general del 14% y local del 5,9%, sin impacto en supervivencia libre de enfermedad ni supervivencia global44. El periodo libre de recurrencia mejoró de 14 a 25 meses para la cirugía conservadora, mas no para la mastectomía. La supervivencia libre de enfermedad a 5 años es significativamente mejor cuando el tratamiento es cirugía conservadora con radioterapia versus sin radioterapia o mastectomía (p=0,006)44,45. En cuanto a supervivencia global, no existe diferencia significativa entre los tres procedimientos44, similar a lo reportado por el grupo oncológico de Milán donde la radioterapia adyuvante no impactó en supervivencia libre de metástasis a distancia y global27.
No obstante, el uso de radioterapia adyuvante en TF ha aumentado. Se reportó un uso del 9,5% en el periodo de 1998-1999, que contrasta con un 19,5% en el periodo 2008-2009, siendo este aumento significativo (p=0,0001)27,36,44.
Existe una falta de consenso en el mundo sobre el uso de la radioterapia adyuvante en TF. Actualmente está indicada en TF malignos asociado a algún factor de mal pronóstico como tamaño tumoral >10cm con cirugía conservadora, compromiso ganglionar, y en las recaídas locales. En márgenes quirúrgicos positivos no es clara su utilidad. Su uso muestra beneficio en supervivencia libre de enfermedad a 5 años, mas no en supervivencia global27.
QuimioterapiaSu uso y beneficio se basa en los resultados de la quimioterapia en el manejo de sarcomas36. Se describen diferentes esquemas como: ifosfamida monoagente o con doxorrubicina, cisplatino con doxorrubicina y etopósido o FEC37. Su mayor utilidad se describe en TF Maligno, en algunas series con resultados poco alentadores en mortalidad y progresión de la enfermedad, que contrasta con otras cohortes en que su uso logró prevenir el desarrollo de metástasis a distancia con respuesta completa del primario a los 20 a 61 meses, pero en TF malignos de tamaño pequeño37,43,46. El estudio más significativo no mostró impacto en la tasa de supervivencia libre de enfermedad a 5 años para quimioterapia adyuvante con doxorrubicina y dacarbazina, con respecto a quienes no la recibieron47. Su limitado uso se describe en el escenario de enfermedad metastásica pulmonar, abdominal y en recurrencia local42. Hasta la fecha sigue sin poderse dilucidar cuál es el beneficio real de esta terapia sistémica.
HormonoterapiaUn 20 a 84% de los TF sobreexpresan receptores de estrógenos positivos y casi un 100% expresan receptores de progesterona positivos42. Un estudio multicéntrico de 143 pacientes mostró que la frecuencia de expresión de receptores hormonales es diferente en los tres tipos histológicos: benigno (60,8%), limítrofe (25,9%) y maligno (13,3%), siendo la relación entre la expresión de los receptores hormonales y el grado histológico inversamente proporcional27,48,49. La expresión de receptores hormonales en el 95% de los casos es por el componente epitelial; sin embargo, en un 2,4% esta expresión se da nivel del componente estromal42,48. No es claro cuál es el papel de las terapias anti-hormonales en estos tumores ya que su comportamiento está dado por el componente mesenquimal más que el epitelial42 (fig. 1).
Recurrencia, enfermedad a distancia y supervivencia globalTumor filoide benignoEs el tipo histológico de TF con comportamiento más favorable, la tasa libre de enfermedad a 5 años posterior al tratamiento primario es hasta del 95%, la tasa de recurrencia local a 5 años de hasta un 4,3% y de enfermedad a distancia hasta de un 1,2%41,49,50. El tratamiento quirúrgico inicialmente planeado debe ser conservador, con intención curativa, la tasa de recurrencia local posterior a realizar una escisión local marginal es del 14 al 21%, para una escisión local amplia de un 0 - 6% y para una mastectomía de un 0%35. Sin embargo, no se observó un impacto significativo en mortalidad entre los tres procedimientos, con tasas de supervivencia global a 60 meses de hasta el 99% como lo describe Barth34.
Tumor filoide limítrofeLa tasa de recurrencia local a 5 años para el TF limítrofe posterior a tratamiento quirúrgico en general es del 14 al 17%, variando según el tipo de cirugía, siendo para escisiones marginales de hasta un 50%, escisiones locales amplias de 14 a 36,6% y para mastectomía de 8,3%. La tasa de metástasis a distancia es de 11,1%, en donde en el 50% de los casos es precedida de una recurrencia local42,49,50. Debido a su baja incidencia, la mayoría de series de casos se han realizado en conjunto con grupos de tumores de histología maligna, por tanto los marcadores predictivos para recaída y supervivencia global son similares al filoides maligno.
Tumor filoide malignoEl tumor filoide maligno muestra tasas de recurrencia local cercanas al 21% (rango de 12 - 65%) y de metástasis de un 25%42,49,50. En una serie de casos realizada en el Royal Marsden con 322 mujeres con tumor filoide maligno a quienes se realizó cirugía, se analizaron los factores predictivos de recurrencia local y sistémica a 9 años encontrando que los márgenes quirúrgicos positivos y el tamaño de la lesión son fuertes predictores de recurrencia, siendo siete veces mayor la probabilidad de recurrir en tumores >10cm (HR=11,1, p=0,006) y cuatro veces mayor cuando no se garantiza márgenes negativos de enfermedad (HR=4,9, p=0,008)42. Otros factores como celularidad, número de mitosis, crecimiento estromal y tipo de cirugía realizada no han sido estadísticamente significativos en predecir riesgo de recurrencia local42.
La vía hematógena es mediante la cual el TF maligno presenta compromiso metastásico en un 10 a 15% de los casos. Los principales órganos comprometidos son: pulmón (70-80%), pleura (60-70%) y hueso (25 -30%)27,42.
El presentar una recurrencia local da un riesgo del 50% de desarrollar posteriormente enfermedad a distancia (HR=20), en un tiempo promedio de 4 meses (rango de 2 a 60m)42.
La supervivencia global a 5 años descrita en la literatura es de un 54 a 65%, y a 10 años del 23%41. Son el tamaño tumoral y el compromiso positivo de los márgenes por enfermedad, con un HR=2,5 (p=0,001) y HR=4,1 (p=0,003) respectivamente, los principales factores pronóstico para este desenlace42.
En conclusión, considerando la ausencia de estudios prospectivos por la baja incidencia de esta enfermedad, se infiere que la piedra angular del tratamiento del TF se basa en la resección local amplia asegurando márgenes negativos, reservándose la mastectomía simple para los tumores con mala relación seno-tumor, y para los tumores de histología maligna con otros factores de mal pronóstico. El manejo adyuvante con radioterapia, quimioterapia y hormonoterapia, no se contempla dentro del manejo inicial, quedando indicados para los casos de TF de histología maligna, tributario a cirugía conservadora, o tamaño mayor de 10cm o con compromiso ganglionar y en los casos de recurrencia locorregional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónEste trabajo ha sido desarrollado con apoyo financiero del Instituto Nacional de Cancerología E.S.E.