La pandemia por COVID-19 tiene relación con arritmias que ocurren a través de efectos directos en el miocardio o de efectos indirectos por los tratamientos que podrían ser útiles para detener al virus. Esta revisión muestra el mal pronóstico que confiere el antecedente de arritmias o el desarrollo de estas durante el curso de la enfermedad por COVID-19, el efecto proarrítmico de algunos tratamientos y las medidas de prevención y tratamiento en caso de presentar arritmias.
The COVID-19 pandemic has a relationship with arrhythmias that occur through direct effects on the myocardium, or through indirect effects of the treatments that could be used in detaining the virus. In this review, it demonstrates the poor prognosis conferred by having a history of arrhythmias or the development of these during the course of the illness due to COVID-19, the proarrhythmic effect of some treatments, and the prevention measures, and treatment in cases presenting with arrhythmias.
La pandemia relacionada con el coronavirus SARS-CoV-2, conocida como COVID-19, se manifiesta comúnmente con síntomas respiratorios, pero en casos más severos puede llevar a compromiso cardiovascular y multisistémico. A la fecha de escribir esta revisión (junio 29/2020) se han confirmado 10.307.039 casos en el mundo con 506.473 muertes; en Colombia se han diagnosticado 91.995 casos y 3.256 muertes. Pese al infradiagnóstico de la infección, lo cual altera la verdadera mortalidad, ha sido evidente que es una enfermedad capaz de colapsar los sistemas de salud de algunos países.
La avalancha de información relacionada con COVID-19 lleva a la aparición de estudios no revisados por pares, noticias falsas y recomendaciones basadas en ideas no comprobadas que invaden los chats y las redes sociales. De igual manera, al buscar en PubMed el término COVID hay 15.289 publicaciones indexadas, lo cual demuestra el gran interés en el tema. El objetivo de esta revisión de la literatura es presentar la información publicada en cuanto a arritmias y COVID-19, y mostrar su prevalencia y relación con el pronóstico, los posibles riesgos con los tratamientos y manejos recomendados.
Compromiso cardiovascular y COVID-19Se han publicado excelentes revisiones de COVID-19 y compromiso cardiovascular1,2, en las que se incluye una en la Revista Colombiana de Cardiología3. En resumen, algunos síntomas de la infección, como tos, disnea, palpitaciones y dolor torácico, pueden ser confundidos como de origen cardiovascular primario y son importantes para tener en cuenta en el diagnóstico diferencial. Además, tener enfermedades cardiovasculares previas se asocia con cinco veces mayor mortalidad; finalmente, la enfermedad por COVID-19 puede tener compromiso miocárdico, ya sea por miocarditis o isquemia, lo cual ensombrece gravemente el pronóstico.
ArritmiasHay una relación clara de arritmias y severidad de la infección por COVID-19. El desarrollo de lesión miocárdica asociado a COVID-19 no es raro y se relaciona con aparición de arritmias. En una serie de casos de 187 pacientes, aquellos con aumento de troponina T tenían mayor riesgo de arritmias ventriculares malignas que aquellos que no lo tenían (17.3 vs. 1.5%), lo cual sugiere que son un marcador de lesión miocárdica aguda4. En otro estudio de 138 pacientes se documentaron eventos arrítmicos en 23 pacientes (16.7%), y fueron más prevalentes en aquellos que requerían tratamiento en la unidad de cuidado intensivo (44 vs. 7%), dato que plantea que se asocian a severidad de la enfermedad, pese a que no se especificó el tipo de arritmia diagnosticado5.
Es importante anotar que en el estudio de Wang5 hubo más arritmias (16.7%) que lesión miocárdica (7.2%), por lo que es posible que existan otros mecanismos que expliquen la mayor cantidad de eventos. Esto pudiera estar en relación con los efectos proarrítmicos de drogas usadas en el tratamiento de la enfermedad por COVID-19 o con alteraciones en la homeostasis propia de enfermedades agudas graves. La severa reacción inflamatoria observada en algunos pacientes puede, en teoría, favorecer arritmias a través de hiperactividad simpática y por efectos de las interleuquinas (especialmente IL-6) sobre los canales de potasio y en el CYP3A4, que pueden llevar a prolongación de la repolarización6.
Un asunto no menor es el pronóstico de pacientes con arritmias de base que desarrollan COVID-19. Un estudio que incluyó 8.910 pacientes evaluó la mortalidad, y encontró, en un análisis multivariado, que el antecedente de arritmias otorga mayor riesgo (OR 1.95, IC 95% 1.33-2.86)7. Sin embargo, tampoco hay información sobre el tipo de arritmia ni el efecto que cada una muestre sobre este riesgo.
Por otro lado, la relación de la enfermedad por COVID-19 en muerte súbita no se ha evaluado. Una investigación del instituto nacional de salud italiano encontró un aumento inexplicado de los casos de muerte en hogares geriátricos durante la pandemia de COVID-198. De igual manera, un estudio investigó el comportamiento de las muertes en las provincias más afectadas por el virus SARS-CoV-2 en Italia, y encontró que el paro cardiaco extrahospitalario de origen médico, el paro en casa y la incidencia de paro cardiaco no presenciado aumentaron 6.5, 7.3 y 11.3 puntos porcentuales, respectivamente. Además, se evidenció que el resultado de reanimación no exitosa aumentó 14.9%9.
Aunque pueden existir múltiples causas de estos datos, como por ejemplo insuficiencia respiratoria por COVID-19 en pacientes que tardan en consultar, eventos de origen cardiaco o extracardiaco que agudamente amenazan la vida y no consulta a urgencias por miedo al contagio, no se puede descartar una relación directa de COVID-19 y muerte cardiaca súbita.
No se tienen datos sobre qué ocurre con las arritmias de base en pacientes que presentan COVID-19. Dado que hay relación de fibrilación auricular (FA) con sepsis es posible que se exacerben los eventos. De igual forma, ante la infección severa y el aumento en los requerimientos metabólicos, en pacientes con cardiopatía de base pueden aumentar los casos de arritmias ventriculares.
ElectrocardiogramaNo se han descrito cambios electrocardiográficos específicos de COVID-19. Hay reportes de casos que han encontrado patrón transitorio S1Q3T3 y bloqueo AV que se han intentado explicar por sobrecarga aguda del ventrículo derecho e inflamación miocárdica, respectivamente. También se ha reportado supradesnivel del ST, el cual se ha relacionado con miocarditis10. En vista de que la relación más plausible de la lesión miocárdica aguda por COVID-19 sea la miocarditis, se esperaría que sean posibles otras manifestaciones electrocardiográficas, como cambios inespecíficos de la onda T, del ST, del segmento PR y aparición de ondas Q. La escasa información disponible posiblemente está asociada con la dificultad de realizar electrocardiogramas a estos pacientes por el riesgo de diseminación de la infección a través de los electrocardiógrafos y el riesgo para los trabajadores de la salud.
Tratamiento de COVID-19 y riesgo arrítmicoPara el momento del envío de este escrito no se ha demostrado que algún tratamiento modifique sustancialmente la mortalidad o la admisión a unidad de cuidado intensivo de los pacientes con COVID-19; sin embargo, se han propuesto algunos tratamientos con base en resultados in vitro o resultados previos con otros coronavirus. Algunos de ellos pueden tener un efecto proarrítmico.
Hidroxicloroquina/cloroquinaLa hidroxicloroquina y la cloroquina se han postulado como posibles tratamientos para la enfermedad por COVID-19 y son recomendadas por el consenso colombiano de manejo de COVID-19 en establecimientos de salud11. Su utilidad está basada en efectos in vitro al alcalinizar el pH endosomal que lleva a menor glicosilación de los receptores ECA2, requeridos para la entrada del virus a la célula12. Además, la hidroxicloroquina podría atenuar la tormenta de citoquinas observada en casos severos. Estos medicamentos bloquean los canales de potasio hERG/Kv 11.1 y pueden prolongar el QT corregido (QTc). El registro de la FDA (Federal and Drugs Administration) de eventos adversos FAERS (por sus siglas en inglés), que se lleva desde 1964, tiene 344 eventos de prolongación del QTc o taquicardia de puntas torcidas con hidroxicloroquina/cloroquina (con 3.412 muertes en este lapso)13. Este registro tiene el inconveniente de ser alimentado voluntariamente por quienes detectan el evento adverso y no tiene datos sobre prescripciones hechas. En un estudio14 que utilizó este registro, se compararon estos medicamentos con amoxicilina y no se encontraron diferencias estadísticas en el riesgo de prolongación del QTc o desarrollo de taquicardia de puntas torcidas. Sin embargo, no están incluidos pacientes con COVID-19. Por otra parte, también con dichos medicamentos se han descrito eventos de bloqueo de rama, bloqueo AV y miocardiopatía15.
Así mismo, se han publicado varios estudios clínicos de pacientes con COVID-19 tratados con hidroxicloroquina/cloroquina sin resultados alentadores en puntos finales fuertes. Adicionalmente, hay información respecto a riesgo arrítmico. En un estudio de 95 pacientes con COVID-19 tratados con cloroquina se encontró que 23% prolongaron el QTc>500ms, para un alargamiento promedio de 35ms; no se observaron eventos de taquicardia de puntas torcidas16. Otro estudio, que evaluó la utilidad de dosis altas de cloroquina (600mg cada 12 horas por 10 días)17, que era necesaria en estudios in vitro para tener actividad antiviral, fue suspendido en el brazo de altas dosis por aumento en la mortalidad, con incremento del QTc>500ms en 19% de los casos. No se encontraron eventos de taquicardia de puntas torcidas, por lo que la elevación de la mortalidad no parece ser arrítmica, pero contraindica el uso de dosis altas de cloroquina.
La hidroxicloroquina tiene más estudios publicados. En una serie18 se compararon 201 pacientes tratados con hidroxicloroquina (95%)/cloroquina (5%) con 59.2% que recibían azitromicina. No se observó taquicardia de puntas torcidas y aunque hubo prolongación del QTc, más frecuente en aquellos tratados con la combinación de azitromicina, en solo 3.5% se tuvieron que retirar los medicamentos. Posteriormente, han aparecido estudios con resultados menos alentadores. En uno se evaluaron 90 pacientes con COVID-19 que recibían hidroxicloroquina (59% en conjunto con azitromicina)19, 20% desarrollaron prolongación del QTc>500ms o hubo un aumento del QTc>60ms, que fue mayor con el uso de la azitromicina. Como predictores de riesgo se encontraron el uso de diuréticos, QTc basal>450ms y desarrollo de síndrome de respuesta inflamatoria sistémica. Se reportó un caso de taquicardia de puntas torcidas. En otra serie con 40 pacientes en unidad de cuidado intensivo se encontró que el 93% prolongaba el QTc y en 36% era>500ms o con aumento de 60ms20. Recientemente, un registro con 96.032 pacientes hospitalizados con COVID-19 encontró que aquellos tratados con hidroxicloroquina o cloroquina (con o sin macrólidos) tenían mayor mortalidad. Comparado con el grupo control (9.3%), la mortalidad hidroxicloroquina fue casi el doble (18.0% HR 1.33, IC 95% 1.223-1.457), y aumentaba con la combinación con macrólido (23.8% HR 1.447, IC 95% 1.368-1.531). En cuanto a cloroquina también hubo aumento en la mortalidad (cloroquina 16.4% HR 1.365, IC 95% 1.218-1.531) e igualmente aumentaba con el uso de concomitante de macrólido (22.2% HR 1.368, IC 95% 1.273-1.469). Además, el uso de estos medicamentos se asoció a más riesgo de arritmias ventriculares; hidroxicloroquina 6.1% (HR 2.369, IC 95% 1.935-2.9), hidroxicloroquina con macrólido 8.1% (HR 5.106, IC 95% 4.106-5.983), cloroquina 4.3% (HR 3.561, IC 95% 2.760-4.596) y cloroquina con macrólido 6.5% (HR 4.011, IC 95% 3.344-4.812) vs el grupo control 0.3%21. El estudio no evaluó el QTc.
AzitromicinaLos macrólidos han demostrado tener efectos antivirales. La azitromicina en estudios clínicos ha sido útil en infecciones por rinovirus, virus sincitial respiratorio e influenza. Además, se ha encontrado efecto in vitro contra el zika y el ébola. En un estudio pequeño, que incluyó 6 pacientes que recibieron hidroxicloroquina con azitromicina, al sexto día tenían 100% de curación virológica (PCR negativa en muestras nasofaríngeas)22. Se han descrito efectos sobre el QTc, inducción de taquicardia de puntas torcidas y muerte súbita23. Cuando fue evaluada en el registro FAERS14 se encontró que aumentaba el riesgo de prolongación del QTc administrado solo o en combinación con hidroxicloroquina. Actualmente, la guía colombiana no se pronuncia en favor o en contra del uso de azitromicina11 en estos pacientes.
Lopinavir/RitonavirEstos antivirales, utilizados en infección por el virus de la inmunodeficiencia humana, han mostrado actividad in vitro contra los coronavirus SARS-CoV y MERS. Con su uso se han descrito casos de prolongación del QTc, del PR, taquicardia de puntas torcidas y bloqueo AV de segundo y tercer grado15. Un estudio evaluó su utilidad en neumonía severa por COVID-19; se encontró tendencia no significativa de menor mortalidad y falla respiratoria24. No hubo complicaciones arrítmicas y de 99 pacientes solo 1 prolongó el QTc. Las guías colombianas recomiendan su uso en pacientes con neumonía grave11.
RemdesivirIgual que otros medicamentos, el remdesivir ha demostrado efectividad in vitro contra varios coronavirus (SARS-CoV, MERS-CoV) y también contra el SARS-CoV-2. Un estudio evaluó su uso en 60 pacientes con compromiso respiratorio severo y encontró mejoría clínica en el 68%25. Sin embargo, un estudio aleatorizado no mostró utilidad26. No se reportaron arritmias o cambios en el QTc. No está disponible en Colombia.
Se han propuesto otros tratamientos, como ivermectina, tocilizumab, interferón alfa y varios antivirales. Para el momento de escribir este artículo no había estudios clínicos que respaldaran su uso.
COVID-19 y síndromes arritmogénicosHay muy poca información del efecto del SARS-CoV-2 en pacientes con síndromes arritmogénicos. Dado que algunos de los tratamientos propuestos para este virus prolongan el QTc hay que tener especial precaución con los pacientes con síndrome de QT prolongado. Se debe mantener el equilibrio ácido-base, evitar el uso de medicamentos que actúen en el CYP3A4, que metaboliza la cloroquina/hidroxicloroquina, evitar otras drogas que prolonguen el QTc y mantener el uso de betabloqueadores27. En pacientes con síndrome de QT corto es poco probable algún efecto deletéreo por los posibles tratamientos de COVID-19.
En el síndrome de Brugada se han descrito casos de cambios electrocardiográficos diagnósticos (patrón tipo 1) en pacientes con COVID-1928. Se ha descrito que la fiebre puede hacer evidentes los cambios electrocardiográficos de síndrome de Brugada y desarrollo de arritmias ventriculares. Los pacientes de alto riesgo (mutaciones en canales de sodio, menores de 26 años o mayores de 70 años, cambios electrocardiográficos espontáneos de síndrome de Brugada o síncope de origen cardiaco) se deben hospitalizar para monitorización electrocardiográfica y observar hasta que haya mejoría de la fiebre y de los cambios electrocardiográficos. Los pacientes que no son de alto riesgo pueden manejarse en casa27.
En pacientes con taquicardia ventricular polimorfa catecolaminérgica afectados por COVID-19 se debe evitar el uso de medicamentos vasoactivos con efecto simpático (adrenalina, dobutamina, etc.) que puede llevar a arritmias ventriculares posiblemente mortales27. Si el estado hemodinámico lo permite, se deben iniciar o mantener betabloqueadores27.
Prevención del riesgo de complicaciones arrítmicasQT corregido (QTc)Dado el riesgo de taquiarritmias ventriculares por prolongación del QTc que otorgan los tratamientos para el COVID-19, es importante la adecuada determinación del QTc. La duración del QT cambia con la frecuencia cardiaca, por ello se utiliza el QTc. Aunque existen varias formas de calcular el QTc, la más fácil y utilizada es la corrección a través de la fórmula de Bazett QTc=QTRR. Aunque se ha criticado su exactitud, con base en ella se han establecido los riesgos de prolongación del QTc.
Es la recomendada por el Colegio Colombiano de Electrofisiología y la Sociedad Latinoamericana del Ritmo Cardiaco (LAHRS) en pacientes con COVID-1929.
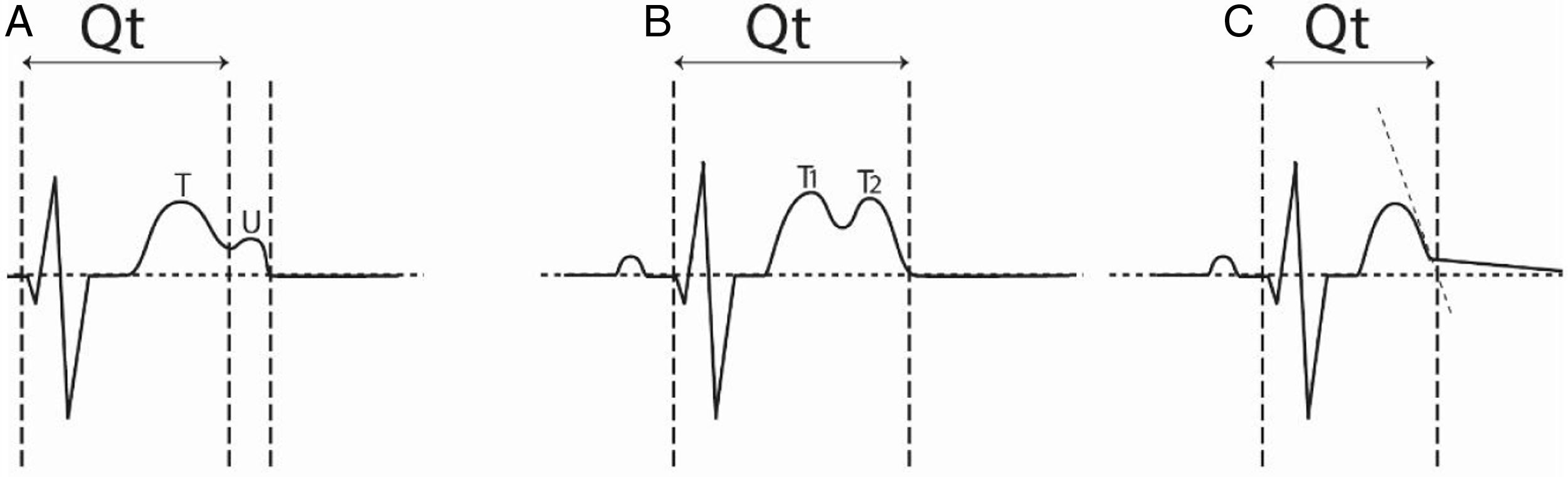
El QT se mide desde el inicio del QRS hasta el final de la onda T determinado en DII, V5 o V6 y tomando el valor más largo. Habitualmente es fácil de medir, pero puede haber dificultad si la onda T tiene dos picos, en cuyo caso se debe diferenciar entre onda T bífida o la presencia de onda U. Si los dos picos son de amplitud similar es una onda T bífida y el intervalo se mide hasta el final del descenso del segundo pico. Si el segundo pico es de menor amplitud (onda U) se debe calcular el QT hasta el sitio de unión de las dos ondas y el intervalo hasta el final de la segunda onda (QTU) y hacer seguimiento a ambos. En otros casos, por procesos de compensación del electrocardiógrafo, se observa un marcado cambio de la pendiente descendente de la onda T que llega tardíamente a la línea de base, incluso muy cerca a la onda P; en estos casos se debe trazar una tangente a la rama descendiente de la T antes del cambio y llevarla hasta la línea de base y tomar ese punto como terminación del QT13 (fig. 1). En presencia de fibrilación auricular se deben promediar 10 latidos para determinar el valor del QTc.
En casos de prolongación del QRS (bloqueos de rama o estimulación ventricular de un marcapaso) se debe “corregir” el QTc al ancho del QRS. Se calcula el QTc y luego se resta el valor del ancho del QRS – 100ms (QTc ajustado=QTc-(duración del QRS-100ms)29.
Por el riesgo de diseminación del COVID-19 a través del electrocardiógrafo y el riesgo del personal de salud se han propuesto otras formas de registro electrocardiográfico. Recientemente se ha aprobado un sistema de toma de ECG (Kardia Mobile 6L) que registra entre los pulgares y la rodilla o el tobillo, lo cual permite generar un ECG con seis derivaciones30. Aunque los relojes y teléfonos inteligentes dan una imagen electrocardiográfica, no hay validación para la determinación del QTc. En casos de uso de medios diferentes al ECG para determinar el QTc, una forma práctica para saber si hay prolongación es establecer si el QT es mayor que el 50% del RR, en cuyo caso será menor 460ms.
Riesgo de prolongación del QTEn síndrome de QT prolongado congénito, cada aumento de 10ms se asocia con 5 a 7% de riesgo del taquicardia de puntas torcidas y un QTc>500ms duplica o triplica el riesgo de taquicardia de puntas torcidas31. También confiere riesgo un cambio del QTC>60ms (delta QTc). Se ha considerado que este riesgo también se aplica a la prolongación adquirida del QTc.
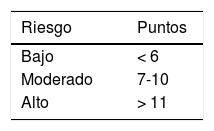
Se ha intentado predecir qué pacientes pueden tener más riesgo de prolongar el QTc. En un estudio de 900 pacientes en cuidado intensivo, Tisdale32 evaluó un puntaje para predecir la prolongación del QTc (> 500ms o un cambio>60ms) encontrando predictores (tabla 1) que clasificaban en tres grupos de riesgo con buena sensibilidad y especificidad (tabla 2). Llama la atención que recibir un medicamento que prolongue el QTc, confiere mayor riesgo que recibir dos o más. Pese a esta limitación, no hay otros predictores descritos y fue el escogido por el consenso colombiano para utilizarse en pacientes con COVID-1911.
Factores de riesgo del puntaje de Tisdale para prolongación del QTc
| Factores de riesgo | Puntos |
|---|---|
| Edad>68 años | 1 |
| Sexo femenino | 1 |
| Uso de diuréticos de ASA | 1 |
| Potasio<3.5 mEq/L | 2 |
| QTc inicial>450 ms | 2 |
| Infarto agudo de miocardio | 2 |
| Uso de>2 medicamentos que alargan el QTc | 3 |
| Sepsis | 3 |
| Falla cardiaca | 3 |
| Uso de 1 medicamento que prolonga el QTc | 3 |
Este puntaje fue validado en pacientes con COVID-19 que recibían hidroxicloroquina encontrando que 20% prolongaron el QTc>500ms o delta QTc>60ms19. Se observó que tuvo utilidad en el grupo de alto riesgo (> 11 puntos), con significancia estadística limítrofe OR 3.07 (0.99-9.52).
Medidas de prevención de alargamiento del QTPese a datos iniciales que muestran pocos eventos arrítmicos es claro que debemos tomar todas las medidas necesarias para disminuir el riesgo, teniendo en mente que si estos tratamientos disminuyen la mortalidad (no demostrado hasta ahora) se podría ser más liberal en su uso dado su poco riesgo de taquicardia de puntas torcidas. La población con COVID-19 con mayor riesgo de mortalidad son ancianos con enfermedades cardiovasculares, hipertensión, diabetes y otras enfermedades crónicas, y no es rara la presencia de falla cardiaca e isquemia, las cuales favorecen la prolongación del QTc.
Además de la medición inicial del QTc se deben buscar incisivamente situaciones clínicas modificables que favorezcan la prolongación del QTc, como alteraciones electrolíticas (hipocalcemia, hipocalemia e hipomagnesemia) y medicamentos. Por otra parte, existen factores no modificables que deben alertar a ser más rigurosos en la monitorización del QTc en estos pacientes e incluyen condiciones demográficas (edad>65 años, sexo femenino), cardiovasculares (síndrome coronario agudo, bradicardia<45, falla cardiaca, síndrome de QT prolongado, miocardiopatía hipertrófica, estado posreanimación o antecedente familiar de muerte súbita), condiciones neurológicas (evento de accidente cerebrovascular la última semana, hemorragia subaracnoidea o trauma craneoencefálico y primeras 24 horas de estado posconvulsivo), condiciones endocrinológicas (feocromocitoma, hipoglicemia en ausencia de diabetes, diabetes mellitus) y otras condiciones (anorexia nerviosa, desnutrición severa, necesidad de diálisis)33.
Si antes del inicio del tratamiento o durante el mismo se encuentra una causa modificable se debe corregir. Un objetivo terapéutico es llevar el potasio a>4 mEq/ L y el magnesio a>2mg/dl34. Es importante evaluar la necesidad en esos momentos del uso de varias drogas cardiovasculares, como antiarrítmicos (amiodarona, dronedarona, ivabradina, propaferona), diuréticos y otras drogas que pueden prolongar el QTc (disponibles en www.crediblemeds.org) y suspenderlas si es posible.
El consenso colombiano11 recomienda no iniciar medicamentos para el tratamiento del COVID-19 que prolonguen el QTc si el QTc basal es>500ms o tiene un riesgo alto en el puntaje Tisdale. Se deben corregir factores modificables (si no se ha hecho antes) y revalorar el QTc. Sin embargo, algunos expertos no descartan el tratamiento en estos casos si se ha demostrado que mejora mortalidad u otros desenlaces duros y debe ser definido el riesgo/beneficio por un grupo interdisciplinario (infectólogos, internistas, cardiólogos, intensivistas)33. Este grupo debe valorar cómo disminuir el riesgo de desarrollar taquicardia de puntas torcidas y qué hacer para tratarla. Si se decide iniciar tratamiento con QTc>500ms se debe reevaluar el QTc a las 2 a 4 horas de la dosis inicial y luego a las 48 a 96 horas, y tomar medidas para diagnosticar y tratar la taquicardia de puntas torcidas, como traslado a unidades de cuidado intensivo, uso de chalecos desfibriladores (no disponibles en Colombia) o colocación del desfibrilador externo y el carro de paro con sulfato de magnesio disponible a la cabecera del paciente33. Existen algunos criterios electrocardiográficos que, unidos a la prolongación del QTc, sugieren que hay mayor riesgo del taquicardia de puntas torcidas como alternancia de la onda T (cambios en la polaridad de la onda T) y desarrollo de extrasístoles ventriculares. En estos casos se deben adoptar las medidas previamente descritas.
Si el QTc es>470ms en hombres o>480ms en mujeres pero<500ms se inicia el tratamiento y se repite la medición del QTc a las 48 horas. Igualmente, se debe tomar la misma acción si el paciente recibe medicamentos que prolonguen el QT y no se hayan podido retirar. Si durante el tratamiento del QTc se prolonga a>500ms se debe suspender o evaluar riesgo/beneficio con un grupo interdisciplinario34.
Manejo de la taquicardia de puntas torcidasSi la taquicardia de puntas torcidas se asocia a colapso hemodinámico se debe desfibrilar inmediatamente. Sin embargo, en la mayoría de los casos la taquicardia de puntas torcidas inicia en formas no sostenidas y el manejo es la infusión de 2g de sulfato de magnesio en 1 a 2 minutos, y una segunda dosis si es necesario35. El sulfato de magnesio suprime la taquicardia de puntas torcidas sin acortar el QTc y su mecanismo de acción es posiblemente la suspensión del flujo de calcio a través de la corriente tipo L con reducción en los pospotenciales tempranos36.
Si el magnesio no suprime la taquicardia de puntas torcidas se debe aumentar la frecuencia cardiaca ya sea con marcapaso (idealmente con estimulación auricular si no hay bloqueo AV) o con isoproterenol. El aumento de la frecuencia cardiaca acorta el QTc y suprime la taquicardia de puntas torcidas37. Por último, se puede usar lidocaína. Pese a la utilidad de amiodarona en muchas arritmias ventriculares, en estos casos está contraindicada. No hay estudios específicos en pacientes con COVID-19, pero no hay información que sugiera que haya que cambiar este tratamiento estándar.
ConclusionesEn la pandemia por COVID-19 se ha encontrado que el antecedente de arritmias confiere mayor riesgo de complicaciones y mortalidad. El desarrollo de éstas durante la enfermedad es indicador de mal pronóstico y se explica parcialmente por daño miocárdico agudo. Por último, algunos tratamientos propuestos son proarrítmicos, fundamentalmente por prolongación del QTc, por lo que hay que establecer medidas diagnósticas, de prevención y tratamiento en estos pacientes debido al riesgo de taquicardia de puntas torcidas y muerte.
Conflictos de interésNinguno.