Las patologías degenerativas que ocasionan daños morfológicos, moleculares y biomecánicos en el cartílago articular conducen a una reorganización bioquímica de la matriz extracelular, a la vez que alteran las moléculas principales, como el colágeno de tipo II y el agrecano. En busca de opciones terapéuticas, los campos eléctricos han sido una herramienta utilizada para tratar las patologías asociadas con el cartílago articular. Estos aumentan la viabilidad celular y estimulan la proliferación y expresión génicas de proteínas como el colágeno de tipo II y la proteína central del agrecano. Esta revisión resalta tanto la morfofisiología, como las patologías y los tratamientos del cartílago articular, y destaca la importancia del uso de los campos eléctricos como un estímulo para los condrocitos articulares cultivados en monocapa. En conclusión, se muestra que los campos eléctricos aumentan la viabilidad celular y estimulan la proliferación y síntesis de las principales moléculas de la matriz extracelular del cartílago. Esto tiene implicaciones desde el punto de vista terapéutico para futuras aplicaciones tanto en la ingeniería de tejidos como en la medicina regenerativa.
Nivel de evidencia clínica. Nivel IV.
Degenerative pathologies that induce morphological, molecular and biomechanical damages in articular cartilage lead to the biochemical reorganisation of the extracellular matrix, affecting the main molecules, such as collagen type II and aggrecan. In pursuit of therapeutic options, electric fields have been useful as treatment for articular cartilage pathologies. These increase cellular viability and stimulate proliferation and expression of proteins such as collagen type II and the aggrecan core protein. This review focuses on the morphology and physiology, pathologies, and treatments of the articular cartilage, emphasising the importance of using electric fields to stimulate articular chondrocytes cultures. In conclusion, it is shown that electric fields increase cell viability and stimulate proliferation and synthesis of major molecules in the cartilage extracellular matrix. This has implications from a therapeutic point of view for the development of novel applications in tissue engineering and regenerative medicine.
Evidence level. IV.
El daño del cartílago articular está ocasionado por lesiones traumáticas o desgaste, lo que conlleva a la disfunción de la articulación1. Adicionalmente, representa una carga económica para el sistema sanitario. En 1999, en Estados Unidos el gasto en enfermedades asociadas con el cartílago excedió los 40 billones de dólares2. Además, estudios más recientes pusieron de manifiesto que patologías como la osteoartritis (OA) afecta al 9,6% de los hombres y al 18% de las mujeres mayores de 60 años a nivel mundial3. La OA representa un problema de salud pública ya que el 80% de los adultos mayores padecen esta enfermedad y del 10 al 20% manifiesta limitación en sus actividades, donde las articulaciones con mayor compromiso son las rodillas (40%), manos (30%) y caderas (19%)4.
Diversas estrategias se han desarrollado para el tratamiento del cartílago articular. Entre estas están las intervenciones no invasivas, como la fisioterapia, los tratamientos farmacológicos para aliviar localmente el dolor5 y tratamientos invasivos, como las intervenciones quirúrgicas6–10. Por desgracia, con ninguno de estos tratamientos se han observado efectos a largo plazo. Además, las intervenciones quirúrgicas generan pérdida en las propiedades mecánicas del tejido debido a la formación de fibrocartílago. Este tejido fibroso no tiene las mismas propiedades que el cartílago original, en especial sus características mecánicas, ya que es menos rígido y más permeable, lo que genera un cartílago más propenso a la degradación con el tiempo. Por tanto, es necesario encontrar otras opciones terapéuticas para estimular la proliferación y aumentar la viabilidad de los condrocitos. Estudios in vitro han demostrado que los condrocitos responden a estimulaciones biofísicas externas, como presiones hidrostáticas, compresiones dinámicas, flujos de fluido, ultrasonido y estimulaciones eléctricas. Respecto a esta última se ha reportado que provoca la proliferación de los condrocitos cultivados y la síntesis de las moléculas que componen la matriz extracelular (MEC)11–20, componente crítico para el sostenimiento de los condrocitos que regula la dinámica celular y actúa como transductor de señales entre las células.
En la siguiente revisión se muestran tres aspectos fundamentales del cartílago articular. En primer lugar, se hace hincapié en su morfofisiología. En segundo lugar, se pone énfasis en las principales lesiones y patologías que afectan a dicho tejido. Por último, se resaltan tratamientos para las lesiones del cartílago articular, haciendo hincapié en el uso de los campos eléctricos como una herramienta en la ingeniería de tejidos y la medicina regenerativa para aumentar la viabilidad celular y estimular la proliferación y síntesis de las principales moléculas de la MEC del cartílago, como el colágeno de tipo II y el agrecano.
Desarrollo embriológico del cartílagoEl cartílago es un tejido conjuntivo avascular que, dependiendo de la composición de la MEC y su ubicación en el cuerpo humano, se clasifica como cartílago elástico, fibrocartílago y cartílago hialino. El cartílago elástico contiene haces de elastina dispersas en la MEC que le proporcionan rigidez y elasticidad al tejido. Este tejido se encuentra en el oído y en la epiglotis. El fibrocartílago contiene una MEC fibrosa rica en colágeno de tipo I y se encuentra entre los discos vertebrales y los meniscos21,22.
El cartílago hialino surge de condensaciones de células mesenquimales durante el desarrollo embriológico en un proceso denominado condrogénesis23,24. Este proceso se inicia con el reclutamiento de células mesenquimales al sitio donde posteriormente se originarán los elementos del esqueleto. Después de la migración, resultado de interacciones entre epitelio y mesénquima, se origina la condensación celular25. Las células de estas condensaciones proliferan y se diferencian en condrocitos para formar un molde cartilaginoso mediante la secreción de una MEC rica en colágeno de tipo II y proteoglucanos (PG). El molde cartilaginoso sufre posteriormente un proceso de osificación para dar paso a la formación de huesos largos, excepto en los extremos donde persistirá como cartílago articular26–28. Las funciones principales del cartílago articular son proveer de un bajo coeficiente de fricción durante el movimiento entre los extremos óseos para soportar y distribuir las cargas mecánicas sobre toda la superficie de contacto.
La diferenciación de células mesenquimales a condrocitos durante la condrogénesis es regulada por la actividad de factores de transcripción que controla la expresión de las principales proteínas que componen la MEC del cartílago articular, como el SOX9, que se retienen una vez que se ha formado el cartílago articular29. El proceso de condrogénesis está altamente regulado por interacciones celulares con la MEC y factores de crecimiento que inician o suprimen cascadas de señalización y factores de transcripción. Dentro de estos últimos se destaca el SOX9, factor de transcripción esencial para la diferenciación de condroprogenitores30, que regula la expresión del colágeno de los tipos II, IX y XI, y agrecano31.
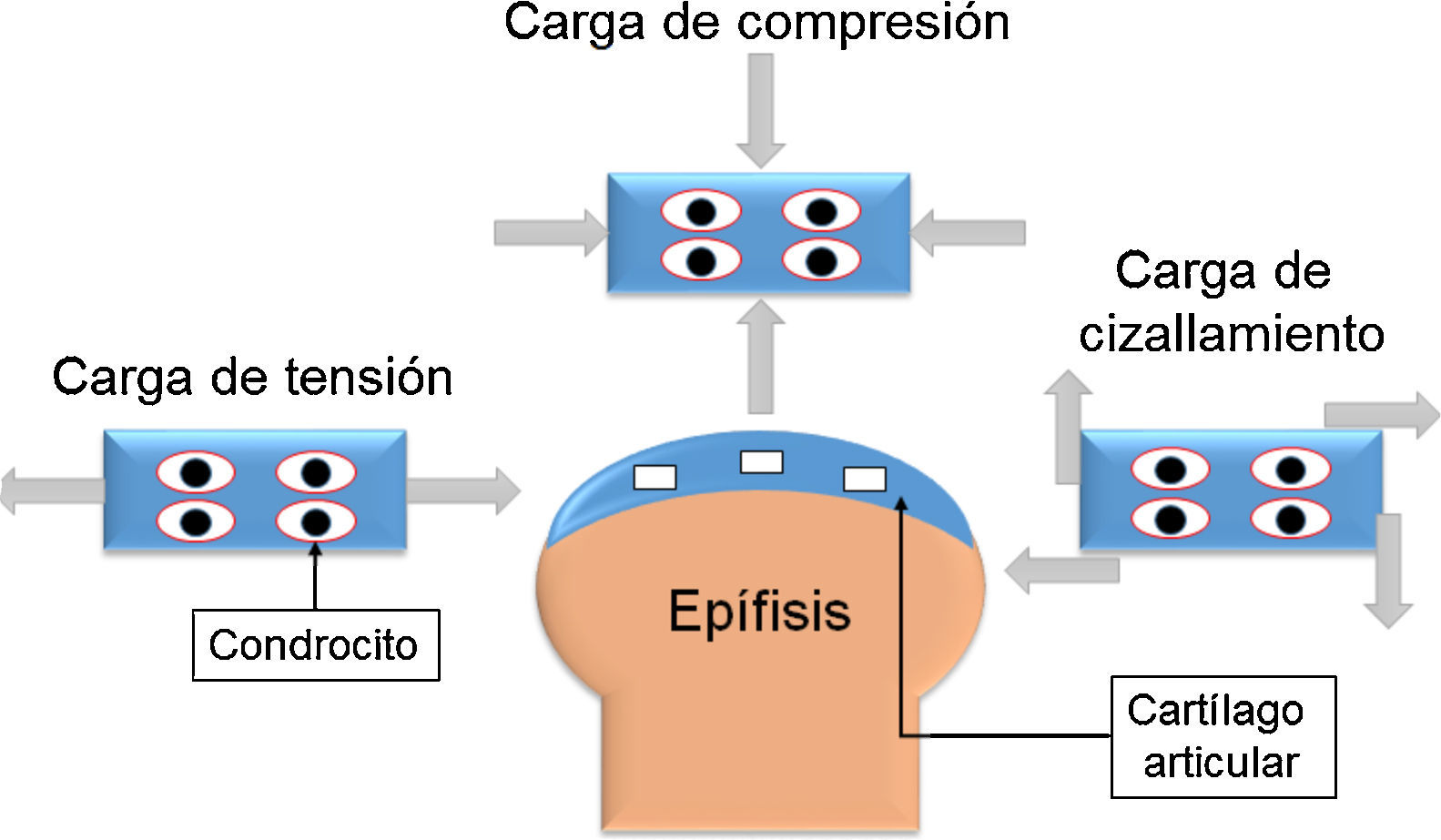
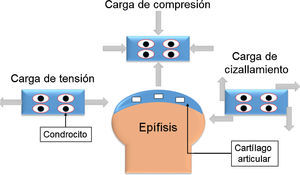
Anatomía del cartílago articularEl cartílago articular está ubicado en las articulaciones sinoviales, en los extremos de los huesos que forman la articulación. El grosor del cartílago articular varía en función de su ubicación; por ejemplo, en las articulaciones interfalángicas, el grosor varía entre 1 y 2 mm, mientras que en la rodilla o cadera, que soportan mayor peso, es de 3 a 5 mm. Dada la función de amortiguación del cartílago articular, este está expuesto a diferentes cargas mecánicas, como compresión, tensión y cizallamiento (fig. 1). Algunas articulaciones, como la cadera o el tobillo, soportan cargas que varían de 1 a 4 MPa (megapascales). Sin embargo, articulaciones como la rodilla experimentan cargas de 5 a 10 MPa en la marcha normal y pueden incrementarse a 18 MPa cuando se realiza alguna actividad física32,33.
Esquema de las diferentes cargas mecánicas que soporta el cartílago articular. La carga de tensión ejerce fuerza hacia fuera y es paralela al objeto. La carga de compresión actúa de forma paralela hacia dentro del objeto y reduce el volumen del cuerpo. La fuerza de cizallamiento es tangencial al cuerpo donde actúa y deforma el cuerpo en varias direcciones.
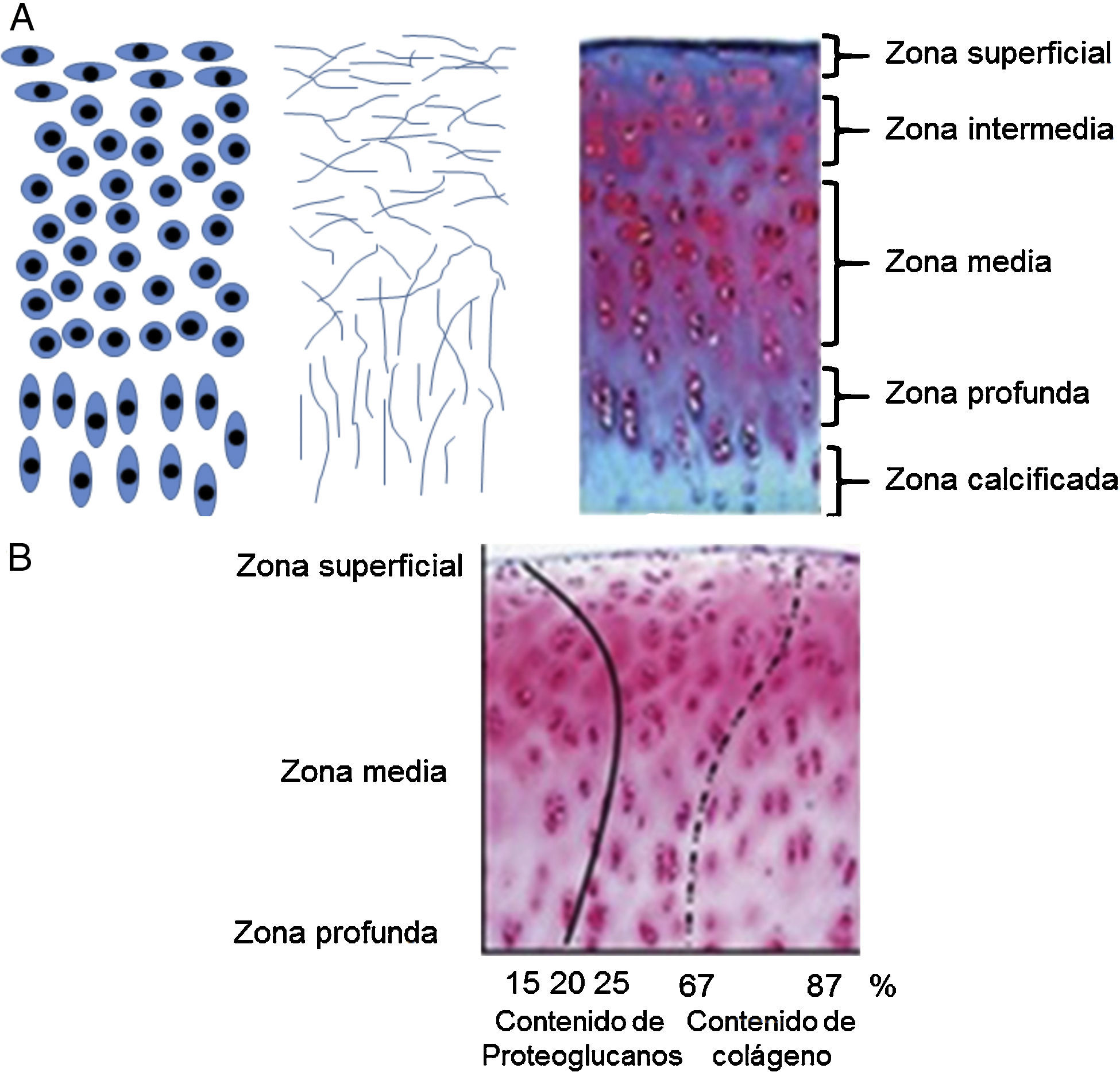
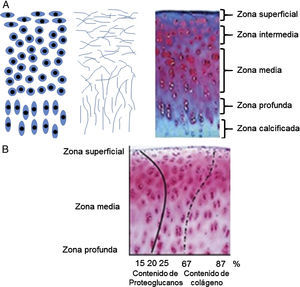
Para que el cartílago articular pueda soportar las diferentes cargas mecánicas, su estructura y composición es fundamental. Este es un tejido con una alta relación MEC-células. Los condrocitos son el único componente celular del tejido, representan aproximadamente el 1-5% del volumen total del cartílago. La morfología del condrocito varía de acuerdo con su ubicación dentro del cartílago, tipo de cartílago y edad del individuo (fig. 2A). De acuerdo con esto, pueden ser circulares, ovalados o aplanados. Aparte de ello, la MEC constituye más del 95% del volumen del cartílago articular. Esta contiene aproximadamente el 60-80% de agua, el 15% de colágenos totales, entre ellos los colágenos de los tipos II, VI, IX, X y XI, y, por último, el 9% de PG. Sin embrago, los porcentajes de colágeno y PG en el cartílago articular varían según la zona en que se encuentre dentro del tejido (fig. 2B).
Esquemas de las zonas del cartílago articular34. A) Morfología de los condrocitos en las diferentes capas del cartílago articular (izquierda). Organización de las fibras de colágeno dentro de la matriz extracelular (centro). Zonas del cartílago articular (derecha). B) Porcentajes de colágeno y proteoglucanos dentro del cartílago articular.
El cartílago articular está organizado por zonas de acuerdo con la morfología celular y la orientación del colágeno de tipo II (fig. 2A)34. Las zonas más distantes al hueso forman la zona superficial o tangencial, y forman la capa más delgada del tejido (aproximadamente de 50 a 100 μm). Esta zona está compuesta por condrocitos de morfología aplanada y fibras de colágeno paralelas a la articulación. Además, las concentraciones de PG son bajas35. A continuación, una región de transición establece la zona intermedia del cartílago articular. Esta zona presenta menor densidad celular de condrocitos con morfología ovalada. Seguida de la zona media, se encuentran condrocitos más circulares que forman pequeñas agrupaciones. Las células sintetizan activamente colágeno de tipo II, organizado de manera oblicua, y agrecano. En la zona profunda, el colágeno de tipo II se encuentra de manera perpendicular a la articulación y los condrocitos de morfología circular se ordenan en columnas. Finalmente, en la zona calcificada se reagrupan condrocitos de morfología más alargada y aplanada que sintetizan colágeno de tipo X con el objeto de formar fibrocartílago y proveer de amortiguación entre el hueso subcondral y el cartílago articular.
Componentes moleculares del cartílago articularFibras de colágenoEl principal componente de la MEC del cartílago articular es el colágeno de tipo II. Esta es una proteína fibrilar sintetizada como un monómero, ensamblado en un trímero y procesada extracelularmente para eliminar los extremos amino y carboxilo-terminal36. Estas fibras de colágeno se alinean de acuerdo con la dirección de la carga soportada por el cartílago y le proporcionan mayor rigidez. Además, en el cartílago articular se encuentran otros cinco tipos de colágenos (tabla 1).
Tipos de colágeno y su respectiva función33,58
| Tipo de colágeno | Función |
|---|---|
| Tipo II | Constituye la mayor parte del total del colágeno dentro del cartílago articular (aproximadamente el 80%) y es el encargado de proveer de una alta resistencia a la compresión cíclica |
| Tipo VI | Concentra la mayor parte alrededor de las células y ayuda a que los condrocitos se adhieran a la MEC. Compone aproximadamente el 5% del total de colágeno en el cartílago articular |
| Tipo IX | Facilita la interacción entre las fibrillas de colágeno con los PG dentro la MEC. Compone aproximadamente el 15% del total de colágeno en el cartílago articular |
| Tipo X | Organiza las fibrillas de colágeno en una red hexagonal tridimensional en la zona calcificada del cartílago articular (fig. 2A) y compone aproximadamente el 5% del total de colágeno en el cartílago articular |
| Tipo XI | Regula el tamaño de las fibrillas que forman la cesta pericelular del condrocito. Además, permite la producción de colágeno de tipo II. Compone aproximadamente el 15% del total de colágeno en el cartílago articular |
MEC, matriz extracelular; PG, proteglucanos.
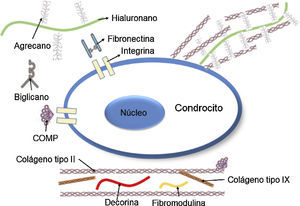
Los PG son hidratos de carbono complejos que componen la MEC del tejido cartilaginoso y le proporcionan al tejido soporte y tridimensionalidad (fig. 2B)37. Estas moléculas, de gran peso molecular, retienen agua y mantienen la distancia entre las células. Además, le brindan al tejido una capacidad de resistencia osmótica y le proporcionan propiedades de compresibilidad. Adicionalmente, los PG están unidos a la membrana celular de los condrocitos, pueden actuar como moduladores de señal en procesos de comunicación entre la célula y su entorno, y en ciertos casos, promueven la adhesión celular.
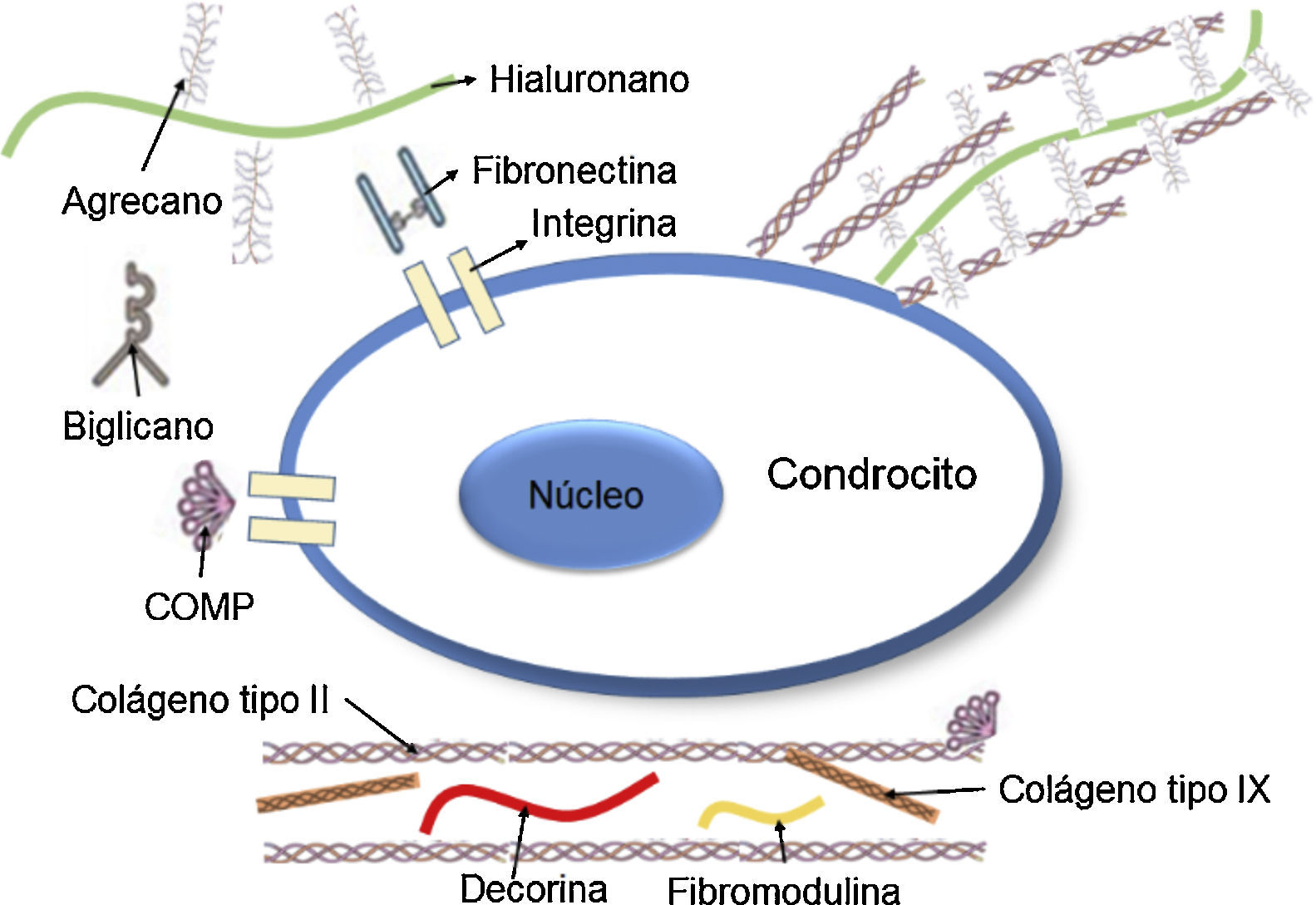
Los PG están compuestos por una cadena central proteica a la cual se unen de manera perpendicular dímeros repetidos de hidratos de carbono, por lo general altamente sulfatados denominados glucosaminoglucanos (GAG)38. El principal PG del cartílago hialino es el agrecano, compuesto por una proteína central de 210 a 250 kDA con tres dominios globulares: dos en el amino terminal (G1 y G2) y un tercer dominio en el carboxilo-terminal (G3). A este tercer dominio lo separa una región de GAG compuesta por queratán-sulfato (KS) seguido de otra región de condroitín-sulfato (CS; fig. 3)39,40. La función de los dominios globulares es proporcionar agregación, sitios de unión al hialuronano, adhesión celular y aportar a los procesos de apoptosis de los condrocitos.
Representación esquemática de los proteoglucanos y las fibras de colágeno dentro del cartílago articular, dominios globulares (G1, G2 y G3) y GAGs37.
El agrecano interactúa con otros constituyentes de la MEC, como el colágeno de tipo II, e interconecta la MEC con los constituyentes de la superficie celular. Otros PG de menor peso molecular, como la decorina y la fibromodulina, se unen con el colágeno de tipo II y tienen un rol importante en la determinación de las propiedades físicas de las fibras de colágeno41.
GlucoproteínasAunque en menor proporción que el colágeno de tipo II y el agrecano, el cartílago hialino también posee glucoproteínas de diversas especies y funciones. Por ejemplo, la proteína oligomérica del cartílago (COMP) es una glucoproteína no colagenosa que se encuentra en el cartílago hialino y está localizada en la MEC alrededor de los condrocitos, que ayuda al crecimiento, proliferación y fijación de las células en su entorno42,43. Igualmente, la fibronectina está localizada a nivel pericelular y le permite al condrocito adherirse a la MEC y actuar con otras moléculas, como el colágeno de tipo II44. La tromboespondina, otra glucoproteína no colagenosa, tiene varias funciones; entre ellas, ayudar a la adhesión, migración y proliferación celular.
Lesiones y patologías que afectan al cartílago articularA lo largo de la vida, el cartílago articular está condicionado por un desgaste interno debido a las cargas mecánicas externas soportadas por el tejido y este desgaste genera alteraciones morfológicas y funcionales. Sin embargo, existen lesiones y algunas patologías que pueden ocurrir con anticipación debido a factores genéticos, de crecimiento, metabólicos y traumáticos45.
Hay tres tipos de lesiones que afectan al cartílago. En primer lugar, se encuentran las lesiones que alteran y deterioran la MEC del tejido. Sin embargo, los condrocitos viables restantes aumentan su actividad sintética y reparan las zonas afectadas. En segundo lugar, están las alteraciones en el espesor del cartílago que generan fisuras en la superficie del cartílago. Por último, están las lesiones que afectan a todo el espesor del cartílago hasta penetrar en el hueso subcondral. La reparación del daño se lleva a cabo por parte de células progenitoras que migran desde la médula ósea hasta el tejido alterado y lo reemplazan con cartílago hialino y fibrocartílago.
La patología degenerativa del cartílago articular, con mayor incidencia, que afecta tanto a los condrocitos como a la MEC es la OA46–49. Estudios realizados han encontrado que la OA afecta tanto a hombres como a mujeres mayores de 60 años y se especula que en el año 2020 será la cuarta causa de discapacidad a nivel mundial50. El desarrollo de la OA involucra a múltiples factores, entre los cuales se encuentran daño mecánico de la articulación, inflamación y predisposición genética51. La OA se manifiesta con grandes cambios morfológicos, bioquímicos, moleculares y biomecánicos, resultado del desequilibrio entre síntesis y degradación de los componentes de la MEC del cartílago. Como consecuencia, se presenta fibrilación de la superficie del cartílago, alteración en las proteínas primarias, como el colágeno y los PG, que disminuyen la resistencia a la tracción, rigidez y espesor del cartílago articular, remodelación del hueso subcondral e inflamación crónica de la membrana sinovial52,53.
Otras patologías, como la artropatía neurogénica, espondiloartritis y osteocondritis afectan al cartílago articular y causan dolor, inflamación, dificultades de movimiento, fragmentación y fractura de las articulaciones54. Debido a las patologías que afectan a la morfología, el nivel molecular y biomecánico del cartílago articular, existe la necesidad de realizar tratamientos apropiados o encontrar alternativas fisioterapéuticas para evitar daños morfológicos y funcionales en el tejido cartilaginoso.
Tratamientos de las lesiones del cartílago articularLa fisioterapia se ha utilizado como una alternativa no invasiva para tratar lesiones en las articulaciones y se basa en el uso de diferentes estímulos físicos sobre el tejido afectado. Dentro de estos se incluyen: la termoterapia (aplicación de calor local), la ecografía (estimulación con ondas de alta frecuencia), la magnetoterapia (aplicación de campos magnéticos estáticos) y la electroterapia mediante estimulación eléctrica transcutánea nerviosa o TENS55.
La electroterapia ha tenido resultados importantes para la OA en rodilla. Farr et al. reportaron el uso de un estimulador eléctrico transcutáneo para evaluar el efecto de los campos eléctricos en 288 pacientes con OA de rodilla. Los pacientes que usaron el dispositivo más de 750 horas (73% de la población) presentaron mejoras y disminuyeron el uso de fármacos antiinflamatorios el 45,3%. Además, el uso del dispositivo prorrogó la posibilidad de una intervención quirúrgica en pacientes crónicos. Clínicamente, el tratamiento de OA en rodilla mediante un dispositivo generador de campos eléctricos durante 6 horas cada día mostró mejora de los síntomas de los pacientes y reducción del dolor en la articulación.
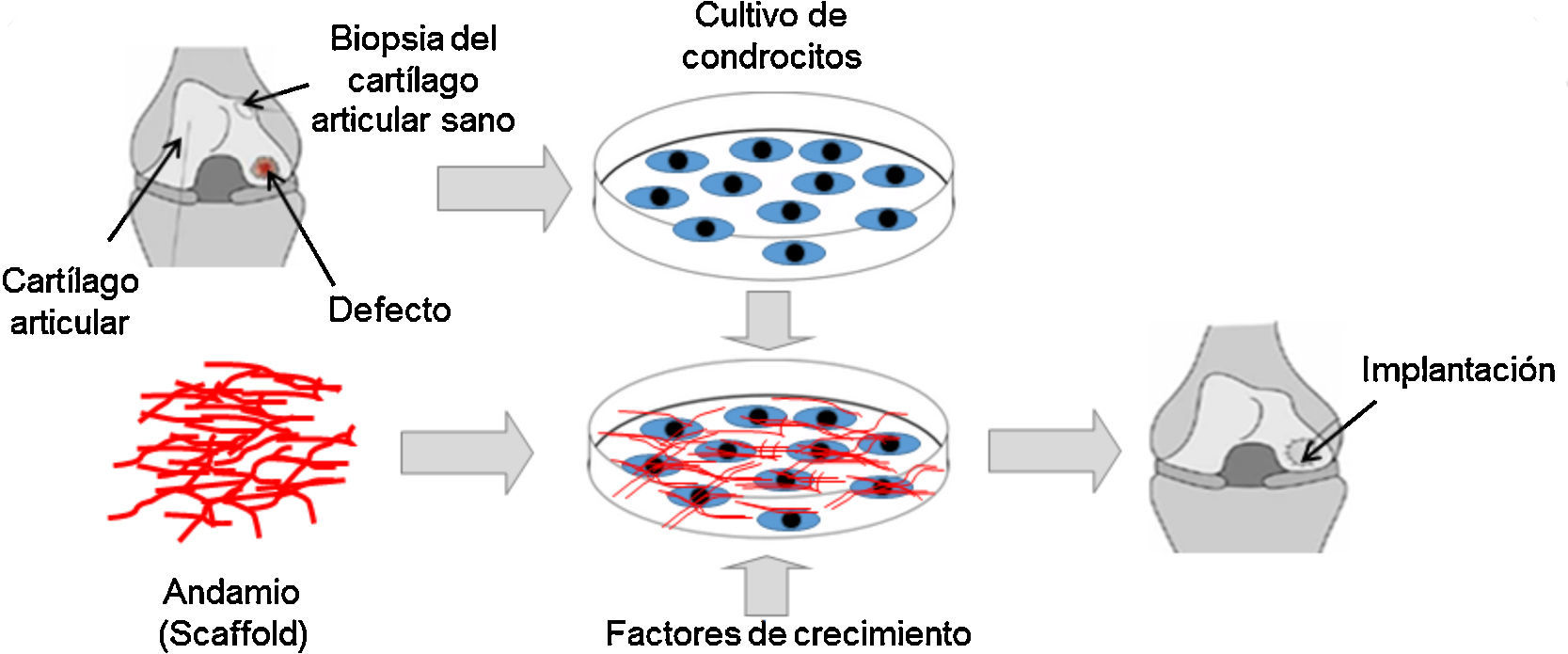
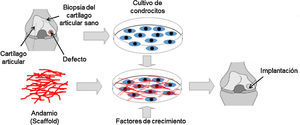
Aparte de ello, existen tratamientos quirúrgicos, como la estimulación de la médula ósea, que consisten en realizar microfracturas a través del cartílago articular hasta penetrar en el hueso subcondral, lo que permite que células mesenquimales migren hacia la superficie de la lesión y se diferencien a condrocitos para reparar la zona lesionada. La mosaicoplastia consiste en tomar pequeños cilindros de tejido sano de los bordes exteriores del cartílago e insertarlos en pequeñas perforaciones previamente realizadas en la zona afectada para que el tejido cartilaginoso se regenere. Un tratamiento similar son los injertos de tejido. Esta técnica consiste en tomar pequeñas cantidades de cartílago sano de otras partes del cuerpo y trasplantarlas al cartílago afectado. También se puede practicar la osteotomía, procedimiento quirúrgico en el cual se elimina parte del hueso en la superficie de la articulación para reducir la carga sobre esta. Por último está la implantación autóloga de condrocitos, técnica utilizada por la ingeniería de tejidos para regenerar o reemplazar un cartílago articular lesionado (fig. 4). Para llevar a cabo este tratamiento, se requiere del cultivo ex vivo de condrocitos sobre andamios (scaffolds) para proporcionar estructuras tridimensionales que imiten la MEC del tejido. Además, los andamios pueden contener factores de crecimiento para estimular la proliferación y expresión génica de señales asociadas con el tejido cartilaginoso. La construcción tisular se implanta posteriormente en la articulación afectada.
Los tratamientos mencionados hasta el momento son técnicas costosas e invasivas con efectos a corto y medio plazo. Dichos tratamientos afectan a varios tejidos sanos y, en la mayoría de los caso, las zonas afectadas son remplazadas por tejido fibrocartilaginoso, el cual no tiene las mismas propiedades morfofisiológicas del cartílago articular. Esto representa una limitación ya que el tejido no va a responder de manera adecuada a estímulos mecánicos. Por tanto, se continúa en la búsqueda de opciones terapéuticas, donde la ingeniería de tejidos ha incursionado en el diseño y construcción de dispositivos, como generadores de campos eléctricos, con fines terapéuticos para aumentar la viabilidad y estimular la proliferación y expresión génica de los condrocitos.
Campos eléctricos como alternativa terapéuticaLos campos eléctricos son generados en un espacio definido por partículas cargadas eléctricamente. El campo eléctrico genera fuerzas puntuales, matemáticamente representadas como vectores, que alteran las partículas posicionadas en el centro del campo eléctrico. Como consecuencia, las partículas experimenten un movimiento aleatorio con distribución uniforme en el espacio56.
La estimulación eléctrica en la regeneración del cartílago articular ha sido usada en sistemas in situ, in vitro e in vivo. En el primer caso, en 1974 Backer et al. realizaron lesiones in situ en el cartílago articular del cóndilo femoral de un conejo con el objetivo de colocar un dispositivo electroquímico directamente en la lesión. Los resultados mostraron que el uso del dispositivo aumentó en el 71% la producción de cartílago hialino comparado con los controles que demostraron la síntesis de fibrocartílago.
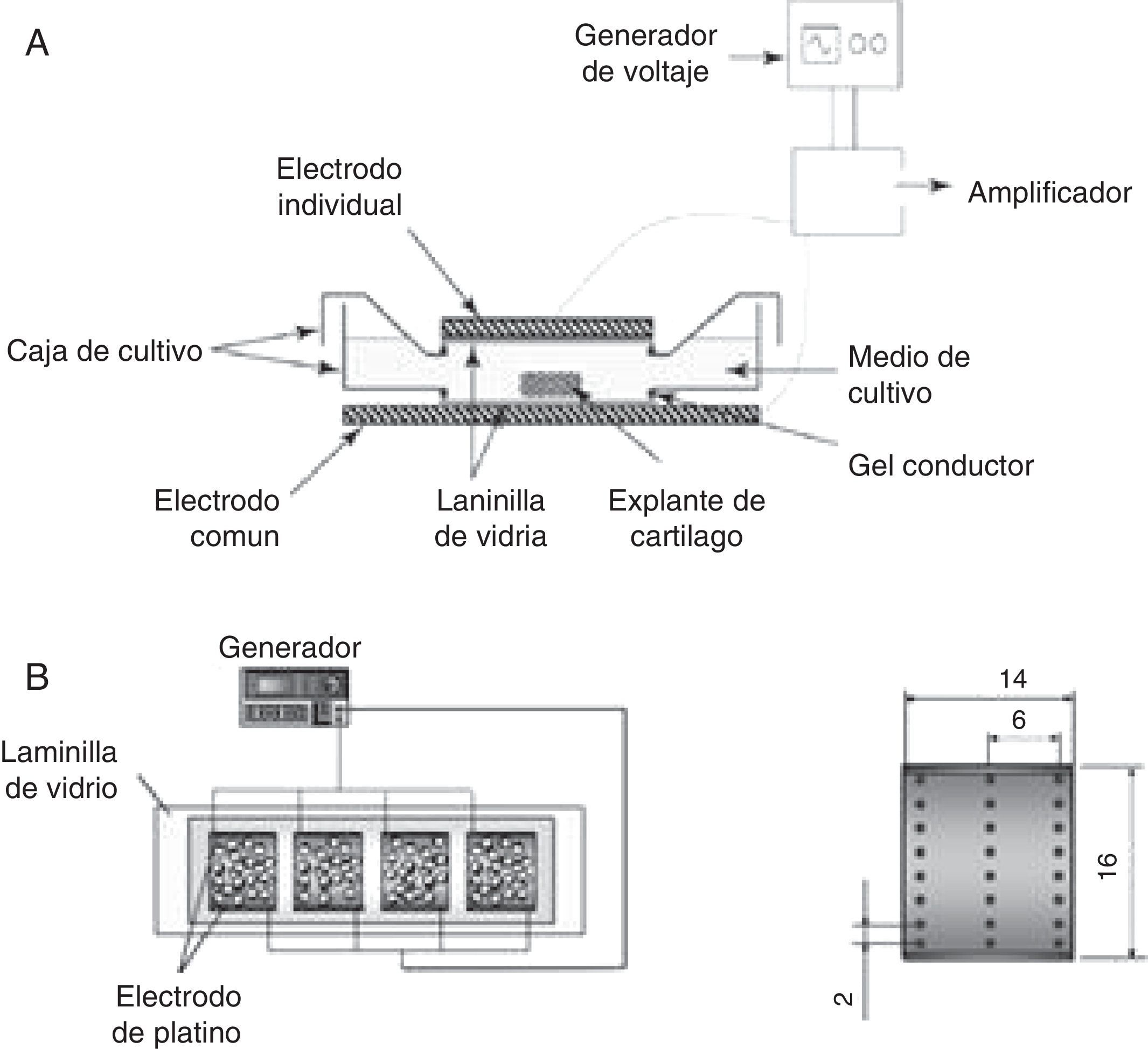
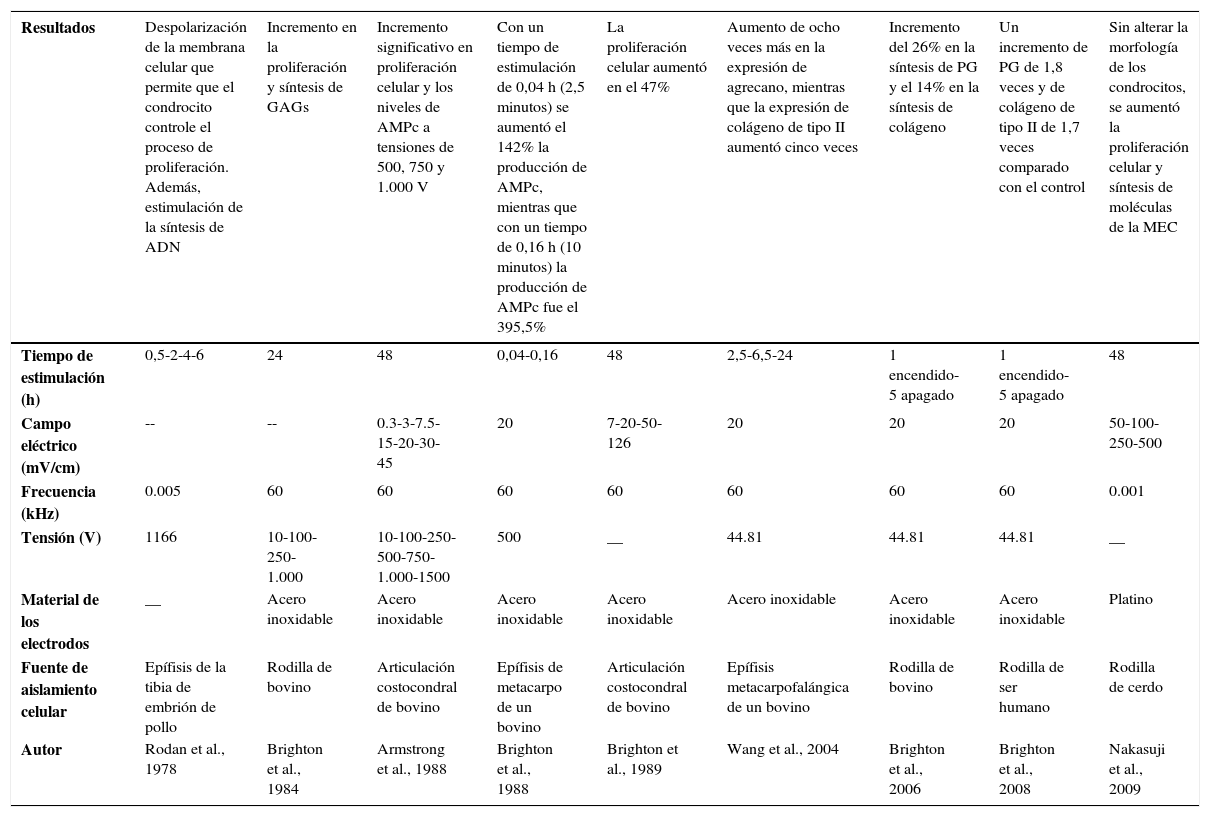
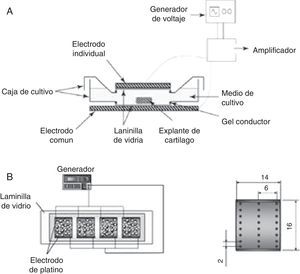
De acuerdo con los estudios desarrollados por varios investigadores desde los años setenta del siglo pasado hasta la fecha para estimular la síntesis y expresión de moléculas asociadas con cartílago articular y tratar las patologías asociadas con el tejido cartilaginoso, se ha puesto de manifiesto que los campos eléctricos alteran la actividad celular de los condrocitos y estimulan la proliferación e incrementan las principales moléculas asociadas con la MEC, como el colágeno de tipo II y el agrecano. Con el objetivo de potenciar dichos efectos, se han evaluado a nivel in vitro diferentes dispositivos (fig. 5) y distintas intensidades de campo eléctrico (tabla 2). Según Balint et al., los dispositivos mostrados (fig. 5) son diseños que distribuyen homogéneamente el campo eléctrico sobre la caja de cultivo celular y estimulan de manera equitativa cada una de las células cultivadas. Además, disminuye la posibilidad de contaminación ya que los electrodos no están en contacto directo con el material biológico. Sin embargo, pueden existir limitaciones al generar altas tensiones (p. ej., 100 V) entre los electrodos57,58.
Dispositivos empleados para estimular condrocitos cultivados en monocapa. A) El sistema consta de un generador de señales que, conectado a un amplificador de voltaje, suministra la tensión adecuada para que dos electrodos, posicionados de forma horizontal sobre la caja de cultivo celular, generen un campo eléctrico y estimulen el cultivo celular17. B) El dispositivo empleado para estimular el cultivo celular está compuesto por un generador de señales que alimenta dos láminas de platino, colocadas de forma vertical sobre el cultivo celular. Adicionalmente, el electrodo contiene agujeros que permiten medir el campo eléctrico en diferentes puntos mientras el cultivo celular está siendo estimulado18.
Cuadro comparativo de la aplicación de campos eléctricos sobre condrocitos cultivados en monocapa
| Resultados | Despolarización de la membrana celular que permite que el condrocito controle el proceso de proliferación. Además, estimulación de la síntesis de ADN | Incremento en la proliferación y síntesis de GAGs | Incremento significativo en proliferación celular y los niveles de AMPc a tensiones de 500, 750 y 1.000 V | Con un tiempo de estimulación de 0,04 h (2,5 minutos) se aumentó el 142% la producción de AMPc, mientras que con un tiempo de 0,16 h (10 minutos) la producción de AMPc fue el 395,5% | La proliferación celular aumentó en el 47% | Aumento de ocho veces más en la expresión de agrecano, mientras que la expresión de colágeno de tipo II aumentó cinco veces | Incremento del 26% en la síntesis de PG y el 14% en la síntesis de colágeno | Un incremento de PG de 1,8 veces y de colágeno de tipo II de 1,7 veces comparado con el control | Sin alterar la morfología de los condrocitos, se aumentó la proliferación celular y síntesis de moléculas de la MEC |
|---|---|---|---|---|---|---|---|---|---|
| Tiempo de estimulación (h) | 0,5-2-4-6 | 24 | 48 | 0,04-0,16 | 48 | 2,5-6,5-24 | 1 encendido-5 apagado | 1 encendido-5 apagado | 48 |
| Campo eléctrico (mV/cm) | -- | -- | 0.3-3-7.5-15-20-30-45 | 20 | 7-20-50-126 | 20 | 20 | 20 | 50-100-250-500 |
| Frecuencia (kHz) | 0.005 | 60 | 60 | 60 | 60 | 60 | 60 | 60 | 0.001 |
| Tensión (V) | 1166 | 10-100-250- 1.000 | 10-100-250-500-750-1.000-1500 | 500 | __ | 44.81 | 44.81 | 44.81 | __ |
| Material de los electrodos | __ | Acero inoxidable | Acero inoxidable | Acero inoxidable | Acero inoxidable | Acero inoxidable | Acero inoxidable | Acero inoxidable | Platino |
| Fuente de aislamiento celular | Epífisis de la tibia de embrión de pollo | Rodilla de bovino | Articulación costocondral de bovino | Epífisis de metacarpo de un bovino | Articulación costocondral de bovino | Epífisis metacarpofalángica de un bovino | Rodilla de bovino | Rodilla de ser humano | Rodilla de cerdo |
| Autor | Rodan et al., 1978 | Brighton et al., 1984 | Armstrong et al., 1988 | Brighton et al., 1988 | Brighton et al., 1989 | Wang et al., 2004 | Brighton et al., 2006 | Brighton et al., 2008 | Nakasuji et al., 2009 |
ADN, ácido desoxirribonucleico; AMPc, adenosín-monofosfato cíclico; MEC, matriz extracelular; PG, proteoglucanos.
Hasta el momento, no existe consenso en la bibliografía que establezca el valor óptimo de tensión para generar el campo eléctrico y del tiempo de estimulación al cultivo celular. Por el contrario, existe un equivalente en cuanto al material de los electrodos y la frecuencia (tabla 2).
El uso de campos eléctricos ha mostrado ser una herramienta fundamental para tratar patologías degenerativas asociadas con el cartílago articular, donde es necesario obtener condrocitos apropiadamente definidos y en óptimas condiciones. Se espera que la investigación en los campos eléctricos contribuya a la mejora de patologías como la OA, como una herramienta fisioterapéutica. También se espera que en la ingeniería de tejidos y la medicina regenerativa se puedan utilizar estos tratamientos con expansión de condrocitos ex vivo, con fines terapéuticos como estrategia para aumentar la producción de MEC.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.