Se trata de un paciente masculino de 31 años con diagnóstico de fibroma condromixoide del ilíaco derecho manejado en el Hospital Universitario San Ignacio en febrero del 2018. El paciente fue llevado inicialmente a biopsia abierta para confirmación histológica, posteriormente fue llevado a embolización preoperatoria, manejo intralesional con curetaje, fresado extendido, manejo adyuvante local y aplicación de cemento óseo. Se realiza seguimiento postoperatorio por 18 meses sin evidencia clínica ni radiográfica de recidiva tumoral. El objetivo de este trabajo es hacer una revisión de la literatura sobre el fibroma condromixoide con énfasis en su localización pélvica y su tratamiento.
Nivel de Evidencia: IV
We report a case of a 31-year-old male patient with diagnosis of chondromyxoid fibroma (CMF) of the iliac bone diagnosed at Hospital Universitario San Ignacio in february 2018; an open biopsy allowed recognizement and description of cytologic features, forward diagnosis and treatment with combination of pre-operative embolization, local and extended curettage, local adyuvance and bone cement as described. At 18 months follow-up have found the patient remains without clinical or radiologic recurrence of CMF. We made a review of literature on chondromixoid fibroma emphasizing on pelvic bones compromise regarding diagnosis and management options.
Evidence Level: IV
El fibroma condromixoide (CMF) es un tumor benigno raro. Se define por la OMS dentro de la clasificación de tumores de tejidos blandos y óseos de 2013 como un tumor benigno con lóbulos de células aspecto ahusado o estrelladas con abundante mezcla de tejido intercelular condroide y mixoide1, su presentación habitual es en la región metafisaria de huesos largos tubulares de miembros inferiores2,3.
Fue descrito por primera vez por Jaffe y Lichtenstein en 19484, previo a su descripción varias lesiones de aspecto similar eran clasificadas de forma errónea como mixoma óseo, encondroma e incluso condrosarcomas.
Distintas series de caso han reportado una prevalencia del CMF menor al 0.5% de todos los tumores óseos y se estima que la prevalencia es ligeramente superior en pacientes de sexo masculino5. Los casos que se presentan en pacientes jóvenes entre la segunda y tercera década de la vida generalmente corresponden a pacientes con compromiso en huesos largos, mientras que el compromiso de huesos planos y pequeños es más común en pacientes de edad avanzada6,7.
A pesar de estar descrito como un tumor benigno, los CMF localizados particularmente en pelvis han sido reportados como lesiones altamente agresivas.
Reporte de caso clínicoSe trata de un paciente masculino de 31 años quien consulta por primera vez al servicio de Ortopedia Oncológica del Hospital Universitario San Ignacio.
Presenta un cuadro clínico de 1 año de evolución de dolor a nivel de región inguinal y cadera derecha. Al examen físico se encuentra una masa palpable indurada y adherida a planos profundos sobre el alerón Ilíaco derecho la cual es no dolorosa y no tiene cambios cutáneos asociados. Los arcos de movilidad de las articulaciones del miembro inferior ipsilateral se encuentran conservados y no tiene alteraciones neurovasculares distales.
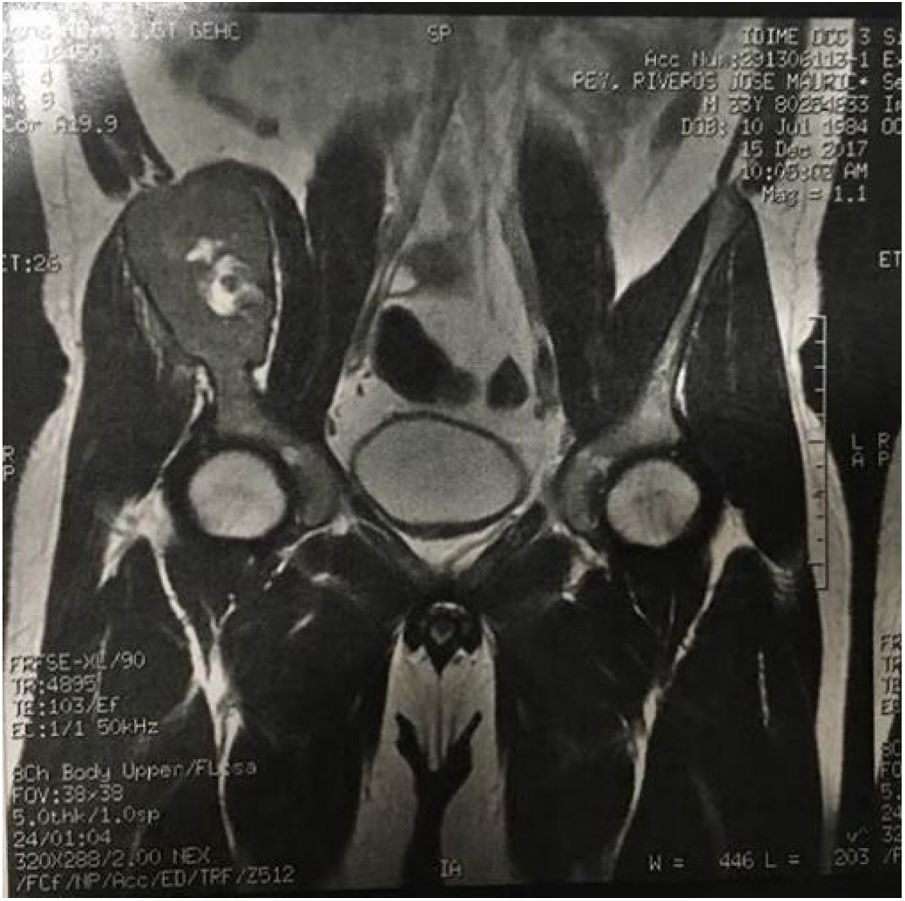
Trae una radiografía simple de pelvis que muestra una masa lítica expansiva a nivel del ilíaco derecho. El estudio se complementa con una resonancia magnética de pelvis que evidencia una lesión osteolítica multilobulada y de intensidad heterogénea en el hueso ilíaco derecho (Ver fig. 2) con posibilidad diagnóstica de tumor de células gigantes del hueso y como diagnóstico diferencial de quiste óseo aneurismático.
Se realiza biopsia abierta donde los hallazgos microscópicos reportan: Tejido de consistencia fibroelástica, irregular, de color pardo, levemente hemorrágico, células gigantes y parénquima blanquecino que sugieren tumor de células gigantes del hueso. Dada la sintomatología del paciente, las características clínicas, radiológicas e histopatológicas de la masa se determina su indicación quirúrgica.
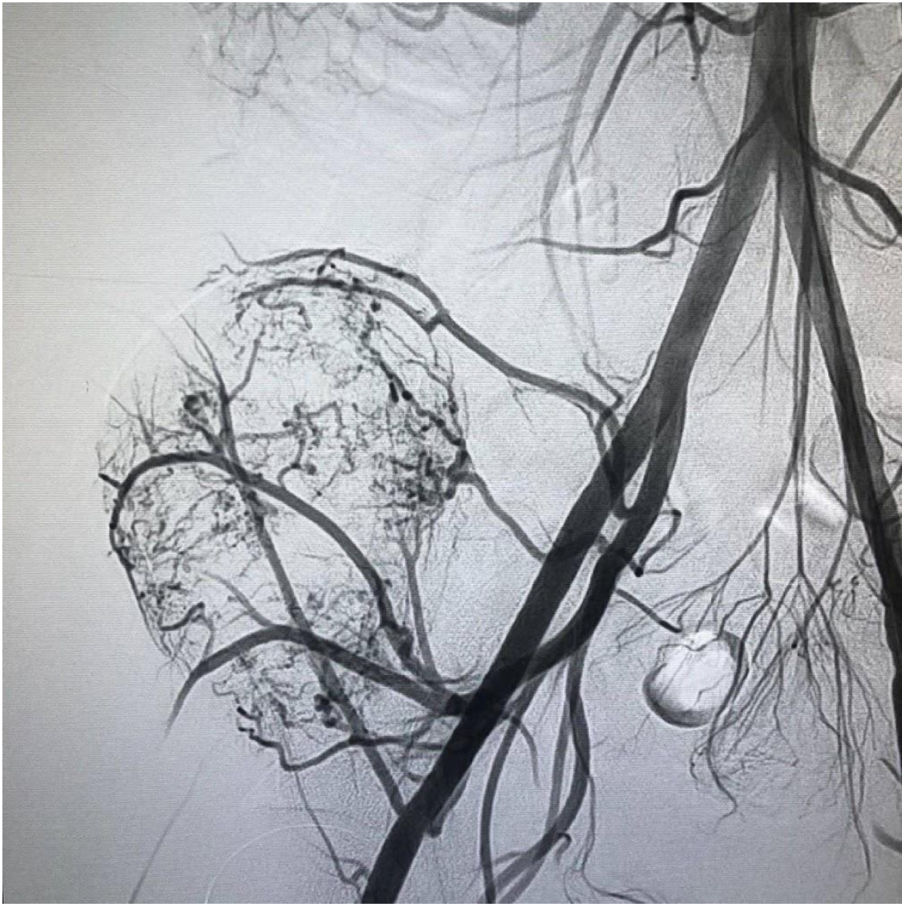
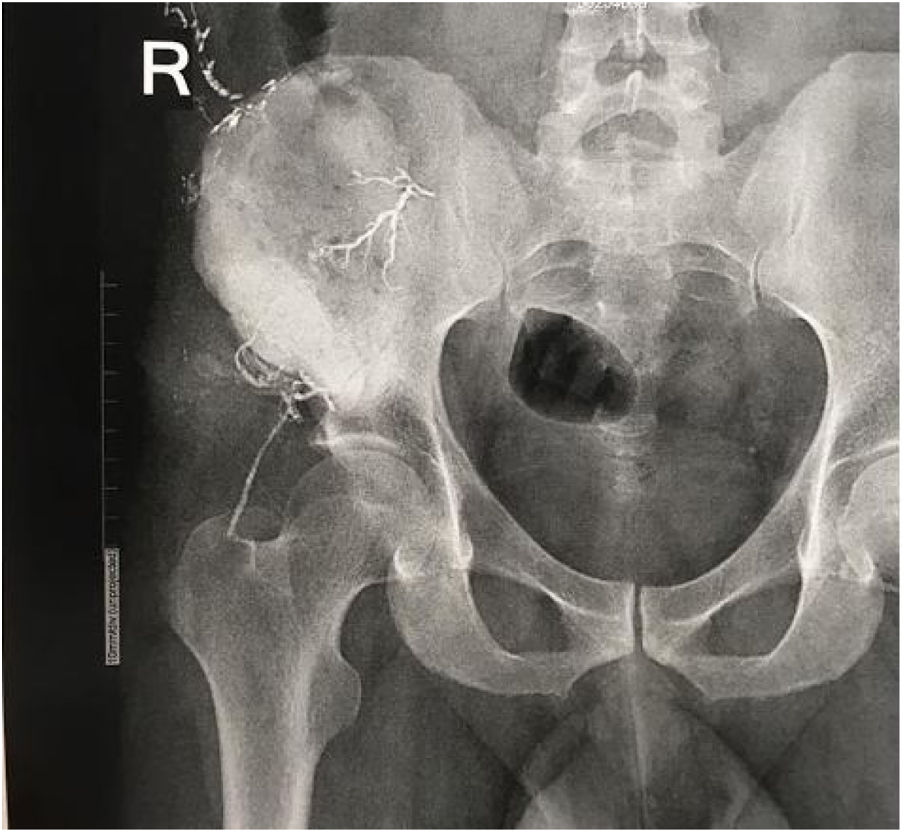
El paciente es hospitalizado y el día de la cirugía se lleva a embolización selectiva de los vasos tumorales por parte del grupo de Radiología intervencionista (fig. 3).
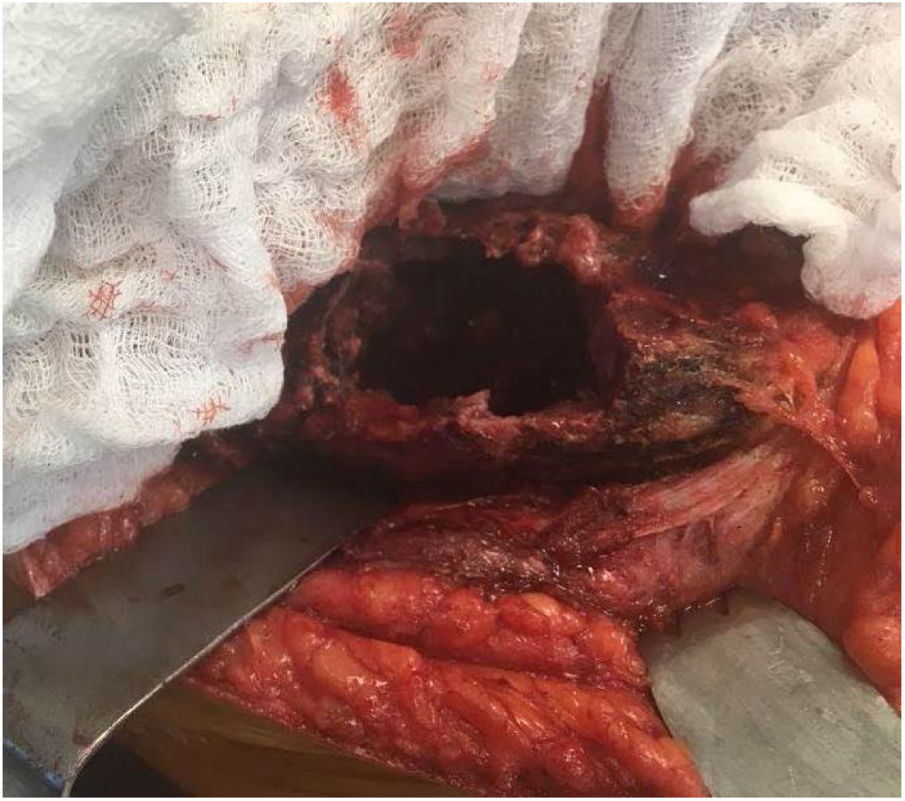
Es llevado a cirugía donde se realiza una incisión sobre el alerón ilíaco derecho, se reseca la cicatriz quirúrgica de la biopsia. Se diseca por planos hasta identificar la lesión. Por medio de bisturí frío se crea una ventana para exponer el interior del tumor. Se encuentra una masa de coloración blanquecina de aproximadamente 5 x 7 x 10cm, sin hemorragia y con escasos focos necróticos (ver fig. 4). Se efectúa una resección intralesional y curetaje hasta encontrar hueso sano. Se envía esta muestra para estudio histopatológico. Se realizó curetaje extendido por medio de fresas y se da manejo adyuvante local con peróxido de hidrógeno y posteriormente con nitrógeno líquido. Se verifica la hemostasia del lecho. Se aplica polimetilmetacrilato como parte del tratamiento adyuvante y para restituir arquitectura ósea.
El procedimiento es llevado a cabo sin complicaciones y tras cumplir unos días de hospitalización se da de alta al paciente.
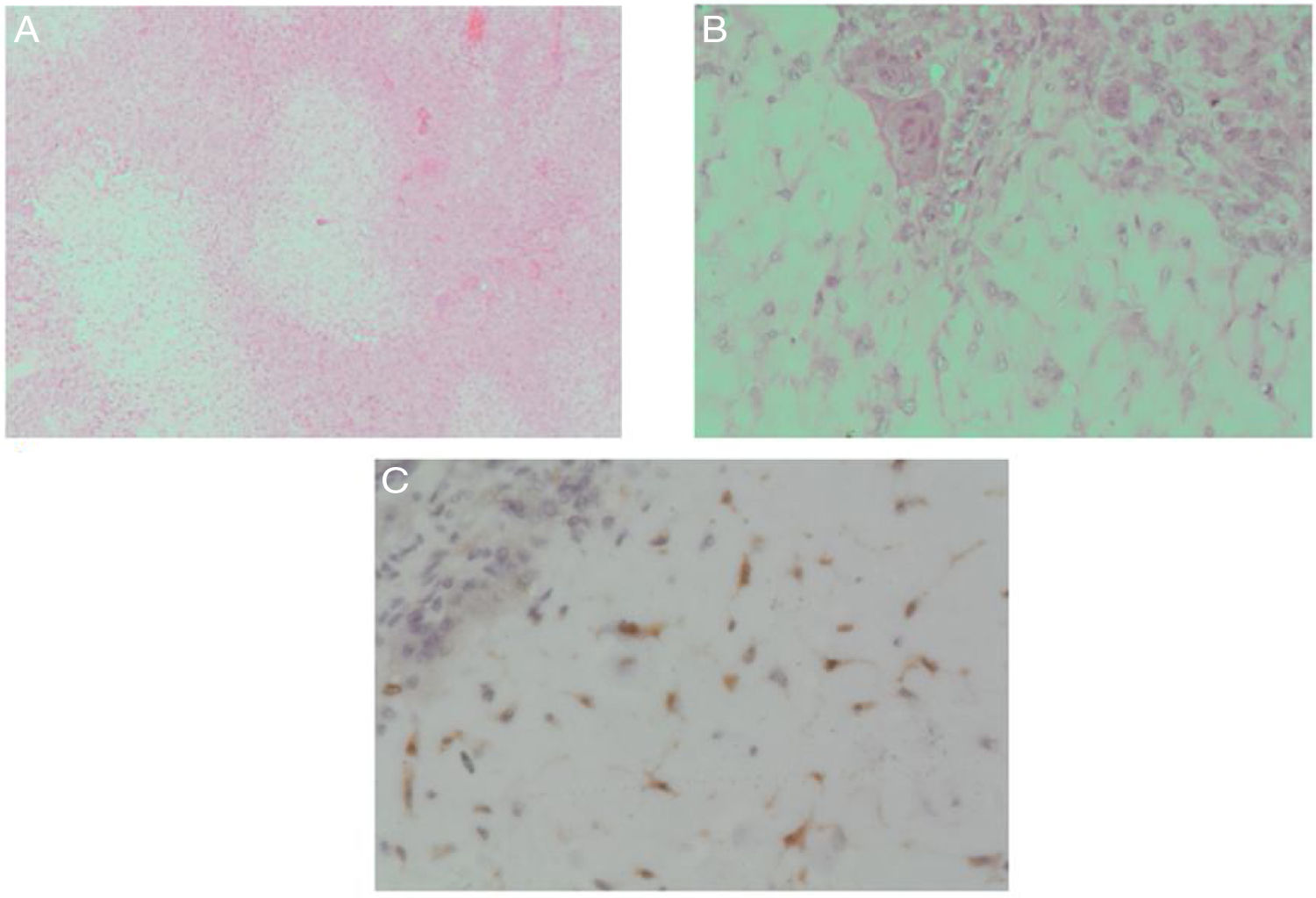
En el servicio de patología se recibieron múltiples fragmentos irregulares de tejido blando, blanquecinos que fueron procesados en su totalidad. Los cortes mostraron una lesión mesenquimal de apariencia multinodular (fig. 5A), no se encontraron áreas de hemorragia ni necrosis. En el acercamiento los lóbulos están compuestos por un centro mixoide de células fusocelulares de apariencia condroide con mayor celularidad en la periferia y presencia de ocasionales células gigantes (fig. 5B). El estroma entre los lóbulos era de apariencia fusocelulares sin mitosis.
El estudio de inmunohistoquímica demostró diferenciación cartilaginosa con S100 (fig. 5C). Los hallazgos histológicos plantearon varios diagnósticos diferenciales que incluyeron un tumor de células gigantes, condroblastoma, fibroma condromixoide y menos probable condrosarcoma. Se realizaron otros marcadores como DOG-1 (descrito positivo en algunos condroblastoma), el cual fue negativo y el índice de proliferación celular con ki67 fue menor al 5%.
Es llevado a Junta multidisciplinaria entre los servicios de Ortopedia Oncológica, Radiología, Oncología y Patología. Dado el cuadro clínico,las imágenes diagnósticas y el estudio histo-patologico se determina que el diagnóstico definitivo es un fibroma condromixoide.
Ha asistido a controles clínicos y radiológicos por 18 meses mostrando adecuado control analgésico. Al examen físico no ha mostrado signos de infección local ni cambios en el miembro inferior ipsilateral. En el último control de agosto de 2019 trae una radiografía y resonancia de pelvis de control que no muestra ningún signo de recidiva tumoral ni complicaciones asociadas (ver fig. 6).
DiscusiónA la fecha, no existen descripciones de anormalidades citogenéticas características, o mutaciones cromosómicas específicas que expliquen el desarrollo del CMF por lo cual su etiología permanece incierta. El estudio citogenético de los CMF ha permitido identificar en el tejido fibroso la diferenciación mio-fibroblástica inducida por factor transformante β-18,9, así mismo, la hiperactividad en la expresión de genes Sox-9 a los cuales se les atribuye la diferenciación condrocítica y de expresión de genes específicos de cartílago en los condrocitos maduros, especialmente para la síntesis de colágeno tipo II10.
Los rearreglos cromosómicos del brazo largo del cromosoma 6 han sido detectados en series de 14 pacientes, utilizando técnicas de hibridación fluorescente in situ FISH, y ha sido posible identificar rearreglos en el gen COL12A1 en pacientes que cursan con expresiones aberrantes de 6q13. Las anormalidades cromosómicas con compromiso 6q13 son las más frecuentes encontrándose hasta en el 50% de los casos estudiados con CMF. El gen COL12A1, se encuentra asociado a las vías de síntesis de colágeno tipo XII alfa 111.
El aspecto macroscópico de los CMF por lo general se describe como un tumor lobulado, bien circunscrito y limitado de la médula ósea, generalmente su aspecto macroscópico es de color blanco y firme al tacto, al corte se muestra como una masa sólida amarilla, blanco-grisácea o incluso azul-grisácea.
A la visualización bajo el microscopio, el CMF se evidencian tres componentes clásicos del CMF: zonas mixomatosas, zonas fibrosas y áreas de aspecto condroide. Las descripciones histológicas generalmente reportan lóbulos de células aspecto ahusado o estrelladas con abundante mezcla de tejido intercelular condroide y mixoide. Los lóbulos tienen una disposición central hipocelular con una periferia con condensaciones nucleares hipercelulares.
La serie de casos más larga publicada por Tu Wu, C y colaboradores documentó información de 278 casos de CMF donde la localización más frecuente se reportó a nivel de fémur proximal; respecto a los huesos planos el compromiso más frecuente se presentó a nivel del alerón ilíaco por un total de 38 casos12. La revisión de la literatura médica a la fecha cuenta con menos de 70 casos de CMF publicados con compromiso en el iliaco13–19.
En términos de manifestaciones clínicas, el dolor crónico es el síntoma predominante en los pacientes que cursan con CMF localizado en la pelvis, sin embargo, el tiempo que transcurre entre el inicio de los síntomas y el diagnóstico oscila entre meses y varios años dado lo inespecífico de los síntomas, las características del dolor en los pacientes con CMF se han descrito como un dolor intermitente que no limita en su totalidad la funcionalidad del paciente por lo que su diagnóstico generalmente es tardío. La segunda queja más frecuente en los pacientes con CMF es inflamación local y sensación de palpable.
No existen reportes que en los que se documente compromiso metastásico en los pacientes que cursan con CMF7. La mayoría de los pacientes reportados en la literatura médica con diagnóstico de CMF de localización en pelvis se encontraban en estadio 3 al momento del diagnóstico, y a pesar del comportamiento localmente agresivo no se ha documentado compromiso a distancia de la lesión primaria.
Dentro de las opciones de tratamiento se incluyen el curetaje óseo, curetaje con injerto óseo o cemento, o la escisión en bloque de la lesión que tiene las tasas más bajas de recurrencia de la lesión.
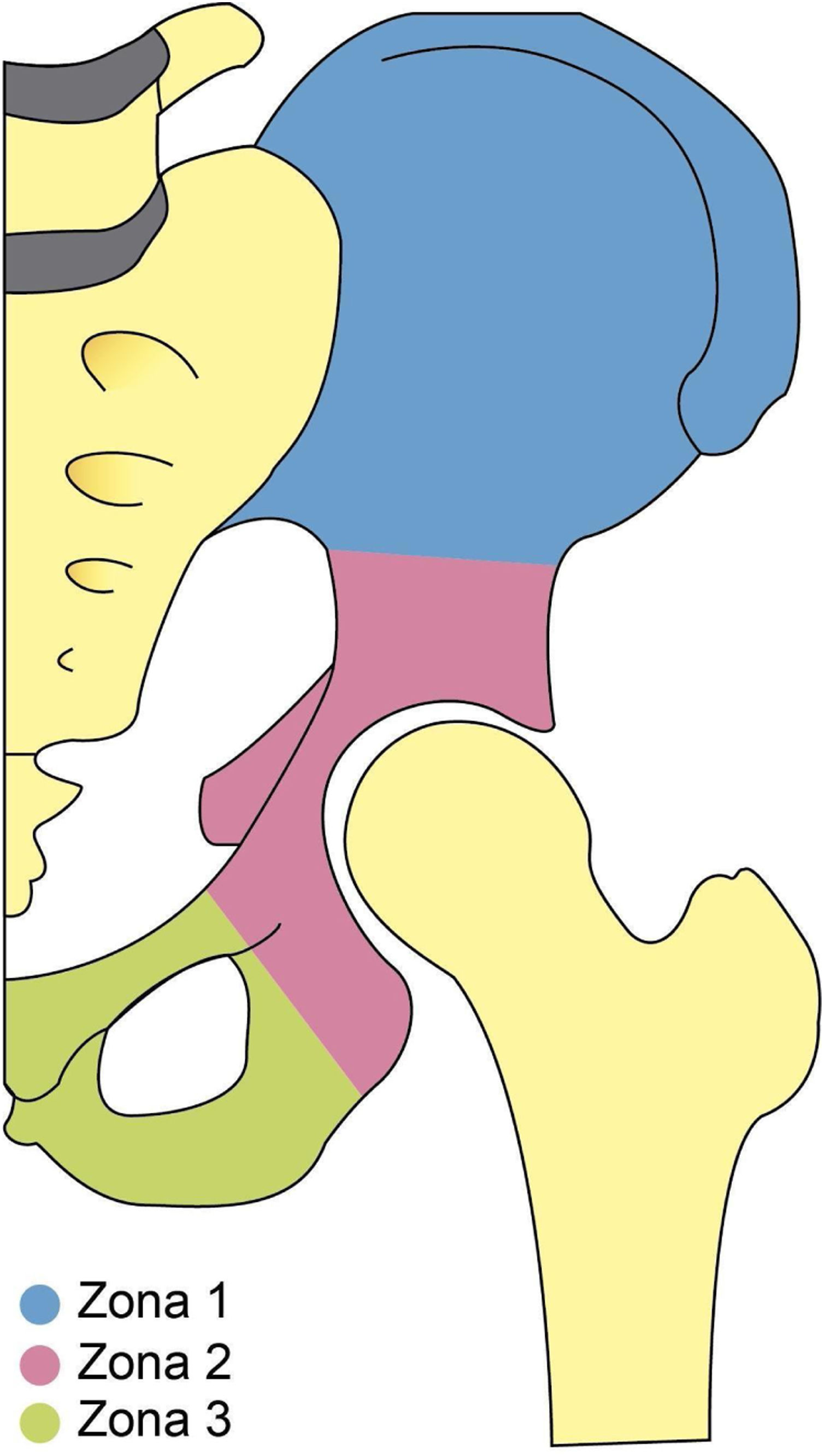
El compromiso pélvico por CMF puede clasificarse según la localización y extensión de la lesión, para ello se utiliza la clasificación de Enneking WF y Dunham WK, quienes dividieron la pelvis en tres zonas para documentar con precisión la localización de la lesión. Para ello, delimitan en la zona 1 todas aquellas lesiones que se extienden sobre el hueso ilíaco, la zona 2 comprende todas las lesiones que abarcan el área periacetabular, finalmente la zona 3 incluye todas las lesiones que se extienden sobre los huesos del pubis e isquion20. Ver figura 1.
En la radiografía convencional, el aspecto habitual de las lesiones por CMF son lesiones medulares de aspecto radiolúcido lítico con un halo esclerótico delgado que delimita la lesión. En la mayoría de los casos las lesiones son de bordes bien definidos con desvanecimiento o compromiso parcial de las corticales óseas21.
Usualmente se localiza en las corticales de las metáfisis de huesos largos, rara vez el compromiso se extiende sobre la fisis o cicatriz fisiaria hasta la epífisis o hacia la diáfisis. Cuando el compromiso se produce a nivel de huesos cortos entonces la lesión compromete toda la extensión del hueso generalmente, de manera que produce adelgazamiento de las corticales.
A diferencia de otros tumores cartilaginosos, el CMF rara vez se calcifica, se estima que solo del 2.4% al 16% de los casos tienen aspecto radiológico que sugiera calcificación3, cuando se presenta, en general se asocia más a casos de localización en huesos planos y pacientes mayores de 40 años21-23.
La Clasificación de Enneking y Campanacci se basa en las características radiológicas del tumor24. Fue diseñada para definir la extensión de la resección quirúrgica25: Grado 1: Son las lesiones con bordes bien diferenciados, cortical intacta o ligeramente adelgazada pero no deformada. Grado 2: Lesión con márgenes relativamente bien definidos, sin presencia de anillo radiopaco y con una cortical delgada y expandida. Por último la Grado 3: Lesión con bordes mal definidos (crecimiento rápido y permeativo), con compromiso de tejidos blandos, que no sigue el contorno del hueso y no está cubierta por capa de hueso reactivo.
Por otro lado, modalidades diagnósticas como la escanografía computarizada permiten evaluar con certeza la integridad cortical, así como la calcificación de la matriz condral y mixoide del tumor. En la resonancia magnética del CMF se caracteriza un halo periférico de intensidad intermedia con un centro hiperintenso en la secuencia de T2, dichos hallazgos se correlacionan en la secuencia de T1 como un realce periférico nodular en la intensidad de la señal asociado a una porción central hipointensa. Sin embargo, ninguna de las características radiológicas descritas representa un hallazgo específico que oriente sobre el diagnóstico del CMF, por lo que su confirmación es histológica.
El CMF es una patología neoplásica benigna de pronóstico favorable en la mayoría de los pacientes, sin embargo la literatura médica no reporta casos de resolución espontánea de este tipo de tumores y tampoco existe evidencia a favor de manejo conservador de los mismos por lo cual el pilar del tratamiento en los pacientes que cursan con CMF es el manejo quirúrgico.
En la actualidad, las opciones de manejo quirúrgico reportadas con mayor frecuencia en la literatura incluyen el curetaje de la lesión, resección local asociada a neoadyuvancia local con polimetilmetacrilato, resección extendida o escisión en bloque con o sin relleno del defecto cavitario haciendo uso de injertos óseos.
En general, la resección extendida y escisión en bloque han demostrado menores tasas de recurrencia, sin embargo, la posibilidad de realizar resecciones amplias se limita a la localización de la lesión por lo cual en algunos pacientes debe considerarse el uso de injertos o sustitutos óseo para cubrir defectos extendidos atribuidos a la resección.
El tratamiento con curetaje óseo solo tiene tasas de recurrencia hasta del 25%, sin embargo su combinación con el uso de adyuvantes locales como el polimetilmetacrilato disminuye la recurrencia según algunos autores, de manera que alcanza resultados similares a los obtenidos con la resección extendida.
Respecto a las consideraciones especiales para el manejo del CMF en pelvis, series de casos de CMF con compromiso a nivel pélvico han mostrado resultados satisfactorios para alternativas terapéuticas que incluyen el curetaje óseo con injerto local, resección local o incluso, algunos autores han planteado el uso de embolización selectiva preoperatoria seguido de resección, todas las alternativas anteriormente mencionadas sin evidencia de recurrencia clínica o radiológica tras 4 años de seguimiento.
El fibroma condromixoide es una neoplasia rara de comportamiento benigno, corresponde a menos de 0.5% de los tumores óseos. Cuando se presenta, generalmente su localización es a nivel de huesos los huesos largos de miembros inferiores, sin embargo, cuando se presenta en huesos planos, su localización más frecuente es a nivel del hueso iliaco, sin embargo no existen más de 70 casos reportados en la literatura médica a la fecha de compromiso del fibroma condromixoide a ese nivel, las descripciones de casos de CMF en el hueso iliaco se han descrito en pacientes mayores de 40 años de sexo masculino. Se presenta el caso de un paciente joven, funcional que asiste por un dolor de 1 año de evolución en la región inguinal.
Clínica y radiológicamente el tumor tiene las características típicas de un fibroma condromixoide a pesar de ser hallazgos inespecíficos. Dada la localización de la masa se decide realizar una resección intralesional asociada a tratamiento adyuvante local para disminuir la tasa de recidiva. De manera preoperatoria se lleva a embolización selectiva lo que disminuye el sangrado intraoperatorio. Se realiza un seguimiento a 8 meses en los cuales no hay signos clínicos ni radiológicos de recidiva, el dolor es controlado y la funcionalidad se ha recuperado paulatinamente.
La literatura actual reporta baja tasa de recurrencia en el manejo intralesional asociado a adyuvancia local tal como se manejó nuestro paciente, requiere mayor seguimiento para poder determinar resultados a mediano y largo plazo.
Fuentes de financiaciónRecursos propios de los autores
Declaración de conflicto de interésTodos los autores se declaran libres de conflicto de interés financiero o personal con lo relacionado al manuscrito o su contenido.