Se cuenta con poca literatura que relacione el mieloma múltiple con el hiperparatiroidismo primario en el contexto de las fracturas patológicas. Se presenta un paciente que consulta al Hospital Departamental Universitario del Quindío San Juan de Dios de Armenia por una fractura patológica, quien posteriormente presenta hallazgos sugestivos de mieloma múltiple asociado a hipercalcemia, lo que lleva al equipo terapéutico a plantear la asociación de ambas patologías en el manejo integral del paciente.
Due to the limited amount of information related to the association of multiple myeloma, hyperparathyroidism and pathological fractures, a case report is presented on a patient who arrived in the emergency room presenting with a pathological fracture accompanied with laboratory tests suggesting multiple myeloma, associated with increase serum calcium levels. This particular scenario led the medical team to consider a special therapeutical approach with regards of the presence and association of these two entities along with the diagnosis of a pathological fracture in the same patient.
Se presenta el caso de un paciente que consulta por dolor marcado en el miembro inferior derecho sin antecedente traumático, el cual presenta una fractura patológica y a quien, al realizar los estudios de laboratorio, se le encuentran hallazgos tanto para mieloma múltiple (MM) como para hiperparatiroidismo (HP) primario, una asociación inusual que se pretende discutir en este artículo.
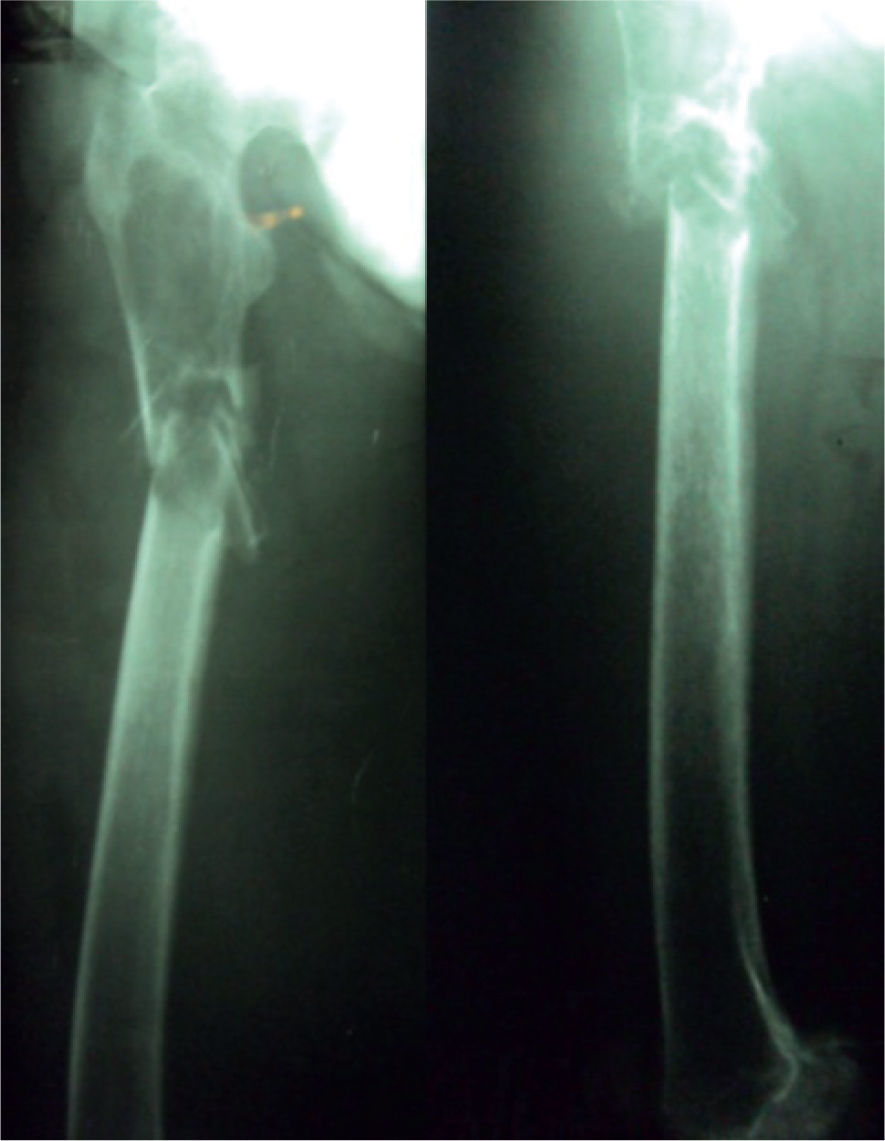
Caso clínicoUn hombre de 63 años, de raza mestiza, vigilante callejero de automóviles, ingresó en el Servicio de Urgencias del Hospital Departamental Universitario del Quindío San Juan de Dios de Armenia el 12 de agosto de 2011, luego de presentar, el día anterior, una caída desde su altura sobre el miembro inferior derecho. En el examen clínico de ingreso no se evidenció fractura ni deformidad, por lo que se decidió dar de alta hospitalaria con manejo analgésico y antiinflamatorio. El día siguiente, regresó al servicio de urgencias, refiriendo dolor a la movilidad del miembro inferior e incapacidad para lograr la bipedestación y la deambulación. Se le tomó una radiografía anteroposterior de fémur derecho que evidenció una fractura diafisaria en el tercio proximal (fig. 1) —fractura que no se había sospechado clínicamente en la primera consulta—, y se hospitalizó inicialmente para el manejo quirúrgico de la fractura.
Se obtuvieron los siguientes resultados de laboratorio: hemoglobina de 10g/dl; hematocrito de 31,8%; leuco citos de 8120/ml; monocitos de 7%; cayados de 2%; plaquetas de 228 000/ml; velocidad de sedimentación globular de 53mm/h (n: < 15mm/h); nitrógeno ureico de 32,1mg/dl; creatinina de 1,9mg/dl; fosfatasa alcalina de 440U/l (n: 44–147UI/l). En la radiografía de tórax se evidenció un nódulo solitario entre los lóbulos medio e inferior del pulmón derecho (fig. 2).
Durante la hospitalización fue valorado por el servicio de medicina interna por las características patológicas de la fractura del fémur derecho, por el nódulo pulmonar y por los valores elevados de la fosfatasa alcalina. Este servicio solicitó realizar una gammagrafía ósea, la cual informó: “Compromiso metastásico poliostótico metabólicamente activo en hombro derecho, articulación acromioclavicular izquierda, unión esternoclavicular derecha, cuarto arco costal derecho, cuerpo vertebral de T8, en varias uniones costovertebrales derechas, en la cresta ilíaca derecha y en la unión del tercio proximal con los 2 tercios distales del fémur derecho” (fig. 3). Igualmente, informaron en este mismo examen que el nódulo solitario en la base pulmonar derecha era una calcificación. En un principio, se consideró el diagnóstico de MM. Se solicitó valoración por el servicio de oncología, donde le tomaron los siguientes exámenes paraclínicos: electroforesis de proteínas que reportó hipogammaglobulinemia marcada en 5,7% (n: 9,0–16,0%); proteína de Bence Jones positiva; biopsia de médula ósea con cambios megaloblásticos en todas las líneas hematopoyéticas, con aumento del pool plasmocítico y discrasia plasmocitaria compatible con MM, confirmándose este diagnóstico.
Durante la hospitalización fue valorado por el servicio de nefrología para el estudio de la función renal alterada. Se solicitaron nuevos paraclínicos, cuyos resultados fueron: BUN de 43,2mg/dl; creatinina de 2,4mg/ml; proteínas en orina en 24h de 687,9mg/24h con un volumen de 3640cm3; calcio sérico de 14,1mg/dl (n: 9–11mg/dl), y fósforo (no documentado en la historia). Se consideró que el paciente cursaba con insuficiencia renal aguda, además de su enfermedad renal crónica de base, secundaria a hipercalcemia, la cual fue manejada con furosemida y líquidos endovenosos.
También por la hipercalcemia se solicitaron los niveles de paratohormona (PTH), cuyo resultado fue de 2137pg/ml (n: 10–55pg/ml), surgiendo la impresión diagnóstica de HP primario. Se realizó una ecografía de tiroides que mostró una “lesión nodular hiperecoica de 20×19×25mm adyacente al lóbulo izquierdo de la tiroides y medial a la arteria carótida izquierda, sugestiva de tumor adenomatoso”. Para confirmar el diagnóstico de HP primario, se realizó una gammagrafía paratiroidea (fig. 4) en la cual se evidenció un adenoma paratiroideo hiperfuncionante adyacente al polo superior del lóbulo izquierdo de la glándula tiroides. Con los diagnósticos documentados, se remitió el paciente al servicio de cirugía de cabeza y cuello para la resección del tumor paratiroideo, y al servicio de oncología para el manejo del MM.
DiscusiónEl HP es una alteración de las glándulas paratiroides. Hay entre 1 y 8 glándulas (generalmente 4), y se encuentran ubicadas en la cara posterior y bordes laterales de la glándula tiroides1. En esta entidad clínica existe mayor producción de hormona paratiroidea (PTH), la cual se va a traducir en el cuerpo en un aumento del calcio sérico, en especial el ionizado2, además de incrementar la excreción de fósforo a nivel renal y la síntesis de 1,25-dihidroxivitamina D3. Clínicamente se manifiesta con hipercalcemia, hipofosfatemia, hipercalciuria y PTH elevada3,4. En cuanto a los huesos, se comporta como una osteítis fibrosa quística o, como en este caso, con fracturas patológicas sintomáticas5–8. Se observan imágenes en “sal y pimienta” (reabsorción de áreas medulares de hueso trabecular, con aspecto punteado del cráneo, áreas radiolúcidas que alternan con pequeños puntos de esclerosis) (fig. 5), al igual que la reabsorción subperióstica de la cara radial de las falanges de las manos, particularmente de los dedos índice y medio.
En cuanto a la histología, se presenta reabsorción osteoclástica intratrabecular formadora de túneles, signo patognomónico de reabsorción ósea secundaria al HP. El HP se puede clasificar como primario cuando hay una alteración propia de las glándulas paratiroides, como adenomas (80%), hiperplasia (15%), carcinoma (2–3%)9. Se considera HP secundario cuando hay una disfunción paratiroidea que lleva a hipocalcemia sostenida (asociado a otra patología como enfermedad renal crónica, deficiencia de vitamina D, síndrome de malabsorción intestinal y pseudohipoparatiroidismo —respuesta deficiente de los receptores periféricos de PTH—). En el HP primario el crecimiento de las paratiroides es autónomo y quizá irreversible, mientras que en el secundario es una hiperplasia adaptativa y quizá reversible de todas las glándulas. Luego del trasplante renal exitoso en el HP secundario, se normalizan la excreción de fosfato y la hidroxilación renal de vitamina D, con lo que disminuye la PTH y la resorción ósea, se normaliza la calcemia y se reduce la hiperplasia de células paratiroideas, mejorando el cuadro clínico en 6 a 18 meses. Pero en el 2 al 40% de los enfermos, luego del trasplante persiste la elevación de PTH y el síndrome bioquímico del HP. Se desconoce si esto se debe a la autonomía de las glándulas o a la hipofosfatemia o hipocalcemia persistentes. Se atribuiría a inactivación monoclonal de un factor supresor del crecimiento.
El MM se conoce como una proliferación excesiva de células plasmáticas, en especial las células linfoides B maduras, lo que implica una disminución marcada de las células madre pluripotenciales de la médula ósea, además de la reducción de eritrocitos y otras células linfoides, y la aparición de paraproteínas en plasma y orina, que en últimas son las que ayudan a hacer el diagnóstico10–14. Clínicamente, se va a expresar como anemia, inmunosupresión, hipercalcemia, falla renal, proteína de Bence Jones positiva en sangre u orina, electroforesis de proteínas en sangre con hipergammaglobulinemia (en este paciente se halló hipogammaglobulinemia, hallazgo inusual, el cual también se puede encontrar en algunos casos de leucemia), además de lesiones osteolíticas, con formaciones tumorales infiltrativas de células plasmocíticas en la medula ósea. Además, se producen citocinas inflamatorias como la interleucina-6 y el factor de necrosis tumoral beta, las cuales estimulan las células osteoclásticas y, por ello, se aumenta la reabsorción ósea y la progresión de esta enfermedad10–12. Igualmente, se encuentra hipercalcermia e hipercalciuria, signos clínicos también presentes en el HP primario, que pueden aparecer en el 20–40% de los casos de MM15.
La asociación del HP primario con las gammapatías monoclonales (GMC), en especial el MM, ha sido un tema poco descrito en la literatura médica actual: solo hay 17 casos reportados en la literatura mundial16–18. En un intento por hacer el mayor acercamiento a la realidad de este tema específico, Arnulf et al.19 recomiendan hacer la búsqueda de MM siempre que se compruebe HP primario; estos autores, en una población de 101 pacientes con HP primario, encontraron la asociación con algún tipo de GMC en el 10% de los casos. El primer estudio sobre la presentación concomitante de estas patologías fue realizado en 1982, e informó la aparición de alguna GMC en el 1% de una población de 911 pacientes estudiados en la Clínica Mayo en esa época20. Se ha asociado a personas entre los 60 y 80 años, principalmente en mujeres después de la menopausia, como grupo poblacional con mayor incidencia de ambas patologías21,22. Otro grupo en el que se debe buscar concomitancia con MM o alguna otra GMC son los pacientes paratiroidectomizados en quienes persista la hipercalcemia. En Colombia, solo se ha descrito un reporte de caso, en la ciudad de Cali, con aparición simultánea de HP primario y GMC de significado incierto23. Se describe la gran importancia de la IL-6 como factor proinflamatorio, además de la activación osteoblástica, que entre sus múltiples funciones inmunológicas se asocia a la activación de linfocitos B y plasmocitos, como posibles desencadenantes de alguna de las GMC que se pueden relacionar con el HP primario24.
Dentro del estudio clínico para la búsqueda del HP primario, conviene hacer una anamnesis completa y un examen físico suficiente para orientar el diagnóstico inicial de esta patología; además, entre los exámenes paraclínicos para el estudio de esta enfermedad, se recomienda solicitar niveles de PTH y de calcio sérico. El 80% se puede atribuir a adenomas hiperfuncionantes de las paratiroides, que remiten con manejo quirúrgico en la gran mayoría de los casos25,26, además del tratamiento concomitante con calcio y vitamina D, reduciendo la probabilidad de fracturas incidentales secundarias a esta patología27.
Generalmente, los médicos con experiencia en estos casos pueden encasillar el diagnóstico de alguna de estas 2 patologías por separado, y el hecho de no considerar la concomitancia entre ambas puede hacer que sus pacientes reincidan en la sintomatología que los ha hecho consultar. El hallazgo de ambas patologías y el tratamiento integral de estas lograrán la evolución adecuada del paciente y mejorarán el pronóstico del mismo.
En el paciente presentado en este reporte de caso se encontró hipercaptación en la gammagrafía ósea, cuando lo común es que exista hipocaptación. La gammagrafía ósea, usualmente es de poca utilidad en pacientes con MM, salvo que se presenten fracturas patológicas. Consideramos que el hallazgo de hipercaptación con lesiones metabólicamente activas en nuestro paciente puede corresponder a osteítis fibrosa quística, a las fracturas patológicas o a los casos inusuales de hipercaptación y MM publicados en la literatura.
Durante la hospitalización del paciente se le hizo acompañamiento permanente y se le explicó en múltiples ocasiones sus enfermedades y los resultados de los exámenes de laboratorio. De igual forma, se le explicó el deseo de realizar este escrito con base en su caso clínico, para lo cual se contó con su aprobación mediante la firma del consentimiento informado para la divulgación científica del caso sin revelar identificación alguna.
AgradecimientosLos autores agradecen al personal asistencial y administrativo del Hospital Departamental Universitario del Quindío San Juan de Dios de la ciudad de Armenia, que suministró el apoyo para lograr el diagnóstico, en especial a los servicios de medicina interna y nefrología, que ayudaron en el enfoque del caso clínico. Los autores ofrecen un agradecimiento especial a los miembros del servicio de cirugía ortopédica y traumatología del mismo hospital, que evaluaron cada día al paciente, por brindar los espacios de discusión académico- científica para el grupo de médicos especialistas, médicos generales, médicos internos y estudiantes de medicina de la Universidad del Quindío con el fin de aprovechar al máximo las enseñanzas de este inusual caso.