El tumor pardo, también conocido como osteoclastoma ó como osteítis fibrosa quística, es un tumor lítico, que se presenta en hiperparatiroidismo (primario, secundario y terciario), aunque su presentación habitual es altamente invasiva, no tiene potencial de malignidad. Los tumores pardos en la mano son muy poco frecuentes y existen solo algunos reportes de casos.
Presentamos un paciente masculino de 18 años con una tumoración dura, no móvil, adherida a planos profundos en región dorsal de la mano derecha sobre el cuarto metacarpiano, que además limita la flexión y extensión del cuarto dedo sin alterar su función neurovascular. El paciente fue sometido a resección de la tumoración que involucraba por completo al cuarto metacarpiano derecho, además se realizó un abordaje lateral directo en miembro pelvico izquierdo para tomar un injerto autólogo de peroné no vascularizado.
Es importante la detección temprana de este tipo de tumores y se debe dar un adecuado seguimiento, ya que, al progresar, generan una destrucción ósea importante y el tratamiento se vuelve de mayor complejidad.
En etapas tempranas, el manejo agresivo con resección y aporte óseo puede evitar secuelas funcionales.
El uso de injerto no vascularizado de peroné de seis centímetros para la sustitución del cuarto metacarpiano por osteolísis secundaria a un tumor pardo es una alternativa adecuada de tratamiento que permite la preservación estético funcional de la mano.
The brown tumour, also known as osteoclastoma, or as osteitis fibrosa cystica, is a lytic tumour, which occurs in hyperparathyroidism (primary, secondary, and tertiary), although its usual presentation is highly invasive, has no potential for malignancy. Brown tumours of the hand are sporadic, and there are only few case reports.
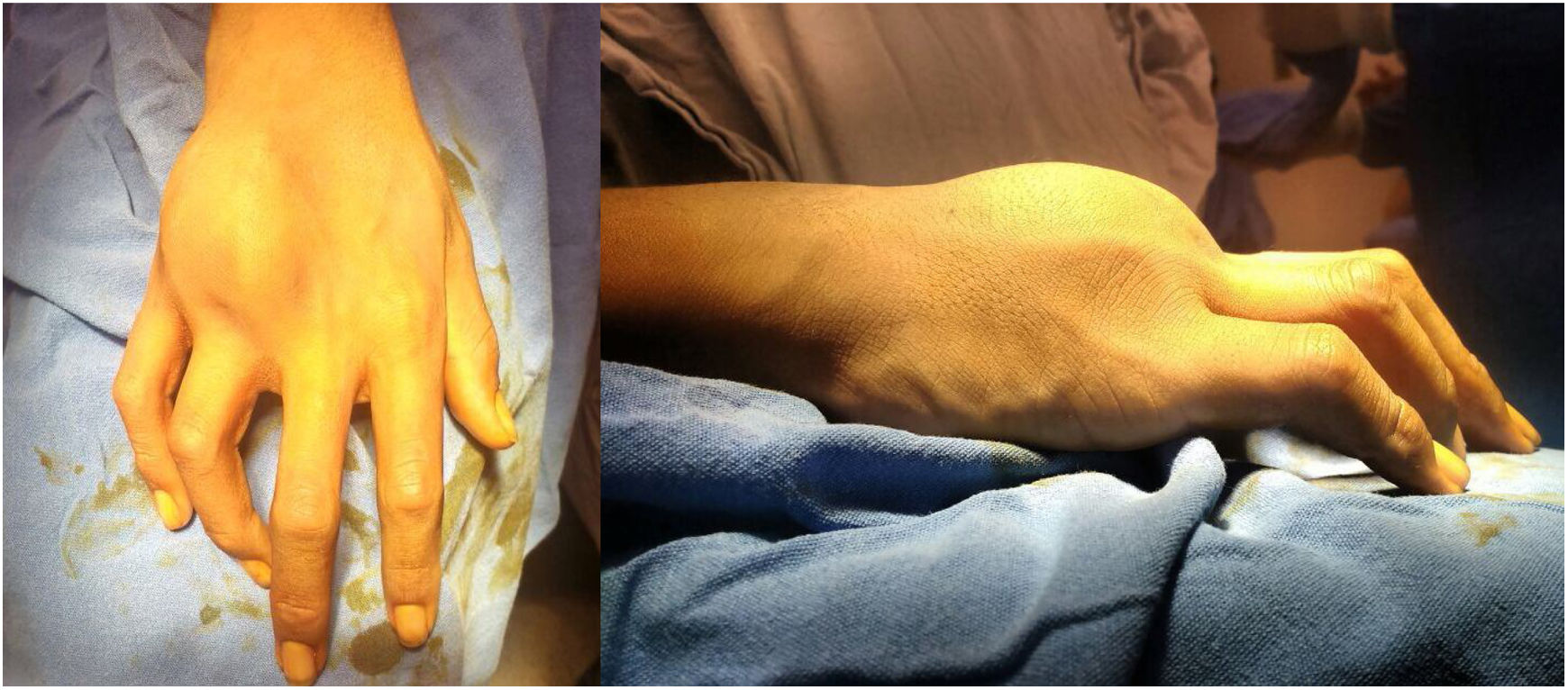
The case is presented of an 18-year-old male patient with a solid, non-mobile tumour, adhered to deep planes, in the dorsal region of the right hand over the fourth metacarpal. This also limited the flexion and extension of the fourth finger, but did not show alterations in the neurovascular function of the finger.
The patient underwent a tumour resection that completely involved the right fourth metacarpal. A direct lateral approach was made in the left pelvic limb to perform a non-vascularised autologous fibular graft.
Early detection of this type of tumour is important, and an adequate follow-up must be carried out, since when they progress, they generate significant bone destruction and the treatment becomes more complex.
In early stages, aggressive management of resection and bone support can prevent functional sequelae.
El tumor pardo, también conocido como osteoclastoma, ó como osteítis fibrosa quÍstica, es un tumor lítico, que se presenta en hiperparatiroidismo (primario, secundario y terciario), aunque su presentación habitual es altamente invasiva, no tiene potencial de malignidad1,2.
La incidencia reportada de los tumores pardos es de 1.5% -13% en pacientes en tratamiento de diálisis, principalmente en pacientes con osteodistrofia renal no tratada de un hiperparatiroidismo secundario3,4. Usualmente, la aparición de este tumor, es el resultado de un exceso de actividad osteoclástica y consiste en una colección de osteoclastos mezclados con tejido fibroso y tejido óseo pobremente mineralizado5–7. Este tumor, contiene hemosiderina fagocitada que le da su coloración parda8. Se manifiesta con lesiones únicas ó multiples en hueso y tejidos blandos, y el no tratarlo puede llevar a formación de quistes con necrosis central y fracturas9. Los tumores pardos en la mano son muy poco frecuentes y existen solo reportes de casos10. El diagnóstico diferencial de este tipo de tumores es con el tumor de células gigantes de hueso11,12 el cual se caracteriza por presentar similares hallazgos clínicos e imagenológicos, sin embargo, la descripción histopatologíca es diferente.
Nuestro paciente acepta y firma el concentimiento para la presentación de su caso.
Presentación del casoPaciente masculino de 18 años con insuficiencia renal desde los 10 años de edad, que ha sido tratado con hemodiálisis por 6 años por presentar rechazo a transplante renal a los 15 años; asiste a la consulta externa del hospital, por presentar un tumor no doloroso en el dorso de su mano derecha, el cual, había empezado 12 meses antes como una pequeña lesión, recibiendo tratamiento sustitutivo con calcio y vitamina D3; sin embargo, el volumen aumentó progresivamente hasta que decidió acudir a valoración de servicio de ortopedia.
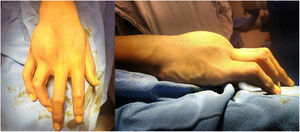
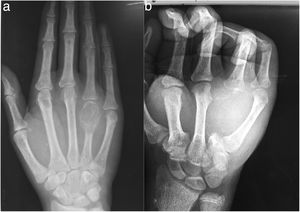
A la exploración física, se observa una tumoración dura, no móvil, adherida a planos profundos, en región dorsal de la mano derecha sobre el cuarto metacarpiano, que además limita la flexión y extensión del cuarto dedo, no presenta alteraciones en la función neurovascular del dedo. (fig. 1).
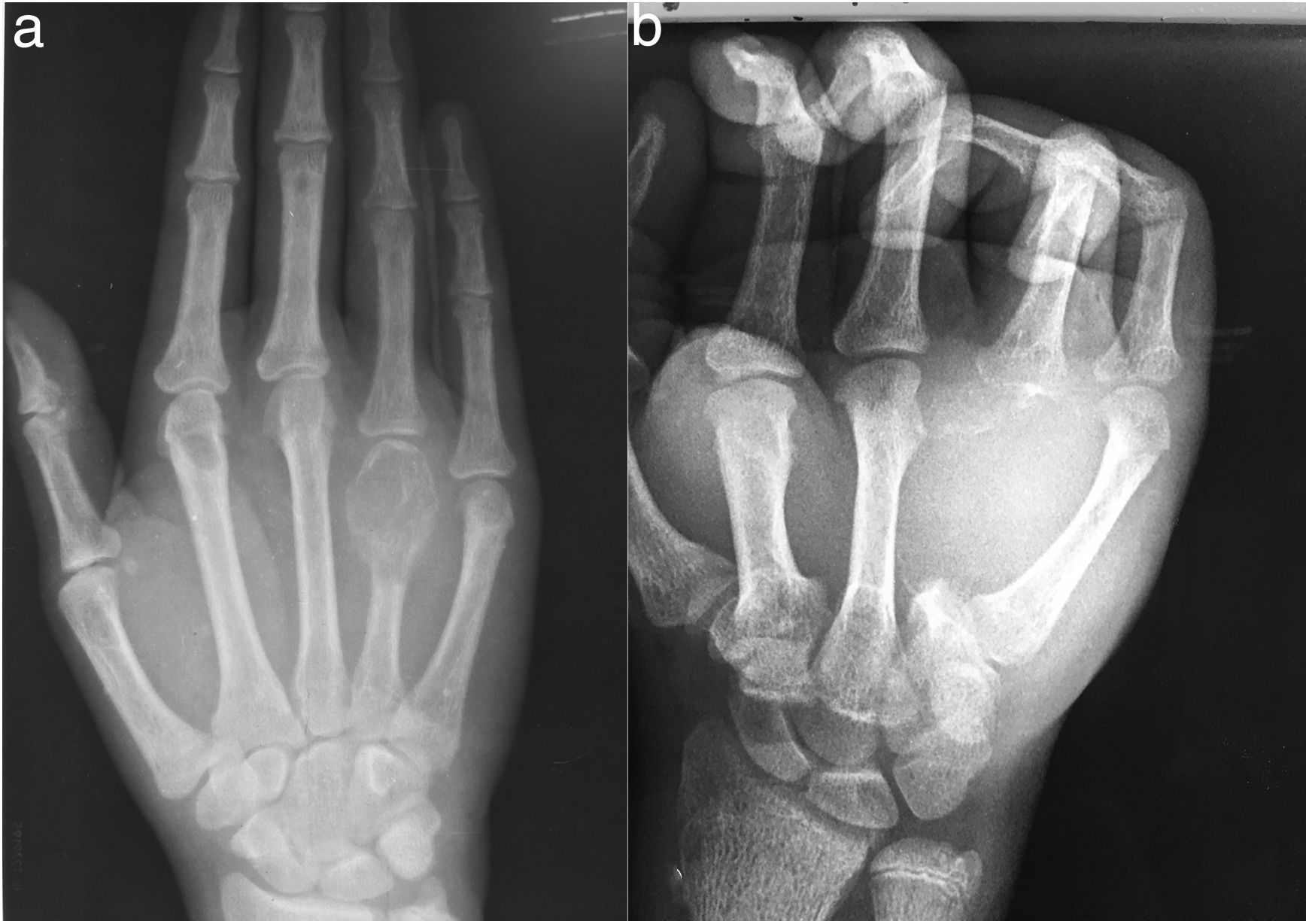
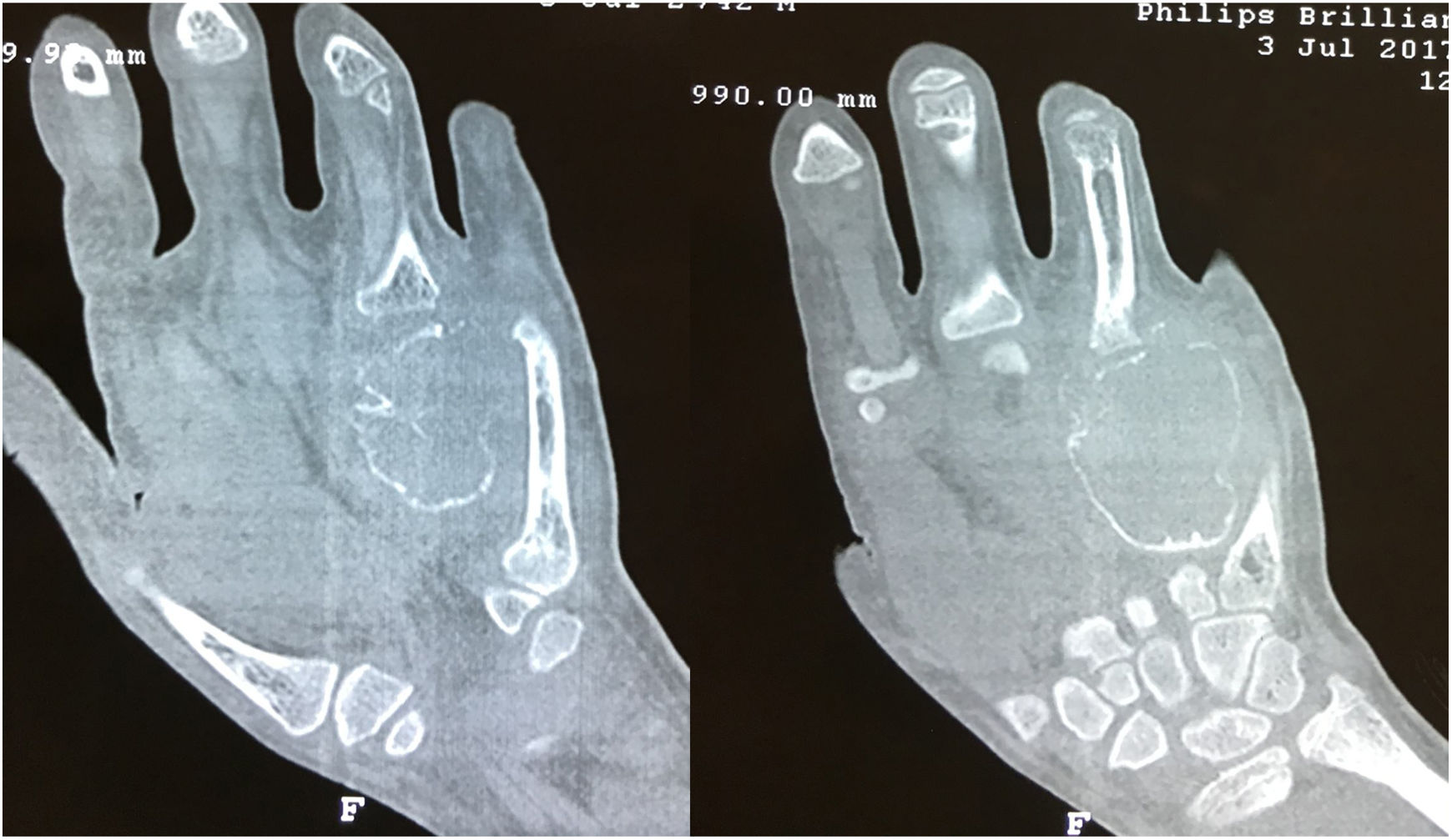
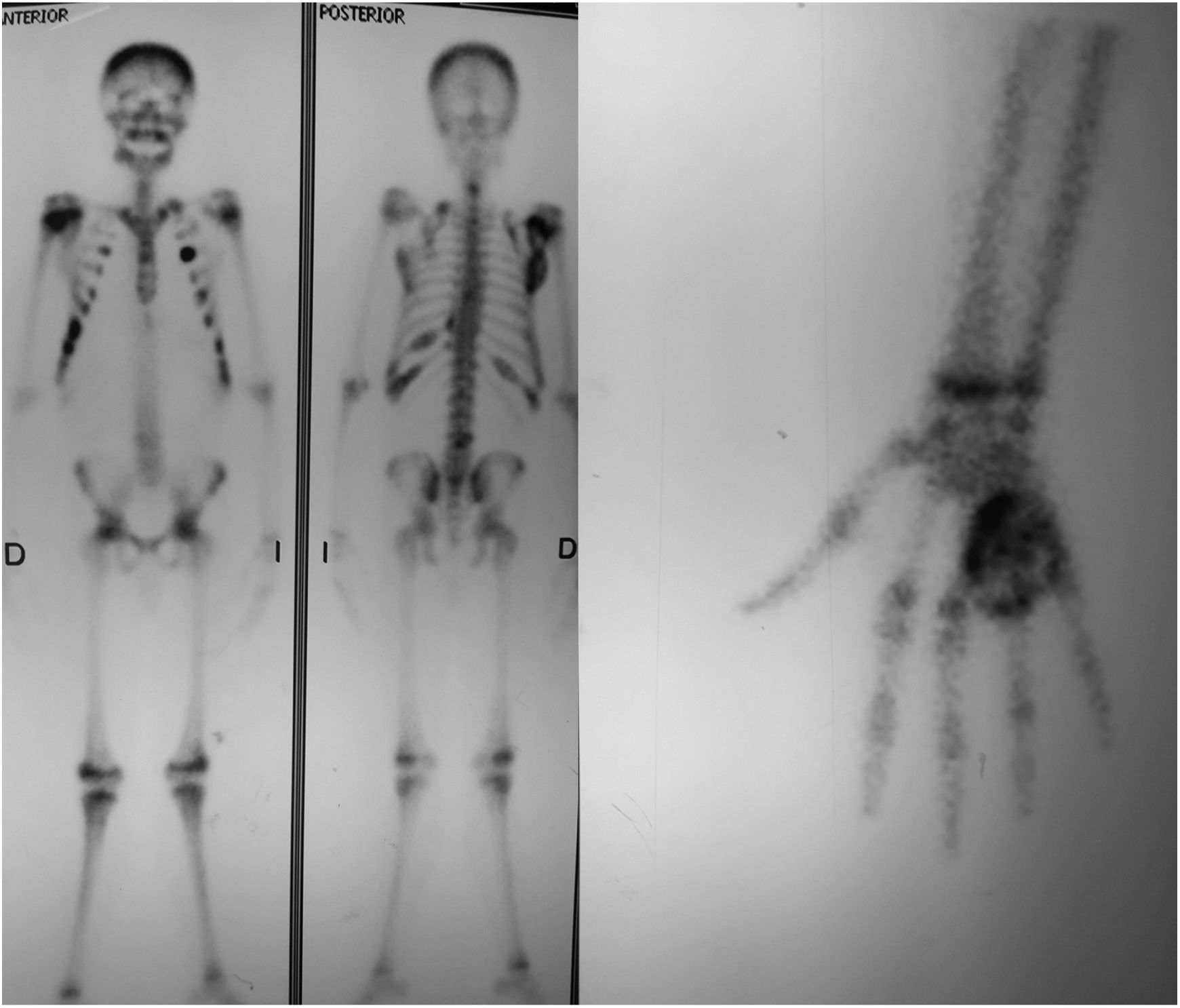
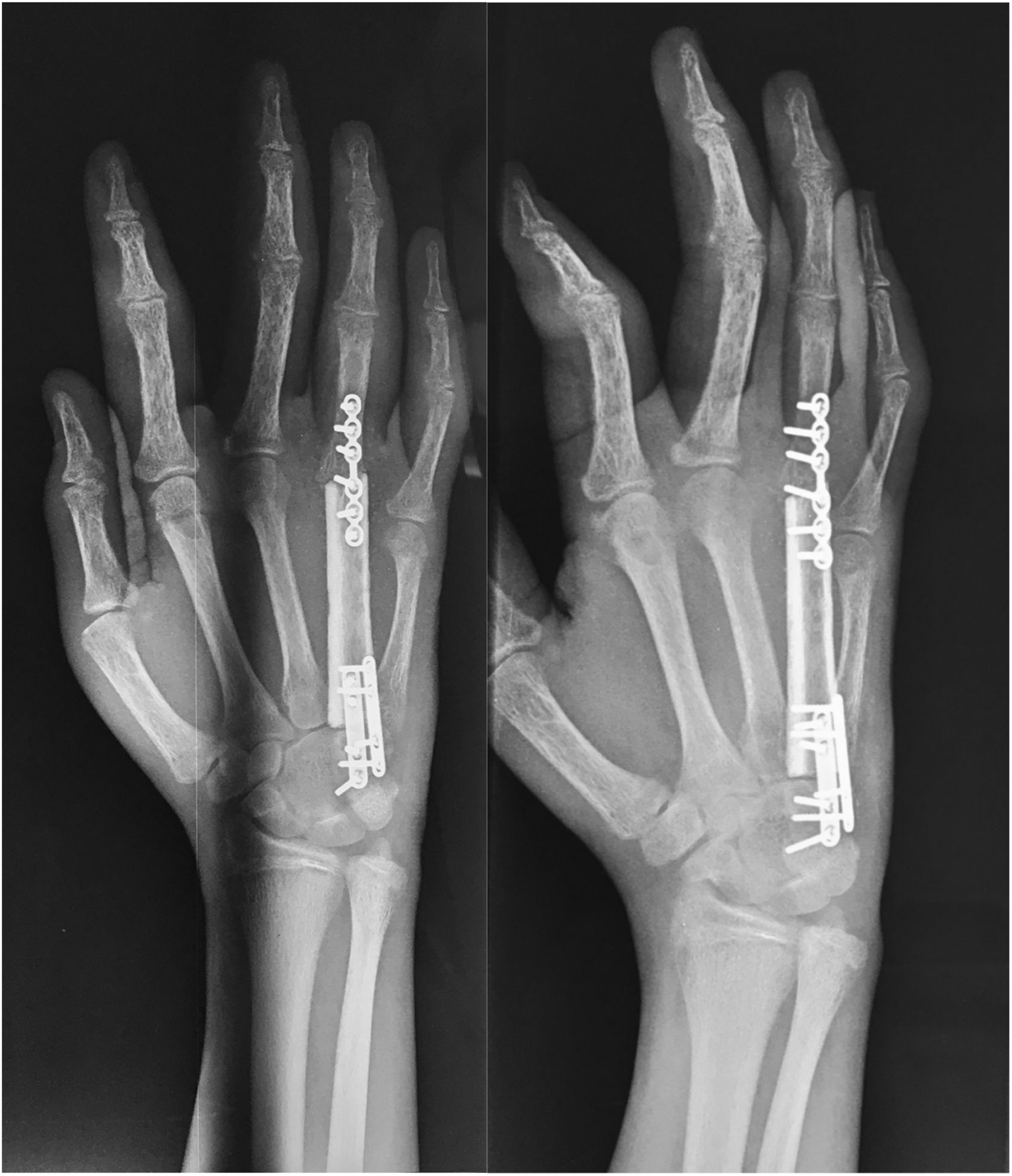
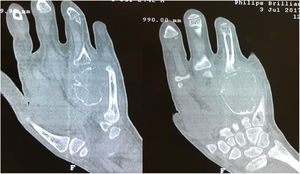
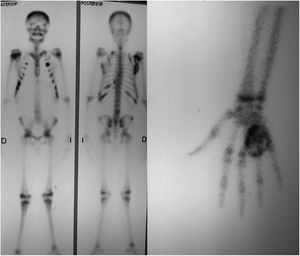
Las radiografías de la mano derecha mostraron lesión quística en expansión en el cuarto metacarpiano, Se cuenta con serie radiográfica desde las valoraciones iniciales antes de ser enviado a la consulta de ortopedia, donde llega ya en etapa avanzada, (fig. 2) una Tomografía computarizada de la mano reveló una lesión ósea difusa y heterogénea de características lítica multiloculada (fig. 3); se realizó además estudio gamagráfico con evidencia de múltiples lesiones con aumento del recambio óseo en mandíbula, tórax, columna vertebral, hombro derecho y esqueleto apendicular, secundario a osteodistrofia renal (fig. 4). La biopsia incisional de la lesión mostro células gigantes multinucleadas dentro de un estroma fibroso compatible con tumor pardo.
Creatinina sérica: 8.71mg/dl, fosfatasa alcalina (432 U/l); los niveles de calcio sérico fueron 2.3 mmol/L y su hormona paratiroidea fue 1193 pg/ml (normal en ERC estadio V: 250-300 pg/ml), Urea 20.0mg/dl, potasio 7.50mEq/l, magnesio 1.4mEq/l y hemoglobina 8.4g/dl. Así entonces la correlación de los datos clínicos, estudios de imagen, hallazgo histopatológico y datos de laboratorio, llevaron a la conclusión que la lesión ósea en su mano derecha correspondía a un tumor pardo desarrollado por un cuadro de hiperparatiroidismo secundario, asociado a la osteodistrofia renal del paciente.
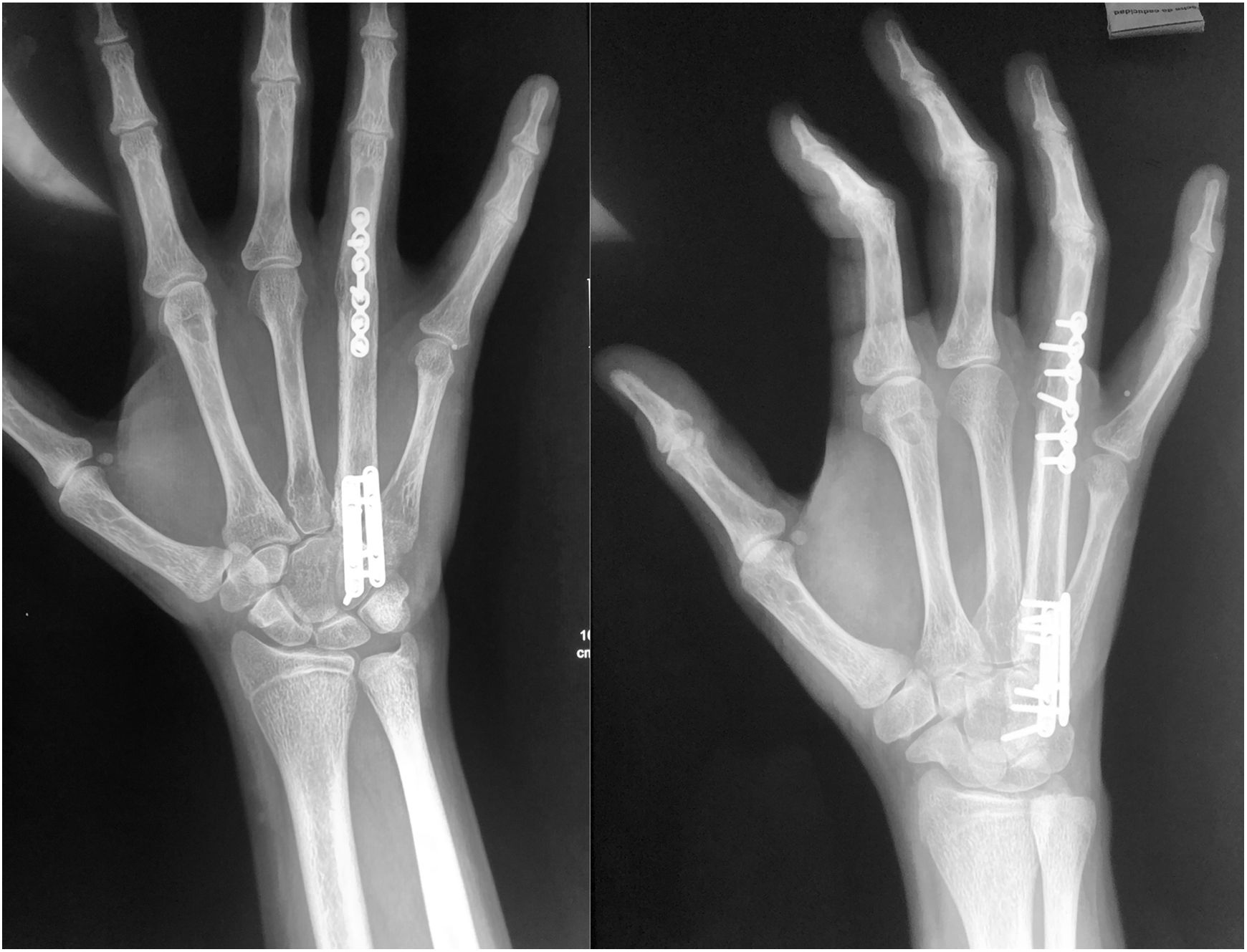
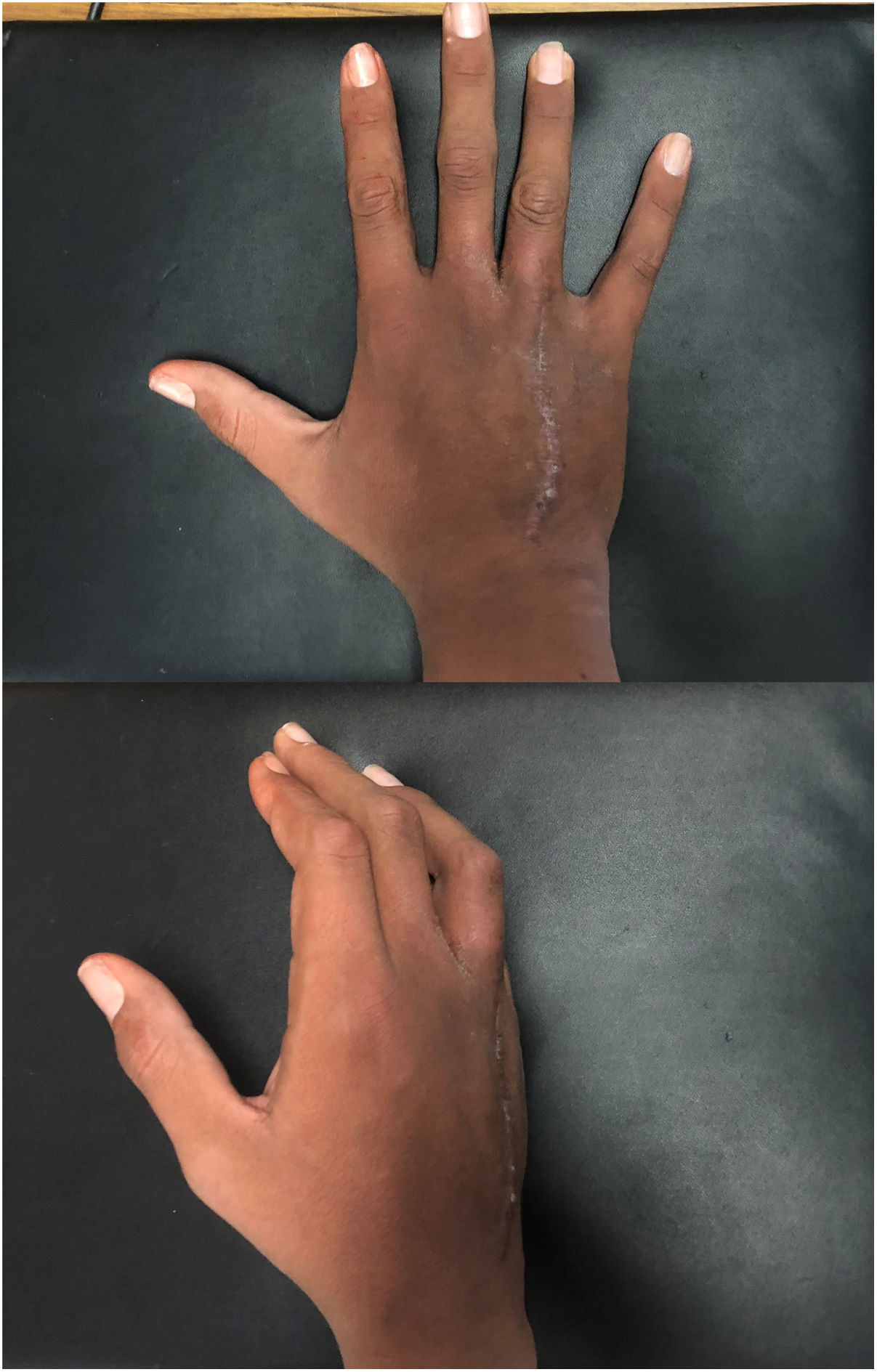
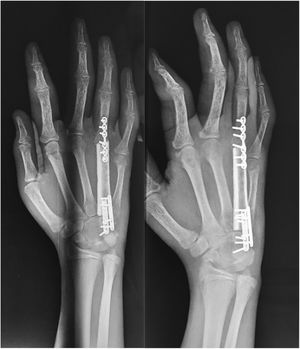
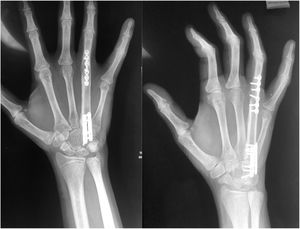
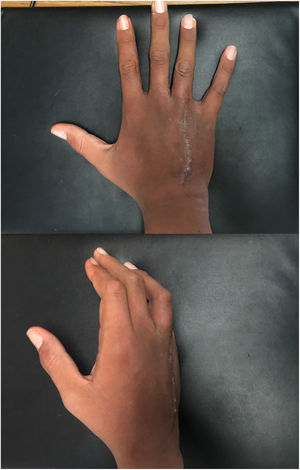
Técnica quirúrgicaEl paciente es sometido a resección de tumoración que involucra por completo al cuarto metacarpiano derecho, se realiza abordaje lateral directo en miembro pelvico izquierdo para realizar toma de injerto autólogo de peroné no vascularizado (7cm), el cual es resecado con microsierra de alta velocidad, colocación de injerto del peroné el cual es remodelado y adaptado a la medida del 4to metacarpo resecado por completo por la afección tumoral (6cm) se presenta el injerto y se fija con placas de adaptación 2.0mm, realizando artrodesis ganchoso – metacarpo – falángica. Y se sutura por planos, (fig. 5). A los 3 meses el paciente evoluciona favorablemente mediante osteointegración completa del injerto de peroné no vascularizado (fig. 6). Hay una cicatrización completa y adecuada y se conserva flexión y extensión de articulación interfalangica proximal y distal del cuarto dedo, sin alteraciones neurovasculares (fig. 7).
Actualmente el paciente presenta en el cuestionario de evaluación funcional DASH (Disabilities of the Arm, Shoulder and Hand) una puntuación de 13, un resultado muy bueno, el paciente realiza actividades como cargar objetos y actividades manuales habituales para su vida diaria sin dolor13.
DiscusiónLos tumores pardos del hueso se describen como patologías benignas y de baja frecuencia. Este tipo de tumor se ha encontrado localizado principalmente en huesos largos y en mandibula, sin embargo, ya se han descrito multiples sitios de localización y el impacto que produce por su tamaño (efecto de masa) y por su alta sospecha de malignidad.
Como ha sido comentado por varios autores la localización de tumor pardo en metacarpo es muy poco frecuente14.
El proceso fisiopatológico de la formación de la lesión se encuentra íntimamente relacionado por la sobreactividad de la parato-hormona (PTH)15–19 por disfunción de los sistemas renales para la producción de 1,25-dihidroxicolecalciferol y la regulación de la reabsorción de calcio y fosfatos en los túbulos renales, al igual que la absorción de calcio a nivel intestinal20–22. Este proceso es indirecto y depende de la unión de la PTH al PTHR1 presente en los osteoblastos. Tanto la PTH como la 1,25-(OH)2D aumentan la expresión del ligando activador del receptor NF-κB (RANKL) en los osteoblastos. La unión de RANKL a su receptor RANK presente en los preosteoclastos promueve su diferenciación a osteoclastos activos. Además, la 1,25-(OH)2D incrementa la osteoclastogénesis al inhibir la expresión de la osteoprotegerina, un receptor soluble del osteoblasto que compite con RANK por la unión de RANKL. De esta forma, la PTH y la 1,25-(OH)2D aumentan la calcemia al incrementar los osteoclastos activos en el hueso. La sobreactividad de PTH produce una diferenciación y división de osteoclastos, osteoblastos y osteocitos de manera desproporcionada y se ve corrompido el proceso de reparación, resorción y mineralización del hueso; haciéndolo susceptible a microfracturas que posteriormente se repletarán de hematomas y sustitución grasa con depósitos de hemosiderina y un contenido membranoso quístico que se expande de manera exocítica.
Cuando el tumor es secundario a un déficit de vitamina D, la sustitución médica con vitamina D3 a 45000 UI y calcio 500mg diario, es suficiente para restituir la pérdida ósea, sin embargo cuando nos enfrentamos a un paciente con enfermedad renal crónica, la sustitución con vitaminas en etapas avanzadas de la enfermedad no es suficiente, y se requiere ofrecer alternativas farmacológicas y quirúrgicas para evitar dolor, afecciones estrucutrales óseas diafisarias ó articulares, limitaciones del movimiento y lesión de nervios periféricos23,24. En la mayoría de los esquemas terapéuticos se han descrito la resección quirúrgica de paratiroides, que se acompaña de resección quirúrgica del tumor, siempre acompañada de manejo farmacológico25–52.
Nuestro paciente en una valoración inicial por otro servicio de ortopedia, le fué propuesto la amputación funcional del cuarto dedo con resección del cuarto metacarpiano, sin emabrgo, el paciente no estuvo de acuerdo por lo que solicitó una segunda opinión con nuestro servicio, donde se propone el tratamiento descrito con la finalidad de preservar el dedo, logrando la satisfacción del paciente al preservar el dedo y logrando restaurar las actividades cotidianas del paciente, sin dolor.
Es importante la detección temprana de este tipo de tumores y se debe dar un adecuado seguimiento, ya que al progresar, generan una destrucción ósea importante y el tratamiento se vuelve de mayor complejidad.
En etapas tempranas, un manejo agresivo de resección y aporte óseo puede evitar secuelas funcionales.
El uso de injerto no vascularizado de peroné de 6cm para la sustitución de 4to metacarpiano por osteolisis secundaria a tumor pardo, es una alternativa adecuada de tratamiento, que permite la preservación estético funcional de la mano.
FinanciaciónLa financiación ha sido realizada con recursos propios de los autores.
Conflicto de interésNo contamos con conflicto de intereses para la presentación de este artículo.