La atención psicosocial y el tratamiento de mantenimiento con metadona (TMM) son las estrategias preferidas para el manejo de adictos a heroína, pero los resultados siguen siendo insatisfactorios, lo que justifica la búsqueda e intervención sobre los factores que influyen en la respuesta al tratamiento.
MétodosCon el propósito de determinar la contribución de una serie de variables demográficas, clínicas y genéticas en las concentraciones séricas y la respuesta a la metadona, estudiamos a pacientes del TMM que estuvieran recibiendo metadona con supervisión y sin cambios en las dosis por lo menos durante las últimas 2 semanas. Se les registró edad, sexo, índice de masa corporal (IMC), tiempo de abuso de heroína, adicción a otras drogas, antecedentes delictivos, dosis diaria actual de metadona, tiempo de permanencia en el TMM, comorbilidad y comedicación. Se les tomaron muestras de sangre para determinar concentraciones séricas de metadona racémica y sus enantiómeros R- y S-, y para la tipificación de alelos candidatos de los genes POR, CYP2B6, ABCB1, GRIN1, OPRM1, SLC6A3, DßH y ARRB2, todos ellos asociados con el metabolismo, la distribución tisular y el mecanismo de acción de la metadona. La cuantificación de metadona se hizo mediante HPLC-DAD y la detección de los marcadores genéticos por los métodos de PCR en tiempo real y VNTR.
ResultadosSe incluyó a 80 personas de 23,5±5 años (el 86% varones), todos policonsumidores de sustancias adictivas, el 60% con antecedentes delictivos, con 5,1±2,9 años de consumo de heroína y 5,3±4 meses de ingreso al TMM, con 41±12mg/día de metadona tomada con supervisión. Las concentraciones valle de RS-, R- y S-metadona fueron, respectivamente, 168±77, 84±40 y 84±42 ng/ml. Todos los genotipos estuvieron en equilibrio de Hardy-Weinberg. Las dos pruebas de orina fueron negativas para heroína en el 61,3% (49/80) de los voluntarios; el descenso en el consumo de cocaína/basuco fue del 83%; el de marihuana, del 30% y el de otros psicoactivos (inhalantes, benzodiacepinas, anfetaminas) bajó a cero, mientras el consumo de tabaco permaneció en el 93,5% (75/80). Las concentraciones de metadona racémica y sus enantiómeros se correlacionaron significativamente con las dosis diaria del fármaco, pero ninguna de las demás variables demográficas, clínicas o genéticas incidió en la concentración sérica de metadona. En cuanto a los resultados del TMM, los no consumidores y los consumidores ocasionales de heroína, así como los que abandonaron el consumo de otros psicoactivos y los que no, tuvieron características similares con respecto a las variables demográficas, genéticas y clínicas, incluidas las concentraciones sanguíneas de metadona, con excepción de los individuos que no disminuyeron el consumo de otros psicoactivos distintos de heroína, quienes tuvieron significativamente (p=0,03) mayores concentraciones sanguíneas de S-metadona que quienes sí abandonaron el consumo.
ConclusionesHubo importante reducción en los consumos de heroína y otros psicoactivos y reinserción social de los pacientes; sin embargo, la amplia superposición entre las dosis efectivas e inefectivas de metadona apunta a la presencia de variables personales y sociales que trascienden el simple manejo farmacológico y probablemente deban ser abordadas con más éxito desde lo psicosocial, particularmente en lo que tiene que ver con la identificación y superación de las experiencias detonantes de recaídas y con ciertos rasgos del paciente, tales como su nivel de estrés psicológico o sus trastornos psiquiátricos.
Psychosocial care and methadone maintenance treatment (MMT) are the preferred strategies for the management of heroin addicts, but the results are still unsatisfactory, justifying the search and intervention of the factors influencing the response to treatment.
MethodologyIn order to determine the contribution of demographic, clinical and genetic variables on serum concentrations and response to methadone, we investigated patients on MMT, who were receiving methadone in supervised and unchanged doses at least during the previous two weeks. The age, gender, body mass index (BMI), duration of heroin abuse, addiction to other drugs, criminal background, current daily methadone doses, time spent in the TMM, comorbidity and concomitant medication were recorded. Blood samples were taken for the determination of serum levels of racemic methadone and its R and S-enantiomers, and for typing of candidate alleles of POR, CYP2B6, ABCB1, GRIN1, OPRM1, SLC6A3, DßH and ARRB2 genes, all associated with the metabolism, tissue distribution and mechanism of action of methadone. Methadone quantification was by HPLC-DAD, and the detection of genetic markers by Real Time PCR and VNTR methods.
ResultsA total of 80 subject volunteers were enrolled, with a mean age of 23.5 (5) years (86% male), all of them were addicts of multiple drugs, 60% with a criminal background, 5.1 (2.9) years taking heroin, and 5.3 (4) months on MMT, and taking a supervised dose of 41 (12) mg/day methadone. The (R), (S) and (R, S) methadone enantiomer trough plasma levels were, 84 (40), 84 (42), and 168 (77) ng/mL, respectively. All genotypes were in Hardy-Weinberg equilibrium. The two urine tests were negative for heroin in 61.3% (49/80) of the volunteers, the decline in cocaine/crack use was 83%, 30% of marijuana, and other psychoactives (inhalants, benzodiazepines, amphetamines) decreased to zero, while the consumption of snuff remained at 93.5% (75/80). Blood concentrations of racemic methadone and its enantiomers were significantly associated with the dose/day of the medication, but none of the other demographic, clinical or genetic variables impacted on serum levels of methadone. As for the results of the MMT, non-users and occasional users of heroin, as well as those who stopped taking other psychoactive drugs, and the ones who did not, were similar as regards the demographic, genetic and clinical variables. This included the blood metahdone concentrations, except for individuals who did not reduce their consumption of other psychoactives other than heroin, who had significantly (P=.03) higher blood levels of S-methadone, compared with those who did stop taking them.
ConclusionsThere was a significant reduction in the consumption of heroin and other psychoactives, and social rehabilitation of patients. However, the extensive overlap between effective and ineffective doses of methadone suggests the presence of personal and social variables that transcend the simple pharmacological management. These probably need to be addressed more successfully from the psychosocial features, particularly as regards to identifying and overcoming relapse-trigger experiences, as well as certain features of the patient, such as their psychological distress level or their psychiatric disorders.
La adicción es una enfermedad crónica, recurrente, caracterizada por búsqueda y consumo compulsivos de la droga, pese a sus consecuencias físicas, psíquicas y sociales negativas1. La probabilidad de que una persona haga la transición del consumo ocasional y socialmente controlado hasta el consumo compulsivo y disfuncional que caracterizan la adicción depende de la interacción de factores relacionados con la propia droga (disponibilidad, potencial adictivo, toxicocinética), con el individuo expuesto (herencia, trastornos psiquiátricos) y con su medio ambiente2.
Como ocurre en otros países en desarrollo, el problema de las drogas psicoactivas en Colombia es especialmente crítico, ya que padecemos la múltiple condición de productores, exportadores, importadores y consumidores de sustancias ilícitas, situación que desborda el campo de la salud pública y genera enormes problemas de corrupción y violencia derivadas del comercio ilegal3.
Aunque el abuso de heroína en el país es más reciente y menos conocido que el de otras sustancias, las autoridades sanitarias señalan que dicho consumo es ya un problema socialmente relevante que «demanda esfuerzos adicionales de investigación para establecer sus características específicas y su verdadera dimensión»4, pues, debido al alto poder adictivo de la heroína, cuando una persona inicia su consumo puede escalar hacia el abuso y la farmacodependencia con mayor frecuencia que con otras drogas de uso ilegal.
Debido a una mejor comprensión de los mecanismos patogénicos de la enfermedad adictiva, es claro que su manejo debe ser multidisciplinario, con las dos principales herramientas terapéuticas disponibles actualmente: la farmacológica y la psicosocial. Entre los fármacos con mayor evidencia de resultados favorables para el reemplazo de la heroína está la metadona (tratamiento de mantenimiento con metadona [TMM]), cuyo papel es bloquear los efectos euforizantes de la heroína, prevenir el síndrome de abstinencia y reducir la búsqueda compulsiva de droga (craving), todo lo cual se asocia con disminución del uso de heroína, reducción de conductas criminales, mejor desempeño social y reducción de la morbimortalidad5–7. Para alcanzar tales metas, el prescriptor emplea un esquema de dosis flexibles, con ajustes periódicos según criterios clínicos bien definidos en los TMM. Existe, sin embargo, amplia variabilidad interindividual en la respuesta a la metadona, y en un porcentaje importante de pacientes la estrategia de ensayo y error en la búsqueda de las dosis adecuadas no solamente puede retardar peligrosamente que el paciente perciba beneficio, sino que entraña importantes riesgos de inefectividad o toxicidad8–10.
La metadona es un opioide sintético administrado como mezcla racémica de (R)- y (S)-enantiómeros. Aunque la R-metadona es la que tiene efectos terapéuticos y la S–metadona parece aportar los efectos adversos y no los terapéuticos, la RS-metadona es la usada comúnmente debido a que tiene menores costos de producción que la R–metadona sola; en consecuencia, la relación seguridad/efectividad de la RS-metadona puede variar según las concentraciones relativas de R- y S-metadona11,12. En la tabla 1 se presentan los factores reportados como de mayor influencia en la variabilidad interpersonal de la respuesta a la metadona2,13–23. Aunque todos ellos deberían ser tenidos en cuenta dentro de un programa de manejo individualizado de pacientes adictos a heroína, la mayoría de ellos no son visibles al prescriptor en el contexto clínico, lo cual justifica la búsqueda de protocolos de tratamiento con mejor poder predictivo. Como un aporte para el futuro desarrollo de un algoritmo de dosificación que mejore la efectividad, minimice los riesgos y optimice la costo-efectividad de los TMM, en este estudio describimos las principales características e impactos del programa de mantenimiento con metadona del Hospital Mental de Risaralda (HOMERIS).
Factores asociados con variación interpersonal en la respuesta a la metadona2,13–23
| Variable | Comentario |
| Concentraciones sanguíneas de R- y S-metadona | La metadona es una mezcla racémica. La R-metadona causa los efectos terapéuticos, mientras la S-metadona está implicada en cardiotoxicidad y efectos desagradables |
| Consumo simultáneo de otras drogas legales o ilegales | Potenciales interacciones con la metadona |
| Tolerancia a opioides | Los pacientes adictos a heroína adquieren altos niveles de tolerancia a todos los opioides |
| Genes relacionados con el metabolismo de la metadona | POR: afecta a la actividad de la enzima encargada del metabolismo del enantiómero activo R-metadona |
| CYP2B6: principal enzima encargada del metabolismo del enantiómero S-metadona | |
| Genes relacionados con la absorción y la distribución tisular de la metadona | ABCB1: codifica el transportador de glucoproteína P (P-gp), el cual participa en la absorción y la disposición de la metadona en el cerebro |
| Genes relacionados con las acciones de la metadona | OPRM1: codifica el receptor μ opioide |
| ARRB2: codifica la ß-arrestina 2, una de las proteínas que regulan la actividad del receptor μ opioide | |
| GRIN1: codifica para la unidad N-metil-d-aspartato 1 del receptor del glutamato, cuya actividad la metadona bloquea | |
| D2: receptor clave en el sistema dopaminérgico de recompensa, implicado en la conducta adictiva | |
| SLC6A3: transportador que recapta la dopamina desde la sinapsis hasta la terminal de la neurona presináptica | |
| DßH: codifica la enzima que convierte dopamina en norepinefrina |
El estudio se hizo con 80 pacientes de ambos sexos, quienes recibían metadona como terapia de mantenimiento a largo plazo en el Centro de Atención de Drogadictos del Hospital Mental de Risaralda. Para minimizar los efectos de la estratificación poblacional, solamente se estudió a sujetos colombianos de rasgos fenotípicos mestizos. Los criterios de inclusión fueron: a) 15–45 años de edad; b) consumir la metadona diaria en forma supervisada y no haber modificado la dosis por lo menos durante las últimas 2 semanas; c) someterse a las pruebas periódicas de detección de heroína en orina, y d) firmar el consentimiento informado. Se excluyó a los individuos que durante las últimas 2 semanas incumplieron la toma supervisada de la metadona o cambiaron la dosis y quienes consumían medicamentos que pudieran interferir con la farmacocinética de la metadona.
Durante la entrevista médica se diligenció el formulario de recolección de información y se tomaron al paciente muestras de sangre para la genotipificación y la cuantificación de las concentraciones séricas de metadona racémica y sus enantiómeros R- y S-. A fin de cuantificar las concentraciones valle del estado estable de metadona (cuando las concentraciones de metadona son más bajas, justo antes de la siguiente dosis), la muestra de sangre se obtuvo inmediatamente antes de la toma de la dosis diaria supervisada. Las pruebas toxicológicas en orina se practicaron una vez por semana, sin previo aviso. El protocolo fue aprobado por los comités técnico-científicos y de bioética de la Universidad Tecnológica de Pereira y el HOMERIS.
Genotipificación de SNPPrevia extracción del ADN genómico de 200 μl de sangre completa, con el kit Qiagen DNA Minikit (QIAGEN), se determinaron mediante reacción en cadena de la polimerasa (PCR) en tiempo real los SNP seleccionados de los genes ABCB1 (rs1045642), CYP2B6 (rs3745274), OPRM1 (rs1799971), ARRB2 (rs3786047, rs2036657 y rs1045280), DßH (rs1611115), GRIN1 (rs6293, rs4880215 y rs2301364) y POR (rs1057868, rs28931608 y rs28931608). Los primers y las sondas Taqman fueron diseñados y suministrados por Applied Biosystems. Cada reacción de PCR se realizó en un volumen de 25 μl con 1–10 ng de ADN genómico, 1X TaqMan Genotyping Master Mix y 1X Taqman SNP Genotyping Assay Mix, siguiendo el protocolo del fabricante. En cada PCR se utilizó un control positivo y negativo. La amplificación y la detección se llevaron a cabo en el equipo SmartCycler (Cepheid), con las siguientes condiciones: un calentamiento inicial de 95°C durante 10 min, seguido de 40 ciclos que consisten en 15 s a 95°C y 1 min a 60°C. Los resultados se analizaron en el software SmartCycler (Cepheid) de acuerdo con la visualización de la curva específica fluorescente para cada alelo.
Genotipificación VNTR Intron 8 del gen DATLa amplificación del VNTR se realizó mediante PCR, la cual se llevó a cabo en un volumen total de 10 μl con 1–10 ng de ADN genómico, 1X Qiagen Multiplex PCR Master Mix (Qiagen), 1X Q-solution (Qiagen) y 0,2 μM de cada uno de los primers (forward: Yaquima-5’-GGTGTAGGGAACGGCCTGAG-3’; reverse: 5’-CTGGAGGTCACGGCTCAAGG-3’). La amplificación se realizó en un termociclador automático (DNA Thermal Cycler; MJ Research) con los siguientes parámetros: un paso inicial de desnaturalización por 15 min a 95°C, seguido por 40 ciclos de amplificación, desnaturalización a 94°C por 1 min, annealing a 60°C por 1 min y extensión a 72°C por 1 min, con una extensión final a 72°C por 7 min. Se mezcló 1 μl del producto amplificado con 9 μl de Hi-Di fomamida y 0,5 GeneScan-500 Liz internal size standard (Applied Biosystems). La detección se llevó a cabo en el secuenciador ABI Prims 3100-Avant Genetic Analyzers (Applied Biosystems) por electroforesis capilar (CE) con capilar de 36 cm de longitud y polímero POP-4 (Applied Biosystems), con el módulo de corrida Fragment Analysis-36-POP-4. Los datos se analizaron de acuerdo con el color de los picos y el tamaño de los fragmentos mediante el software Genemapper v3.2 (Applied Biosystems). La presencia de los polimorfismos se confirmó por secuenciación directa de muestras seleccionadas.
Cuantificación de metadona en sangreDe cada paciente se recolectaron 8 ml de sangre completa en tubos al vacío con EDTA. Las muestras se centrifugaron a 2600 G por 10 min y el plasma se conservó a –20°C hasta el momento del análisis. Las concentraciones séricas de R- y S-metadona se cuantificaron por HPLC mediante un método previamente descrito por Pham-Huy C et al24, con algunas modificaciones en la fase móvil y en la extracción en fase sólida. Se utilizó un HPLC System 2000 plus marca JASCO equipado con bomba de gradiente cuaternario, automuestreador, horno para columnas y detector de arreglo de diodos MD 2015 controlado por EZChrom Elite v3.16. Se utilizó la columna quiral analítica CYCLOBOND I 2000 HP-RSP (25 cm de largo×4,6 mm de diámetro interno, 5 μm tamaño de partícula; Supelco, Estados Unidos). El sistema de elución fue isocrático con una mezcla de agua:acetonitrilo 75:25+0,1% de ácido acético a 0,8 ml/min. El detector se programó en la banda de 200-300 nm y la cuantificación de los enantiómeros se hizo a 205 nm. Para la preparación de los estándares se adicionó RS-metadona y papaverina a plasma humano libre del fármaco, a concentraciones de 10, 20, 40, 60, 80, 120, 160 y 320 ng/ml de cada enantiómero. Los estándares y las muestras se extrajeron en fase sólida en cartuchos RP-18 (500 mg; Merck) previamente activados con 3 ml de metanol:HCL al 37% (99:1), 6 ml de metanol seguido de 9 ml de hidróxido de amonio al 2%. A 2 ml de estándar o muestra, se adicionaron 200 ng de papaverina como estándar interno y se alcalinizaron con 1 ml de hidróxido de amonio al 2% y se aplicaron al cartucho, que se secó por succión. El lavado se realizó con tres porciones de 0,5 ml de hidróxido de amonio al 2%, dos porciones de 0,5 ml de hidróxido de amonio 2%-metanol (60:40) y dos porciones de 0,25 ml de metanol, secando entre lavados por succión. La elución se realizó con tres porciones de 0,25 ml de metanol-HCL al 37% (99:1); posteriormente la solución se evaporó hasta sequedad bajo una corriente de nitrógeno y se reconstituyó en 200 μl de fase móvil, de la cual se inyectaron 80 μl para la detección, con las condiciones mencionadas anteriormente.
Para la cuantificación se generaron curvas lineales de calibración. Cada uno de los estándares fue preparado e inyectado en el HPLC por duplicado, lo que permitió obtener el porcentaje de desviación estándar relativa (%RSD), el límite de detección y el límite de cuantificación, para lo cual se utilizó el software EZChrom Elite v3.16. El límite de detección se definió como 3 veces la señal de ruido y el límite de cuantificación, como 3,3 veces el límite de detección. Con la finalidad de determinar el porcentaje de recuperación, se prepararon tres patrones por triplicado en plasma libre de metadona en concentraciones de cada enantiómero de 20, 80 y 320 ng/ml; se comparó el área de cada uno con el área del patrón inyectado directamente en el equipo.
La separación de los enantiómeros fue completa, y se consiguió una resolución de 1,9 para los picos analizados (R- y S-metadona) con la eficiencia del sistema reflejada en el factor de asimetría de 1,3 y 1,4, y una pureza de los picos>98%. Los tiempos de retención de los analitos fueron 7,1 y 7,8 min para R- y S-metadona respectivamente. Parámetros analíticos: a) coeficiente de correlación r2>0,99; b) límites de detección, 2 ng/ml (R-metadona) y 3 ng/ml (S-metadona); c) límites de cuantificación, 6,6 ng/ml (R–metadona) y 9,9 ng/ml (S-metadona), y d) porcentajes de recuperación>90% para los tres niveles estudiados.
Manejo estadísticoLas variables continuas se compararon con ANOVA o la prueba de la t de Student. Se empleó la prueba de la χ2 para comparar variables categóricas y verificar el equilibrio de Hardy-Weinberg. Para muchos análisis estadísticos se utilizaron las concentraciones valle de rac-, R- y S-metadona corregidas por el índice de masa corporal (IMC), a las que llamaremos RS-imc, R-imc y S-imc, respectivamente. Se utilizaron los intervalos de confianza del 95% (IC95%) y se consideró significativos los valores de p<0,05 en test de dos colas. Los análisis estadísticos se hicieron con el software SPSS 19 for Windows.
ResultadosLa tabla 2 muestra las características demográficas y clínicas de los 80 individuos incluidos en el estudio. Se consideró «no consumidores» al 61% de los pacientes (n=49) cuyos tests en orina fueron negativos durante las 2 semanas de observación del estudio y afirmaron que ya no consumían heroína, mientras el 39% restante (n=31), que tuvieron al menos una prueba de orina positiva, admitieron consumo esporádico de heroína y se los clasificó como «consumidores ocasionales», aunque se destaca el hecho de que los 80 pacientes del estudio eran adherentes al programa y estaban comprometidos con un franco proceso de recuperación psicosocial y de reintegración a su vida familiar y laboral o educativa.
Características demográficas y clínicas de los pacientes del estudio (n=80)
| Edad (años) | 23,5±5 |
| Sexo | |
| Varones | 69 (86,3) |
| Mujeres | 11 (13,7) |
| IMC | 20,9±2,2 |
| Antecedentes delictivos | |
| Sí | 48 (60) |
| No | 32 (40) |
| Abuso previo de otros psicoactivos | |
| Tabaco | 75 (93,5) |
| Marihuana | 73 (91,2) |
| Cocaína/basuco | 48 (60) |
| Otros | 25 (31,2) |
| Ninguno | 0 |
| Abuso actual de otros psicoactivos | |
| Tabaco | 75 (93,5) |
| Marihuana | 51 (63,8) |
| Cocaína/basuco | 8 (10) |
| Otros | 0 |
| Ninguno | 5 (6,3) |
| Años de abuso de heroína | 5,1±2,9 |
| Meses en el TMM | 5,3±4 |
| Días sin cambios en dosis de metadona | 63,7±59 |
| Dosis de metadona (mg/día) | 41±12 |
| Concentración sérica de metadona (ng/ml) | |
| RS-metadona | 168,4±77 |
| R-metadona | 84,1±39,7 |
| S-metadona | 84,3±41,5 |
| R/S metadona | 1,04±0,35 |
| Test de orina para heroína | |
| Positivos 1.a semana | 25 (31,3) |
| Positivos 2.a semana | 21 (26,3) |
| Negativos | 49 (61,3) |
TMM: tratamiento de mantenimiento con metadona.
Las variables cuantitativas se expresan como media±desviación estándar y las cualitativas, como n (%).
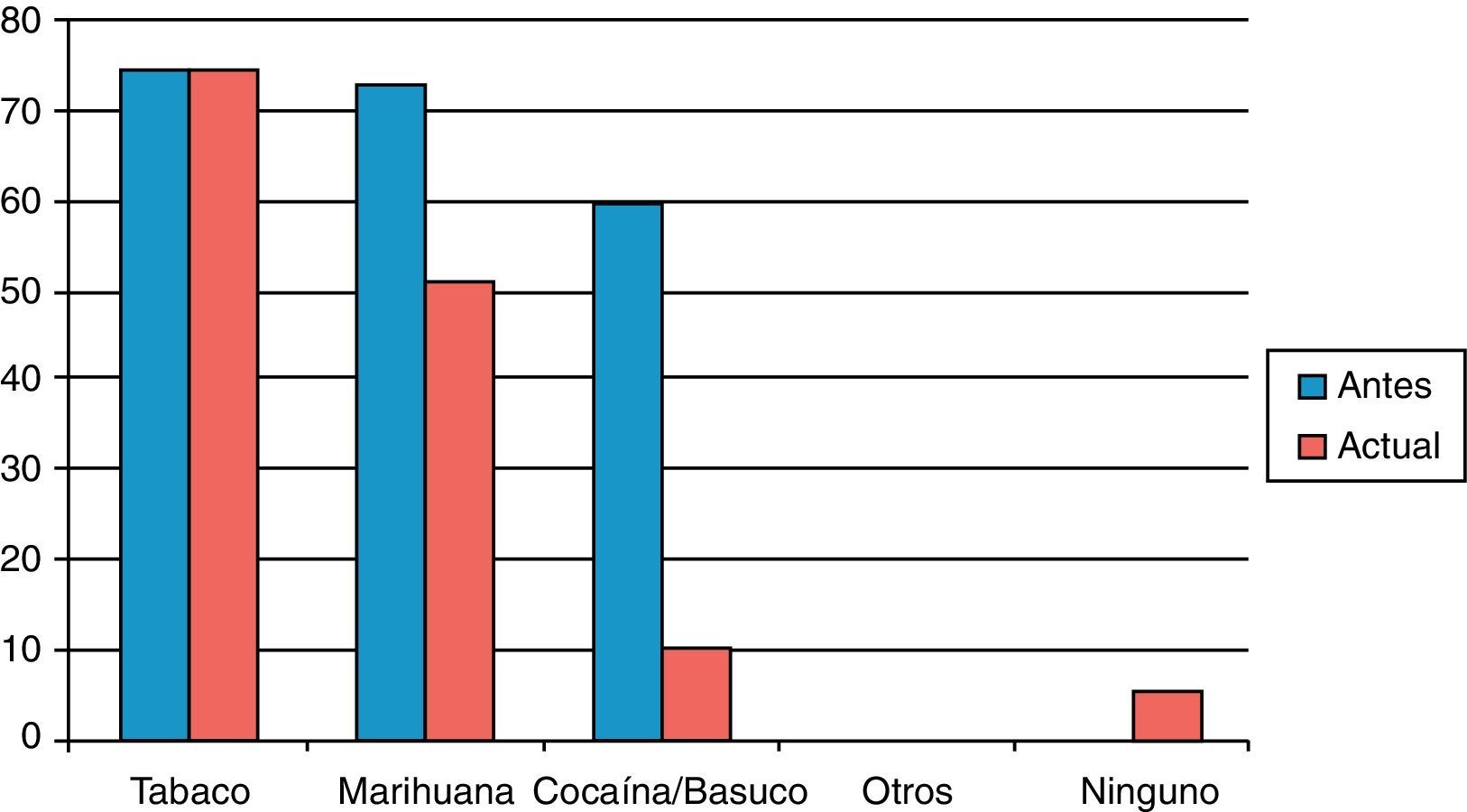
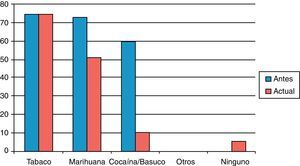
Con respecto al consumo de otras sustancias psicoactivas, todos los pacientes eran policonsumidores antes de entrar al programa de rehabilitación, pero al momento del estudio se había disminuido en un significativo 30% el consumo de marihuana (odds ratio [OR]=0,51; p<0,0001) y en un 83% el de cocaína/basuco (OR=0,21; p<0,0001), mientras los de otros psicoactivos (inhalantes, sedantes, anfetaminas) bajaron a cero y el consumo de tabaco permaneció igual; 5 pacientes (6,3%) afirmaron no consumir sustancias psicoactivas lícitas o ilícitas (tabla 2 y fig. 1).
En la tabla 3 se presentan las variantes genotipificadas en el estudio, con sus correspondientes frecuencias genotípicas y alélicas; todos los genotipos estuvieron en equilibrio de Hardy-Weinberg.
Características genéticas de los pacientes (n=80)
| Gen | Genotipo | n | Frecuencia (IC95%) | HWE, p | Alelo | n | Frecuencia (IC95%) |
| ABCB1 | |||||||
| rs1045642 | AA | 26 | 0,325 (0,238-0,430) | A | 89 | 0,556 (0,469-0,646) | |
| AG | 37 | 0,462 (0,375-0,586) | G | 71 | 0,444 (0,354-0,531) | ||
| GG | 17 | 0,213 (0,100-0,313) | 0,90 | ||||
| SLC6A3 | |||||||
| VNTRint8 | 5/6 | 32 | 0,400 (0,300-0,523) | 5/6 | 64 | 0,400 (0,325-0,465) | |
| 6/6 | 45 | 0,562 (0,450-0,673) | 6/6 | 90 | 0,562 (0,497-0,646) | ||
| Otro | 3 | 0,038 (0,000-0,088) | 0,18 | Otro | 6 | 0,038 (0,013-0,065) | |
| ARRB2 | |||||||
| rs1045280 | CC | 14 | 0,175 (0,100-0,250) | C | 62 | 0,388 (0,335-0,474) | |
| CT | 34 | 0,425 (0,338-0,548) | T | 98 | 0,612 (0,526-0,665) | ||
| TT | 32 | 0,400 (0,302-0,513) | 0,64 | ||||
| rs2036657 | AA | 48 | 0,600 (0,500-0,713) | A | 118 | 0,738 (0,664-0,812) | |
| AG | 22 | 0,275 (0,164-0,388) | G | 42 | 0,263 (0,188-0,336) | ||
| GG | 10 | 0,125 (0,057-0,211) | 0,053 | ||||
| rs3786047 | CC | 42 | 0,525 (0,425-0,618) | C | 112 | 0,700 (0,635-0,765) | |
| CT | 28 | 0,350 (0,275-0,468) | T | 48 | 0,300 (0,235-0,365) | ||
| TT | 10 | 0,125 (0,052-0,211) | 0,27 | ||||
| CYP2B6 | |||||||
| rs3745274 | GG | 39 | 0,487 (0,377-0,613) | G | 109 | 0,681 (0,629-0,753) | |
| GT | 31 | 0,388 (0,282-0,473) | T | 51 | 0,319 (0,247-0,371) | ||
| TT | 10 | 0,125 (0,046-0,200) | 0,59 | ||||
| DBH | |||||||
| rs1611115* | CC | 40 | 0,513 (0,396-0,625) | C | 113 | 0,724 (0,629-0,775) | |
| CT | 33 | 0,423 (0,270-0,518) | T | 43 | 0,276 (0,206-0,346) | ||
| TT | 5 | 0,064 (0,025-0,138) | 0,87 | ||||
| GRIN1 | |||||||
| rs6293* | AA | 45 | 0,563 (0,434-0,655) | A | 121 | 0,776 (0,681-0,819) | |
| AG | 31 | 0,388 (0,288-0,513) | G | 35 | 0,224 (0,160-0,288) | ||
| GG | 2 | 0,025 (0,000-0,063) | 0,43 | ||||
| rs4880215 | AA | 3 | 0,038 (0,000-0,088) | A | 43 | 0,269 (0,206-0,350) | |
| AC | 37 | 0,463 (0,350-0,586) | C | 117 | 0,731 (0,650-0,794) | ||
| CC | 40 | 0,500 (0,382-0,604) | 0,24 | ||||
| rs2301364 | CC | 3 | 0,038 (0,000-0,088) | C | 29 | 0,181 (0,113-0,228) | |
| CT | 23 | 0,288 (0,170-0,393) | T | 131 | 0,819 (0,772-0,887) | ||
| TT | 54 | 0,674 (0,564-0,788) | 0,96 | ||||
| POR | |||||||
| rs1057868 | CC | 37 | 0,462 (0,357-0,563) | C | 106 | 0,662 (0,588-0,740) | |
| CT | 32 | 0,400 (0,295-0,493) | T | 54 | 0,338 (0,260-0,412) | ||
| TT | 11 | 0,138 (0,088-0,225) | 0,61 | ||||
HWB: equilibrio de Hardy-Weinberg; IC95%: intervalo de confianza del 95%.
Las concentraciones sanguíneas de metadona racémica y sus enantiómeros se correlacionaron significativamente con las dosis diarias del fármaco. En efecto, los coeficientes de correlación (r) entre las concentraciones plasmáticas de rac-, R- y S-metadona y las dosis de metadona corregidas por IMC fueron r=0,615 (p=0,01), r=0,631 (p=0,01) y r=0,535 (p=0,01) respectivamente.
Se hallaron asociaciones significativas entre los polimorfismos rs2301364 del gen GRIN1 y concentraciones sanguíneas de S-imc (CC+CT, 4,9±2,2 frente a TT, 3,8±2,2; p=0,043), y entre el rs3786047del gen ARRB2 y R-imc (TT, 5,5±2 frente a CC+CT, 3,9±2; p=0,032); no obstante, tales asociaciones dejan de ser significativas con la corrección de Bonferroni para múltiples tests. Ninguna de las demás variantes genéticas ni las variables edad, sexo, IMC, tiempos de abuso y de estabilización en las dosis de metadona se encontraron significativamente asociadas con las concentraciones sanguíneas de rac-, R- o S-metadona corregidas por IMC (datos no mostrados).
Como se muestra en la tabla 4, los no consumidores y los consumidores ocasionales de heroína tenían características similares respecto a las variables demográficas y clínicas, incluidas las concentraciones sanguíneas de rac-, R- y S-metadona. Tampoco había diferencias entre la condición de «no consumidor» o «consumidor ocasional» y los polimorfismos genéticos estudiados (datos no mostrados). Puesto que el enantiómero S–metadona se ha implicado en los efectos disfóricos del fármaco, resulta interesante que, a iguales dosis de metadona, los 19 pacientes que no disminuyeron el consumo de otros psicoactivos distintos de heroína tuvieron concentraciones de S-metadona significativamente (p=0,03) mayores (102,3±53,7 ng/ml) que los 61 que abandonaron su consumo (78,8±35,6 ng/ml).
Características demográficas y clínicas de los pacientes clasificados según su condición de consumidores ocasionales o no consumidores
| Variables | No consumidores (n=49) | Consumidores ocasionales (n=31) | p |
| Edad (años) | 23,8±4,8 | 22,9±5,3 | 0,413 |
| Sexo | |||
| Varones | 41 (83,7) | 28 (90,3) | |
| Mujeres | 8 (16,3) | 3 (9,7) | 0,312 |
| IMC | 20,8±2,1 | 21,1±2,2 | 0,480 |
| Antecedentes delictivos | |||
| Sí | 19 (38,8) | 13 (41,9) | |
| No | 30 (61,2) | 18 (58,1) | 0,480 |
| Abuso previo de otros psicoactivos | |||
| Tabaco | 45 (91,8) | 30 (96,8) | 0,644 |
| Marihuana | 43 (87,8) | 30 (96,8) | 0,239 |
| Cocaína/basuco | 32 (65,3) | 16 (51,6) | 0,249 |
| Otros | 15 (30,6) | 10 (32,3) | 0,998 |
| Ninguno | 0 | 0 | |
| Abuso actual de otros psicoactivos | |||
| Tabaco | 45 (91,8) | 30 (96,8) | 0,644 |
| Marihuana | 28 (57,1) | 23 (74,2) | 0,155 |
| Cocaína/basuco | 4 (8,1) | 4 (12,9) | 0,704 |
| Otros | 0 | 0 | |
| Ninguno | 4 (8,1) | 1 (3,2) | 0,644 |
| Años de abuso de heroína | 5,1±2,5 | 5±3,5 | 0,941 |
| Meses en el TMM | 4,9±3,9 | 5,8±4,2 | 0,300 |
| Días sin cambios en las dosis de metadona | 70,8±64 | 52,4±48 | 0,175 |
| Dosis de metadona (mg/día) | 39±12 | 44±12 | 0,079 |
| Concentración sérica de metadona (ng/ml/IMC) | |||
| RS-imc | 7,8±4,4 | 8,9±3,6 | 0,254 |
| R-imc | 3,8±2,2 | 4,6±2,0 | 0,142 |
| S-imc | 4±2,5 | 4,4±1,8 | 0,467 |
| R/S | 1±0,37 | 1,1±0,30 | 0,545 |
IMC: índice de masa corporal; TMM: tratamiento de mantenimiento con metadona.
Las variables cuantitativas se expresan como media±desviación estándar y las cualitativas, como n (%).
La farmacodependencia es una enfermedad compleja causada por una intrincada red de variables psíquicas, fisiológicas, farmacológicas, ambientales y genéticas. La identificación de los factores que influyen en la susceptibilidad para adquirir la adicción, la persistencia de esta y la propensión a las recaídas redundará en una mejor fundamentación científica de los programas de prevención y atención a drogadictos. Aunque el abuso de heroína en el país es más reciente y menos reconocido, los datos indican que este es ya un problema socialmente relevante, más si se tiene en cuenta que, cuando una persona inicia su consumo, puede escalar hacia el abuso y luego a la farmacodependencia con más celeridad e intensidad que con ninguna otra droga de uso ilegal25.
Las características demográficas y clínicas de los pacientes del estudio (tabla 2) coinciden con diferentes reportes epidemiológicos. Se trata de una población relativamente joven, de predominio masculino, con alto índice de antecedentes delictivos (60%) y larga historia de abuso de heroína y otras sustancias psicoactivas. Su tiempo promedio de permanencia en el programa estaba alrededor de los 6 meses, pero su estabilización en las dosis de metadona se logró sólo aproximadamente 3 meses después del ingreso al programa, con dosis relativamente bajas (41 mg/día), lo que se refleja en concentraciones sanguíneas de metadona medias muy inferiores a las consideradas en la literatura en el límite inferior de la «ventana terapéutica» (≥ 200 ng/ml de R-metadona o ≥ 400 ng/ml de RS-metadona), es decir, la franja de concentraciones séricas con que se consigue el máximo beneficio con el mínimo riesgo26. Es más, el 21% (17/80) de los pacientes tenían concentraciones valle de RS-metadona<100 ng/ml, valores considerados inefectivos por algunos autores27, aunque en este estudio no se demostró la existencia de un umbral de concentración de RS-metadona asociado con respuesta terapéutica.
Nuestros hallazgos muestran una relación estadísticamente significativa entre dosis y concentraciones valle de RS-, R- y S-metadona, reflejo de una farmacocinética lineal en una amplia gama de dosis28; esta correlación entre dosis y concentraciones sanguíneas de metadona racémica y sus enantiómeros refuerza la confiabilidad del método analítico utilizado (HPLC-DAD) y lo valida como útil para monitorizar la adherencia al tratamiento y los potenciales efectos de la metadona; sin embargo, en concordancia con otros reportes26,29, la influencia de las dosis en la variación de los valores valle de RS- (R2=38%), R- (R2=40%) y S-metadona (R2=27%) es relativamente moderada e indica que otras variables también afectan a la correlación dosis-concentración sérica.
Por otro lado, no encontramos asociación entre concentración sanguínea de metadona y consumo de heroína, hallazgo que coincide con otros estudios en los que se ha hallado que pacientes con concentraciones de metadona en ventana terapéutica y aun mayores tienen ocasionales o frecuentes recaídas en el consumo de heroína, aunque se mantienen adherentes al programa de rehabilitación, lo que confirma que los valores séricos de metadona no son confiables para determinar las dosis óptimas. Se ratifica así la opinión general de que las pruebas de orina para detección de consumo y la evaluación médica de signos y síntomas de abstinencia o sobredosis son «un método sensible, confiable y costo-efectivo para el ajuste de dosis»30,31. Se sabe, eso sí, que las mayores tasas de abandono se relacionan con menores dosis de metadona, y la evidencia muestra que la retención es mayor con dosis ≥ 60mg/día32,33.
Creemos que uno de los resultados más importantes del TMM es la confirmación de la reducción del consumo de otros psicoactivos, en particular los derivados de la coca, la marihuana, los inhalantes y los sedantes (figura 1). El impacto del TMM en otras drogas de abuso ya se ha notificado en muchas partes del mundo30, y podría ser el resultado no solo del conjunto de factores que influyen en la recuperación psicosocial del paciente, sino también de la propia metadona, ya que este fármaco bloquea los receptores NMDA del glutamato y, en animales, los antagonistas del glutamato reducen la autoadministración de cocaína, anfetaminas y alcohol34,35.
Las frecuencias alélicas y genotípicas de todos los marcadores investigados no fueron diferentes entre quienes consumían y no consumían heroína o entre quienes abandonaron el consumo de otros psicoactivos o no. Tampoco las concentraciones sanguíneas de rac-, R- o S-metadona estuvieron relacionadas con los diferentes marcadores genéticos estudiados. Al respecto, se debe hacer algunas consideraciones: a) la asociación de algunos de estos biomarcadores con respuesta a metadona en adictos a opioides se explora por primera vez en este estudio y puede que en realidad no exista; b) la falta de asociación genotipo-concentración sérica de metadona y genotipo-resultados del TMM también se ha reportado en otras investigaciones15,36; c) el aporte del marcador estudiado puede ser tan pequeño que no alcance a ponerse en evidencia en el tamaño de muestra de nuestro estudio, y d) el gen estudiado sí está implicado, pero no el SNP incluido en la investigación. De todos modos, las discrepancias en los resultados de los estudios genéticos relacionados con drogadicción no deben sorprender. Ello se debe en buena medida a la dificultad para identificar biomarcadores de riesgo de enfermedades como la farmacodependencia, fruto de complejas interacciones de factores genéticos y medioambientales, donde probablemente intervienen múltiples genes y cada uno de ellos hace solo una pequeña contribución al riesgo total.
La amplia superposición entre las dosis efectivas e inefectivas de metadona indica la presencia de variables personales y sociales que trascienden el simple manejo farmacológico y probablemente se aborde con más éxito desde lo psicosocial, particularmente en lo que tiene que ver con la identificación y la superación de las propias experiencias estresantes y detonantes del deseo vehemente de consumir heroína y otros psicoactivos37. Aunque las dosis de metadona sean adecuadas para evitar síntomas de abstinencia, no se debe olvidar que el adicto en rehabilitación permanece vulnerable a estímulos condicionados (visuales, auditivos, olfativos, etc.) que le recrean el contexto en el cual él consumía (estímulo drug-cue)38. Conviene mencionar que nuestros pacientes que no abandonaron el consumo de psicoactivos diferentes de heroína tenían mayores concentraciones séricas de S-metadona que quienes sí abandonaron el consumo, pues se sabe que la S-metadona parece ser la causa de los efectos disfóricos del fármaco11,12, lo cual podría aumentar la ansiedad en este subgrupo de pacientes.
Además, en la percepción y la satisfacción con el tratamiento también influyen ciertos rasgos del paciente, como su nivel de estrés psicológico o sus trastornos psiquiátricos; se ha demostrado, por ejemplo, que los adictos deprimidos sufren síntomas de abstinencia con mayor frecuencia que los adictos no deprimidos39. Esta condición, que no se exploró adecuadamente en nuestro estudio, es de particular importancia por la alta prevalencia de comorbilidad psiquiátrica en estos pacientes; las más frecuentes son los trastornos del ánimo, el estrés postraumático y la personalidad antisocial3.
Es necesario destacar algunas limitaciones de este estudio. Primero, el tamaño de la muestra limita la potencia de la investigación; segundo, aunque se introdujeron controles objetivos, como los tests de orina, la toma supervisada de metadona y la determinación de la concentración sanguínea de metadona, muchos datos provienen de lo declarado por el paciente, con las consecuentes reservas de credibilidad; tercero, el grupo estudiado no representa a todos los adictos a heroína y ni siquiera a quienes habían tomado parte del programa con metadona y se habían retirado, por motivos que podrían ser de interés en esta investigación. Por último, haber elegido un periodo de 2 semanas (evidentemente arbitrario) como ventana de observación del estudio obedece a dos razones: a) para poder obtener determinaciones de metadona en sangre confiables en el estado-estable (equilibrio), se requiere que no se hayan hecho cambios en la dosificación por lo menos durante ese tiempo, de modo que, si prolongábamos el intervalo, se nos hacía más difícil el reclutamiento de pacientes, y b) limitaciones presupuestarias.
FinanciaciónEsta investigación se ha hecho con recursos de la Vicerrectoría de Investigaciones, Innovación y Extensión de la Universidad Tecnológica de Pereira, Pereira (Colombia).
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.
Agradecemos la colaboración de las autoridades y del equipo de salud de la ESE Hospital Mental de Risaralda (Colombia), que nos facilitaron el acceso a sus instalaciones, y de los pacientes que proporcionaron la información.