La apatía, entendida como un déficit para el inicio y el mantenimiento de la acción, es un síntoma que afecta a los pacientes con diversas enfermedades psiquiátricas y neuropsiquiátricas, como demencias, secuelas de traumatismo craneal, esquizofrenia y depresión y enfermedad de Parkinson (EP). La apatía afecta negativamente a la funcionalidad y la calidad de vida de los pacientes con EP y es fuente importante de estrés del cuidador. El tratamiento farmacológico de la apatía en la EP es el foco de esta revisión sistemática.
MétodosSe realizó una búsqueda con selección sistemática de artículos originales sobre el tratamiento de la apatía en la EP en diferentes bases de datos, se consolidaron los resultados, se realizó lectura crítica de los artículos y se discutieron los hallazgos.
ResultadosSe incluyeron 11 estudios. Aunque algunos mostraron eficacia, todos presentaban limitaciones metodológicas importantes, que no permitían considerar que se pueda tomar en cuenta los resultados de dichos ensayos clínicos como evidencia para guiar las decisiones clínicas.
ConclusionesHasta el momento no se puede ofrecer recomendaciones basadas en la evidencia para el tratamiento farmacológico de la apatía en la EP. Hacen falta estudios con mejor calidad metodológica. Es un área de investigación potencialmente fructífera y muy necesaria para los pacientes con EP y sus familiares.
Apathy, defined as a deficit for initiating and maintaining action, is a symptom affecting patients with diverse psychiatric and neuropsychiatric diseases, including dementia, sequelae of traumatic brain injury, schizophrenia, depression, and Parkinson's disease (PD). Apathy negatively affects function and quality of life of PD patients, and it is an important cause of caregiver's distress. The pharmacological treatment of apathy in PD is the focus of this systematic review.
MethodsA comprehensive search and systematic selection was performed in different databases of original research papers on the treatment of apathy in PD. The results were then consolidated, and a critical analysis was made of the research papers. The results are then discussed according to the methodological standards for systematic reviews of the literature.
ResultsA total of 11 studies were included. Although some studies showed efficacy, all of them had important methodological limitations that hampered the interpretation of results. The results of the examined studies cannot be considered as evidence for guiding clinical decisions.
ConclusionsSo far, no evidence-based recommendations can be offered for the treatment of apathy in PD. More studies with better methodological quality are needed. It is a potentially fruitful area for research and one badly needed by both PD patients and their caregivers.
La apatía y sus consecuencias funcionales se cuentan entre las principales causas de discapacidad y estrés del cuidador por las enfermedades neuropsiquiátricas y psiquiátricas1–5. Pese a que la apatía está incorporada a la medicina y la psiquiatría desde el siglo xix, siguen existiendo dificultades para una definición y una conceptualización adecuadas6. Estas dificultades se derivan en gran parte de que la concepción de cuál es la función que putativamente se encuentra alterada ha sufrido importantes cambios con el paso del tiempo. En primera instancia se consideró una afección de la volición o la voluntad. Sin embargo, la voluntad como constructo psicológico perdió vigencia hacia finales del s. xix. Su reemplazo más contemporáneo por constructos como motivación, drive, conato, función ejecutiva, actividad dirigida a metas, etc., no ha sido satisfactorio6. Pese a la polisemia y la ambigüedad del término motivación, las definiciones actuales de apatía se fundamentan en el constructo de motivación, entendido como ese proceso o conjunto de procesos que inicia, dirige y mantiene la conducta en relación con una meta1.
De manera general, se puede afirmar que por apatía se entiende un complejo sintomático caracterizado por al menos los siguientes elementos: a) falta, incapacidad o disminución marcada para la experiencia emocional en general, que puede manifestarse a través de las narrativas del paciente o inferirse de la expresión afectiva; b) disminución de las cogniciones y la actividad dirigida a metas; c) suele implicar un cambio notorio en la conducta previa del paciente (con posibles excepciones como los trastornos del desarrollo), y d) causa interferencia funcional o discapacidad significativa1,7–10. La apatía no siempre es causa de malestar o sufrimiento para el paciente (con la posible excepción de la apatía depresiva) y tiende a ser una preocupación mayor para los familiares, lod cuidadores y/o los profesionales de la salud. El diagnóstico diferencial también es fuente de dificultades, pues con frecuencia no se logra distinguirla fácilmente de la depresión, la anhedonia, la desmoralización, ciertos tipos de déficit cognitivo y problemas motores que dificultan expresar emociones, cunplir órdenes o ejecutar acciones, entre otras10.
La apatía se considera un déficit bastante ubicuo y se encuentra en diversos trastornos y enfermedades neuropsiquiátricas. Es frecuente en trastornos neurocognitivos mayores (demencias) como la enfermedad de Alzheimer, la enfermedad de Parkinson (EP) y la demencia frontotemporal, pero también en los menores como el llamado déficit cognitivo leve. Es frecuente en las secuelas de la lesión cerebral adquirida (traumática, tumoral o vascular) y la esclerosis múltiple y también se considera un componente sintomático de gran importancia en la esquizofrenia y la depresión mayor11. Más recientemente se ha estado prestando atención a su relación con psicofármacos. Los estudios y la experiencia clínica indican que la apatía puede ser inducida por medicamentos de uso común en psiquiatría como, por ejemplo, los antidepresivos inhibidores de la recaptación de serotonina y los antipsicóticos12,13. También se ha reportado desarrollo de apatía y otros síntomas no motores en pacientes con EP sometidos a estimulación cerebral profunda14.
Existen varios instrumentos clínicos y de investigación para la evaluación de la apatía en trastornos neuropsiquiátricos, como la escala de evaluación de la apatía, aunque no son específicos para la EP15. Según la literatura revisada, estos instrumentos, sin ser ideales, poseen adecuadas propiedades psicométricas tanto para la clínica como para la investigación16.
Se han propuesto unos criterios diagnósticos de apatía9,17:
- •
Un criterio temporal: mínimo 4 semanas, la mayor parte del tiempo.
- •
Un criterio central que consiste en la pérdida o una marcada disminución en la motivación que es claramente distinguible del funcionamiento habitual del paciente.
- •
Presencia de al menos 1 síntoma en 2 de 3 dominios principales. Los dominios son uno conductual (conducta dirigida a metas), uno cognitivo (pensamiento/cogniciones dirigidas a metas) y uno emocional (alteraciones de la experiencia y expresión emocional).
- •
Unos criterios de exclusión (p. ej., alteraciones del nivel de conciencia) y de gravedad (debe generar interferencia o discapacidad funcional cotidiana).
Desde un punto de vista etiológico y fisiopatológico, se ha considerado que los mecanismos neuroquímicos (déficit dopaminérgico) afectan a los circuitos encargados de la motivación, la recompensa y la organización de la acción (p. ej., circuitos de recompensa, ganglios basales y corteza prefrontal), aunque se piensa que hay gran heterogeneidad en las causas y los mecanismos de la apatía18,19.
Para el tratamiento de la apatía se han utilizado estrategias farmacológicas y no farmacológicas. Entre los tratamientos farmacológicos, se han utilizado estimulantes (p. ej., metilfenidato, modafinilo, atomoxetina), medicamentos prodopaminérgicos (como la amantadina), anticolinérgicos (como la rivastigmina y la galantamina) y antidepresivos (como el bupropión). En general, el tratamiento farmacológico ha mostrado respuestas discordantes en diferentes enfermedades y trastornos, con estudios que indican mejoría y otros que no20–22. Los estudios sobre tratamientos no farmacológicos también presentan múltiples limitaciones de tipo metodológico. En cuanto a la utilidad de las intervenciones no farmacológicas, se ha encontrado que las denominadas actividades terapéuticas y las de tipo ocupacional tienen el potencial de reducir la apatía, en especial cuando se aplican de manera individual23–25.
La EP es un trastorno neuropsiquiátrico en el que coexisten la disfunción motora, las alteraciones cognitivas y una serie de síndromes y trastornos psiquiátricos. Aunque tradicionalmente se ha considerado una enfermedad del movimiento de origen neurodegenerativo, cada vez más se reconoce la importancia fisiopatológica y clínica de los llamados «síntomas no motores». Estos incluyen, además de las alteraciones cognitivas de gravedad variable, un amplio espectro de síndromes como depresión, ansiedad, psicosis, fatiga, dolor, alteraciones del sueño y apatía. Los síntomas no motores tienen un impacto negativo en el curso y los desenlaces de la EP, fuera de incrementar el sufrimiento del paciente y la carga de los cuidadores26–28.
La apatía afecta a un 40% de los pacientes con EP, según un metanálisis reciente29. En este mismo estudio se encontró que edad, puntuación en el Mini-Mental Test, alteraciones motoras, depresión, duración de la enfermedad entre otros, se encuentran relacionados con la presencia de apatía en pacientes con EP. Estos estudios han mostrado que la estructura tripartita (cognitiva, emocional y conductual) encontrada en otras poblaciones de pacientes neuropsiquiátricos también se presenta en los pacientes con EP30. Frente a la relación con otras afecciones, los estudios tienden a mostrar que la apatía en la EP se encuentra más relacionada con los trastornos cognitivos, en especial los de tipo disejecutivo. Esta relación puede darse incluso en etapas tempranas de la EP31. Finalmente es posible distinguir clínica y psicométricamente la apatía de otros trastornos como depresión y fatiga29,32. Los criterios diagnósticos de apatía enunciados anteriormente fueron validados para la EP por Drijgers et al. en 201133, que mostraron que dichos criterios eran útiles y de fácil aplicación para la práctica clínica y la investigación. Los estudios acerca del impacto de la apatía en la calidad de vida de los pacientes con EP y sus cuidadores muestran un deterioro de la calidad de vida de los pacientes y un incremento del estrés del cuidador23,34,35.
En cuanto al tratamiento farmacológico de la apatía en la EP, en general, estos estudios mencionan los tratamientos con modificadores de la enfermedad, antidepresivos y agentes prodopaminérgicos. A este respecto se han publicado varios estudios controlados y no controlados, reportes de casos y revisiones narrativas (p. ej., Dujardin et al.32 y Pagonagarraba et al.36). En cuanto a revisiones sistemáticas que incluyen tratamientos para pacientes con EP, se trata de estudios diseñados para obtener información sobre las demencias en general y no específicamente la EP20,22.
Por lo tanto, hasta el momento no se ha publicado una revisión sistemática sobre tratamiento farmacológico específicamente dirigida a los pacientes con EP. El objetivo principal de este estudio es contribuir al conocimiento acerca de la apatía en la EP mediante una revisión sistemática del tratamiento farmacológico.
MétodosBúsqueda en la literaturaSe buscaron artículos en diferentes bases de datos científicas publicados entre el 1 de enero de 2000 y el 31 de diciembre de 2016, escritos en inglés, español, francés, ruso y alemán; se utilizó el siguiente algoritmo de búsqueda: “Parkinson Disease”[MeSH] AND “Apathy”[MeSH] AND (“Therapeutics”[MeSH] OR “therapy” [Subheading] OR “Treatment Outcome”[MeSH]). Las bases de datos utilizadas fueron PubMed, Ovid, Ebesco, EMBASE, Scielo, Cochrane, ClinicalTrials.org y Google Scholar. Cuando se consideró pertinente, se revisaron las tablas de referencia de los artículos encontrados en busca de nuevos artículos y se interrogó a expertos en el tema sobre literatura gris. Del total de la búsqueda, se seleccionaron 124 artículos por título para la lectura del resumen.
Los criterios de inclusión fueron: estudios realizados en pacientes con EP con o sin demencia, cuya respuesta de la apatía a un tratamiento farmacológico se hubiera medido como resultado primario o secundario. Los criterios de exclusión fueron: revisiones sistemáticas, metanálisis, revisiones de la literatura, estudios de corte transversal y reportes de caso. Tras la lectura de los resúmenes teniendo en cuenta los criterios de inclusión, se seleccionaron 16 artículos para la lectura del texto completo; de estos 16, se excluyeron 5 por cumplir los criterios de exclusión. Se incluyeron finalmente 11 artículos para la revisión.
Registro de la información y análisis metodológicoTodos los artículos incluidos fueron evaluados por 2 investigadores independientes, quienes consolidaron la información (tabla 1) tras llegar a un acuerdo de la lectura realizada. El análisis metodológico se llevó a cabo según lo propuesto en el instrumento Cochrane Collaboration's tool for bias risk assessment37.
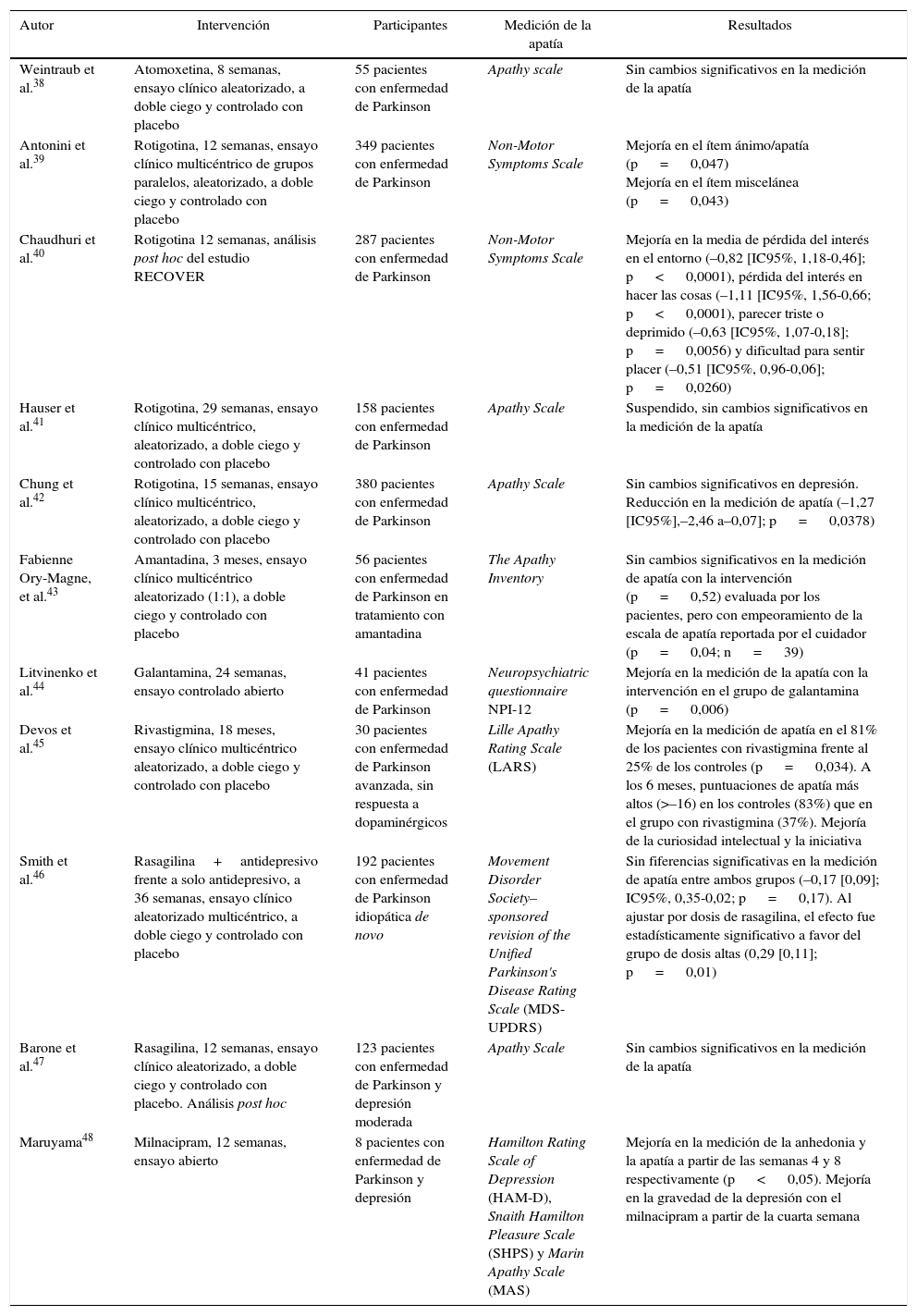
Resumen de los artículos
| Autor | Intervención | Participantes | Medición de la apatía | Resultados |
|---|---|---|---|---|
| Weintraub et al.38 | Atomoxetina, 8 semanas, ensayo clínico aleatorizado, a doble ciego y controlado con placebo | 55 pacientes con enfermedad de Parkinson | Apathy scale | Sin cambios significativos en la medición de la apatía |
| Antonini et al.39 | Rotigotina, 12 semanas, ensayo clínico multicéntrico de grupos paralelos, aleatorizado, a doble ciego y controlado con placebo | 349 pacientes con enfermedad de Parkinson | Non-Motor Symptoms Scale | Mejoría en el ítem ánimo/apatía (p = 0,047) Mejoría en el ítem miscelánea (p = 0,043) |
| Chaudhuri et al.40 | Rotigotina 12 semanas, análisis post hoc del estudio RECOVER | 287 pacientes con enfermedad de Parkinson | Non-Motor Symptoms Scale | Mejoría en la media de pérdida del interés en el entorno (–0,82 [IC95%, 1,18-0,46]; p < 0,0001), pérdida del interés en hacer las cosas (–1,11 [IC95%, 1,56-0,66; p < 0,0001), parecer triste o deprimido (–0,63 [IC95%, 1,07-0,18]; p = 0,0056) y dificultad para sentir placer (–0,51 [IC95%, 0,96-0,06]; p = 0,0260) |
| Hauser et al.41 | Rotigotina, 29 semanas, ensayo clínico multicéntrico, aleatorizado, a doble ciego y controlado con placebo | 158 pacientes con enfermedad de Parkinson | Apathy Scale | Suspendido, sin cambios significativos en la medición de la apatía |
| Chung et al.42 | Rotigotina, 15 semanas, ensayo clínico multicéntrico, aleatorizado, a doble ciego y controlado con placebo | 380 pacientes con enfermedad de Parkinson | Apathy Scale | Sin cambios significativos en depresión. Reducción en la medición de apatía (–1,27 [IC95%],–2,46 a–0,07]; p = 0,0378) |
| Fabienne Ory-Magne, et al.43 | Amantadina, 3 meses, ensayo clínico multicéntrico aleatorizado (1:1), a doble ciego y controlado con placebo | 56 pacientes con enfermedad de Parkinson en tratamiento con amantadina | The Apathy Inventory | Sin cambios significativos en la medición de apatía con la intervención (p = 0,52) evaluada por los pacientes, pero con empeoramiento de la escala de apatía reportada por el cuidador (p = 0,04; n = 39) |
| Litvinenko et al.44 | Galantamina, 24 semanas, ensayo controlado abierto | 41 pacientes con enfermedad de Parkinson | Neuropsychiatric questionnaire NPI-12 | Mejoría en la medición de la apatía con la intervención en el grupo de galantamina (p = 0,006) |
| Devos et al.45 | Rivastigmina, 18 meses, ensayo clínico multicéntrico aleatorizado, a doble ciego y controlado con placebo | 30 pacientes con enfermedad de Parkinson avanzada, sin respuesta a dopaminérgicos | Lille Apathy Rating Scale (LARS) | Mejoría en la medición de apatía en el 81% de los pacientes con rivastigmina frente al 25% de los controles (p = 0,034). A los 6 meses, puntuaciones de apatía más altos (>–16) en los controles (83%) que en el grupo con rivastigmina (37%). Mejoría de la curiosidad intelectual y la iniciativa |
| Smith et al.46 | Rasagilina+antidepresivo frente a solo antidepresivo, a 36 semanas, ensayo clínico aleatorizado multicéntrico, a doble ciego y controlado con placebo | 192 pacientes con enfermedad de Parkinson idiopática de novo | Movement Disorder Society–sponsored revision of the Unified Parkinson's Disease Rating Scale (MDS-UPDRS) | Sin fiferencias significativas en la medición de apatía entre ambos grupos (–0,17 [0,09]; IC95%, 0,35-0,02; p = 0,17). Al ajustar por dosis de rasagilina, el efecto fue estadísticamente significativo a favor del grupo de dosis altas (0,29 [0,11]; p = 0,01) |
| Barone et al.47 | Rasagilina, 12 semanas, ensayo clínico aleatorizado, a doble ciego y controlado con placebo. Análisis post hoc | 123 pacientes con enfermedad de Parkinson y depresión moderada | Apathy Scale | Sin cambios significativos en la medición de la apatía |
| Maruyama48 | Milnacipram, 12 semanas, ensayo abierto | 8 pacientes con enfermedad de Parkinson y depresión | Hamilton Rating Scale of Depression (HAM-D), Snaith Hamilton Pleasure Scale (SHPS) y Marin Apathy Scale (MAS) | Mejoría en la medición de la anhedonia y la apatía a partir de las semanas 4 y 8 respectivamente (p < 0,05). Mejoría en la gravedad de la depresión con el milnacipram a partir de la cuarta semana |
Los estudios revisados incluyen los siguientes medicamentos: atomoxetina, rotigotina, amantadina, anticolinesterásicos (galantamina y rivastigmina), rasagilina y milnacipram.
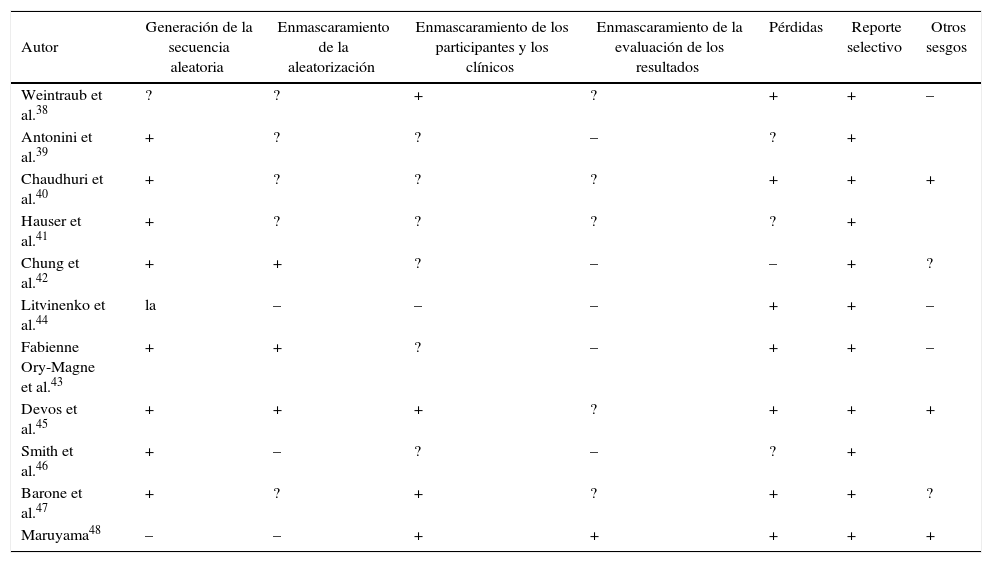
Los resultados de los estudios fueron consolidados (tabla 1). La evaluación general metodológica de estos se encuentra en la tabla 2.
Evaluación global metodológica
Autor | Generación de la secuencia aleatoria | Enmascaramiento de la aleatorización | Enmascaramiento de los participantes y los clínicos | Enmascaramiento de la evaluación de los resultados | Pérdidas | Reporte selectivo | Otros sesgos |
|---|---|---|---|---|---|---|---|
| Weintraub et al.38 | ? | ? | + | ? | + | + | – |
| Antonini et al.39 | + | ? | ? | – | ? | + | |
| Chaudhuri et al.40 | + | ? | ? | ? | + | + | + |
| Hauser et al.41 | + | ? | ? | ? | ? | + | |
| Chung et al.42 | + | + | ? | – | – | + | ? |
| Litvinenko et al.44 | la | – | – | – | + | + | – |
| Fabienne Ory-Magne et al.43 | + | + | ? | – | + | + | – |
| Devos et al.45 | + | + | + | ? | + | + | + |
| Smith et al.46 | + | – | ? | – | ? | + | |
| Barone et al.47 | + | ? | + | ? | + | + | ? |
| Maruyama48 | – | – | + | + | + | + | + |
–: alto riesgo;?: riesgo poco claro;+ bajo riesgo.
El estudio sobre la atomoxetina de Weintraub et al.38 se llevó a cabo para determinar la eficacia antidepresiva de este medicamento en la EP, a dosis entre 40 y 80 mg, en una muestra de 55 pacientes. Es un ensayo clínico aleatorizado a doble ciego y controlado con placebo. El efecto en la apatía era uno de los desenlaces secundarios. En cuanto a la apatía, a las 8 semanas no había cambios significativos en la escala con el tratamiento con atomoxetina (p = 0,14).
RotigotinaCuatro estudios que evaluaron la eficacia de la rotigotina en pacientes con EP y apatía se seleccionaron para esta revisión. La rotigotina es un agonista dopaminérgico no relacionado con los derivados del ergot que se une a receptores D1/D2/D3.
El de Antonini et al.39 es un ensayo clínico multicéntrico controlado con placebo y a doble ciego, llevado a cabo en 12 semanas sobre 349 pacientes para evaluar la eficacia de la rotigotina en los síntomas no motores de la EP. En el apartado específico de ánimo/apatía, presentó diferencias significativas (p = 0,047) en el análisis exploratorio. Sin embargo, en el artículo no hay claridad acerca de aspectos importantes como el análisis de la pérdida de pacientes y el procedimiento de enmascaramiento posterior a la aleatorización, y no se sabe si hubo enmascaramiento en la evaluación de los resultados.
El estudio de Chaudhuri et al.40 es un análisis post–hoc del estudio RECOVER, un ensayo clínico aleatorizado, controlado y a doble ciego. Se incluyó a 287 pacientes en 2 grupos con dosis de rotigotina escaladas hasta la máxima de 16 mg/día, con seguimiento de 12 semanas. En el ítem de ánimo/apatía, hubo mejoría en la media de 4 subítems, así: pérdida del interés en el entorno, en los alrededores, 0,82 (1,18-0,46 95% CI) p<0.0001, pérdida del interés en hacer las cosas, 1,11 (1,56-0,66 95% CI) p<0,0001, parecer triste o deprimido, 0,63 (1,07-0,18 95% CI) p=0.0056 y dificultad para experimentar placer, 0,51 (0,96-0,06 95% CI) p=0,0260. No se menciona si se tuvo en cuenta el estadio de la enfermedad u otras comorbilidades que pudieran incidir en la intensidad de los síntomas no motores o prestarse a confusión.
El de Hauser et al.41 es un estudio multicéntrico a doble ciego y controlado con placebo para evaluar la eficacia de la rotigotina en parches transdérmicos para pacientes con apatía y síntomas motores. Este estudio se interrumpió por análisis de futilidad, ya que no se cumplían los criterios de continuación. Por lo tanto, todo el análisis debe considerarse descriptivo y los valores de p, exploratorios.
El de Chung et al.42 evaluó primariamente la eficacia de la rotigotina en parches transdérmicos, pero también incluyó una medida de la apatía, mediante un ensayo clínico multicéntrico aleatorizado y a doble ciego de fase 4, a 15 semanas en pacientes surcoreanos (196 en el grupo de placebo y 184 en el grupo de rotigotina). No se encontró diferencia estadísticamente significativa en el cambio de la escala de Hamilton de depresión. La apatía mejoró numéricamente, aunque con una magnitud del efecto pequeña, clínicamente no significativa, y con un intervalo de confianza cercano a 0 (–1,27; IC95%, –2,46 a –0,07; p = 0,0378). Además, en el estudio hubo una importante pérdida de pacientes que no se analizó y no se menciona enmascaramiento en la evaluación de la respuesta.
La tolerabilidad de la rotigotina reportada en estos estudios fue relativamente buena, sin una diferencia significativa con el placebo.
Es llamativo que se permiten medicamentos que son potencialmente inductores de apatía, como los antipsicóticos de segunda generación (p. ej., olanzapina, aripiprazol o ziprazidona) en el estudio de Hauser et al.41.
AmantadinaLa amantadina se ha considerado útil para el tratamiento de la apatía en otras condiciones neurológicas (como las secuelas de traumatismo craneoencefálico). Este estudio controlado buscó evaluar la eficacia para mejorar la apatía en EP como uno de los desenlaces secundarios43. El objetivo primario era comparar el comportamiento de las discinesias inducidas por L–dopa cuando se retiraba o se mantenía la amantadina. Esta se utilizó a una dosis ≥ 200 mg/día. La evaluación referida por los pacientes no mostró diferencias en la apatía con el uso de la amantadina, mientras que según los cuidadores empeoró. Esta diferencia puede deberse a diversos factores: la falta de conciencia de los pacientes sobre algunas manifestaciones de la apatía, las grandes expectativas de los cuidadores, etc. La principal limitación metodológica es que no se reportó si hubo o no enmascaramiento al momento de la evaluación.
AnticolinesterásicosEl estudio de Litvinenko et al.44 con galantamina durante 24 semanas mostró una disminución de la apatía que era estadísticamente significativa. El riesgo de sesgos era importante, principalmente por la falta de enmascaramiento, porque el estudio no se diseñó específicamente para evaluar la respuesta de la apatía y porque su diseño no daba una clara idea del impacto clínico de esta mejoría.
El estudio de Devos et al.45 evaluó la respuesta a la rivastigmina 9,5 mg en parche transdérmico comparada con placebo. Es un estudio aleatorizado y controlado, con seguimiento de 6 meses, en que se evaluó el comportamiento de la apatía en una población de pacientes sin demencia. Uno de los grupos de pacientes, además de la rivastigmina, recibió una optimización de su tratamiento prodopaminérico. Se encontró una reducción significativa en las puntuaciones de las escalas de apatía en los pacientes que recibieron la rivastigmina frente al placebo. Hubo más efectos adversos en el grupo que recibió rivastigmina que en el de placebo. No hubo diferencia entre el grupo que recibió la optimización de dopaminérgicos y el que no. Los ítems que más mejoraron con la rivastigmina fueron la curiosidad intelectual y la iniciativa. También hubo mejoría en algunos aspectos cognitivos como la atención. La principal limitación encontrada es el tamaño de la muestra (30 pacientes).
RasagilinaSmith et al.46 evaluaron el efecto de la rasagilina (un inhibidor irreversible de la MAO-B, utilizado como monoterapia en la EP) en la depresión, la cognición y otros síntomas no motores en pacientes con EP que tomaban un antidepresivo en el estudio ADAGIO. Es un estudio multicéntrico a doble ciego y controlado por placebo en pacientes con EP. Por lo tanto, se trata de un análisis post-hoc del estudio ADAGIO. Se aleatorizó a los 192 pacientes a rasagilina o placebo y se les dio un seguimiento de 32 semanas. No se permitía tomar antiparkinsonianos. Se medía la falta de empeoramiento. El grupo de rasgilina reveló tendencia no significativa a una reducción del empeoramiento de la apatía comparado con placebo, con una diferencia de tratamiento de–0,17 (p = 0,07). Otros aspectos interesantes del estudio: la rasagilina fue bien tolerada y hubo mejoría motora y de otros síntomas no motores. En cuanto a la tolerabilidad, no hubo diferencia entre los grupos de rasagilina y placebo. Es llamativo que se permitiera el tratamiento con medicamentos como sertralina, paroxetina o escitalopram que, al ser inhibidores selectivos de la recaptación de serotonina, han estado implicados en la aparición de apatía en pacientes sin EP y empeoramiento en aquellos con EP.
En el estudio de Barone et al.47, se estudió la rasagilina (1 mg/día) con el objetivo primario de evaluar su efecto antidepresivo y en aspectos cognitivos de pacientes con EP y síntomas depresivos. La evaluación de la apatía se planeó como un desenlace secundario. Se trata de un estudio aleatorizado a doble ciego y controlado con placebo en 123 pacientes durante 12 semanas. En este estudio, la apatía no mejoró de manera significativa en el grupo de rasagilina. En cuanto a la tolerabilidad, 4 pacientes abandonaron el estudio por efectos adversos (vértigo, náuseas, discinesia y distonía del tronco) y 15 reportaron un efecto adverso de leve a moderado (frente a 17 en el grupo de placebo).
MilnacipramMaruyama48 efectuó un pequeño ensayo abierto para evaluar el potencial del milnacipram (un antidepresivo «dual» que inhibe la recaptación de serotonina y noradrenalina) para aliviar los síntomas depresivos de los pacientes con EP, particularmente la anhedonia y la apatía, en 8 pacientes con EP (3 mujeres y 5 varones), todos con depresión según la escala de Hamilton. Se administró el milnacipram 2 veces por día durante 12 semanas, escalándolo hasta la dosis de 60 mg/día. La apatía, entendida como un tipo de síntoma depresivo, mejoró con el milnacipram a estas dosis. Las limitaciones de este estudio son múltiples: el tamaño de la muestra, la falta de aleatorización, no hay un tratamiento comparador, la incorporación de la apatía como un síntoma depresivo y la falta de enmascaramiento, entre otras. El medicamento fue bien tolerado en general y se considera que tiene un potencial bajo de interacciones con medicamentos utilizados para el tratamiento de la EP, como la levodopa y los agonistas dopaminérgicos (bromocriptina, pergolida o cabergolina) y amantadina. No se incluyó (se supone que por precaución) a pacientes que tomaran rasagilina o selegilina (efecto en la monoaminooxidasa y riesgos de síndrome serotoninérgico).
DiscusiónEsta revisión sistemática muestra (como es frecuente en los ensayos clínicos en pacientes neuropsiquiátricos) que la evidencia que se desprende de dichos estudios sigue siendo insuficiente para hacer recomendaciones contundentes en cuanto al tratamiento farmacológico de la apatía en la EP. Los estudios revisados tienen problemas metodológicos de diversa índole que limitan la interpretación de los resultados, tanto en los casos en que hubo efecto positivo como aquellos en que no. Por ejemplo, aunque en los estudios con la amantadina43 y la atomoxetina38 no hubo diferencia significativa con placebo, la duración de los ensayos, el estadio de la enfermedad y que el objetivo primario no fuera la apatía hacen posible que estos medicamentos no lograran mostrar su efectividad por cuestiones de diseño. Aunque puede sonar a frase de cajón, ante estos resultados, «no se puede recomendar o proscribir el uso de estos medicamentos para el tratamiento de la apatía en pacientes con EP, hacen falta más estudios». Entre las principales dificultades metodológicas, se encuentran: tipo de diseño, tamaño de la muestra, falta de especificación de aspectos como la aleatorización de los pacientes, objetivo primario distinto de la respuesta de la apatía como tal, diversidad de instrumentos de medición y presencia de medicamentos que pueden inducir apatía, entre otros. El criterio de tiempo de espera adecuado para observar la respuesta es cuestionable, y las dosis de algunos de los medicamentos tampoco fueron las máximas. En resumen, en este momento no se cuenta con un tratamiento farmacológico para la apatía en la EP que sea eficaz con base en la evidencia. Sin embargo, desde el punto de vista de los autores, pese a la falta de evidencia adecuada, esta revisión abre la puerta a otro tipo de discusiones que son igualmente relevantes para la actividad clínica.
Por una parte, está la posibilidad de mejorar los aspectos metodológicos de futuros estudios con el fin de incrementar su calidad y, por ende, la aplicabilidad de los resultados. En esta misma línea de ideas, Harrison et al.22 enuncian una serie de aspectos que se debería tener en cuenta para incrementar la calidad y la utilidad de los ensayos clínicos en áreas como esta: falta de estudios diseñados específicamente para evaluar apatía, heterogeneidad del diagnóstico y la evaluación, falta de claridad en el impacto de los tratamientos en la vida cotidiana, la presencia de depresión y otros síndromes (o la presencia de medicamentos que inducen apatía) que pueden llevar a confusión diagnóstica, estudiar la apatía como si fuera un constructo unitario, no se caracterizan adecuadamente las poblaciones que se estudian, duración de los ensayos, etc. Como mencionan estos autores, uno de los problemas de la investigación en estas áreas tiene que ver con la presunción de homogeneidad de los síndromes neuropsiquiátricos. La presunción de homogeneidad se refiere a que se tiende a pensar que, por ejemplo, la apatía es un constructo unitario que tiene validez y confiabilidad transnosológica. Esto significa que se tiende a considerar como un mismo fenómeno un síndrome apático en pacientes con traumatismo de cráneo o con demencia, con posibles diferencias cuantitativas, pero no cualitativas, gracias a que se utilizan criterios diagnósticos estandarizados. Esta presunción es una posible fuente de las inconcordancias y de que no se confirmen los resultados de los estudios. Además, dado que la apatía es un constructo cuya estructura tiene al menos 3 componentes centrales (cognitivo, motor/acción y emocional) es de esperar que los tratamientos actúen de manera diferencial sobre estos componentes. Esta acción diferencial puede quedar enmascarada si solo se toma en cuenta las puntuaciones globales de las escalas22.
A partir de esta revisión, un tema que también queda para la discusión es que se puede preguntar si la falta de evidencia adecuada para el tratamiento farmacológico incrementa o no la utilización de intervenciones no farmacológicas. La pregunta es relevante porque actualmente dichas intervenciones pueden estar mejor respaldadas por la evidencia y muy probablemente sean más seguras que las de tipo farmacológico. La tendencia a la polifarmacia y la subutilización de las intervenciones psicosociales en múltiples áreas de la psiquiatría, pero especialmente en neuropsiquiatría, puede llevar a pensar que la conducta más frecuente es insistir en los tratamientos farmacológicos, más allá de lo que puedan ofrecer. Esta insistencia resta oportunidades de implementación de intervenciones psicosociales dirigidas a la rehabilitación y la mejora de la calidad de vida del paciente y/o sus cuidadores50–52.
La falta de evidencia proveniente de estudios clínicos adecuadamente efectuados para informar la práctica cotidiana es una situación compleja. Aunque parezca una redundancia, la falta de evidencia no se puede resolver a partir de la evidencia. Para resolver las necesidades clínicas en estos casos, es necesario apelar a otro tipo de conocimientos y procedimientos, como la experiencia clínica y la relación médico-paciente, que llevan por fuerza a otro tipo de justificación (no siempre carente de valor o una mera arbitrariedad, como pueden pensar algunos) para la prescripción de un tratamiento determinado. Se podría proponer, debatir (y poner a prueba), como guía en casos de poca evidencia, un aforismo médico del tipo «si se indica posible utilidad, sin evidencia de gran riesgo o con riesgo aceptable, se justifica el intento cuidadoso». De hecho, es lo que muy probablemente hacen a diario los psiquiatras y neuropsiquiatras en estos casos: buscar en la literatura medicamentos con algún indicio de utilidad, extrapolar a partir de la experiencia y hacer un seguimiento cauteloso. En casos con evidencia insuficiente y alta preocupación por la seguridad y la tolerabilidad de un medicamento, sirve recordar el primum non nocere y priorizar intervenciones no farmacológicas y otras formas de acompañamiento y ayuda49.
Para terminar, una reflexión sobre el estudio de la apatía es que vale la pena preguntarse si conceptualizaciones diferentes de la apatía como trastorno de la motivación pueden tener más valor y potencial heurístico. Esto porque se sigue considerando la motivación como constructo psicológico problemático. Por ejemplo, se podría enfocar la apatía como una instancia particular de los trastornos de la acción humana, específicamente de los trastornos de iniciación y mantenimiento de la acción (definida esta como la conducta con significado, contextualizada y dirigida a metas). La estructura de la acción humana podría concebirse como compleja, con múltiples componentes en acción. Estos podrían ser los concomitantes de experiencia y expresión emocional, los cognitivos de planeación, los psicomotores de ejecución, además de una serie de componentes de otra índole como, por ejemplo, los de contextualización (social e interpersonal), recompensa anticipada y consumatoria, sensibilidad al condicionamiento operante, etc. El ejercicio teórico, clínico y empírico de cuestionar la idea convencional que se tiene de la acción, como una secuencia lineal de eventos en la que primero hay una fase motivacional («desear» o «necesitar»), luego una fase cognitiva (pensar/planear) que desemboca en una fase final de ejecución de la acción, podría aportar una comprensión adicional de la apatía y los fenómenos conexos.
ConclusionesSe han estudiado diversos medicamentos para el tratamiento de la apatía en pacientes con EP. Debido a las limitaciones metodológicas, no es posible recomendar ninguno de ellos, desde una perspectiva estrictamente basada en la evidencia. Como es frecuentemente necesario en la medicina, la psiquiatría y la neuropsiquiatría, los medicamentos estudiados podrían utilizarse en el caso de un paciente específico, siempre y cuando se logre integrar críticamente la escasa literatura existente, la experiencia clínica, el equilibrio entre beneficios y riesgos potenciales, hacer un seguimiento prudente y adaptar la intervención al contexto de las circunstancias particulares del paciente. Debido a la falta de evidencia concluyente acerca de los tratamientos farmacológicos, se debería considerar la utilización de terapias no farmacológicas como primera opción antes de recurrir a los medicamentos. El tratamiento de los trastornos no motores en la EP es un área de investigación todavía en desarrollo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes. No aparecen nombres de los pacientes, ni sus iniciales, ni los números de historia clínica, ni cualquier dato que permita su identificación.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesJorge Holguin Lew ha participado y recibido remuneración por su participación en eventos organizados por la industria farmacéutica en áreas como esquizofrenia y depresión, pero no en relación con la enfermedad de Parkinson. Los autores no tienen conflictos de intereses con la industria farmacéutica en relación con el tema del estudio, con contrataciones por el Estado, como por ejemplo el Ministerio de Salud, ni los intereses de empresas promotoras de salud.