El tratamiento del trastorno afectivo bipolar (TAB) con litio se ha relacionado con menos deterioro cognitivo y menores cambios en la anatomía estructural cerebral comparado con otros tratamientos. Sin embargo, los estudios son heterogéneos y son pocos los que evalúan si estos efectos están relacionados. El objetivo de este estudio es evaluar y relacionar el desempeño cognitivo y la neuroanatomía estructural en pacientes tratados con y sin litio.
MétodosEstudio de corte trasversal que incluyó a 48 sujetos con TAB I: 22 tratados con litio y 26 sin litio. Se evaluó el desempeño en las pruebas neuropsicológicas Wechsler III (WAIS III), TMT A y B (Trial Making Test), prueba de aprendizaje verbal de California (TAVEC), prueba de figura compleja de Rey y prueba de clasificación de tarjetas de Wisconsin. Se evaluaron estructuras cerebrales obtenidas por resonancia magnétiva (RM) cerebral. Se calculó la diferencia de medias estandarizada (DME) entre ambos grupos, con ajuste por variables de confusión mediante puntuación de propensión, y se empleó el coeficiente de correlación de Spearman (ρ) para evaluar la relación existente entre el desempeño cognitivo y las regiones neuroanatómicas.
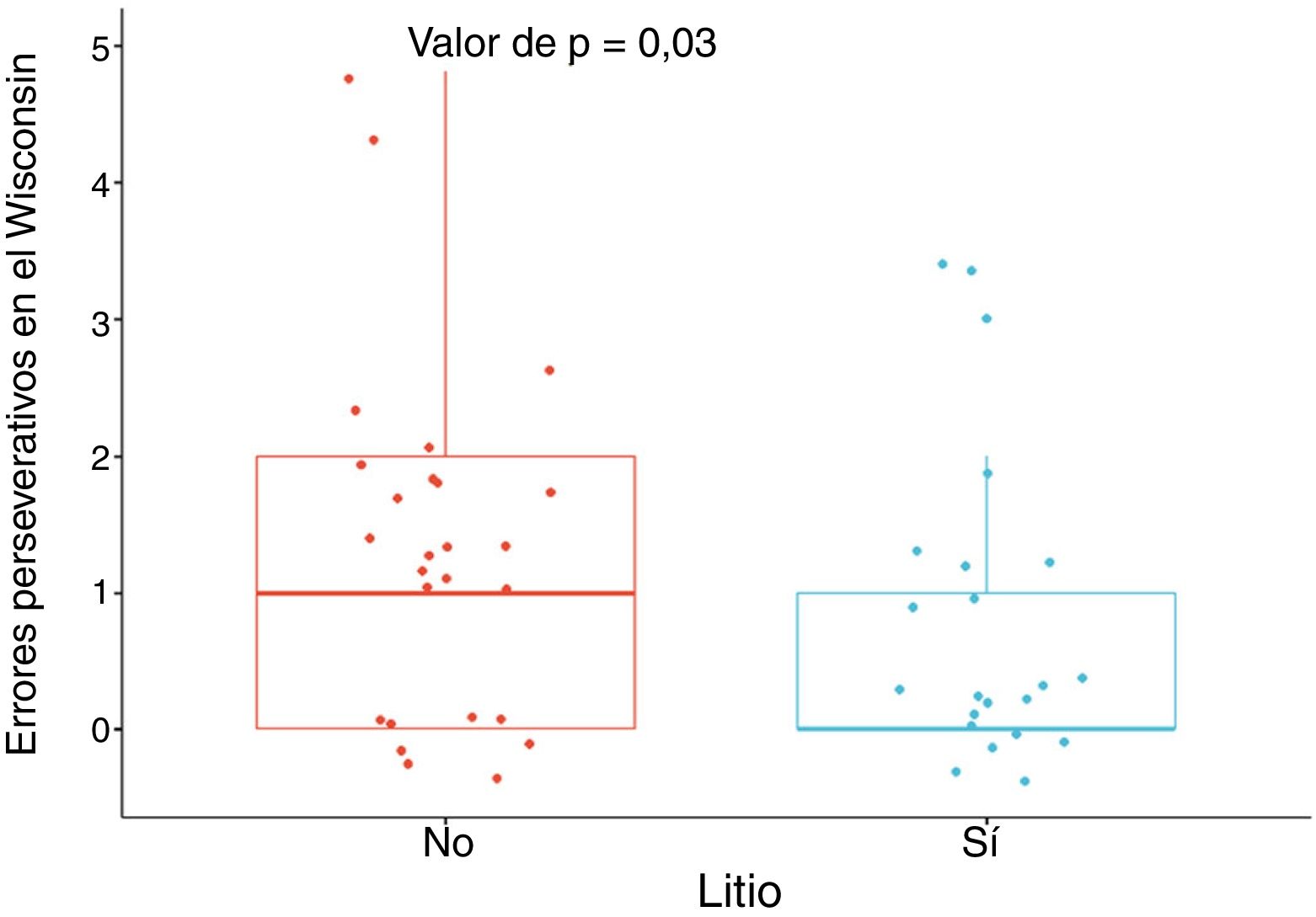
ResultadosRespecto al grupo sin litio, el grupo con litio tuvo menos errores perseverativos en el Wisconsin (DME = –0,69) y mayores áreas corticales derecha e izquierda (DME = 0,85 y DME = 0,92); mayor superficie en el cíngulo anterior izquierdo (DME = 1,32), la corteza orbitofrontal medial derecha (DME = 1,17), el giro frontal superior derecho (DME = 0,82), los giros precentrales derecho e izquierdo (DME = 1,33 y DME = 0,98); mayor volumen de la amígdala derecha (DME = 0,57), el hipocampo derecho (DME = 0,66), el putamen derecho (DME = 0,87) y el tálamo derecho (DME = 0,67). En el grupo con litio, se encontró una correlación con dichos errores y el espesor del giro precentral izquierdo (ρ = –0,78), el volumen del tálamo derecho (ρ = –0,44) y la amígdala derecha (ρ = 0,6).
ConclusionesEl grupo con litio tuvo mejor flexibilidad cognitiva y mayor dimensión en algunas regiones corticales frontales y subcorticales. Además, hubo correlación moderada a alta entre el desempeño en esta función ejecutiva y el espesor del giro precentral derecho, y los volúmenes del tálamo y la amígdala derecha. Estos hallazgos podrían indicar un efecto neuroprotector del litio.
Lithium treatment of bipolar disorder (BD) has been associated with less cognitive impairment and fewer changes in structural brain anatomy compared to other treatments. However, the studies are heterogeneous and few assess whether these effects are related. The objective of this study was to evaluate and relate cognitive performance and structural neuroanatomy in patients treated with and without lithium.
MethodsCross-sectional study that included 48 subjects with BD-I, of which 22 were treated with lithium and 26 without lithium. Performance was assessed on Wechsler III (WAIS III), TMT A and B (Trial Making Test) neuropsychological tests, California verbal learning test (CVLT), Rey complex figure test and Wisconsin card sorting test. Brain structures obtained by magnetic resonance imaging (MRI) were evaluated. The standardised mean difference (SMD) between both groups was calculated, adjusted for confounding variables using a propensity score, and the Spearman correlation coefficient (ρ) was used to assess the relationship between cognitive performance and neuroanatomical regions.
ResultsCompared to the group without lithium, the group with lithium had fewer perseverative errors in the Wisconsin test (SMD = –0.69) and greater left and right cortical areas (SMD = 0.85; SMD = 0.92); greater surface area in the left anterior cingulate (SMD = 1.32), right medial orbitofrontal cortex (SMD = 1.17), right superior frontal gyrus (SMD = 0.82), and right and left precentral gyrus (SMD = 1.33; SMD = 0.98); greater volume of the right amygdala (SMD = 0.57), right hippocampus (SMD = 0.66), right putamen (SMD = 0.87) and right thalamus (SMD=.67). In the lithium group, a correlation was found with these errors and the thickness of the left precentral gyrus (ρ = –0.78), the volume of the right thalamus (ρ =–0.44), and the right amygdala (ρ = 0.6).
ConclusionsThe lithium group had better cognitive flexibility and greater dimension in some frontal and subcortical cortical regions. Furthermore, there was a moderate to high correlation between performance in this executive function and the thickness of the right precentral gyrus, and the volumes of the thalamus and the right amygdala. These findings could suggest a neuroprotective effect of lithium.
El trastorno afectivo bipolar (TAB) se caracteriza por episodios de manía, hipomanía o depresión y es uno de los trastornos mentales más frecuentes, pues afecta a un 1-2% de los adultos de todo el mundo1-3. Según reportes de la Organización Mundial de la Salud, es la sexta causa de discapacidad por enfermedad debido a su impacto en la funcionalidad y la calidad de vida del individuo, dadas la cronicidad y la intensidad de los síntomas4. Uno de los factores relacionados con la alteración funcional es el deterioro cognitivo. Comparados con sujetos sanos, alrededor del 31% de los pacientes con TAB pueden presentar algún tipo de alteración cognitiva, principalmente el tipo I (TAB I)5,6. Varios autores han descrito que los dominios más afectados son la memoria declarativa, la atención y la función ejecutiva. Esto se ha evidenciado no solo en episodios de manía y depresión, sino también en eutimia, cuando se esperaría que los pacientes tuvieran un desempeño normal7–9. El deterioro cognitivo parece ser independiente del coeficiente intelectual (CI), la escolaridad, la edad o el sexo10, y parece ser más evidente en los pacientes con polaridad predominante maniaca, una mayor duración del trastorno y antecedente de síntomas psicóticos. Aunque no se conoce completamente la causa del deterioro cognitivo, se ha encontrado relación con el tratamiento farmacológico. Los anticonvulsivos y antipsicóticos usados para el TAB como estabilizadores de ánimo se han relacionado con mayor déficit cognitivo11–13. En cambio, en sujetos tratados con litio se ha visto menor alteración de la memoria visual, la atención y la función ejecutiva que en los pacientes que no lo tomaban14.
Dentro de la fisiopatología del deterioro cognitivo, se ha propuesto que pueden subyacer los cambios neurobiológicos propios del TAB15. Se sabe que, en comparación con los controles, los pacientes con TAB muestran alteraciones de la anatomía estructural en la resonancia magnética (RM) cerebral, como disminución de la sustancia gris con predominio frontal16,17, aumento del volumen ventricular y disminución del volumen de estructuras límbicas como la amígdala18,19. También se ha encontrado disminución del volumen de sustancia blanca adyacente a la circunvolución del cíngulo18. Hibar et al.20 encontraron disminución del espesor en sustancia gris a nivel frontal (pars opercularis y corteza frontal medial rostral izquierda) y temporal (giro fusiforme izquierdo); en este estudio, los sujetos tratados con litio mostraron mayor espesor, especialmente en el giro paracentral izquierdo y los giros parietales superiores derecho e izquierdo, a diferencia de los tratados con anticonvulsivos, que tuvieron disminución del espesor en el giro occipital lateral y el giro paracentral. Un fenómeno similar se ha observado en estructuras subcorticales: respecto a los controles, los sujetos con TAB tuvieron menores volúmenes de hipocampo, tálamo y amígdala y aumento bilateral de los ventrículos laterales, con un mayor deterioro en el TAB I. Los tratados con anticonvulsivos tuvieron menos volumen de hipocampo que los que no tratados y los que tomaban litio y aumento del volumen de los tálamos respecto a quienes no lo tomaban21. El efecto independiente del litio en la neuroanatomía estructural se observó en un estudio que mostró aumento del volumen del hipocampo, el tálamo y la amígdala en bipolares en monoterapia con litio comparados con bipolares sin tratamiento22.
Según esto, el menor desempeño cognitivo o la disminución de algunas estructuras corticales y subcorticales en los pacientes con TAB pudieran verse atenuados con el tratamiento con litio. Aunque el impacto en la cognición y la anatomía estructural se han estudiado, por lo general, de manera independiente, algunos estudios que correlacionan estas variables han encontrado mejor función ejecutiva con mayor volumen de sustancia gris de corteza prefrontal y dorsal y lateral23; además, una correlación entre menor control inhibitorio y menor volumen en regiones parietales, como el cúneo y lóbulo parietal inferior derecho24. Otros estudios han evaluado la correlación de la función cognitiva con tractografía cerebral o neuroimagen funcional, con hallazgos diversos24,25. La heterogeneidad de los estudios y la poca evidencia hacen difícil esclarecer si los hallazgos estructurales se relacionan con un deterioro clínico significativo en la cognición o son hallazgos sin impacto clínico significativo. Asimismo, si los hallazgos se ven afectados por el tratamiento farmacológico, que podría actuar como un factor predisponente o protector para la neuroprogresión.
El propósito es estudiar las diferencias en el desempeño cognitivo y el volumen y la correlación entre ambos en los pacientes con TAB I tratados con y sin litio pertenecientes la población de Antioquia.
MétodosEstudio de corte transversal derivado del proyecto PRISMA26 del Grupo de Investigación en Psiquiatría (GIPSI) de la Universidad de Antioquia. Fue avalado por el Comité de Bioética de la Facultad de Medicina de la Universidad de Antioquia y el Hospital San Vicente Fundación de Medellín. Acata los principios que protegen los derechos de los participantes según la resolución N.o 008430 de 1993 del Ministerio de Salud de la República de Colombia, y con la Declaración de Helsinki de 2013.
Solo se incluyó en el estudio a los sujetos que firmaron el consentimiento informado para PRISMA. Se garantizó el anonimato de los participantes durante el análisis estadístico con un código que permitió la identificación entre sujetos.
ParticipantesDe la muestra de 302 pacientes de PRISMA, 198 tenían diagnóstico de TAB I. Se analizaron los datos de 48 participantes que cumplían los criterios de elegibilidad. Se incluyó a pacientes de 18-60 años, con reporte de pruebas neuropsicológicas y RM realizadas en el mismo periodo de tiempo, que estuvieran en eutimia en el momento de la evaluación, definida como una escala de manía de Young < 6 puntos y una escala de depresión de Hamilton < 7 puntos. Se excluyó a aquellos con trastorno del espectro de la psicosis y la esquizofrenia, discapacidad intelectual, trastorno cognitivo menor y mayor, traumatismo craneoencefálico grave (pérdida de la conciencia > 30 min), uso de benzodiacepinas a dosis > 2 mg de lorazepam (o equivalente) y haber recibido terapia electroconvulsiva (TECAR) en los 2 años previos a la evaluación. Una vez recolectados estos pacientes, se organizaron en 2 grupos según hubieran recibido tratamiento con litio al menos los 12 meses consecutivos previos a la evaluación o no, por la historia clínica o el reporte verbal del paciente.
Instrumentos y procedimientosVariables sociodemográficas y clínicasPsiquiatras entrenados realizaron la evaluación clínica por medio de la entrevista diagnóstica para estudios genéticos (DIGS) versión 3.0 validada en Colombia27. De ella se obtuvieron las variables sociodemográficas edad, estado civil, escolaridad, número de años escolares aprobados y ocupación. También las variables clínicas edad del diagnóstico, tiempo de evolución del TAB, número de episodios afectivos, polaridad predominante, antecedente de psicosis, intentos de suicidio, tipo de tratamiento farmacológico para la enfermedad (litio, antipsicóticos, benzodiacepinas y antidepresivos), tiempo de tratamiento en semanas continuas y dosis (en miligramos equivalentes de clorpromazina los antipsicóticos y de lorazepam las benzodiacepinas). Para la evaluación de los síntomas afectivos, se usaron las escalas de Hamilton para depresión y Young para manía. La funcionalidad se evaluó con la Escala de Funcionamiento Global (GAF) y la Escala de Evaluación Funcional (FAST).
Evaluación neuropsicológicaUn psicólogo entrenado se encargó de la evaluación neuropsicológica. Según cada dominio, se realizaron las siguientes pruebas y subpruebas:
• Inteligencia: Escala de Inteligencia de Wechsler III (WAIS III) que evalúa la inteligencia verbal, manipulativa y total. Atención: TMT A, que evalúa habilidades motoras, visuoespaciales y atención mantenida. Memoria: WAIS, evalúa memoria lógica, diferida y reconocimiento, y prueba de aprendizaje verbal de California (TAVEC), que evalúa la curva de aprendizaje y la susceptibilidad a la interferencia. Funciones ejecutivas: prueba de clasificación de tarjetas de Wisconsin, que evalúa el razonamiento abstracto y la flexibilidad, y TMT B, que evalúa la flexibilidad. Lenguaje: fluencia verbal semántica y fonológica. Gnosias: prueba de figura compleja de Rey, que evalúa con tiempo y porcentaje de copia, evocación y errores28.
• Evaluación de la estructura cerebral: las RM se realizaron con un resonador Philips Achieva 3 Tesla Ingenia, con el que se obtuvieron imágenes volumétricas axiales en T1 con un tamaño de vóxel isotrópico de 1 mm3. Para el procesamiento de las imágenes, se utilizó el software Freesurfer29,30 con el siguiente flujo de trabajo: primero se hizo un registro afín con el espacio anatómico de Talairach, luego se realizó un etiquetado o segmentación inicial volumétrica, seguida de una corrección de las variaciones de intensidad de la imagen debido a heterogeneidades del campo magnético (bias field correction); posteriormente se aplicó un algoritmo de extracción del cráneo, se realizó una alineación no lineal para el espacio Talairach y se procedió a asignar un etiquetado volumétrico final para cada estructura, que incluyó la segmentación de la sustancia blanca (SB) y la sustancia gris (SG). Se analizaron las estructuras corticales y subcorticales bilateralmente. Se utilizó el atlas de regiones cerebrales de interés de Desikan y Killiany31. Se obtuvieron datos de 68 estructuras corticales (34 de cada hemisferio) y 14 subcorticales (7 de cada hemisferio). Se generó una base de datos teniendo en cuenta las medidas de espesor (mm) y área (mm2) de las estructuras corticales y el volumen (mm3) de las estructuras subcorticales obtenidas de Freesurfer. Para normalizar el volumen de las estructuras cerebrales y posibilitar la comparación, se usó la ecuación v′ = v / VIC, donde v’ es el volumen normalizado, v es el volumen no normalizado y VIC, el volumen intracanal total32. Los resultados de superficie y espesor cortical de Freesurfer se graficaron en MATLAB33.
Análisis estadísticoCon los datos obtenidos, se construyó una base de datos en Excel. Los datos se procesaron con R versión 3.6.3 y R studio versión 1.2.503334,35 y el paquete «esc» versión 0.5.136. Las variables categóricas se describen con frecuencias y porcentajes. Para las variables cuantitativas se usaron medidas de tendencia central (media ± desviación estándar en las volumetrías) y mediana [intervalo intercuartílico] en las demás variables del estudio.
Para comparar el desempeño cognitivo y los resultados en las volumetrías, se calculó la diferencia de medias estandarizada (DME) bruta y ajustada. Dado el pequeño tamaño de la muestra, el ajuste se realizó mediante puntuación de propensión37, calculada mediante regresión logística como la probabilidad de recibir litio según edad, sexo, nivel de escolaridad, antecedente de enfermedad cardiovascular (hipertensión, dislipemia, diabetes, obesidad), duración del TAB, número de episodios maniacos, antecedente de psicosis, intento suicida, toma de benzodiacepinas y consumo de alcohol y otras sustancias psicoactivas. Los resultados se presentaron con el respectivo intervalo de confianza del 95% (IC95%), así como el valor de p calculado con la prueba de la t de Student para muestras independientes en el caso de las volumetrías, y con la prueba de la U de Mann-Whitney para el caso de las variables neuropsicológicas. Ante las limitaciones del valor de p y siguiendo las sugerencias de Greenland et al., se calculó el valor s (Shannon information or surprise value) como s = – log2(p), donde p es el valor del test estadístico utilizado38,39. El valor s debe interpretarse como una medida continua de la cantidad de información o bits suministrada por el test estadístico en contra de la hipótesis contrastada (en nuestro caso, la hipótesis de ausencia de diferencias entre los que reciben litio y los que no). La DME se calculó con su respectivo intervalo de confianza mediante la aplicación en línea de la colaboración Campbell40. Valores de la DME > 0,80, 0,50 o 0,20 se interpretaron como diferencias altas, moderadas o bajas respectivamente41.
Se exploró la relación entre el desempeño en las pruebas neuropsicológicas por dominio cognitivo (atención, memoria, velocidad de procesamiento, inteligencia) y el volumen cerebral corregido de las áreas específicas definida a priori por medio del coeficiente de correlación de Spearman (ρ), se consideraron correlaciones moderadas con ρ > 0,4 y altas con ρ > 0,742,43. Lo anterior se realizó con toda la muestra y según se tomara litio o no.
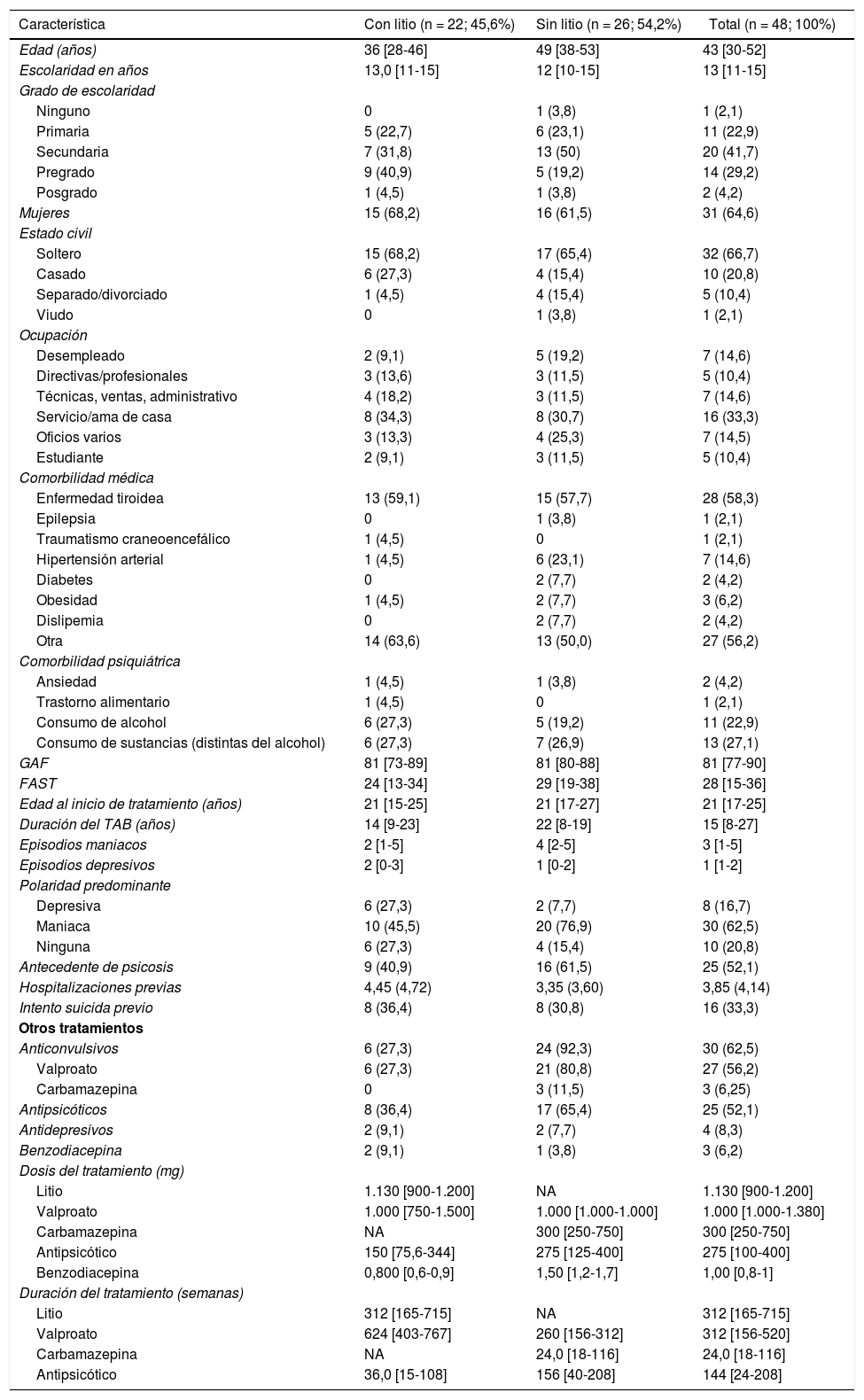
ResultadosCaracterísticas sociodemográficas y clínicasSe obtuvo una muestra de 48 individuos con TAB I que cumplían los criterios de elegibilidad. Se encontró que el 45,6% tomaba litio. Los pacientes con litio eran más jóvenes, tenían mayor porcentaje de empleados, menos hipertensión arterial y una edad de inicio del TAB más temprana. La polaridad predominante fue la maniaca en ambos grupos, pero fue más frecuente en el grupo sin litio, al igual que el antecedente de psicosis.
En el grupo que tomaba litio, el 36% estaba en monoterapia y el resto tenía otros tratamientos, como anticonvulsivos (27%), antipsicóticos (36%), antidepresivos (9%) y benzodiacepinas (9%). En el grupo sin litio, los anticonvulsivos fueron el tratamiento más frecuente (92%).
La dosis de valproato fue similar en ambos grupos, pero los que recibieron litio tomaron anticonvulsivos más tiempo. La dosis de antipsicótico fue más alta y la duración del tratamiento más larga en el grupo sin litio. El uso de benzodiacepinas fue poco frecuente en ambos grupos, pero mayor en el grupo sin litio (tabla 1).
Características sociodemográficas y clínicas de los pacientes con trastorno afectivo bipolar tipo I
| Característica | Con litio (n = 22; 45,6%) | Sin litio (n = 26; 54,2%) | Total (n = 48; 100%) |
|---|---|---|---|
| Edad (años) | 36 [28-46] | 49 [38-53] | 43 [30-52] |
| Escolaridad en años | 13,0 [11-15] | 12 [10-15] | 13 [11-15] |
| Grado de escolaridad | |||
| Ninguno | 0 | 1 (3,8) | 1 (2,1) |
| Primaria | 5 (22,7) | 6 (23,1) | 11 (22,9) |
| Secundaria | 7 (31,8) | 13 (50) | 20 (41,7) |
| Pregrado | 9 (40,9) | 5 (19,2) | 14 (29,2) |
| Posgrado | 1 (4,5) | 1 (3,8) | 2 (4,2) |
| Mujeres | 15 (68,2) | 16 (61,5) | 31 (64,6) |
| Estado civil | |||
| Soltero | 15 (68,2) | 17 (65,4) | 32 (66,7) |
| Casado | 6 (27,3) | 4 (15,4) | 10 (20,8) |
| Separado/divorciado | 1 (4,5) | 4 (15,4) | 5 (10,4) |
| Viudo | 0 | 1 (3,8) | 1 (2,1) |
| Ocupación | |||
| Desempleado | 2 (9,1) | 5 (19,2) | 7 (14,6) |
| Directivas/profesionales | 3 (13,6) | 3 (11,5) | 5 (10,4) |
| Técnicas, ventas, administrativo | 4 (18,2) | 3 (11,5) | 7 (14,6) |
| Servicio/ama de casa | 8 (34,3) | 8 (30,7) | 16 (33,3) |
| Oficios varios | 3 (13,3) | 4 (25,3) | 7 (14,5) |
| Estudiante | 2 (9,1) | 3 (11,5) | 5 (10,4) |
| Comorbilidad médica | |||
| Enfermedad tiroidea | 13 (59,1) | 15 (57,7) | 28 (58,3) |
| Epilepsia | 0 | 1 (3,8) | 1 (2,1) |
| Traumatismo craneoencefálico | 1 (4,5) | 0 | 1 (2,1) |
| Hipertensión arterial | 1 (4,5) | 6 (23,1) | 7 (14,6) |
| Diabetes | 0 | 2 (7,7) | 2 (4,2) |
| Obesidad | 1 (4,5) | 2 (7,7) | 3 (6,2) |
| Dislipemia | 0 | 2 (7,7) | 2 (4,2) |
| Otra | 14 (63,6) | 13 (50,0) | 27 (56,2) |
| Comorbilidad psiquiátrica | |||
| Ansiedad | 1 (4,5) | 1 (3,8) | 2 (4,2) |
| Trastorno alimentario | 1 (4,5) | 0 | 1 (2,1) |
| Consumo de alcohol | 6 (27,3) | 5 (19,2) | 11 (22,9) |
| Consumo de sustancias (distintas del alcohol) | 6 (27,3) | 7 (26,9) | 13 (27,1) |
| GAF | 81 [73-89] | 81 [80-88] | 81 [77-90] |
| FAST | 24 [13-34] | 29 [19-38] | 28 [15-36] |
| Edad al inicio de tratamiento (años) | 21 [15-25] | 21 [17-27] | 21 [17-25] |
| Duración del TAB (años) | 14 [9-23] | 22 [8-19] | 15 [8-27] |
| Episodios maniacos | 2 [1-5] | 4 [2-5] | 3 [1-5] |
| Episodios depresivos | 2 [0-3] | 1 [0-2] | 1 [1-2] |
| Polaridad predominante | |||
| Depresiva | 6 (27,3) | 2 (7,7) | 8 (16,7) |
| Maniaca | 10 (45,5) | 20 (76,9) | 30 (62,5) |
| Ninguna | 6 (27,3) | 4 (15,4) | 10 (20,8) |
| Antecedente de psicosis | 9 (40,9) | 16 (61,5) | 25 (52,1) |
| Hospitalizaciones previas | 4,45 (4,72) | 3,35 (3,60) | 3,85 (4,14) |
| Intento suicida previo | 8 (36,4) | 8 (30,8) | 16 (33,3) |
| Otros tratamientos | |||
| Anticonvulsivos | 6 (27,3) | 24 (92,3) | 30 (62,5) |
| Valproato | 6 (27,3) | 21 (80,8) | 27 (56,2) |
| Carbamazepina | 0 | 3 (11,5) | 3 (6,25) |
| Antipsicóticos | 8 (36,4) | 17 (65,4) | 25 (52,1) |
| Antidepresivos | 2 (9,1) | 2 (7,7) | 4 (8,3) |
| Benzodiacepina | 2 (9,1) | 1 (3,8) | 3 (6,2) |
| Dosis del tratamiento (mg) | |||
| Litio | 1.130 [900-1.200] | NA | 1.130 [900-1.200] |
| Valproato | 1.000 [750-1.500] | 1.000 [1.000-1.000] | 1.000 [1.000-1.380] |
| Carbamazepina | NA | 300 [250-750] | 300 [250-750] |
| Antipsicótico | 150 [75,6-344] | 275 [125-400] | 275 [100-400] |
| Benzodiacepina | 0,800 [0,6-0,9] | 1,50 [1,2-1,7] | 1,00 [0,8-1] |
| Duración del tratamiento (semanas) | |||
| Litio | 312 [165-715] | NA | 312 [165-715] |
| Valproato | 624 [403-767] | 260 [156-312] | 312 [156-520] |
| Carbamazepina | NA | 24,0 [18-116] | 24,0 [18-116] |
| Antipsicótico | 36,0 [15-108] | 156 [40-208] | 144 [24-208] |
FAST: escala de evaluación funcional; GAF: escala de funcionamiento global.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
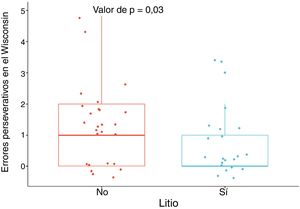
Los pacientes tratados con litio tuvieron mejor desempeño en la función ejecutiva, específicamente en la flexibilidad, dada por menor cantidad de errores perseverativos en el Wisconsin, con una DME moderada, al ajustar por edad, sexo, escolaridad, enfermedad cardiovascular, número de episodios maniacos, antecedente de psicosis, intento suicida, uso de benzodiacepinas, alcohol y otras sustancias psicoactivas (DME = –0,69; IC95%, –1,28 a –0,11; p = 0,03) (figura 1). No se encontraron diferencias importantes en las otras variables neuropsicológicas (tabla 1 del material adicional).
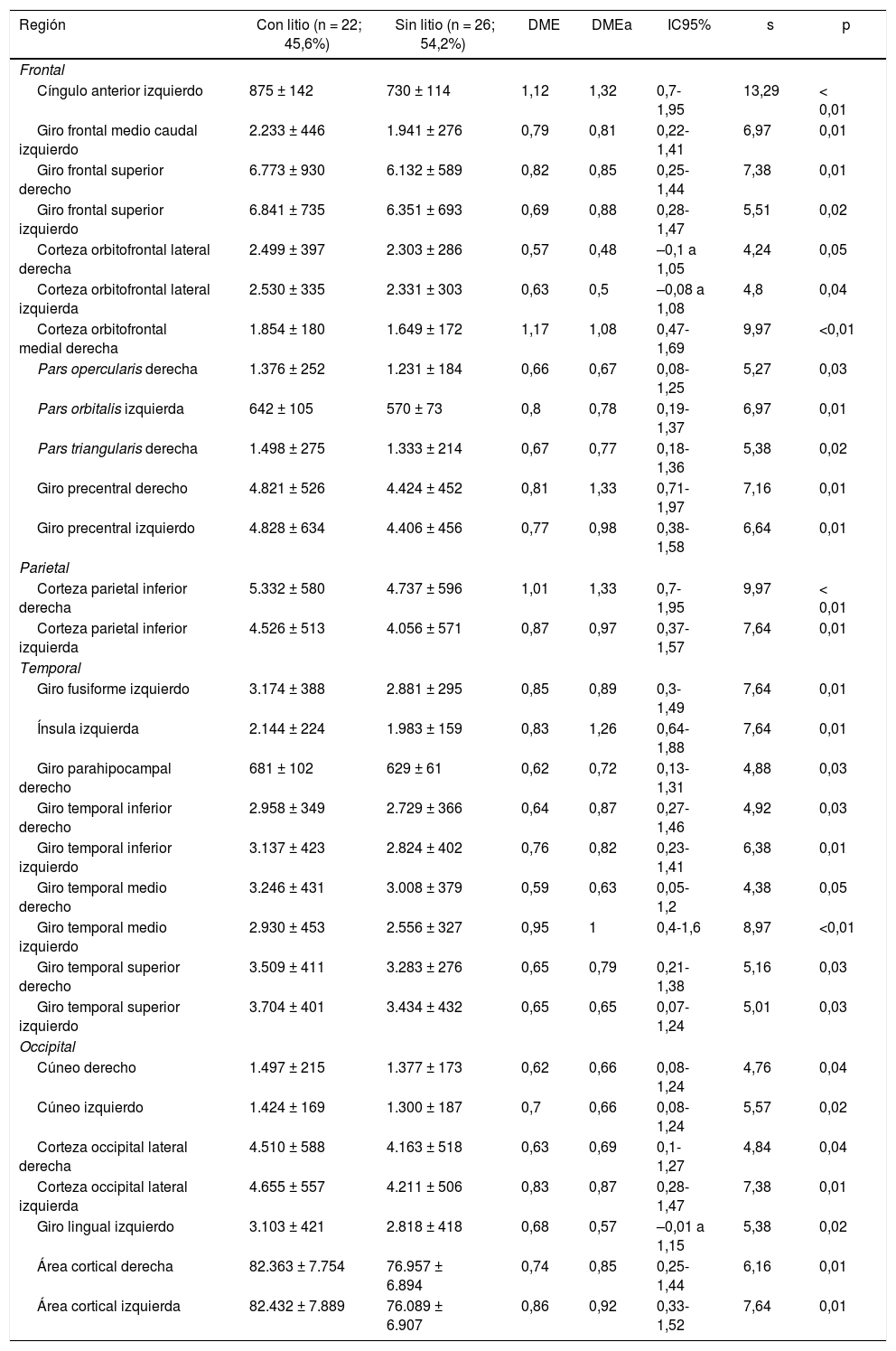
Estructura cerebralSuperficie y espesor de regiones corticalesSe encontró en promedio una mayor área cortical bilateral en el grupo que tomaba litio (tabla 2), sin diferencias importantes en el espesor cortical total entre ambos grupos (tabla 3).
Superficie de las regiones corticales de interés de pacientes con trastorno afectivo bipolar tipo I según cada lóbulo cerebral
| Región | Con litio (n = 22; 45,6%) | Sin litio (n = 26; 54,2%) | DME | DMEa | IC95% | s | p |
|---|---|---|---|---|---|---|---|
| Frontal | |||||||
| Cíngulo anterior izquierdo | 875 ± 142 | 730 ± 114 | 1,12 | 1,32 | 0,7-1,95 | 13,29 | < 0,01 |
| Giro frontal medio caudal izquierdo | 2.233 ± 446 | 1.941 ± 276 | 0,79 | 0,81 | 0,22-1,41 | 6,97 | 0,01 |
| Giro frontal superior derecho | 6.773 ± 930 | 6.132 ± 589 | 0,82 | 0,85 | 0,25-1,44 | 7,38 | 0,01 |
| Giro frontal superior izquierdo | 6.841 ± 735 | 6.351 ± 693 | 0,69 | 0,88 | 0,28-1,47 | 5,51 | 0,02 |
| Corteza orbitofrontal lateral derecha | 2.499 ± 397 | 2.303 ± 286 | 0,57 | 0,48 | –0,1 a 1,05 | 4,24 | 0,05 |
| Corteza orbitofrontal lateral izquierda | 2.530 ± 335 | 2.331 ± 303 | 0,63 | 0,5 | –0,08 a 1,08 | 4,8 | 0,04 |
| Corteza orbitofrontal medial derecha | 1.854 ± 180 | 1.649 ± 172 | 1,17 | 1,08 | 0,47-1,69 | 9,97 | <0,01 |
| Pars opercularis derecha | 1.376 ± 252 | 1.231 ± 184 | 0,66 | 0,67 | 0,08-1,25 | 5,27 | 0,03 |
| Pars orbitalis izquierda | 642 ± 105 | 570 ± 73 | 0,8 | 0,78 | 0,19-1,37 | 6,97 | 0,01 |
| Pars triangularis derecha | 1.498 ± 275 | 1.333 ± 214 | 0,67 | 0,77 | 0,18-1,36 | 5,38 | 0,02 |
| Giro precentral derecho | 4.821 ± 526 | 4.424 ± 452 | 0,81 | 1,33 | 0,71-1,97 | 7,16 | 0,01 |
| Giro precentral izquierdo | 4.828 ± 634 | 4.406 ± 456 | 0,77 | 0,98 | 0,38-1,58 | 6,64 | 0,01 |
| Parietal | |||||||
| Corteza parietal inferior derecha | 5.332 ± 580 | 4.737 ± 596 | 1,01 | 1,33 | 0,7-1,95 | 9,97 | < 0,01 |
| Corteza parietal inferior izquierda | 4.526 ± 513 | 4.056 ± 571 | 0,87 | 0,97 | 0,37-1,57 | 7,64 | 0,01 |
| Temporal | |||||||
| Giro fusiforme izquierdo | 3.174 ± 388 | 2.881 ± 295 | 0,85 | 0,89 | 0,3-1,49 | 7,64 | 0,01 |
| Ínsula izquierda | 2.144 ± 224 | 1.983 ± 159 | 0,83 | 1,26 | 0,64-1,88 | 7,64 | 0,01 |
| Giro parahipocampal derecho | 681 ± 102 | 629 ± 61 | 0,62 | 0,72 | 0,13-1,31 | 4,88 | 0,03 |
| Giro temporal inferior derecho | 2.958 ± 349 | 2.729 ± 366 | 0,64 | 0,87 | 0,27-1,46 | 4,92 | 0,03 |
| Giro temporal inferior izquierdo | 3.137 ± 423 | 2.824 ± 402 | 0,76 | 0,82 | 0,23-1,41 | 6,38 | 0,01 |
| Giro temporal medio derecho | 3.246 ± 431 | 3.008 ± 379 | 0,59 | 0,63 | 0,05-1,2 | 4,38 | 0,05 |
| Giro temporal medio izquierdo | 2.930 ± 453 | 2.556 ± 327 | 0,95 | 1 | 0,4-1,6 | 8,97 | <0,01 |
| Giro temporal superior derecho | 3.509 ± 411 | 3.283 ± 276 | 0,65 | 0,79 | 0,21-1,38 | 5,16 | 0,03 |
| Giro temporal superior izquierdo | 3.704 ± 401 | 3.434 ± 432 | 0,65 | 0,65 | 0,07-1,24 | 5,01 | 0,03 |
| Occipital | |||||||
| Cúneo derecho | 1.497 ± 215 | 1.377 ± 173 | 0,62 | 0,66 | 0,08-1,24 | 4,76 | 0,04 |
| Cúneo izquierdo | 1.424 ± 169 | 1.300 ± 187 | 0,7 | 0,66 | 0,08-1,24 | 5,57 | 0,02 |
| Corteza occipital lateral derecha | 4.510 ± 588 | 4.163 ± 518 | 0,63 | 0,69 | 0,1-1,27 | 4,84 | 0,04 |
| Corteza occipital lateral izquierda | 4.655 ± 557 | 4.211 ± 506 | 0,83 | 0,87 | 0,28-1,47 | 7,38 | 0,01 |
| Giro lingual izquierdo | 3.103 ± 421 | 2.818 ± 418 | 0,68 | 0,57 | –0,01 a 1,15 | 5,38 | 0,02 |
| Área cortical derecha | 82.363 ± 7.754 | 76.957 ± 6.894 | 0,74 | 0,85 | 0,25-1,44 | 6,16 | 0,01 |
| Área cortical izquierda | 82.432 ± 7.889 | 76.089 ± 6.907 | 0,86 | 0,92 | 0,33-1,52 | 7,64 | 0,01 |
DME: diferencia de medias estandarizada; DMEa: DME ajustada por edad, sexo, escolaridad, enfermedad cardiovascular, número de episodios maniacos, antecedente de psicosis, intento suicida y consumo de benzodiacepinas, alcohol y otras sustancias psicoactivas.
Los valores expresan media ± desviación estándar en milímetros.
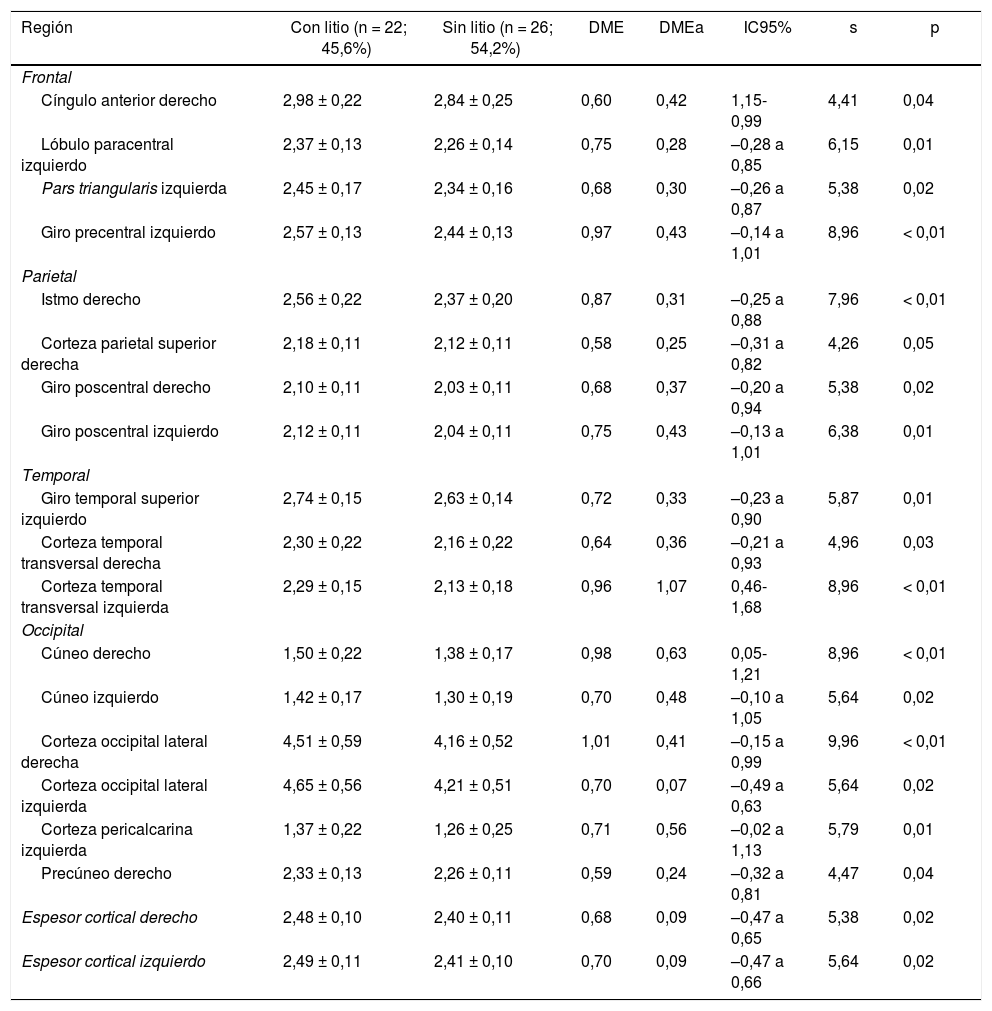
Espesor de las regiones corticales de interés de pacientes con trastorno afectivo bipolar tipo I según cada lóbulo cerebral
| Región | Con litio (n = 22; 45,6%) | Sin litio (n = 26; 54,2%) | DME | DMEa | IC95% | s | p |
|---|---|---|---|---|---|---|---|
| Frontal | |||||||
| Cíngulo anterior derecho | 2,98 ± 0,22 | 2,84 ± 0,25 | 0,60 | 0,42 | 1,15-0,99 | 4,41 | 0,04 |
| Lóbulo paracentral izquierdo | 2,37 ± 0,13 | 2,26 ± 0,14 | 0,75 | 0,28 | –0,28 a 0,85 | 6,15 | 0,01 |
| Pars triangularis izquierda | 2,45 ± 0,17 | 2,34 ± 0,16 | 0,68 | 0,30 | –0,26 a 0,87 | 5,38 | 0,02 |
| Giro precentral izquierdo | 2,57 ± 0,13 | 2,44 ± 0,13 | 0,97 | 0,43 | –0,14 a 1,01 | 8,96 | < 0,01 |
| Parietal | |||||||
| Istmo derecho | 2,56 ± 0,22 | 2,37 ± 0,20 | 0,87 | 0,31 | –0,25 a 0,88 | 7,96 | < 0,01 |
| Corteza parietal superior derecha | 2,18 ± 0,11 | 2,12 ± 0,11 | 0,58 | 0,25 | –0,31 a 0,82 | 4,26 | 0,05 |
| Giro poscentral derecho | 2,10 ± 0,11 | 2,03 ± 0,11 | 0,68 | 0,37 | –0,20 a 0,94 | 5,38 | 0,02 |
| Giro poscentral izquierdo | 2,12 ± 0,11 | 2,04 ± 0,11 | 0,75 | 0,43 | –0,13 a 1,01 | 6,38 | 0,01 |
| Temporal | |||||||
| Giro temporal superior izquierdo | 2,74 ± 0,15 | 2,63 ± 0,14 | 0,72 | 0,33 | –0,23 a 0,90 | 5,87 | 0,01 |
| Corteza temporal transversal derecha | 2,30 ± 0,22 | 2,16 ± 0,22 | 0,64 | 0,36 | –0,21 a 0,93 | 4,96 | 0,03 |
| Corteza temporal transversal izquierda | 2,29 ± 0,15 | 2,13 ± 0,18 | 0,96 | 1,07 | 0,46-1,68 | 8,96 | < 0,01 |
| Occipital | |||||||
| Cúneo derecho | 1,50 ± 0,22 | 1,38 ± 0,17 | 0,98 | 0,63 | 0,05-1,21 | 8,96 | < 0,01 |
| Cúneo izquierdo | 1,42 ± 0,17 | 1,30 ± 0,19 | 0,70 | 0,48 | –0,10 a 1,05 | 5,64 | 0,02 |
| Corteza occipital lateral derecha | 4,51 ± 0,59 | 4,16 ± 0,52 | 1,01 | 0,41 | –0,15 a 0,99 | 9,96 | < 0,01 |
| Corteza occipital lateral izquierda | 4,65 ± 0,56 | 4,21 ± 0,51 | 0,70 | 0,07 | –0,49 a 0,63 | 5,64 | 0,02 |
| Corteza pericalcarina izquierda | 1,37 ± 0,22 | 1,26 ± 0,25 | 0,71 | 0,56 | –0,02 a 1,13 | 5,79 | 0,01 |
| Precúneo derecho | 2,33 ± 0,13 | 2,26 ± 0,11 | 0,59 | 0,24 | –0,32 a 0,81 | 4,47 | 0,04 |
| Espesor cortical derecho | 2,48 ± 0,10 | 2,40 ± 0,11 | 0,68 | 0,09 | –0,47 a 0,65 | 5,38 | 0,02 |
| Espesor cortical izquierdo | 2,49 ± 0,11 | 2,41 ± 0,10 | 0,70 | 0,09 | –0,47 a 0,66 | 5,64 | 0,02 |
DME: diferencia de medias estandarizada; DMEa: DME ajustada por edad, sexo, escolaridad, enfermedad cardiovascular, número de episodios maniacos, antecedente de psicosis, intento suicida y consumo de benzodiacepinas, alcohol y otras sustancias psicoactivas.
Los valores expresan media ± desviación estándar en milímetros.
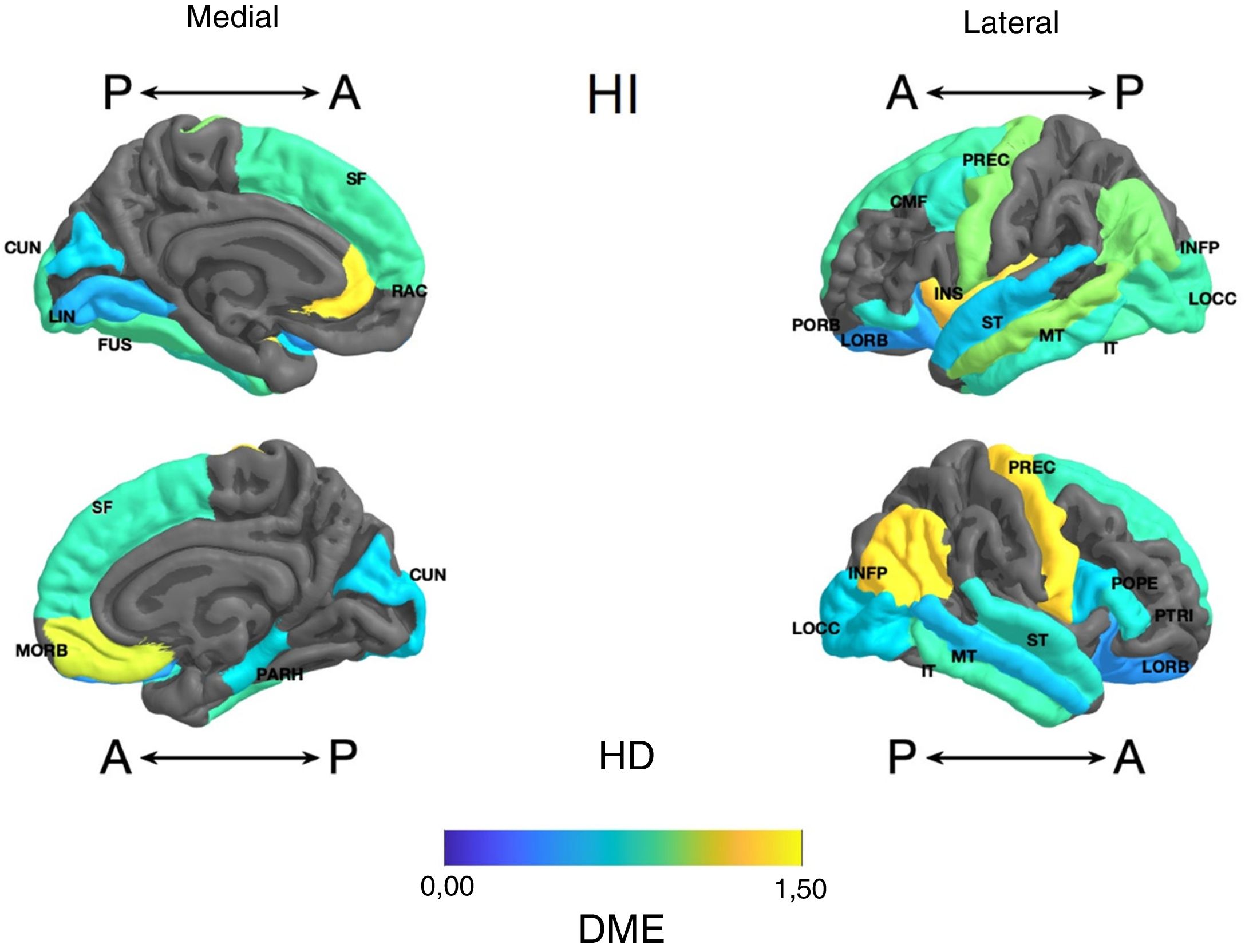
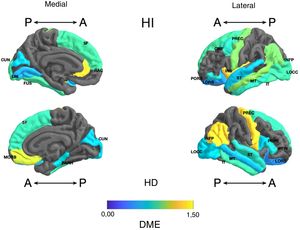
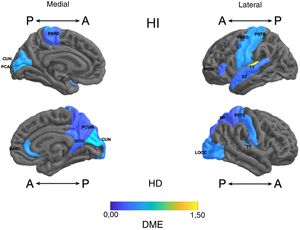
Frontal. Se encontró en el grupo de litio una mayor superficie en el cíngulo anterior izquierdo, el giro frontal medio caudal izquierdo, los giros frontales superiores derecho e izquierdo, la corteza orbitofrontal medial derecha y el giro precentral bilateralmente (DME alta). Asimismo, mayor superficie de la corteza orbitofrontal lateral izquierda, la pars orbitalis izquierda, la pars opercularis y triangularis derecha (DME moderada) (tabla 2 y figura 2). Se encontró mayor espesor en el cíngulo anterior derecho y el giro precentral izquierdo (DME baja) (figura 3 y tabla 2 del material adicional).
Diferencia de medias estandarizada (DME) de la superficie de las regiones corticales de interés en pacientes con trastorno afectivo bipolar tipo I tratados con y sin litio, de los hemisferios derecho (HD) e izquierdo (HI) y con vistas anterior (A) y posterior (P). CMF: frontal medio caudal; CUN: cúneo; FUS: fusiforme; INFP: parietal inferior; INS: ínsula; IT: temporal inferior; LIN: lingual; LOCC: lateral occipital; LORB: orbitofrontal lateral; MORB: orbitofrontal medial; MT: temporal medio; PARH: parahipocampal; POPE: pars opercularis; PORB: pars orbitalis; PREC: precentral; PTRI: pars triangularis; RAC: cíngulo anterior rostral; SF: frontal superior; ST: temporal superior.
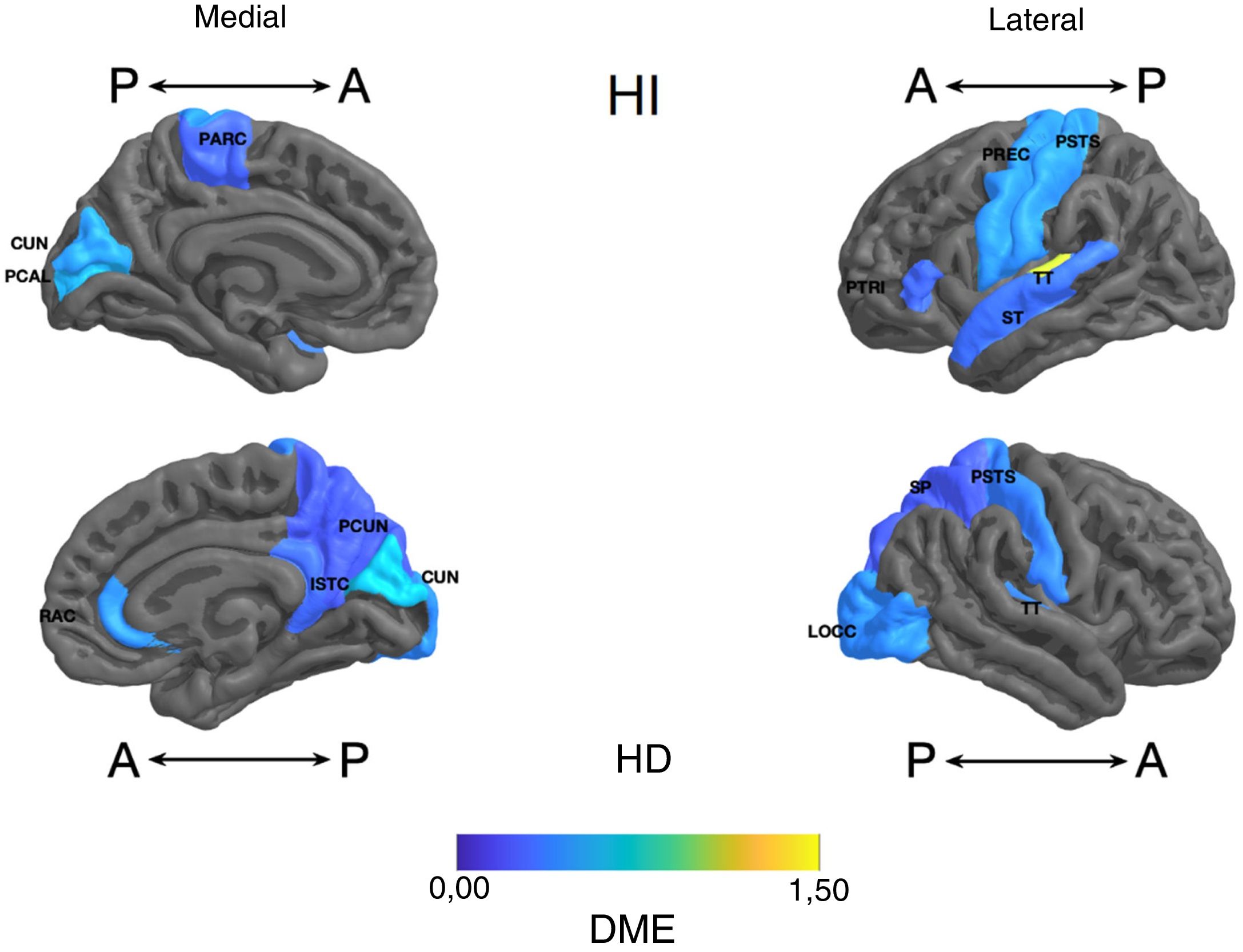
Diferencia de medias estandarizada (DME) del espesor de regiones corticales de interés en pacientes con trastorno afectivo bipolar tipo I tratados con litio y sin litio, según hemisferio derecho (HD) e izquierdo (HI) con vista anterior (A) y posterior (P). RAC: cíngulo anterior rostral; PARC: lóbulo paracentral; PTRI: pars triangularis; PREC: precentral; ISTC: istmo; SP: parietal superior; PSTS: poscentral; ST: temporal superior; TT: temporal transversal; CUN: cúneo; LOCC: lateral occipital; PCAL: pericalcarina; PCUN: precúneo.
Parietal. En el grupo con litio fue mayor la superficie de las cortezas parietales inferiores derecha e izquierda (DME alta) (tabla 2 y figura 2). El espesor del giro poscentral bilateral fue mayor en los del grupo con litio (DME baja) (figura 3 y tabla 2 del material adicional).
Temporal. Se encontró en el grupo con litio mayor superficie del giro fusiforme izquierdo, la ínsula izquierda, el giro temporal inferior bilateral y el temporal medio izquierdo (DME alta), y en el giro parahipocampal derecho y temporal superior bilateral (DME moderada) (tabla 2 y figura 2). Se encontró mayor espesor cortical en la corteza temporal transversal izquierda (DME alta) (figura 3 y tabla 2 del material adicional).
Occipital. El grupo con litio presentó mayor superficie en la corteza occipital lateral izquierda (DME alta) y el cúneo bilateral, el giro lingual izquierdo y la corteza lateral occipital derecha (DME moderada) (tabla 2 y figura 2). El espesor cortical en el grupo con litio fue mayor en el cúneo bilateral y la corteza pericalcarina derecha (DME moderado) (figura 3 y tabla 2 del material adicional).
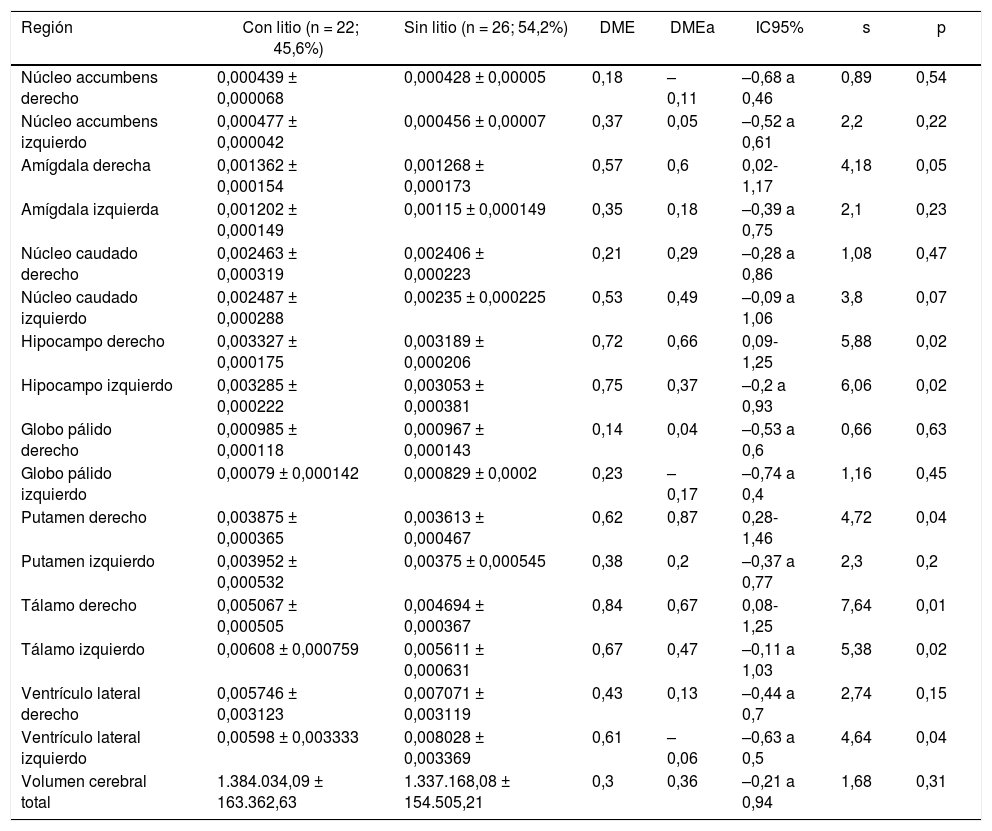
Volumen de regiones subcorticalesEn el grupo con litio se encontró mayor volumen de la amígdala derecha, el hipocampo derecho, el putamen derecho y el tálamo derecho (DME moderada) y mayor volumen en los caudados derecho e izquierdo, el hipocampo izquierdo y el tálamo izquierdo (DME baja). No se identificaron diferencias en el volumen de ventrículos laterales derecho e izquierdo ni en el volumen cerebral total (tabla 4).
Volumen normalizado* de regiones subcorticales de interés de pacientes con trastorno afectivo bipolar tipo I
| Región | Con litio (n = 22; 45,6%) | Sin litio (n = 26; 54,2%) | DME | DMEa | IC95% | s | p |
|---|---|---|---|---|---|---|---|
| Núcleo accumbens derecho | 0,000439 ± 0,000068 | 0,000428 ± 0,00005 | 0,18 | –0,11 | –0,68 a 0,46 | 0,89 | 0,54 |
| Núcleo accumbens izquierdo | 0,000477 ± 0,000042 | 0,000456 ± 0,00007 | 0,37 | 0,05 | –0,52 a 0,61 | 2,2 | 0,22 |
| Amígdala derecha | 0,001362 ± 0,000154 | 0,001268 ± 0,000173 | 0,57 | 0,6 | 0,02-1,17 | 4,18 | 0,05 |
| Amígdala izquierda | 0,001202 ± 0,000149 | 0,00115 ± 0,000149 | 0,35 | 0,18 | –0,39 a 0,75 | 2,1 | 0,23 |
| Núcleo caudado derecho | 0,002463 ± 0,000319 | 0,002406 ± 0,000223 | 0,21 | 0,29 | –0,28 a 0,86 | 1,08 | 0,47 |
| Núcleo caudado izquierdo | 0,002487 ± 0,000288 | 0,00235 ± 0,000225 | 0,53 | 0,49 | –0,09 a 1,06 | 3,8 | 0,07 |
| Hipocampo derecho | 0,003327 ± 0,000175 | 0,003189 ± 0,000206 | 0,72 | 0,66 | 0,09-1,25 | 5,88 | 0,02 |
| Hipocampo izquierdo | 0,003285 ± 0,000222 | 0,003053 ± 0,000381 | 0,75 | 0,37 | –0,2 a 0,93 | 6,06 | 0,02 |
| Globo pálido derecho | 0,000985 ± 0,000118 | 0,000967 ± 0,000143 | 0,14 | 0,04 | –0,53 a 0,6 | 0,66 | 0,63 |
| Globo pálido izquierdo | 0,00079 ± 0,000142 | 0,000829 ± 0,0002 | 0,23 | –0,17 | –0,74 a 0,4 | 1,16 | 0,45 |
| Putamen derecho | 0,003875 ± 0,000365 | 0,003613 ± 0,000467 | 0,62 | 0,87 | 0,28-1,46 | 4,72 | 0,04 |
| Putamen izquierdo | 0,003952 ± 0,000532 | 0,00375 ± 0,000545 | 0,38 | 0,2 | –0,37 a 0,77 | 2,3 | 0,2 |
| Tálamo derecho | 0,005067 ± 0,000505 | 0,004694 ± 0,000367 | 0,84 | 0,67 | 0,08-1,25 | 7,64 | 0,01 |
| Tálamo izquierdo | 0,00608 ± 0,000759 | 0,005611 ± 0,000631 | 0,67 | 0,47 | –0,11 a 1,03 | 5,38 | 0,02 |
| Ventrículo lateral derecho | 0,005746 ± 0,003123 | 0,007071 ± 0,003119 | 0,43 | 0,13 | –0,44 a 0,7 | 2,74 | 0,15 |
| Ventrículo lateral izquierdo | 0,00598 ± 0,003333 | 0,008028 ± 0,003369 | 0,61 | –0,06 | –0,63 a 0,5 | 4,64 | 0,04 |
| Volumen cerebral total | 1.384.034,09 ± 163.362,63 | 1.337.168,08 ± 154.505,21 | 0,3 | 0,36 | –0,21 a 0,94 | 1,68 | 0,31 |
DME: diferencia de medias estandarizada; DMEa: DME ajustada por edad, sexo, escolaridad, enfermedad cardiovascular, número de episodios maniacos, antecedente de psicosis, intento suicida y consumo de benzodiacepinas, alcohol y otras sustancias psicoactivas.
*Relación entre el volumen de la región y el volumen cerebral total.
Los valores expresan media ± desviación estándar en mililitros.
Con la toma de litio, se encontró una correlación inversa entre los errores perseverativos del Wisconsin y el espesor del giro precentral izquierdo (ρ = –0,78) que no se observó en el grupo sin litio (ρ = 0,12). No se encontró correlación entre los errores perseverativos del Wisconsin y otras regiones corticales.
Regiones subcorticalesCon la toma de litio se encontró una correlación inversa moderada entre los errores perseverativos del Wisconsin y el volumen del tálamo derecho (ρ = –0,44), que no se observó en el grupo sin litio (ρ = 0,03). También una correlación positiva entre los errores perseverativos del Wisconsin y el volumen de la amígdala derecha (ρ = 0,6), que no se halló en los que no tomaban litio (ρ = –0,1). No se encontró correlación entre los errores perseverativos del Wisconsin y otras regiones subcorticales.
DiscusiónEn este estudio se comparó el desempeño cognitivo y la estructura de diferentes regiones corticales y subcorticales de interés en pacientes con TAB, según tomaran litio o no como tratamiento farmacológico y se correlacionaron estos hallazgos. Se encontró un mejor desempeño en función ejecutiva, indicado por un menor número de perseveraciones en los que usaban litio, que se correlacionó con un mayores espesor del giro precentral izquierdo y volumen del tálamo derecho. Además se encontró una correlación positiva con el volumen de la amígdala derecha y el número de errores perseverativos en los tratados con litio. Los resultados fueron robustos al ajustar por variables clínicas como uso de psicoactivos, antecedente cardiovascular, duración de la enfermedad, número de episodios e intento suicida, que previamente han mostrado influencia en la cognición o la neuroanatomía23,44–49.
La función ejecutiva se ha descrito como la habilidad de responder y adaptarse a situaciones nuevas. Uno de sus componentes es la flexibilidad al cambio, es decir, la toma de nuevas decisiones cuando se han modificado factores ambientales. Un mayor número de perseveraciones habla de más dificultad para cambiar o alternar tareas, menor flexibilidad28. Estudios previos han evidenciado menor desempeño en función ejecutiva no solo en la flexibilidad, sino en la planeación y la respuesta inhibitoria en bipolares comparados con controles sanos50, así como en la memoria y la atención. Y al comparar con el litio, los pacientes tratados con anticonvulsivos tienen un peor desempeño cognitivo5,6,11,51–53. Nuestro estudio encuentra diferencias en la flexibilidad, medida por los errores perseverativos del Wisconsin, al comparar los 2 grupos de tratamiento, con menor errores en el grupo con litio. No hubo diferencias importantes en otras variables del Wisconsin. El tiempo del TMT B fue menor en el grupo con litio, lo que habla de mejor función ejecutiva en este grupo, pero con p > 0,05. Otras pruebas realizadas que evalúan indirectamente la función ejecutiva, como los cubos de Corsi y la fluidez verbal, resultaron similares en ambos grupos. No se encontraron diferencias para los otros dominios cognitivos.
Los lóbulos frontales, el estriado y el tálamo se han considerado el sustrato neurobiológico de las funciones ejecutivas. La corteza orbitofrontal y la corteza anterior del cíngulo son las más relacionadas con la flexibilidad54. En este estudio se encontraron precisamente diferencias en las dimensiones de regiones frontales involucradas en los procesos ejecutivos al comparar con el tratamiento con litio y sin litio. Llamativamente, la correlación fue más fuerte con el giro precentral izquierdo, que contiene el área motora primaria encargada de la función motora, que con las estructuras prefrontales o el cíngulo. También se encontró correlación con el tálamo, que es la región anatómica de integración de la información cortical55.
Un hallazgo llamativo de nuestro estudio es la correlación positiva entre el volumen de la amígdala y los errores perseverativos en los que usaron litio. La amígdala es el sustrato para el procesamiento de emociones primarias56. Estudios en animales han demostrado que las lesiones mesiales que incluyen la amígdala generan disminución del miedo condicionado, y en humanos, han mostrado que reducen la reactividad autonómica a estímulos57,58. Teniendo en cuenta esto, se ha propuesto que la función de la amígdala adicional a la de la corteza orbitofrontal interviene en la toma de decisiones, ya que es un proceso dependiente de las emociones59. Teniendo en cuenta nuestros resultados, una hipótesis es la posible relación del volumen de la amígdala con una mayor interferencia emocional en la función ejecutiva de los que tomaban litio, pero este efecto se vería amortiguado por el mayor volumen de estructuras frontales ya descrito.
Este estudio también encontró disminución de las dimensiones estructurales a nivel parietal, temporal y occipital. El lóbulo parietal está implicado en procesos cognitivos como la atención, la memoria, el lenguaje y la praxis; en este estudio, las 3 primeras no difirieron significativamente entre los grupos y la última no se incluyó en el protocolo; otra función parietal inferior es la integración sensoriomotora y neuronas en espejo, involucradas en procesos afectivos, pero este estudio no evaluó estas áreas cognitivas. La afección parietal no es la primera vez que se evidencia en la literatura; un estudio previo mostró mayor deterioro en la región inferoparietal de bipolares frente a controles sanos, pero no se vio este efecto al ajustar por tratamiento y no se tuvieron en cuenta variables neuropsicológicas20. También otros estudios han encontrado afección temporal y occipital sin tener en cuenta una correlación neuropsicológica que pudiera ser plausible porque el deterioro temporal se ha relacionado con la memoria y el occipital, con procesos de percepción y retención visual60. A pesar de las diferencias estructurales en estos grupos, no se vio relación con cambios en el perfil cognitivo.
La correlación entre las variables neuropsicológicas y volumétricas es un aporte valioso, ya que la mayoría de los estudios encontrados evalúan la función cognitiva y la neuroanatomía estructural en el TAB por separado. Desde lo cognitivo, se han reportado alteraciones de la función ejecutiva, la memoria verbal y la atención5,11,51–53; algunos estudios han mostrado menor desempeño cognitivo con la toma de anticonvulsivos como el ácido valproico y de antipsicóticos11. Por otro lado, Hibar et al.20 evaluaron la estructura cerebral, y encontraron alteraciones en regiones corticales de predominio frontal y temporal, especialmente disminución del espesor, con mayor afección estructural en los pacientes con TAB que tomaban anticonvulsivos y antipsicóticos atípicos que los que tomaban litio, en quienes hubo mayor tamaño del giro precentral, similar a lo descrito en nuestro estudio; en ese estudio no se correlacionó con el desempeño cognitivo. Por otro lado, Moore et al.61 encontraron que los efectos del litio en la neuroanatomía estructural de los bipolares pueden verse a las 4 semanas de tratamiento, y describen incremento en el volumen de la sustancia gris prefrontal. Otro estudio realizado en población antioqueña comparó a pacientes con TAB I tratados con litio y sin tratamiento, y encontró aumento del volumen del hipocampo, el tálamo y la amígdala al ajustar por litemia, que se correlacionó positivamente con el aumento de la amígdala22, aunque no se incluyeron pruebas neuropsicológicas. Los estudios de correlación entre el perfil cognitivo y la neuroanatomía estructural parecen publicarse con menos frecuencia. Abé et al.62 evaluaron la relación entre la función ejecutiva y la estructura cerebral, y encontraron una relación positiva entre el espesor cortical y la función ejecutiva, pero sin diferencias al ajustar por tratamiento farmacológico, lo que dista de los hallazgos de nuestro estudio. También se ha encontrado mejor función ejecutiva, con mayor volumen de la sustancia gris de las cortezas prefrontal, dorsal y lateral23, además de correlación con menor control inhibitorio y menor volumen de las regiones parietales como el cúneo y el lóbulo parietal inferior derecho24.
Una interpretación razonable para nuestros hallazgos es que el litio como tratamiento farmacológico de los pacientes con TAB I podría tener un efecto neuroprotector, que tiene una base teórica por diferentes mecanismos. Se ha propuesto que inhibe la glucógeno sintasa cinasa 3β (GSK-3β), un factor involucrado en el control de la expresión genética, la conducta celular, la adhesión celular, la polaridad neuronal y la plasticidad neuronal. Esta inhibición se asocia con menor deterioro clínico de los pacientes con TAB. Además, la disminución en la acción de la GSK-3β se ha asociado con un incremento en el volumen de la sustancia gris en el lóbulo frontal derecho, específicamente la corteza orbitofrontal. También se le ha atribuido que altera la señalización celular e interactúa con la acción de la Wnt/β-catenina, el factor neurotrófico derivado del cerebro (BDNF), el Nrf2 y NFkB, así como efectos neurogénicos, citoprotectores, antioxidantes y antiinflamatorios61. Por el contrario, otros tratamientos para el TAB pueden llegar a inducir citotoxicidad. El ácido valproico produce mayor daño mitocondrial y tiene efectos proapoptóticos en las neuronas63,64, similar a los antipsicóticos65,66. Sin embargo, la evidencia proveniente de estudios en humanos no es sólida.
Este estudio arroja nueva evidencia a favor del papel del litio en la cognición y la neuroanatomía estructural. Estudiar los factores relacionados con la causalidad del deterioro en el TAB y su relación con el tratamiento farmacológico permitirá tener una evidencia adicional a la hora de prescribir medicamentos. Esto debe acompañarse de estudios que aborden el impacto que puede trascender a la funcionalidad. Se ha reportado, por ejemplo, que en pacientes con TAB el deterioro de la función ejecutiva se relaciona con la ocupación, la calidad de vida y el riesgo suicida, que son desenlaces clínicos relevantes en esta población67–69.
Nuestro estudio tiene la fortaleza de basarse en datos homogéneos, con una base obtenida por evaluación de expertos, con criterios de elegibilidad dirigidos a disminuir la confusión. Sin embargo, es necesario tener en cuenta que se trata de un estudio de corte transversal, por lo que no es posible establecer diferencias entre momentos de medición, de modo que no puede establecerse una causalidad y se debe interpretar solo como descriptivo. Por otro lado, se realizó con una muestra pequeña, en parte por el control de la confusión desde la selección de los pacientes; aun así, los grupos estuvieron sometidos a diferentes grupos farmacológicos, además del litio, y diferentes tiempos de duración y dosis. Una opción para investigaciones futuras sería la comparación con controles sanos. Además, es necesario tener en cuenta como limitación que, por las comorbilidades, los sujetos recibían tratamientos farmacológicos no psiquiátricos que también podrían afectar a la neurobiología y no se tuvo en cuenta. Asimismo, los datos sobre el tratamiento psiquiátrico provienen del reporte de los pacientes, y la toma de litio o anticonvulsivos no se comprobó por mediciones séricas.
Futuros estudios en esta línea de investigación deberían incluir una muestra mayor y un seguimiento en el tiempo para poder establecer la evolución de los cambios y su relación con el tratamiento farmacológico. Otra variable que tener en cuenta es la RM funcional que evalúe la conectividad, ya que permite explorar alteraciones funcionales aun en ausencia de alteraciones estructurales.
ConclusionesNuestro estudio encontró menos errores perseverativos y mayor tamaño en las regiones corticales frontales como el cíngulo anterior izquierdo, la corteza orbitofrontal medial derecha, los giros frontales superiores derecho e izquierdo y precentrales derecho e izquierdo, y las regiones subcorticales como la amígdala, el hipocampo, el putamen y el tálamo derecho de los pacientes con TAB tratados con litio. Se estableció una correlación moderada a alta entre el desempeño en esta función ejecutiva y el espesor del giro precentral izquierdo, y el volumen del tálamo y de la amígdala derecha en los pacientes con TAB tratados con litio, que no se encontró en los que no lo tomaban.
También se encontró mayor superficie y espesor en algunas estructuras parietales y temporales, pero sin diferencias significativas entre grupos en el desempeño en pruebas cognitivas relacionadas con estas áreas.
A pesar de que los factores neurobiológicos implicados en la cognición a la luz de la literatura pueden ser múltiples, estos hallazgos son compatibles con un papel neuroprotector del litio, pues parece que mejora o al menos no empeora la cognición y las dimensiones neuroanatómicas de las estructuras corticales y subcorticales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a las todas las personas que hicieron posible esta investigación. A los pacientes y sus familias, a los profesionales relacionados con el GIPSI que ayudaron con la recolección de los datos analizados y a Johana Valencia Echeverry, neuropsicóloga, por su apoyo y sus recomendaciones.