Aunque la ausencia de deterioro de la memoria se consideró entre los criterios diagnósticos para diferenciar la enfermedad de Alzheimer (EA) de la demencia frontotemporal variante conductual (DFTvC), la evidencia actual, en aumento, señala un importante porcentaje de casos de DFTvC con déficits de la memoria episódica. El presente estudio se diseñó con el fin de comparar el perfil de desempeño de la capacidad denominativa y de la memoria episódica de los pacientes con EA y DFTvC.
MétodosEstudio transversal y analítico con grupo de control (n=32). Se incluyó a 42 sujetos con probable EA y 22 con probable DFTvC, todos mayores de 60 años. Se utilizaron instrumentos del Uniform Data Set validados en español: Multilingual Naming Test (MINT), historia de Craft-21 y figura compleja de Benson, entre otros.
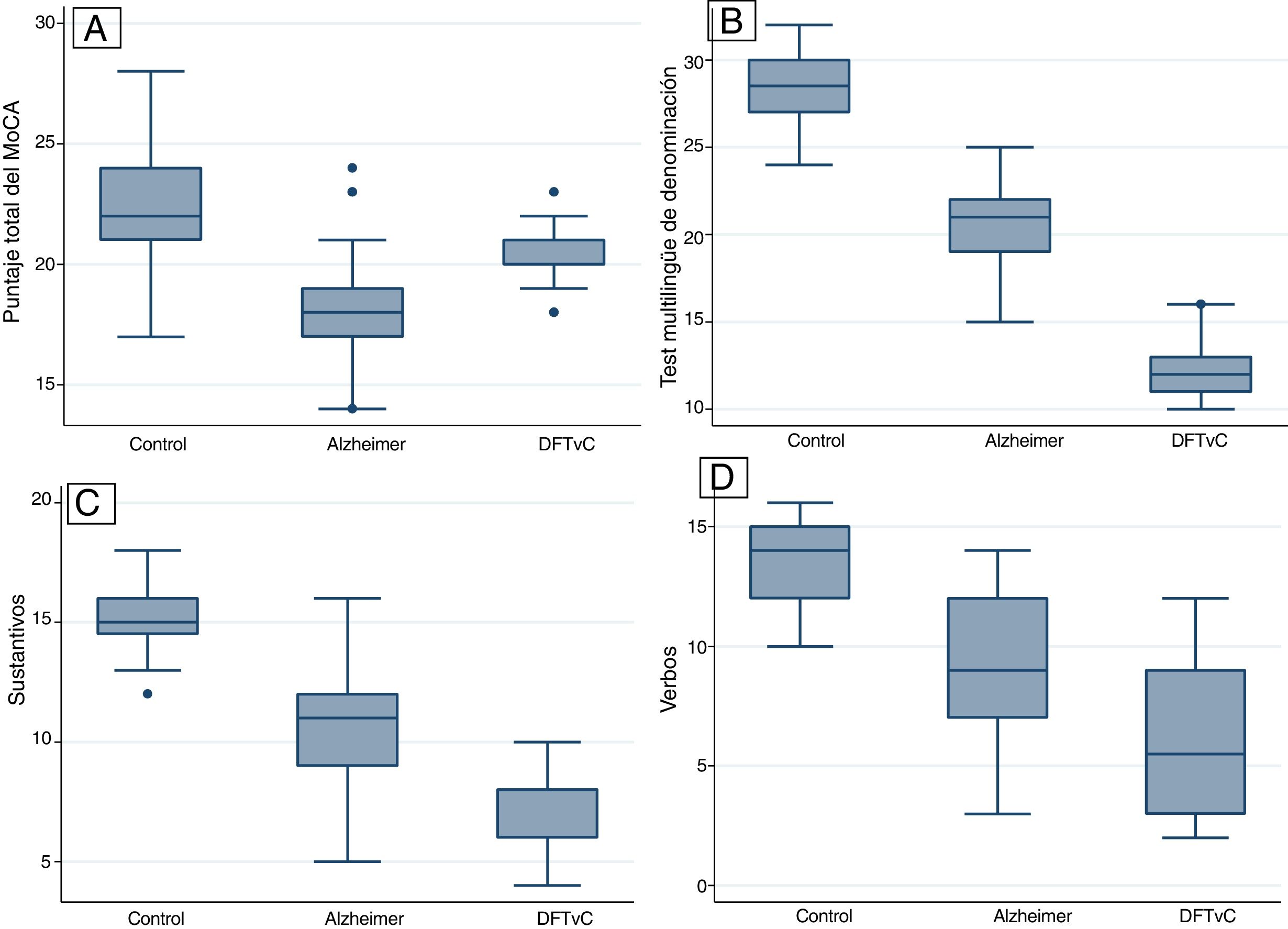
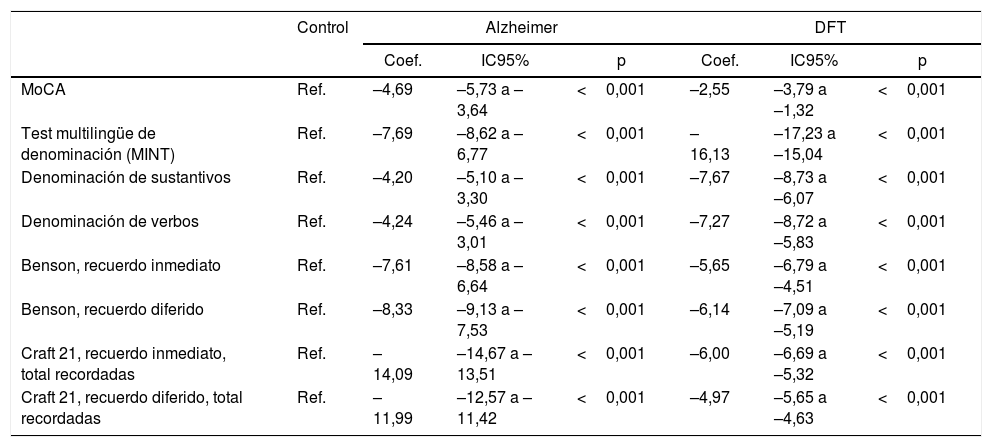
ResultadosSe observó un mayor promedio de edad entre los pacientes con EA. La capacidad denominativa fue mucho menor en los pacientes con DFTvC que en aquellos con EA, medida según el MINT y el coeficiente de denominación sustantivos/verbos. Todos los pacientes con DFTvC, el 73,81% de aquellos con EA y solo el 31,25% de los controles no lograron reconocer la figura compleja de Benson. Todas las diferencias fueron estadísticamente significativas (p<0,001).
ResultadosEste estudio confirma el perfil amnésico de los pacientes con EA y revela la disminución de la capacidad denominativa de los pacientes con DFTvC, un área del lenguaje que se afecta típica y tempranamente con las funciones ejecutivas, según recientes hallazgos.
ConclusionesLos pacientes con EA rinden peor en las tareas de memoria episódica verbal y visual, mientras que los pacientes con DFTvC rinden peor en tareas de denominación. Estos hallazgos abren la posibilidad de explorar los mecanismos de participación prefrontal en la memoria episódica, típicamente atribuida al hipocampo.
Although the absence of memory impairment was considered among the diagnostic criteria to differentiate Alzheimer's disease (AD) from Behavioural Variant of Frontotemporal Dementia (bvFTD), current and growing evidence indicates that a significant percentage of cases of bvFTD present with episodic memory deficits. In order to compare the performance profile of the naming capacity and episodic memory in patients with AD and bvFTD the present study was designed.
MethodsCross-sectional and analytical study with control group (32 people). The study included 42 people with probable AD and 22 with probable bvFTD, all over 60 years old. Uniform Data Set instruments validated in Spanish were used: Multilingual Naming Test (MINT), Craft-21 history and Benson's complex figure, among others. Results: A higher average age was observed among the patients with AD. The naming capacity was much lower in patients with bvFTD compared to patients with AD, measured according to the MINT and the nouns/verbs naming coefficient. All patients with bvFTD, 73.81% of those with AD and only 31.25% of the control group failed to recognise Benson's complex figure. All differences were statistically significant (p <0.001).
ResultsThis study confirms the amnesic profile of patients with AD and reveals the decrease in naming capacity in patients with bvFTD, an area of language that is typically affected early on with executive functions, according to recent findings.
ConclusionsPatients with AD perform worse in verbal and visual episodic memory tasks, while patients with bvFTD perform worse in naming tasks. These findings open the possibility of exploring the mechanisms of prefrontal participation in episodic memory, typically attributed to the hippocampus.
El término demencia se define como un síndrome clínico adquirido, causado por una disfunción cerebral reversible o irreversible. Se caracteriza principalmente por un deterioro grave de las funciones cognitivas, frecuentemente asociado con trastornos psicopatológicos y de la conducta y, en ocasiones, trastornos del movimiento que finalmente afectan a la independencia funcional1. En cuanto al subtipo de demencia, estudios en comunidad urbana de Latinoamérica, del tipo puerta a puerta con individuos de 65 o más años, encontraron que la enfermedad de Alzheimer (EA) era la más frecuente (56,2%), seguida por la EA con enfermedad cerebrovascular (ECV) (15,5%) y la demencia vascular (DV) (8,7%)2. De otras causas degenerativas de demencia, como la demencia frontotemporal (DFT), son escasos los reportes en nuestra región. En estudios de comunidad en Latinoamérica de individuos de 55 o más años, la prevalencia de DFT alcanza los 12-18 casos/1.000 habitantes, y es más alta en la población brasileña (un 2,6-2,8%) que en la peruana (1,9%) y la venezolana (1,53%)3. Respecto a las características clínicas de la EA, los pacientes inician sus síntomas con errores de la memoria episódica de hechos recientes, seguidos por afección de funciones del lenguaje y visuoespaciales, así como dificultades en la praxia, lo que indica la diseminación del daño cortical desde las regiones perihipocampales hacia áreas asociativas posteriores. Por otro lado, la DFT es un síndrome caracterizado por deterioro progresivo de la conducta o el lenguaje, junto con una marcada atrofia de los lóbulos frontal y temporal1. La DFT incluye 3 fenotipos clínicos distintos: variante conductual, variante semántica de la afasia primaria progresiva (APP) y la variante no fluente/agramática de la APP; el subtipo más frecuente es la variante conductual de la DFT (DFTvC)4. Los pacientes con DFTvC tienen cambios progresivos en la personalidad y la conducta social. Según los criterios de consenso5, el diagnóstico de posible DFTvC requiere 3 de las siguientes 6 características: desinhibición, apatía/inercia, pérdida de empatía, perseverancia/conductas compulsivas, hiperoralidad y perfil neuropsicológico de disfunción ejecutiva con relativa conservación de la memoria episódica y las habilidades visuoespaciales. El diagnóstico de DFTvC probable requiere además deterioro de la funcionalidad y signos prominentes de afección frontotemporal focal en las neuroimágenes estructurales y funcionales (particularmente en la corteza orbitofrontal y prefrontal dorsolateral), mientras que el diagnóstico de DFTvC definida se reserva para pacientes con una mutación genética patogénica conocida o con evidencia histopatológica de degeneración lobular frontotemporal. A pesar de las discrepancias sobre los patrones neuropsicológicos, cada vez hay más evidencia sobre el típico patrón disejecutivo del paciente en estadios iniciales de DFTvC4–6 y del patrón amnésico de la mayoría de los pacientes con EA7. En ese sentido, el Centro Coordinador Nacional de Alzheimer (NACC) de Estados Unidos creó en 2005 el Uniform Data Set (UDS) para recolectar datos clínicos uniformes de diversas demencias degenerativas, y en abril de 2008 se creó el UDS Neuropsychology Work Group, que recomienda reemplazar el Mini Mental State Examination (MMSE) por el Montreal Cognitive Assessment (MoCA), el Logical Memory IA-recuerdo inmediato y IIA-recuerdo retrasado de la Weschler Memory Scale-revisado (WMS-R) por la historia de Craft 21, recuerdo inmediato y diferido, el Span de dígitos del WMS-R por el Span de números, y el Boston Naming Test por el MINT8, cuya versión 3.0 en español se implementó en marzo de 2015.
Este estudio tiene como objetivo realizar una evaluación comparativa del rendimiento de la capacidad denominativa (MINT y denominación de sustantivos y verbos) y de memoria episódica (historia de Craft 21 y copia de la figura compleja de Benson) en pacientes con EA y DFTvC con la versión en español de la batería neuropsicológica del UDS.
MétodosDiseño del estudioSe realizó un estudio transversal analítico en pacientes mayores de 60 años que acudieron regularmente a la unidad de diagnóstico de deterioro cognitivo y prevención de demencia del Instituto Peruano de Neurociencias (IPN), entre marzo de 2017 y marzo de 2019.
Población de estudioSe estudiaron 3 grupos: 32 sujetos de control, 42 con diagnóstico de probable EA y 22 con diagnóstico de probable DFTvC en estadios leve-moderado, según los resultados del Clinical Dementia Rating (CDR)9. Se calculó el tamaño muestral para una proporción esperada del 50% con EA10 y un 2% con DFTvC3, según antecedentes, y se realizó una selección por conveniencia hasta completar la muestra.
Los criterios de inclusión fueron: pacientes con edad> 60 años que cumplían los criterios diagnósticos de demencia según el DSM-511. El diagnóstico de EA probable se realizó según los criterios de la National Institute on Aging-Alzheimer's Association7 y el diagnóstico de DFTvc, según los del consorcio internacional5. El grupo de control lo conformaron familiares de los pacientes o voluntarios sanos. Los criterios de exclusión fueron: sujetos con dificultad para realizar las pruebas cognitivas debido a problemas auditivos o visuales u otros problemas físicos que pudieran interferir con su desempeño, lengua diferente del español, bajo nivel de instrucción (definido como menos de 4 años de educación), puntuación> 4 en los criterios del índice modificado de Hachinski, diagnóstico de depresión, ECV concomitante, antecedentes de adicción o abuso de sustancias o deterioro cognitivo explicado por otra causa, como hipotiroidismo, deficiencia de vitamina B12, hepatopatía, nefropatía crónica, neuroinfecciones (infección por VIH o sífilis), traumatismo craneoencefálico grave y hematoma subdural, entre otras.
Evaluación clínica y neuropsicológicaLos sujetos se sometieron a las siguientes evaluaciones sucesivas (cribado, diagnóstico de demencia y tipo de demencia) en cada fase. Durante la fase de cribado, los pacientes pasaron una evaluación clínica integral y pruebas cognitivas breves, que incluyeron: MMSE12, prueba del dibujo de reloj-versión de Manos (PDR-M)13 y Pfeffer Functional Activities Questionnaire (PFAQ)14. Los individuos con respuestas por debajo de las puntuaciones establecidas para este protocolo de investigación pasaron a una segunda evaluación, en la cual se aplicaron nuevas MMSE y PDR-M por un evaluador distinto del que realizó la fase de cribado.
El punto de corte en el MMSE para sospecha de demencia se ajustó por los años de escolarización: 27 para aquellos con más de 7 años, 23 para aquellos con 4-7 años, 22 para aquellos con 1-3 años y 18 para los iletrados10.
La PDR-M evalúa la capacidad del individuo para poner en un círculo dibujado los números del 1 al 12 tal como van en un reloj y luego evalúa la dirección y la proporcionalidad de las manecillas del reloj al intentar plasmar la hora 11.10. El máximo es de 10 puntos, y en los peruanos la puntuación <7 indica deterioro cognitivo14.
El PFAQ incluye 11 preguntas acerca de las actividades de la vida diaria, con puntuaciones de 0-3 según la gravedad de la discapacidad en cada actividad. Más de de 6 puntos indica deterioro funcional, y el máximo es 33 puntos.
De los individuos de los que se confirmó «deterioro cognitivo» en las segundas pruebas, se tomaron muestras para hemograma (hemoglobina, glucosa, urea, creatinina, pruebas de función hepática —TGO y TGP—, concentraciones séricas de albumina y globulina, vitamina B12 y ácido fólico, descarte de sífilis, VDRL, descarte de infección por el VIH —ELISA—, perfil tiroideo —T3, T4 y TSH, electrolitos séricos de sodio, potasio y cloro), tomografía computarizada o resonancia magnética cerebral, y evaluación de síntomas depresivos (inventario de depresión de Beck [BDI] II), para descartar seudodemencia; un evaluador certificado y ciego a las pruebas cognitivas breves aplicó el CDR9 para clasificar el estadio de la demencia. En la última fase con los resultados de los exámenes de sangre, imágenes cerebrales y el informe neuropsicológico, se realizó el diagnóstico por tipo de demencia mediante consenso entre neurólogos y neuropsicólogos del equipo. La batería neuropsicológica del UDS consistió en las siguientes pruebas: MoCA, historia de Craft 21-recuerdo inmediato, copia de la figura compleja de Benson (recuerdo inmediato), prueba de retención de dígitos en orden, prueba de retención de dígitos en orden inverso, fluidez de categorías, prueba de rastreo A y B, historia de Craft 21-recuerdo diferido, copia de la figura compleja de Benson (recuerdo diferido), MINT y prueba de fluidez verbal. La historia de Craft 21 consiste en la lectura de una historia, tras lo cual el individuo evaluado debe recordar (recuerdo inmediato) la mayor cantidad de palabras de la historia: «El niño de María, Ricardo, jugaba fútbol cada lunes a las 3.30. A él le gustaba ir al campo detrás de su casa y unirse al juego. Un día él pateó la pelota tan fuerte que esta se fue por encima de la cerca del vecino, donde vivían tres perros grandes. El dueño de los perros oyó fuertes ladridos, salió en ese momento y les ayudó a recuperar la pelota». Se instruye al evaluado para que trate de no olvidarla, pues a los 20 min aproximadamente se le pedirá que cuente la historia de nuevo (recuerdo diferido). Para la copia de la figura compleja de Benson, se entrega al individuo la figura impresa en una hoja de papel y se solicita que copie el diseño (recuerdo inmediato). Después de terminado el dibujo, se le solicita que recuerde este diseño por que más adelante (aproximadamente 10-15 min) se le pedirá que lo dibuje otra vez de memoria (recuerdo diferido); además, se muestra al paciente 4 figuras, entre las que se encuentra la figura que copió y recordó, y se le pide que reconozca el estímulo original de las 4 opciones (reconocimiento de la figura compleja de Benson). Para la prueba de retención de dígitos en orden, se pide al individuo que repita una serie de números, cada vez de mayor longitud, en el mismo orden, mientras que para la prueba de retención de dígitos en orden inverso, se pide al individuo que repita una serie de números cada vez de mayor longitud en orden inverso o al revés de lo que dicta el evaluador. En la prueba de fluidez de categorías, se pide al individuo que diga todos los animales que pueda en 1 min, después del cual se solicita que diga todos los vegetales o verduras que pueda en 1 min. Para la prueba de rastreo-parte A, se muestra una hoja impresa con diversos números dentro de unos círculos distribuidos en orden aleatorio y se pide al individuo que haga una línea de un círculo a otro en orden ascendente, empezando por el número 1 y terminando en el 25, mientras que para la prueba de rastreo-parte B, se muestra una hoja impresa con diversos números y letras dentro de unos círculos distribuidos en orden aleatorio y se pide al individuo que haga una línea de un círculo a otro, alternando el orden entre números y letras, empezando por el número 1 y terminando en el 13. En el MINT se muestra al individuo unos dibujos de objetos (32 ítems), 1 cada vez, y se le pide que diga el nombre de cada objeto. Finalmente, para la prueba de fluidez verbal, se pide al paciente que durante 1 min diga todas las palabras que pueda que comiencen con la letra P, después de lo cual se pide lo mismo pero con la letra M.
Variables de estudioPara el MINT se empleó la puntuación total de objetos denominados de manera correcta sobre un máximo de 32 puntos, que se obtuvo después de sumar el número total de objetos denominados sin clave con el número total de objetos denominados con clave semántica.
Para la denominación de sustantivos y verbos, se empleó la puntuación total de sustantivos y verbos enunciados de manera correcta, y además se reportó la proporción entre sustantivos y verbos.
Para el recuerdo inmediato y diferido de la copia de la figura compleja de Benson, se consignó la puntuación total obtenida tras evaluar cada elemento figurativo, sobre un máximo de 17 puntos. Además, el reconocimiento de la figura compleja de Benson se reportó de manera dicotómica.
Para la historia de Craft 21, tanto para el recuerdo inmediato como para el diferido, se registró el total de unidades recordadas (puntuación textual) y el total de unidades recordadas con parafraseo (puntuación de parafraseo).
Análisis de datosSe calcularon las frecuencias absolutas y relativas de las variables categóricas y las medidas de tendencia central y su desviación estándar para las variables numéricas. Se determinó la distribución normal de las variables numéricas mediante prueba gráfica o estadística. Se realizaron pruebas de contraste entre las categorías determinadas por los resultados de los pacientes de los grupos de control, de EA (temprano y tardío) y de DFTvC para las variables categóricas utilizando la prueba de la χ2 (reconocimiento de la figura de Benson) y para las variables numéricas (edad, puntuación MoCA, puntuación en las pruebas de denominación, recuerdo inmediato y recuerdo diferido de la historia de Craft 21 y copia de la figura compleja de Benson) mediante ANOVA. Se consideró un valor p <0,05 como estadísticamente significativo y se calcularon los intervalos de confianza al 95% (IC95%). Se utilizó el programa STATA v 14 (StataCorp LP, Estados Unidos).
Aspectos éticosSe respetó la privacidad y el anonimato de cada uno de los participantes, que proporcionaron su consentimiento médico informado. Se obtuvo la aprobación del comité institucional de ética en investigación del Hospital Nacional Docente Madre Niño San Bartolomé.
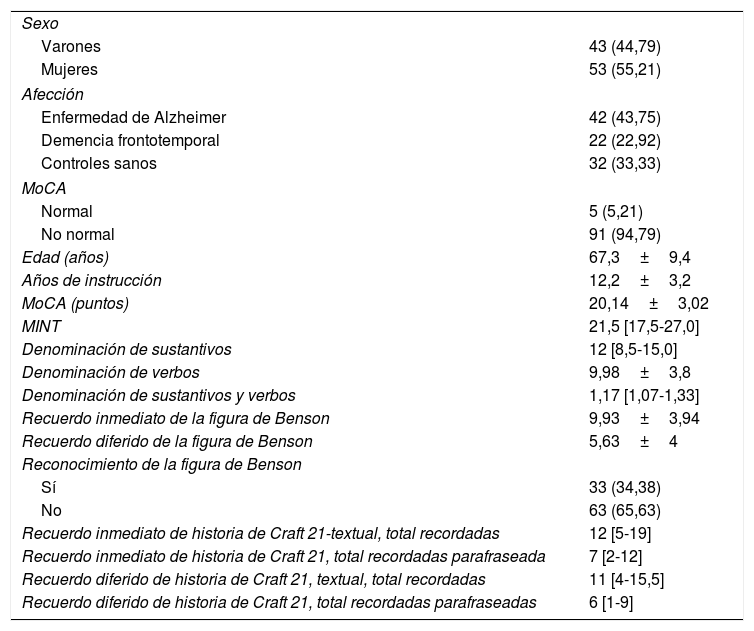
ResultadosSe evaluó a 96 participantes: 42 con EA, 22 con DFTvC y 32 controles sanos. La mayoría eran mujeres, con una media de edad de 67,3 años. La tabla 1 muestra además los resultados promedios de la aplicación de diferentes pruebas cognitivas, como el MoCA, el MINT, la denominación de verbos y sustantivos, reconocimiento inmediato y diferido de la copia de la figura compleja de Benson y la historia de Craft 21. La puntuación obtenida en el MoCA, según recomendaciones de los autores, no refleja el estado cognitivo de los controles.
Características generales de la población estudiada
| Sexo | |
| Varones | 43 (44,79) |
| Mujeres | 53 (55,21) |
| Afección | |
| Enfermedad de Alzheimer | 42 (43,75) |
| Demencia frontotemporal | 22 (22,92) |
| Controles sanos | 32 (33,33) |
| MoCA | |
| Normal | 5 (5,21) |
| No normal | 91 (94,79) |
| Edad (años) | 67,3±9,4 |
| Años de instrucción | 12,2±3,2 |
| MoCA (puntos) | 20,14±3,02 |
| MINT | 21,5 [17,5-27,0] |
| Denominación de sustantivos | 12 [8,5-15,0] |
| Denominación de verbos | 9,98±3,8 |
| Denominación de sustantivos y verbos | 1,17 [1,07-1,33] |
| Recuerdo inmediato de la figura de Benson | 9,93±3,94 |
| Recuerdo diferido de la figura de Benson | 5,63±4 |
| Reconocimiento de la figura de Benson | |
| Sí | 33 (34,38) |
| No | 63 (65,63) |
| Recuerdo inmediato de historia de Craft 21-textual, total recordadas | 12 [5-19] |
| Recuerdo inmediato de historia de Craft 21, total recordadas parafraseada | 7 [2-12] |
| Recuerdo diferido de historia de Craft 21, textual, total recordadas | 11 [4-15,5] |
| Recuerdo diferido de historia de Craft 21, total recordadas parafraseadas | 6 [1-9] |
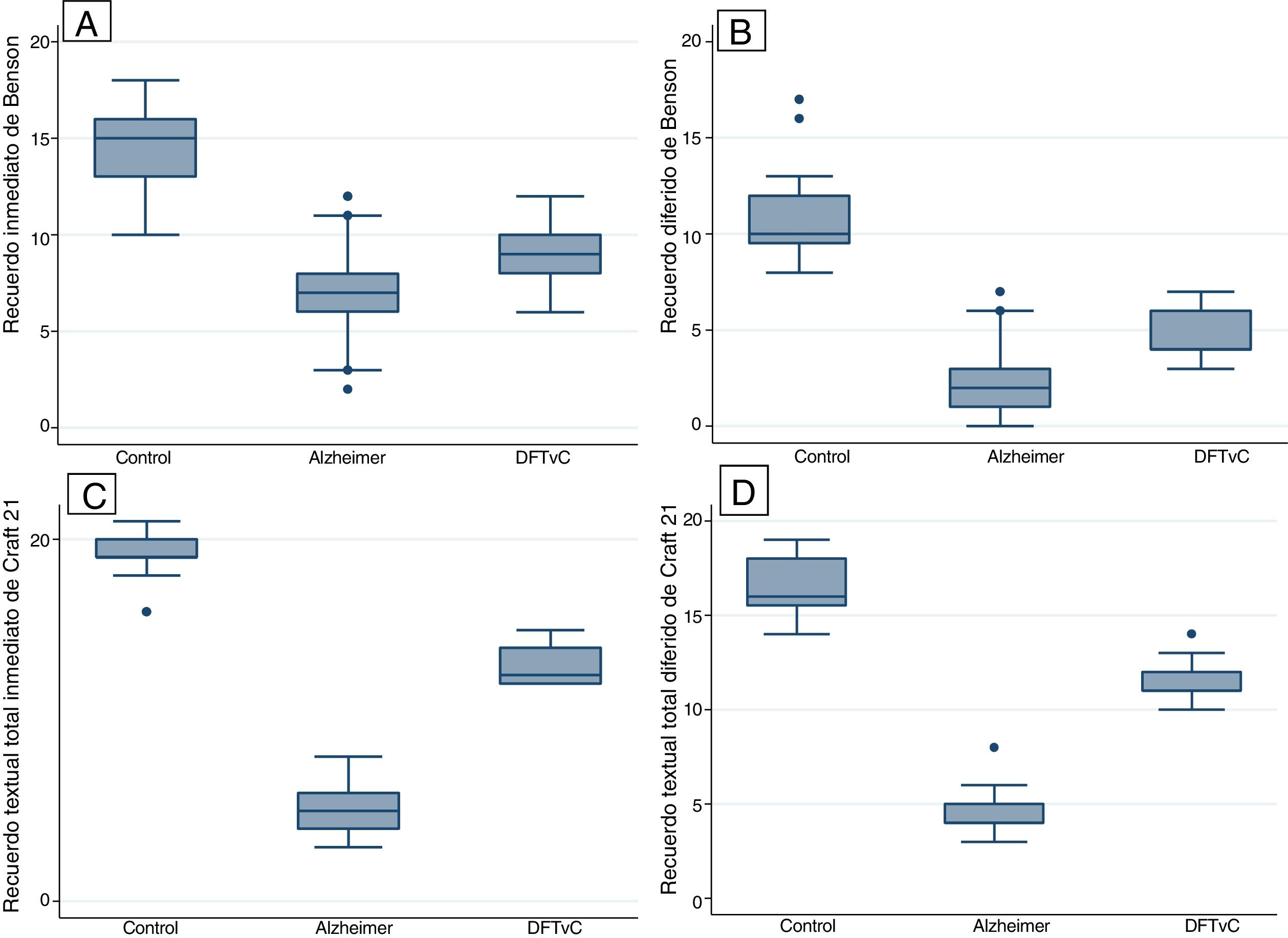
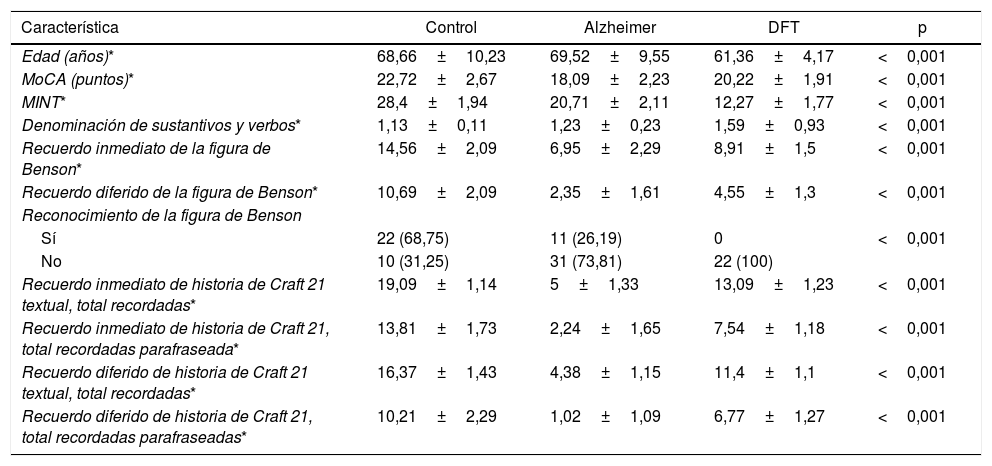
Se encontraron diferencias estadísticas entre los 3 grupos de estudio (controles sanos, EA y DFTvC) en las variables edad y puntuación de los diferentes tests: MoCA, MINT, denominación de verbos y sustantivos, reconocimiento inmediato y diferido de la copia de la figura compleja de Benson y la historia de Craft 21 (tabla 2).
Diferencias entre las puntuaciones de capacidad denominativa y memoria episódica de los pacientes con EA y DFTvc
| Característica | Control | Alzheimer | DFT | p |
|---|---|---|---|---|
| Edad (años)* | 68,66±10,23 | 69,52±9,55 | 61,36±4,17 | <0,001 |
| MoCA (puntos)* | 22,72±2,67 | 18,09±2,23 | 20,22±1,91 | <0,001 |
| MINT* | 28,4±1,94 | 20,71±2,11 | 12,27±1,77 | <0,001 |
| Denominación de sustantivos y verbos* | 1,13±0,11 | 1,23±0,23 | 1,59±0,93 | <0,001 |
| Recuerdo inmediato de la figura de Benson* | 14,56±2,09 | 6,95±2,29 | 8,91±1,5 | <0,001 |
| Recuerdo diferido de la figura de Benson* | 10,69±2,09 | 2,35±1,61 | 4,55±1,3 | <0,001 |
| Reconocimiento de la figura de Benson | ||||
| Sí | 22 (68,75) | 11 (26,19) | 0 | <0,001 |
| No | 10 (31,25) | 31 (73,81) | 22 (100) | |
| Recuerdo inmediato de historia de Craft 21 textual, total recordadas* | 19,09±1,14 | 5±1,33 | 13,09±1,23 | <0,001 |
| Recuerdo inmediato de historia de Craft 21, total recordadas parafraseada* | 13,81±1,73 | 2,24±1,65 | 7,54±1,18 | <0,001 |
| Recuerdo diferido de historia de Craft 21 textual, total recordadas* | 16,37±1,43 | 4,38±1,15 | 11,4±1,1 | <0,001 |
| Recuerdo diferido de historia de Craft 21, total recordadas parafraseadas* | 10,21±2,29 | 1,02±1,09 | 6,77±1,27 | <0,001 |
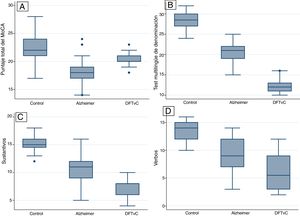
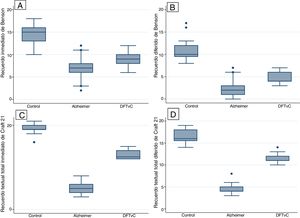
Se observó una media de edad mayor entre los pacientes con EA en comparación con los grupos de DFTvC y de control. El rendimiento de los pacientes en el MoCA fue más bajo en la EA que entre los controles y aquellos con DFTvC. La capacidad denominativa fue mucho menor en los pacientes con DFTvC que en aquellos con EA, medida según el MINT y el coeficiente de denominación sustantivos/verbos (fig. 1, tabla 2 y tabla 3). Por otro lado, los pacientes con EA tuvieron menor rendimiento según la puntuación de memoria episódica visual medida según el recuerdo inmediato y diferido de la figura compleja de Benson y la verbal medida según el recuerdo inmediato y diferido, tanto de la puntuación textual como del parafraseo de la historia de Craft 21 (fig. 2, tabla 2 y tabla 3).
Coeficientes según las puntuaciones y el diagnóstico de EA o DFTvc
| Control | Alzheimer | DFT | |||||
|---|---|---|---|---|---|---|---|
| Coef. | IC95% | p | Coef. | IC95% | p | ||
| MoCA | Ref. | –4,69 | –5,73 a –3,64 | <0,001 | –2,55 | –3,79 a –1,32 | <0,001 |
| Test multilingüe de denominación (MINT) | Ref. | –7,69 | –8,62 a –6,77 | <0,001 | –16,13 | –17,23 a –15,04 | <0,001 |
| Denominación de sustantivos | Ref. | –4,20 | –5,10 a –3,30 | <0,001 | –7,67 | –8,73 a –6,07 | <0,001 |
| Denominación de verbos | Ref. | –4,24 | –5,46 a –3,01 | <0,001 | –7,27 | –8,72 a –5,83 | <0,001 |
| Benson, recuerdo inmediato | Ref. | –7,61 | –8,58 a –6,64 | <0,001 | –5,65 | –6,79 a –4,51 | <0,001 |
| Benson, recuerdo diferido | Ref. | –8,33 | –9,13 a –7,53 | <0,001 | –6,14 | –7,09 a –5,19 | <0,001 |
| Craft 21, recuerdo inmediato, total recordadas | Ref. | –14,09 | –14,67 a –13,51 | <0,001 | –6,00 | –6,69 a –5,32 | <0,001 |
| Craft 21, recuerdo diferido, total recordadas | Ref. | –11,99 | –12,57 a –11,42 | <0,001 | –4,97 | –5,65 a –4,63 | <0,001 |
Coef.: coeficiente; IC95%: intervalo de confianza del 95%; Ref.: referencia.
Todas las diferencias fueron estadísticamente significativas (p <0,001). Todos los pacientes con DFTvC y el 73,81% de los sujetos con EA no lograron reconocer la figura compleja de Benson, así como el 31,25% de los controles.
DiscusiónLa muestra estudiada tiene una instrucción mediana (12,2±3,2 años), lo cual concuerda con estudios realizados en Lima sobre demencia14,15 y DFT16–18, donde las poblaciones estudiadas tienen una media de 11 años de escolarización. Además la muestra de pacientes con EA es de más edad que los pacientes con DFTvC, lo cual coincide con estudios previos realizados en Latinoamérica3,19,20 y en Perú16–18, pues la DFTvC suele presentarse a mediana edad, con inicio alrededor de los 58 años4,6.
Este estudio confirma el perfil amnésico de los pacientes con EA1,7 y revela la disminución de la capacidad denominativa en los pacientes con DFTvC, un área del lenguaje que, según recientes hallazgos21, se afecta típica y tempranamente con las funciones ejecutivas. En nuestra serie de pacientes con EA, se observa un grave deterioro de la memoria episódica de tipo verbal (evaluada por recuerdo inmediato y diferido de la historia de Craft 21) y memoria episódica de tipo visual (evaluada por el recuerdo inmediato y diferido y el reconocimiento de la figura compleja de Benson), la cual también está afectada en pacientes con DFTvc, pero con una diferencia muy significativa. La memoria episódica de los pacientes con demencia solía evaluarse mediante el aprendizaje de una lista de palabras y el recuerdo de historias empleando la memoria lógica22,23, pero desde 2008 el UDS del NACC recomienda la historia de Craft 21 y la copia de la figura compleja de Benson8,23. Craft et al.25 habían diseñado múltiples formas de recuerdos de 22 historias similares a las empleadas en la memoria lógica en un estudio del impacto de la insulina en la cognición de pacientes con EA en estadios iniciales, por lo que el UDS Neuropsychology Work Group, tras diversas pruebas piloto, decidió incluir solo la historia 21, conocida hoy como la historia de Craft 21. Las habilidades visuoespaciales se deterioran tardíamente en las formas amnésicas de EA, y pueden afectarse precozmente en otros síndromes clínicos de la EA, como la atrofia cortical posterior y la demencia asociada con cuerpos de Lewy del tipo cortical1, por lo que el UDS del NACC recomendó incluir la figura compleja de Benson como parte de la evaluación de demencias neurodegenerativas24; además, se han demostrado distintos perfiles de rendimiento y una clara asociación con atrofia regional frontal y parietal en pacientes con DFT y EA25,26. Se ha señalado que los pacientes con DFTvc en estadios iniciales típicamente conservan la memoria episódica, pero cada vez hay más evidencia de que cierta proporción de casos de DFTvC, como los casos con confirmación patológica, puede presentarse con marcado déficit de la memoria episódica27,28 y se caracterizan por afección de las clásicas tareas de memoria basadas en recuerdo inmediato y diferido, con relativa conservación de la memoria de reconocimiento29,30. Además, otros estudios han demostrado que los pacientes con DFTvC tienen un deterioro comparable al de la EA30,31. Las razones para estas discrepancias no están claras, pero podrían atribuirse a varios factores, como diversos estadios en la progresión de la enfermedad, el tipo de memoria evaluada y la inclusión en los estudios de DFTvC con progresiva, lo que se conoce como fenocopias28,30,32. Estos hallazgos abren la posibilidad de explorar los mecanismos de participación prefrontal en la memoria episódica, típicamente atribuida al hipocampo28,33.
Si bien es cierto que el paciente con DFTvC típicamente se presenta con desintegración social y cambios de la personalidad4–6, existen sustanciales superposiciones fenotípicas con otras entidades, en particular las afasias primarias progresivas, aun en estadios tempranos de la DFTvC4,34,35. Se han descrito deficiencias en la denominación por confrontación37–39, la comprensión de palabras aisladas40 y frases41 y las habilidades semánticas41,42. Por otro lado, la atrofia frontotemporal frecuentemente se superpone con la alteración de las redes neurales del lenguaje43,44, y la evidencia neuroanatómica disponible ha relacionado las alteraciones de los circuitos frontales, temporales y parietales con la génesis de las deficiencias del lenguaje de este síndrome21,36. De esta manera, el deterioro de las redes corticales que median el procesamiento verbal semántico puede explicar el perfil lingüístico de los pacientes con DFTvC21,35, por lo que es necesaria una correcta evaluación del lenguaje en este síndrome. El UDS Neuropsychology Work Group del NACC escogió el MINT de 32 ítems para reemplazar la versión corta (de 30 ítems) del test de denominación de Boston (BNT). El MINT se desarrolló en origen como test de denominación en 4 idiomas: inglés, español, hebreo y chino mandarín. Un estudio de corte transversal8 demostró buena correlación entre el BNT y el MINT (r=0,76). Luego se publicaron los datos normativos preliminares del UDS para el MINT24, y recientemente el MINT detectó deficiencias en la denominación a diferentes grados de deterioro cognitivo en pacientes con deterioro cognitivo leve y demencia por EA, pero se requiere corregir por edad, sexo, raza y nivel educativo45.
Entre las principales limitaciones, se puede mencionar al tamaño de la muestra, que podría no ser lo suficientemente grande para que obtener estimaciones más precisas. Por otro lado, se reconoce que los participantes fueron muestreados de una unidad especializada de demencia, lo cual podría disminuir la generalización de los resultados. Una segunda limitación prevista está relacionada con el riesgo de clasificaciones erradas en los grupos de estudio (control, DFTvC y EA), puesto que el diseño transversal del estudio no permite un seguimiento longitudinal de cada caso para establecer con precisión los diagnósticos de cada grupo, y además no se pudo realizar estudios patológicos de muestras cerebrales para establecer diagnósticos definitivos. En ese sentido, se identifica una tercera limitación, relacionada con el diagnóstico del tipo de demencia basado en el juicio clínico, además de análisis sanguíneos e imágenes cerebrales, pero no biomarcadores en sangre y líquido cefalorraquídeo; sin embargo, se basó en una evaluación integral y por consenso del equipo multidisciplinario de clínicos experimentados, para el que el diagnóstico clínico estructurado sirvió como estándar de este estudio. Los clínicos basaron su diagnóstico clínico en la información disponible de la visita del primer día de evaluación en la comunidad, es decir la información de la anamnesis y la entrevista estructurada, el examen clínico (neurológico+psiquiátrico), historia médica y luego la información de pruebas cognitivas y funcionales estandarizadas de especialistas en evaluación cognitiva realizada en el centro especializado de memoria del IPN. Una cuarta limitación de este estudio es que los participantes son de un área urbana, hablan y comprenden el español como habla nativa y los bilingües hablan y comprenden desde hace más de 10 años el español como segunda lengua aprendida, por lo que los resultados probablemente reflejen mejor el rendimiento de la batería del UDS en este grupo lingüístico, pero se desconoce su comportamiento en población rural o con habla exclusiva o predominante distinta del español, como quechua o aimara. Sería importante conocer la probable influencia cultural y del bilingüismo.
ConclusionesLos pacientes con EA rinden peor en las tareas de memoria episódica verbal y visual, mientras que aquellos con DFTvC rinden peor en las tareas de denominación. Además, la batería neuropsicológica del UDS en su versión en español puede usarse en pacientes con escolarización mediana.