Existe una relación compleja, dinámica y bidireccional entre la autoinmunidad y el cáncer. Si bien los mecanismos carcinogénicos y fisiopatológicos de las enfermedades autoinmunes no están claramente dilucidados, existe una base inmunológica común relacionada con la expresión de autoantígenos por parte de las células tumorales que desencadenan una respuesta antitumoral, facilitando el desarrollo de síndromes paraneoplásicos reumáticos y enfermedades autoinmunes reumáticas en población genéticamente susceptible. Se presenta un caso de un hombre que debutó con un síndrome pulmón riñón y se diagnosticó cáncer de pulmón y lupus eritematoso sistémico de forma simultánea.
There is a complex, dynamic, and bidirectional connection between autoimmunity and cancer. The underlying mechanisms of carcinogenesis and physiopathological aspects of autoimmune diseases are not fully understood. However, there is a common immunological base related to expression of autoantigens by tumour cells that cause an anti-cancer immune response, thereby, triggering the development of paraneoplastic rheumatic syndromes and autoimmune rheumatic diseases in a genetically predisposed population. The case is reported of a 57 year-old man presenting with pulmonary renal syndrome, and who was diagnosed lung cancer and systemic lupus erythematosus at the same time.
Existe una relación compleja, dinámica y bidireccional entre el cáncer y la autoinmunidad que hasta la fecha no está completamente esclarecida. Por un lado, se ha descrito que la enfermedad maligna puede inducir pérdida de la tolerancia inmunológica, proceso caracterizado por la generación de autoanticuerpos frente a autoantígenos de origen tumoral1. Por otro lado, la enfermedad autoinmune puede predisponer a la aparición de enfermedades oncológicas2 o bien manifestarse como un síndrome paraneoplásico (SPN)2–4. Esto último, estaría en relación con transformación maligna debida a desregulación inmune, lo que explicaría la incidencia incrementada de leucemias y linfomas en pacientes con artritis reumatoide, lupus eritematoso sistémico (LES) y esclerosis sistémica (ES)2. Cuando en el escenario clínico se hace el diagnóstico simultáneo de ambas entidades, es decir, una enfermedad autoinmune y cáncer, se plantea un reto diagnóstico por demás interesante.
Un SPN se define como un grupo de signos y síntomas que aparecen en pacientes con cáncer, con efectos sistémicos, que toman lugar en sitios alejados del tumor5. Comprende un espectro clínico diverso, siendo las manifestaciones de naturaleza endocrinológica las más comúnmente reportadas y en menor frecuencia las de tipo hematológico, neurológico y reumático. Este último grupo está enmarcado bajo la denominación de síndromes paraneoplásicos reumáticos (SPaR)6 y corresponden a las manifestaciones clínicas articulares y cutáneas. A este grupo pertenece el síndrome similar al lupus (lupus-like)7.
A continuación, se presenta el caso de un hombre que debutó con una hemorragia alveolar, asociada a compromiso renal, con el diagnóstico simultáneo de carcinoma escamocelular pulmonar.
Caso clínicoPaciente de 57 años, de sexo masculino, natural de Santander, Colombia, con cuadro clínico de 3 meses de evolución caracterizado por dolor torácico en hemitórax derecho tipo punzada de características pleuríticas, de intensidad 8/10 (por escala numérica verbal para dolor de 0 a 10, correspondiendo 0 a ausencia de dolor y 10 a un dolor intolerable) asociado a disnea progresiva de 1 a 4/4 según la escala del modified Medical Research Council y tos hemoptoica. Como único antecedente personal, el paciente fue fumador durante 10 años (índice de paquetes año –IPA–: 15 paquetes/año y cese del hábito tabáquico 17 años antes al ingreso actual). A la revisión por sistemas refirió pérdida involuntaria de peso de 8kg en el mes anterior al ingreso hospitalario. Consultó inicialmente a un hospital local en donde le fue ordenada una tomografía de alta resolución (TACAR) de tórax que documentó una masa pulmonar en el lóbulo inferior derecho.
Al examen físico de ingreso se encontraba con signos vitales, presión arterial: 124/78mmHg, frecuencia cardíaca: 101 x́, FR 20 x́, saturación de oxígeno por pulso-oximetría (SaO2): 92% fracción inspirada de oxígeno (FiO2): 21% y temperatura (T): 37,0°C. Se observó palidez mucocutánea y a nivel cardiopulmonar, reforzamiento del S2 en foco mitral y disminución de los ruidos en base pulmonar derecha sin agregados.
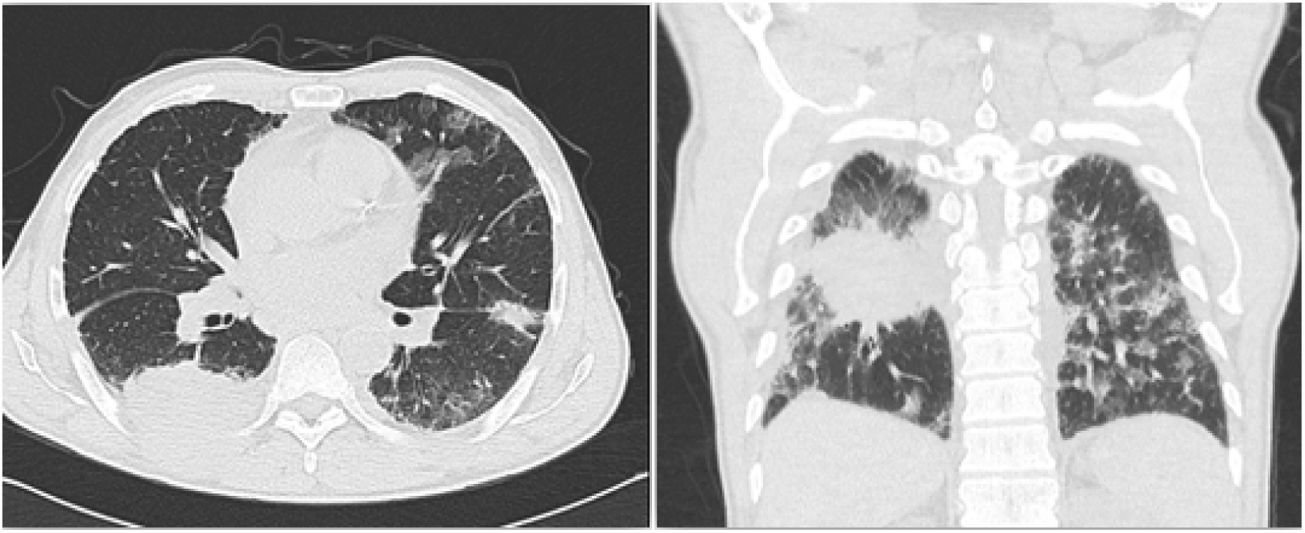
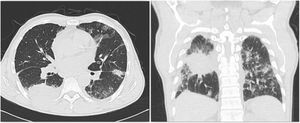
Dado el antecedente de tabaquismo, el hallazgo previo de masa pulmonar y el cuadro actual de dolor pleurítico, hemoptisis y pérdida involuntaria de peso, el abordaje clínico fue orientado hacia la búsqueda de una neoplasia pulmonar. Se contemplaron también los diagnósticos diferenciales de tromboembolismo pulmonar e infección crónica por micobacterias. Se le realizó una segunda tomografía axial computarizada de tórax (fig. 1) que confirmó la presencia de la masa del lóbulo inferior derecho de 63 x 57 x 64mm con extensión extratorácica y de aspecto neoplásico.
Tomografía computarizada de tórax que muestra asa en el lóbulo inferior derecho con extensión extratorácica y de aspecto neoplásico. Engrosamientos pleurales y de las cisuras en el pulmón derecho sin poder descartar compromiso secundario. Cambios fibroatelectásicos apicales bilaterales y masa calcificada apical derecha. Compromiso intersticial pulmonar bilateral.
Los estudios de laboratorio complementarios evidenciaron anemia normocítica normocrómica (Hb 9,45mg/dL, VMC 88 fL), reactantes de fase aguda elevados (velocidad de sedimentación globular –VSG–: 107mm/h y proteína C reactiva –PCR–: 8,49mg/dL), dímero D elevado (11,1mg/L) e hiperazoemia (creatinina: 1,9mg/dl; nitrógeno ureico plasmático –BUN– 40mg/dl). El parcial de orina documentó piuria (75 Leu/ul), proteinuria (500mg/dL) y hematuria (50 eritrocitos/ul) con sedimento urinario activo dado por leucocituria (157 leucocitos/ul), hematuria (141 eritrocitos/ul) y cilindros patológicos. El estudio microbiológico de esputo fue negativo para bacilos ácido-alcohol resistentes y la gammagrafía de ventilación y perfusión (V/Q) fue negativa para tromboembolismo pulmonar. Los estudios de cronicidad para enfermedad renal también fueron negativos (ecografía renal sin cambios atróficos ni pérdida de la relación corticomedular), sugiriendo un compromiso renal agudo.
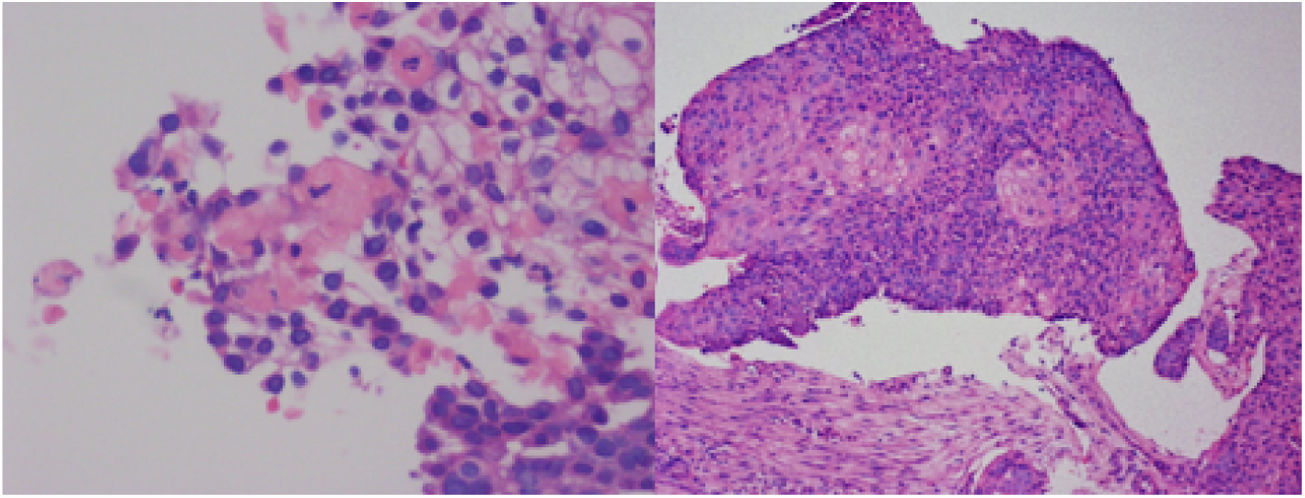
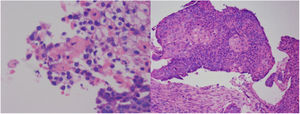
Dado el contexto clínico de un síndrome constitucional con hemoptisis, anemia, lesión renal aguda y sedimento activo, el abordaje diagnóstico se reorientó hacia un síndrome pulmón-riñón (SPR). Se le realizó fibrobroncoscopia y lavado broncoalveolar (fig. 2) obteniéndose líquido progresivamente hemorrágico, hallazgo sugerente de hemorragia alveolar. La descripción citológica evidenció predominancia eritrocitaria con abundantes macrófagos pigmentados, linfocitos y neutrófilos. Las coloraciones de hematoxilina-eosina, Ziehl-Neelsen, ácido peryódico de Schiff y tinción de Grocott y el cultivo fueron negativos. La tinción de hierro confirmó la presencia de hemosiderófagos con un índice de 25%. El perfil inmunológico reportó: anticuerpos anticitoplasma de neutrófilos (ANCA), anticuerpos antimembrana basal glomerular, anticuerpos nucleares extractables totales (ENA) y perfil de síndrome antifosfolípido negativos. Los anticuerpos antinucleares (ANA) fueron positivos en 1:2560, con un patrón homogéneo y el anti-DNA en 1:80 (positivo). Se solicitaron biopsias renal y pulmonar, y por presunción diagnóstica de SPR de origen inmunológico se indicó tratamiento con metilprednisolona 1 g/día por 3 dosis.
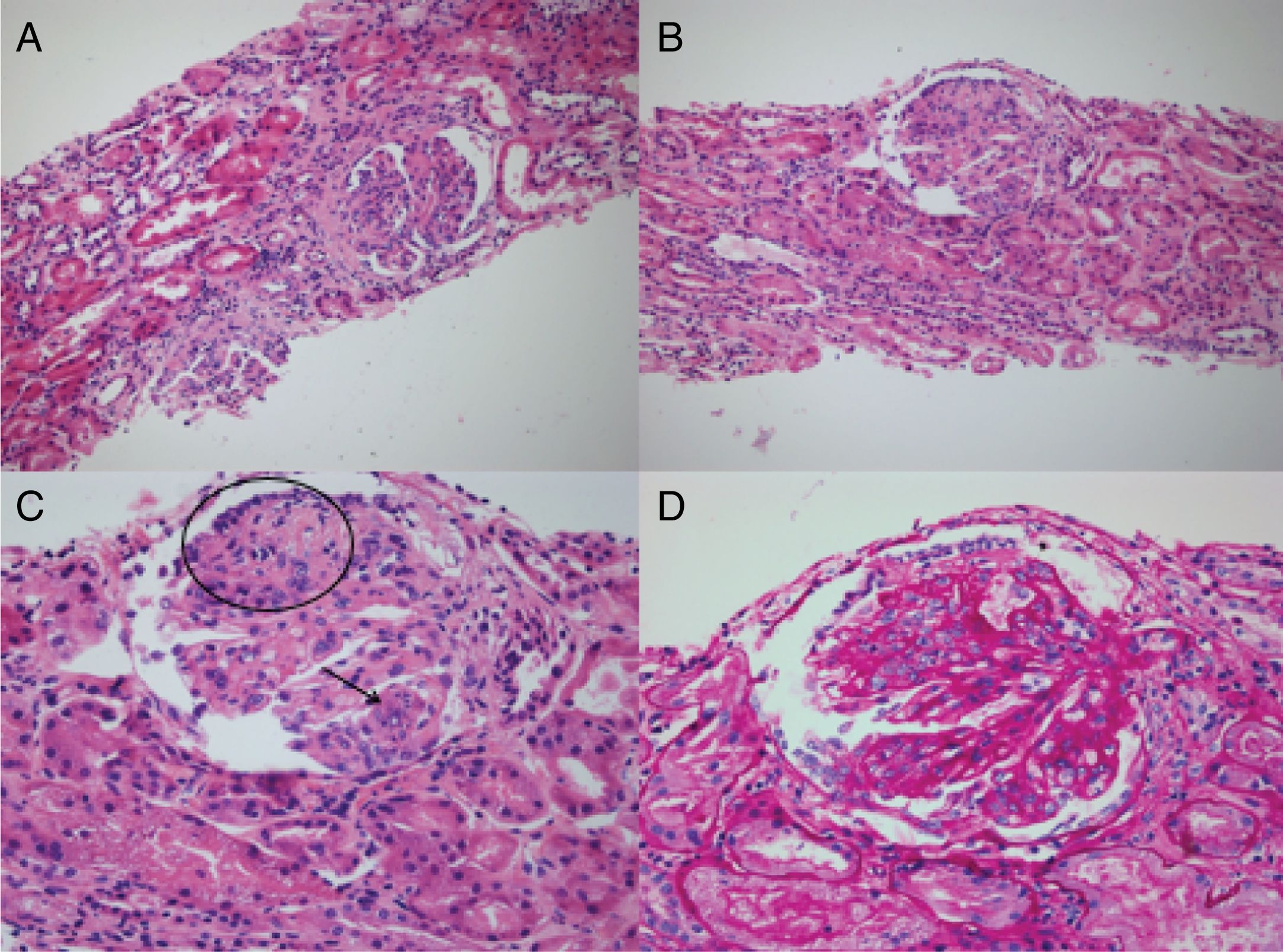
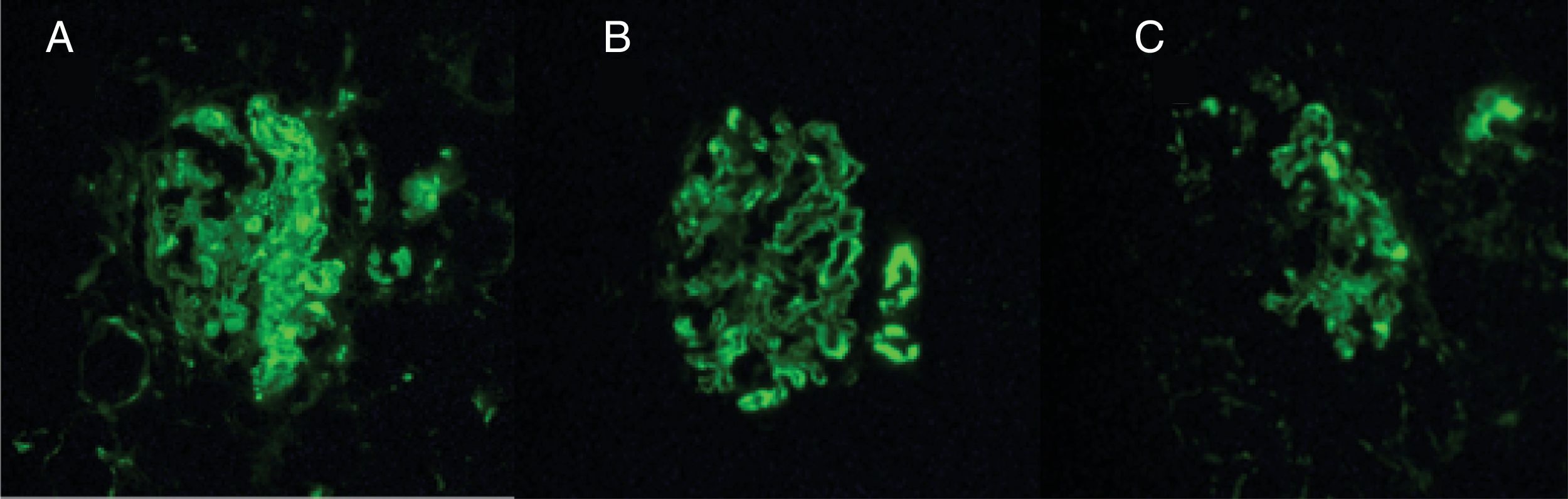
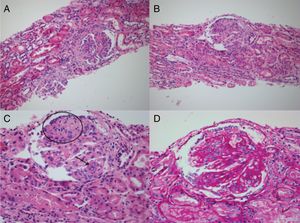
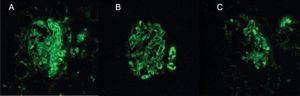
Durante la estancia clínica, el paciente tuvo evolución tórpida requiriendo ser ingresado a la unidad de cuidados intensivos por insuficiencia respiratoria hipoxémica grave. La biopsia pulmonar mostró carcinoma escamocelular queratinizante (fig. 3) y la biopsia renal glomuerulonefritis (GMN) necrotizante con proliferación extracapilar (26%) asociado a nefritis lúpica (NL) difusa clase IV global con índice de actividad 14/24 y de cronicidad 4/12 (fig. 4). La inmunoflouresencia indirecta (IFI) documentó presencia de depósitos reactivos para IgG, IgA y C1q en membrana basal capilar glomerular y mesangio (fig. 5) compatible con patrón en casa llena.
A y B) Coloración H-E 20 x. Se identifican glomérulos con patrón membranoproliferativo, con evidencia de lesiones segmentarias con su respectiva adherencia a la cápsula de Bowman. Nótese la destrucción segmentaria del epitelio parietal y su respectiva membrana basal capilar glomerular. C) H-E 40 x. Glomérulo con cambio membranoproliferativo, colapso (círculo) en donde el epitelio visceral es prominente sin evidencia de luces capilares permeables. También se destaca la presencia de cuerpos hematoxilínicos (flecha) característicos de la nefropatía lúpica acompañados de cariorrexis. D) Coloración de ácido peryódico de Schiff 40 x. Siendo el mismo glomérulo descrito en C, se resalta el engrosamiento de las membranas basales capilares glomerulares con sus dobles contornos y la presencia de depósitos subendoteliales.
Se consideró que se trataba de un SPN con manifestación lupus-like que explica el SPR y el hallazgo histopatológico renal. Por ausencia de indicación de quimioterapia paliativa y no resecabilidad quirúrgica y en vista del mal estado clínico, se consideró limitación del esfuerzo terapéutico. Tras 12 días de hospitalización, el paciente fallece.
DiscusiónEste caso clínico pone en discusión dos perspectivas diferentes en torno a la entidad clínica primaria. La primera, plantea el escenario de concurrencia de dos enfermedades graves y potencialmente mortales y la segunda, pretende explicar la sintomatología renal y pulmonar bajo la existencia de un SPaR en el contexto de un CP.
La evolución clínica se desarrolló en un curso subagudo y no hubo síntomas a la revisión por sistemas que sugirieran autoinmunidad. La pérdida de peso es un síntoma constitucional que pudo estar en relación más al CP. Previo al ingreso hospitalario, ya se tenía documentada una masa pulmonar de características neoplásicas confirmando que el CP precedió la aparición del LES. De hecho, el abordaje clínico inicial estuvo orientado hacia la confirmación diagnóstica de la neoplasia pulmonar (dado el antecedente médico de extabaquismo) y la sospecha de autoinmunidad solo surgió cuando se documentó sedimento urinario activo.
El SPR se define como la coexistencia de hemorragia alveolar difusa (HAD) y GMN y suele ser de mal pronóstico, alcanzando mortalidad del 70%8. El 95% de los casos son secundarios a vasculitis primarias asociadas a ANCA (56 - 77,5%) y enfermedad por anticuerpos antimembrana basal glomerular (12,5 - 17,5%). El 5% restante, se debe a otras vasculitis no ANCA y enfermedades autoinmunes sistémicas, siendo el LES el prototipo de enfermedad de este grupo8,9. En este caso, se confirmó diagnóstico inmunológico e histopatológico de LES, siendo este finalmente la causa del SPR y, por ende, el evento clínico que llevó al paciente a la muerte.
La HAD es una manifestación vasculítica rara del LES y la frecuencia de presentación oscila entre 2 y 5,4%10,11. Histológicamente, los hallazgos más frecuentes son: hemorragia pulmonar blanda, capilaritis semejante a las de las vasculitis sistémicas y daño alveolar difuso12. En este caso, si bien la clínica fue concordante con una HAD, la histología documentó carcinoma escamocelular de pulmón, convirtiéndose en el elemento redireccionador del abordaje clínico a partir del cual fueron considerados otros diagnósticos diferenciales que se expondrán a continuación.
Síndromes reumáticos paraneoplásicos asociados a cáncer de pulmónLos SPN describen al conjunto de manifestaciones clínicas a distancia no relacionadas con la diseminación tumoral por contigüidad, presencia de metástasis o efectos secundarios del tratamiento13. El curso clínico es usualmente paralelo al del tumor, pero puede precederlo14. El espectro clínico de los SPN es variable, siendo más frecuentes los de naturaleza endocrinológica (30%) y menos frecuentes, los de tipo hematológicos, neuromusculares y reumáticos15.
Para el CP, la frecuencia de presentación de los SPN descrita es del 15% al diagnóstico y hasta del 70% durante la evolución de la enfermedad16. Los SPaR están relacionados con la liberación de citocinas por las células tumorales que ocasionan una respuesta inmunológica anormal con daño celular y reacciones cruzadas que conducen al depósito de inmunocomplejos y la subsecuente respuesta inflamatoria17. Entre los más frecuentes se encuentran: osteoartropatía hipertrófica, poliartritis por carcinoma, miositis y vasculitis16. El síndrome similar al lupus (lupus-like) es infrecuente y se ha descrito en otras neoplasias además de la pulmonar: mama, ovario, enfermedad de Hodgkin y leucemia de células peludas. Se caracteriza por poliserositis, fenómeno de Raynaud, artritis inflamatoria, leucopenia y ANA positivos18,19. Si bien el debut de las manifestaciones inmunológicas guarda relación temporal con el diagnóstico del CP, el cuadro clínico de un lupus-like no guarda similitud con lo presentado por el paciente.
Glomerulonefritis paraneoplásicasSon lesiones glomerulares que no están directamente relacionadas con la carga tumoral, la invasión o metástasis, sino que son inducidas por productos de las células tumorales. En tumores sólidos la nefropatía membranosa (GMNM) es generalmente la más reportada y en menor frecuencia la enfermedad de cambios mínimos, glomerulonefritis membranoproliferativa, glomerulonefritis rápidamente progresiva y nefropatía IgA20,21. En la microscopia óptica del paciente, se documentó un patrón membranoproliferativo con engrosamiento de la membrana basal glomerular, dobles contornos, depósitos subendoteliales y cariorrexis; la inmunofluorescencia indirecta mostró patrón «Full House» por lo que dadas las características histopatológicas y la clínica se trató de una NL y no de una GMN membranosa asociada a malignidad.
Como es de notar, el paciente no presentó un cuadro similar al del síndrome lupus-like sino que cumplía estrictamente criterios clasificatorios SLICC para LES22: 1) positividad de ANA en títulos altos; 2) anti-DNA positivo; 3) NL confirmada histológicamente con IFI compatible.
La presencia de títulos elevados de ANA fue otro hallazgo paraclínico contundente para el diagnóstico definitivo de LES. La positividad de ANA está descrita en enfermedad maligna y no solo en CP sino además en cáncer de mama, colon y desórdenes linfoproliferativos23. Un estudio publicado por Solans-Laque et al., mostró que el 27,7% de los pacientes con diagnóstico de cáncer tenían ANA positivos con títulos que oscilaban entre 1:80 y 1:64024. No obstante, su presencia ha sido considerada un epifenómeno sin relevancia clínica clara y su interpretación en el contexto de malignidad aún no es definida1,24. En ese mismo estudio, títulos más elevados entre 1:320 y 1:640 fueron detectados en pacientes con síntomas clínicos de enfermedad reumática o del tejido conectivo, sin demostrase una relación de riesgo para el desarrollo posterior de enfermedad autoinmune24. En este caso, los títulos muy elevados de los ANA y el patrón homogéneo aportan valor diagnóstico y apoyan la existencia real de una enfermedad autoinmune sistémica (LES) y no constituye una casualidad clínica aleatoria.
Integrando los hallazgos clínicos, histológicos y de laboratorio descritos, es claro que sobre la existencia de una enfermedad maligna, hubo un brote de autoinmunidad caracterizado por la presencia de LES, siendo la manifestación debutante un SPR.
A partir de lo expuesto anteriormente, surge el interrogante: ¿puede el cáncer inducir autoinmunidad?
Relación cáncer y autoinmunidad. El cáncer y la autoinmunidad comparten un origen inmunológico común correspondiente a la activación aberrante del sistema inmune que conduce a inflamación crónica y acumulación de daño tisular. Sin embargo, en un punto aún no dilucidado del proceso toman rutas inmunopatológicas distintas. En el cáncer, predomina un microambiente antiinflamatorio mediado por las células tumorales (CTm), estas pierden capacidad antigénica, favoreciendo la progresión y diseminación tumoral. Por otro lado, en las enfermedades autoinmunes, los mecanismos de autotolerancia fallan, hay expresión de autoantígenos que son reconocidos de forma errónea, facilitando la activación de una respuesta inflamatoria excesiva contra el huésped. Sobre esta base inmunológica, se plantean dos escenarios fisiopatológicos opuestos: 1) cáncer inducido por autoinmunidad y 2) autoinmunidad inducida por cáncer. En este caso, el mecanismo concuerda con el fenómeno de inducción de autoinmunidad mediada por carcinogénesis.
Los mecanismos que conducen a la autoinmunidad desde el punto de partida de una enfermedad tumoral son poco comprendidos. Se ha propuesto la presencia de eventos genéticos relacionados con activación de oncogenes, inhibición de genes supresores de tumores e inducción de proteínas inflamatorias.
Lupus eritematoso sistémico y cáncer de pulmónLos pacientes con LES tienen 1,28 veces mayor riesgo de desarrollar cáncer en comparación con la población general, especialmente tumores hematológicos (linfoma no Hodgkin [RR: 5,4 IC 95% 3,75-7,77], linfoma Hodgkin [RR: 3,26; IC 95% 2,17-4,88], leucemia [RR: 2,01; IC 95% 1,61-2,52] y mieloma múltiple [RR: 1,45; IC 95% 1,04-2,03]). Para cáncer no hematológico, las asociaciones reportadas con mayor frecuencia son tumores de laringe, pulmón, hígado, vagina/vulva, vejiga y tiroides4.
En 2016, Wu et al., publicaron un metaanálisis que incluyó 12 estudios y 57.890 pacientes. Se encontró que los pacientes con LES tenían 1,6 veces más riesgo de desarrollar CP25. En términos de distribución histopatológica, no se reportaron diferencias entre pacientes con comorbilidad CP/LES y CP aislado. El tabaquismo resultó ser también un factor de riesgo de desarrollo de CP en LES, en contraste con la exposición a agentes inmunosupresores con los cuales no se encontró relación26. También se ha identificado una base genética para esta asociación. Hay descritos loci compartidos, implicados en la génesis del CP en la población general que también han sido identificados en LES como el 4p15.1-15.3 y 6p2127,28.
ConclusiónExiste una relación bidireccional y dinámica entre el cáncer y la autoinmunidad de la cual sigue siendo difícil discernir si se trata de una asociación o coincidencia. Existe un mecanismo inmunológico complejo compartido entre estos dos grupos de enfermedades que es innegable y hace plausible desde el punto de vista biológico, la concurrencia de estos dos grupos de enfermedades. La diversidad en las manifestaciones clínicas, la alta morbilidad y el reto médico que implica el tratamiento en estos pacientes, obliga una intervención multidisciplinaria, basada en el juicio clínico detallado y la revisión integrada de los hallazgos clínicos y de laboratorio propendiendo un diagnóstico y tratamiento oportuno.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.