Información de la revista
Vol. 32. Núm. 1.
Páginas 56-68 (enero - marzo 2025)
Compartir
Descargar PDF
Más opciones de artículo
Vol. 32. Núm. 1.
Páginas 56-68 (enero - marzo 2025)
Documento de consenso
Consenso para la gestión de riesgo en la prescripción de terapias biológicas o de antirreumáticos sintéticos con blanco dirigido: Asociación Colombiana de Reumatología 2023
Consensus for risk management in the prescription of biologic therapies or targeted synthetic antirheumatic drugs: Colombian Association of Rheumatology 2023
Visitas
2082
Elías Gonzalo Forero Illeraa,b,
, Andrés Ricardo Fernández Aldanab,c, Daniel Gerardo Fernández Ávilab,d, Edwin Antonio Jáuregui Cuartasb,e, Gloria Vásquezb,f, Monique Chalemb,g,h, Wilson Bautista Molanob,g,h,i
Autor para correspondencia
a Departamento de Medicina, Facultad Medicina, Universidad del Norte, Barranquilla, Colombia
b Departamento de Medicina, Asociación Colombiana de Reumatología (Asoreuma), Bogotá, Colombia
c Unidad de Reumatología y Medicina Interna, Inmunar IPS, Ibagué, Colombia
d Unidad de Reumatología, Hospital Universitario San Ignacio, Pontificia Universidad Javeriana, Bogotá, Colombia
e Unidad de Reumatología, Riesgo de Fractura S.A Cayre IPS, Bogotá Colombia
f Sección de Reumatología de la Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
g Departamento de Reumatología, Hospital Universitario Fundación Santa Fe, Bogotá Colombia
h Departamento de Reumatología, Universidad El Bosque, Bogotá Colombia
i Facultad de Medicina, Universidad Militar Nueva Granada, Bogotá, Colombia
Ver másEste artículo ha recibido
Información del artículo
Texto completo
Bibliografía
Descargar PDF
Estadísticas
Tablas (9)
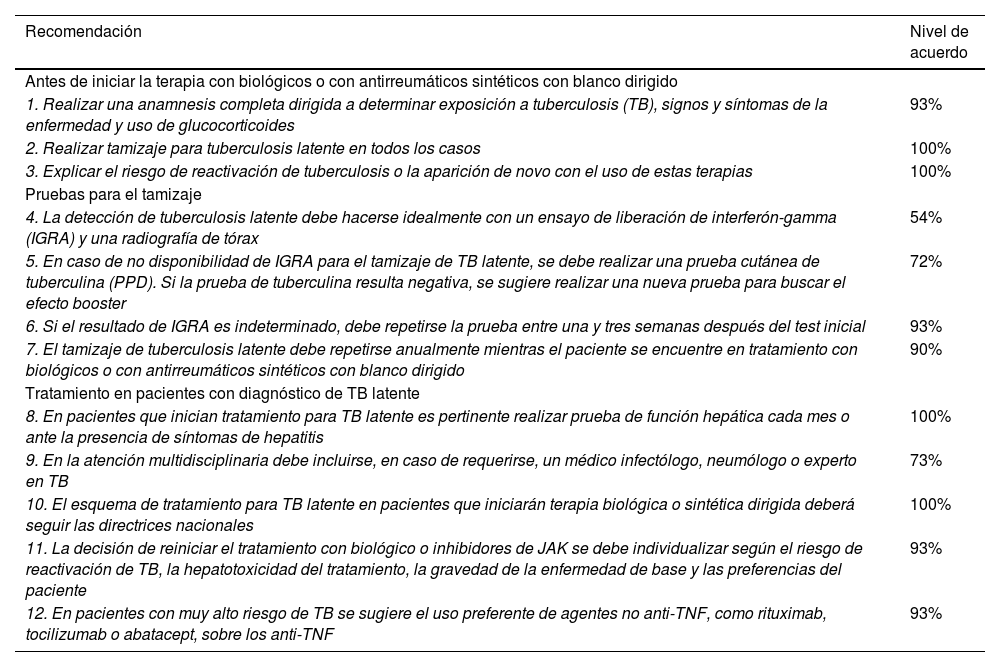
Tabla 1. Resumen de las recomendaciones con respecto a tuberculosis latente y el uso de terapias biológicas o de antirreumáticos sintéticos con blanco dirigido
Tabla 2. Resumen de las recomendaciones en el contexto del cáncer y el uso de terapias biológicas o de antirreumáticos sintéticos con blanco dirigido
Tabla 3. Resumen de las recomendaciones acerca de hepatitis viral y el uso de terapias biológicas o de antirreumáticos sintéticos con blanco dirigido
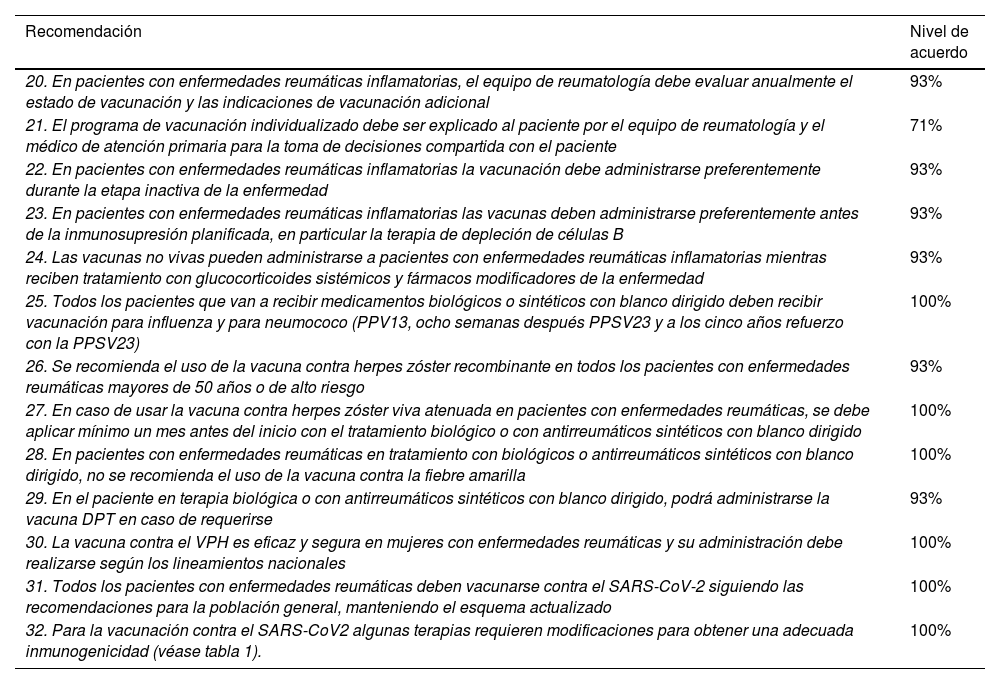
Tabla 4. Resumen de las recomendaciones de vacunación en personas con terapias biológicas o de antirreumáticos sintéticos con blanco dirigido
Tabla 5. Consideraciones sobre temporalidad de la terapia inmunomoduladora y la vacunación por COVID-19
Tabla 6. Manejo de biológicos y otros fármacos en contextos perioperatorios en pacientes con enfermedades reumáticas inflamatorias
Tabla 7. Resumen de las recomendaciones para intervenciones quirúrgicas en personas con terapias biológicas o de antirreumáticos sintéticos con blanco dirigido
Tabla 8. Resumen de recomendaciones con respecto a enfermedad cardiovascular en personas con terapias biológicas o de antirreumáticos sintéticos con blanco dirigido
Tabla 9. Resumen de las recomendaciones para el uso de terapias biológicas o de antirreumáticos sintéticos con blanco dirigido en el contexto de embarazo y lactancia
Mostrar másMostrar menos
Opciones para acceder a los textos completos de la publicación Revista Colombiana de Reumatología
Suscriptor
Comprar
Contactar
Teléfono para suscripciones e incidencias
De lunes a viernes de 9h a 18h (GMT+1) excepto los meses de julio y agosto que será de 9 a 15h
Llamadas desde España
932 415 960
Llamadas desde fuera de España
+34 932 415 960
E-mail