El infarto esplénico es una condición infrecuente, generalmente asociada con afecciones sistémicas. El síndrome antifosfolipídico (SAF) es una enfermedad autoinmune que puede presentarse como dolor abdominal debido a infarto esplénico. Se describe el caso de una paciente con lupus eritematoso sistémico que ingresó con dolor abdominal agudo. La tomografía abdominal evidenció infarto esplénico y las pruebas de laboratorio para anticuerpos antifosfolípidos y anti-β2-glicoproteínaI fueron positivas. Se discute la fisiopatología y la presentación clínica del infarto esplénico asociado con SAF, enfatizando la importancia de incluir esta entidad en el diagnóstico diferencial del dolor abdominal de causa incierta en pacientes con afecciones sistémicas.
Splenic infarction is a rare condition usually associated with systemic conditions. Antiphospholipid syndrome (APS) is an autoimmune condition that can present as abdominal pain due to splenic infarction. We describe a patient with systemic lupus erythematosus, admitted due to acute abdominal pain. Abdominal CT scan showed splenic infarction, and tests for antiphospholipid and anti-β2-glycoproteinI antibodies were positive. The pathophysiology and clinical presentation of splenic infarction associated with APS is discussed, emphasizing the importance of including this entity in the differential diagnosis of abdominal pain of uncertain cause in patients with systemic conditions.
El infarto esplénico es una condición relativamente infrecuente en la práctica clínica. Existen diversas causas que lo ocasionan, entre las cuales la más frecuente son las enfermedades tromboembólicas, como las asociadas a la fibrilación auricular, y también las asociadas con procedimientos cardiacos, vegetaciones bacterianas generadas en las válvulas cardíacas o asociadas con valvulopatías1.
Las etiologías no embólicas del infarto esplénico siguen siendo poco frecuentes e incluyen algunas enfermedades autoinmunes, como el lupus eritematoso sistémico (LES), las vasculitis, los estados de hipercoagulabilidad (p. ej., el síndrome antifosfolipídico [SAF]) o las neoplasias. Otras causas poco reportadas contemplan trastornos hematológicos como la policitemia vera, las enfermedades mieloproliferativas, los linfomas, las leucemias, así como las anemias hemolíticas y hemoglobinopatías (particularmente la anemia de células falciformes), y entre las causas infecciosas se encuentra la endocarditis bacteriana1,2.
Wand et al.3 reportaron los mecanismos subyacentes al desarrollo de los infartos esplénicos, entre los cuales los cardioembólicos representaban el 54,4%, los trastornos vasculares el 20% y los trastornos hematológicos el 15,6%. La fibrilación auricular y la aterosclerosis eran las patologías más frecuentes en los pacientes mayores de 70años, mientras que el SAF predominaba en las personas jóvenes.
El SAF es un trastorno autoinmune sistémico que puede causar episodios tromboembólicos o complicaciones obstétricas asociadas con anticuerpos antifosfolípidos. Puede dividirse en primario o secundario, dependiendo de la presencia de alguna enfermedad autoinmune subyacente, como la artritis reumatoide o el LES4.
Se presenta el caso de una paciente de 41años, con antecedente de LES sin tratamiento, quien ingresó por dolor abdominal, anemia hemolítica, ictericia y hepatoesplenomegalia, y se le hizo el diagnóstico de LES activo asociado con SAF y anemia hemolítica autoinmune.
Presentación del casoMujer de 41años, mestiza, natural y procedente de Lima metropolitana, con antecedente de LES diagnosticado 5años atrás por eritema malar, alopecia, anticuerpos antinucleares positivos e hipocomplementemia. Recibió tratamiento con prednisona en dosis variables durante los 3 primeros años, luego de lo cual lo abandonó debido a la ausencia de síntomas. Cuatro años atrás, durante su tercera y última gestación, con 33 semanas, desarrolló preeclampsia severa, lo que tuvo como desenlace un natimuerto.
La paciente acudió a un hospital de bajo nivel de complejidad por presentar dolor abdominal difuso de 6días de evolución, tipo punzada, de moderada intensidad, predominantemente en el hemiabdomen superior. Se le administraron analgésicos parenterales y se le indicó continuar con manejo ambulatorio. Tres días después reapareció el dolor abdominal, esta vez exacerbado de forma aguda durante las últimas 24horas, el cual se intensificaba con la inspiración profunda, se asociaba con astenia, hiporexia progresiva y náusea, y se encontró una hemoglobina de 3,5g/dl. Por todo ello, se decidió transferirla al servicio de emergencia del Hospital Nacional Hipólito Unánue.
Al ingreso, la paciente persistía con dolor abdominal, asociado con vómitos de contenido bilioso. En la evaluación inicial se encontraba normotensa, taquicárdica, con facie dolorosa y posición antálgica. Se evidenció ictericia marcada en escleras y en mucosas, abdomen con ruidos hidroaéreos presentes, blando, depresible, sin resistencia en la pared abdominal y doloroso a la palpación en el hipocondrio izquierdo. El espacio de Traube se encontró ocupado, se palpó el bazo un centímetro por debajo del reborde costal, en tanto que el resto del examen no fue contributorio.
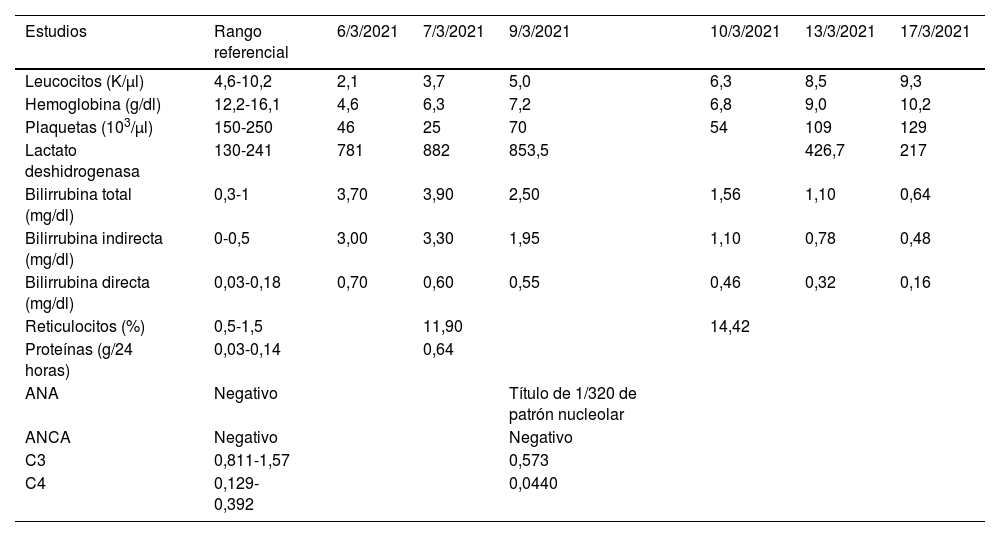
A la paciente se le solicitó analítica sanguínea general (tabla 1), en la que llamó la atención la presencia de anemia severa, leucopenia, trombocitopenia severa e hiperbilirrubinemia a predominio indirecta. La presencia de reticulocitos elevados (índice de producción reticulocitario corregido de 3,0), un test de Coombs directo positivo (+++ según determinación cualitativa con título de 16 diluciones) y la elevación de lactato deshidrogenasa confirmaron el diagnóstico de anemia hemolítica. Dichos hallazgos, junto a la presencia de leucopenia, trombocitopenia, anti-DNA nativo (22,1UI/ml), hipocomplementemia y cilindros granulosos confirmaron actividad lúpica, con un índice de actividad del LES (Sledai) de 10 puntos.
Analítica sanguínea
| Estudios | Rango referencial | 6/3/2021 | 7/3/2021 | 9/3/2021 | 10/3/2021 | 13/3/2021 | 17/3/2021 |
|---|---|---|---|---|---|---|---|
| Leucocitos (K/μl) | 4,6-10,2 | 2,1 | 3,7 | 5,0 | 6,3 | 8,5 | 9,3 |
| Hemoglobina (g/dl) | 12,2-16,1 | 4,6 | 6,3 | 7,2 | 6,8 | 9,0 | 10,2 |
| Plaquetas (103/μl) | 150-250 | 46 | 25 | 70 | 54 | 109 | 129 |
| Lactato deshidrogenasa | 130-241 | 781 | 882 | 853,5 | 426,7 | 217 | |
| Bilirrubina total (mg/dl) | 0,3-1 | 3,70 | 3,90 | 2,50 | 1,56 | 1,10 | 0,64 |
| Bilirrubina indirecta (mg/dl) | 0-0,5 | 3,00 | 3,30 | 1,95 | 1,10 | 0,78 | 0,48 |
| Bilirrubina directa (mg/dl) | 0,03-0,18 | 0,70 | 0,60 | 0,55 | 0,46 | 0,32 | 0,16 |
| Reticulocitos (%) | 0,5-1,5 | 11,90 | 14,42 | ||||
| Proteínas (g/24 horas) | 0,03-0,14 | 0,64 | |||||
| ANA | Negativo | Título de 1/320 de patrón nucleolar | |||||
| ANCA | Negativo | Negativo | |||||
| C3 | 0,811-1,57 | 0,573 | |||||
| C4 | 0,129-0,392 | 0,0440 |
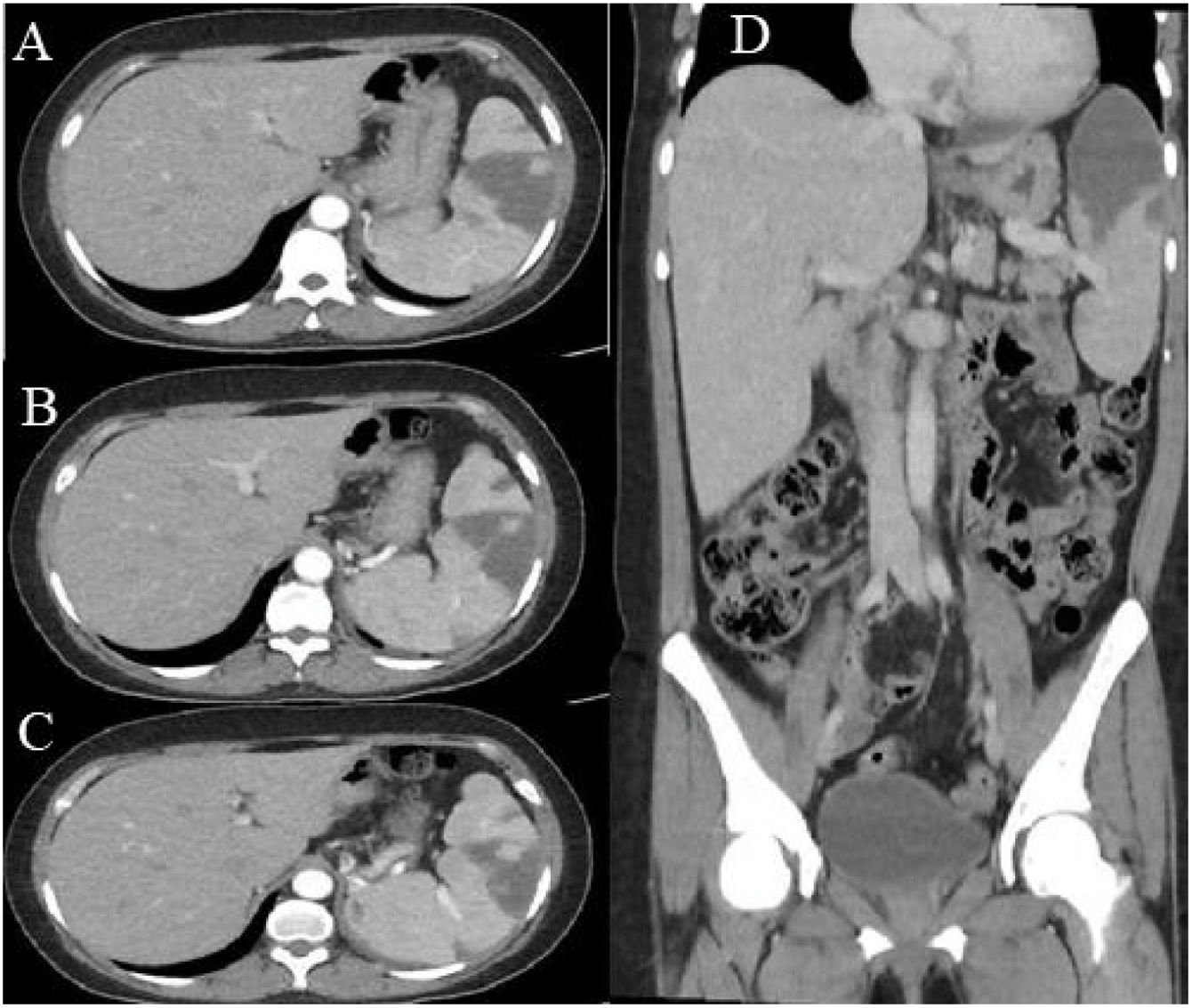
En la ecografía abdominal se observó hepatoesplenomegalia, el lóbulo hepático derecho de 174mm, el izquierdo de 105mm y el bazo de 147×84mm, este último con múltiples áreas hipoecogénicas. La tomografía axial computarizada abdominal contrastada (fig. 1) mostró múltiples áreas hipodensas, en particular en el polo superior del bazo, que abarcaban el 40% del volumen total, lo cual es compatible con infartos esplénicos.
Tomografía abdominal contrastada. A)Tomografía, corte axial, fase portal. Se aprecia imagen hipocaptante hipodensa, en forma de cuña, con punta orientada hacia el hilio en aspecto anterosuperior de parénquima esplénico. B y C)Imágenes hipocaptantes hipodensas múltiples, la más grande en forma de cuña con punta orientada hacia el hilio en aspecto anterosuperior de parénquima esplénico y otras más pequeñas. D)Reconstrucción coronal. Se evidencian múltiples imágenes hipocaptantes, la mayor de ellas ubicada predominantemente en el polo superior del bazo, con forma de cuña en el parénquima esplénico y punta hacia el hilio, que abarca el 40% del volumen del bazo correspondiente a infartos esplénicos.
Se descartaron embolia cardíaca y séptica, así como trastornos hematológicos, neoplasias malignas y trombosis venosa profunda. En la angiotomografía pulmonar no se hallaron signos de trombosis pulmonar, y en el ecocardiograma transtorácico se descartó la presencia de valvulopatías o de vegetaciones valvulares.
Los estudios inmunológicos, destinados a evaluar la presencia de SAF como etiología de los infartos esplénicos, evidenciaron niveles elevados de anticardiolipina IgG (128GLPU/ml) y de beta-2 glicoproteína IgG (>100U/ml), mientras que el coagulante lúpico resultó negativo.
Se inició metilprednisolona parenteral en pulsos durante 3días consecutivos, y una vez confirmado el diagnóstico de SAF se inició la anticoagulación con heparina seguida por cumarínicos. La paciente tuvo una evolución favorable, se le dio el alta y se le prescribió prednisona, hidroxicloroquina y warfarina.
DiscusiónEl SAF es un trastorno autoinmune caracterizado por un estado de hipercoagulabilidad que puede resultar en trombosis venosas recurrentes o eventos arteriales oclusivos y pérdidas fetales asociadas con niveles elevados de anticuerpos antifosfolípidos5,6; asimismo, puede constituir una condición primaria o presentarse en el contexto de enfermedades autoinmunes, sobre todo el LES1,2,5, como ocurrió con nuestra paciente.
Los anticuerpos antifosfolípidos promueven la inhibición de las vías anticoagulantes, lo cual favorece las trombosis. Las células endoteliales, los monocitos, las plaquetas y las vías de activación del complemento desempeñan un papel central en la trombosis arteriovenosa y la embolia inducida por el SAF6.
La gran mayoría de los signos clínicos del SAF se relacionan con trombosis venosas, arteriales o de vasos pequeños recurrentes que se producen en cualquier tejido u órgano7,8. Dichas trombosis pueden ser episodios únicos, sin complicaciones, o bien pueden constituir situaciones potencialmente mortales de eventos tromboembólicos masivos, recurrentes y generalizados, lo que se conoce como SAF catastrófico9.
Entre las manifestaciones clínicas del SAF en el adulto, la trombosis venosa profunda sigue siendo la más frecuente (39% de los casos, y puede estar acompañada de embolia pulmonar), mientras que las enfermedades cerebrovasculares isquémicas y la trombocitopenia representan alrededor del 30% de los casos, y también puede asociarse con pérdidas fetales en alrededor del 50% de los embarazos9. Sin embargo, también pueden desarrollarse trombosis en cualquier otro territorio vascular, siendo los más reportados aquellos que afectan al hígado10, el riñón, la glándula suprarrenal o el corazón5. Los infartos esplénicos, evidenciados en el caso bajo discusión, son aún más raros y se describen frecuentemente como parte de un SAF catastrófico11,12.
Si bien es cierto que el SAF puede estar asociado con enfermedades autoinmunes como el LES, el infarto esplénico como primera manifestación trombótica raramente ha sido reportado13,14.
Otro aspecto inusual dentro de la presentación es la asociación de anemia hemolítica con el evento trombótico. Vianna et al.15 identificaron en una serie de casos que los pacientes con SAF secundario a LES y SAF primario tenían espectros clínicos similares, aunque la anemia hemolítica, los niveles bajos de C4 y la neutropenia parecen ser más frecuentes en los pacientes con SAF secundario a LES.
La anemia hemolítica se asocia con un incremento de eventos trombóticos16. Se ha postulado, con base en modelos animales, que la hemólisis puede desencadenar la activación de factores procoagulantes y alterar la morfología eritrocitaria como posible mecanismo de eventos trombóticos17.
El diagnóstico del SAF se basa en hallazgos clínicos y de laboratorio (tabla 2) y se define mediante al menos uno de dos criterios clínicos y uno de dos resultados de laboratorio (anticuerpos anticardiolipina IgM o IgG o anticuerpos anticoagulantes lúpico o anti-β2 glicoproteínaI)7,12. En nuestro caso, el diagnostico se basó en la presencia del infarto esplénico confirmado tomográficamente, el antecedente de parto prematuro por preeclampsia y 2 criterios laboratoriales: anticuerpos anticardiolipina y anti-β2 glicoproteínaI.
Criterios diagnósticos en el síndrome antifosfolipídico
| Criterios clínicos |
| Trombosis vascular |
| Uno o más episodios de trombosis arterial, venosa o de pequeño vaso en cualquier órgano o tejido del organismo, confirmado por pruebas de imagen apropiadas y/o análisis histopatológico (debiendo estar presente la trombosis sin evidencia de inflamación de pequeño vaso) |
| Morbilidad durante el embarazo |
| a) Una o más muertes de un feto morfológicamente normal menor de 10 semanas de gestación, con morfología normal del feto documentada mediante ecografía o examen directo del feto, |
| o |
| b) Uno o más partos prematuros de un neonato morfológicamente normal antes de la semana 34 de gestación debido a: 1) eclampsia o preclamsia grave, o 2) características reconocibles de insuficiencia placentaria, |
| o |
| c) Tres o más abortos espontáneos consecutivos antes de la semana 10 de gestación, habiendo descartado anomalías anatómicas y hormonales de la madre y anomalías tanto maternas como paternas |
| Criterios de laboratorio |
| 1. Anticoagulante lúpico (aCL) determinado de acuerdo con las recomendaciones de la International Society of Thrombosis and Hemostasis |
| 2. Anticuerpos anticardiolipina (aCA) tipo IgG y/o IgM medidos por ELISA a títulos medios o elevados (>40 GPL o MPL o >percentil 99) |
| 3. Anticuerpos anti-β2 glicoproteínaI (aβ2GPI) tipo IgG y/o IgM medidos por ELISA a títulos medios o elevados (>percentil 99) |
| Se considerará el diagnóstico de SAF definitivo cuando estén presentes al menos un criterio clínico más un criterio analítico que sea positivo en 2 ocasiones, separadas por un intervalo de al menos 12 semanas |
Fuente: adaptado de Ruiz-Irastorza et al.7.
El infarto esplénico puede ser una causa subestimada de dolor abdominal agudo. Su prevalencia es cercana al 0,016%1, y en algunas series de casos los síntomas gastrointestinales son las primeras manifestaciones del SAF18. Los infartos esplénicos se reportan entre el 1,1 y el 1,8% de los pacientes con SAF5,19.
En Latinoamérica, los reportes de infartos esplénicos se han asociado con la presencia de anemia falciforme en individuos afrodescendientes, usualmente expuestos a la altura20-23. En el caso de nuestra paciente no se identificó antecedente de viaje reciente, ni antecedentes personales o familiares de hemoglobinopatías. Con menor frecuencia se han reportado infartos esplénicos relacionados con otros trastornos hematológicos24 e infecciones25.
Los estudios ecográficos de bazo siguen siendo de gran utilidad en el abordaje inicial, aunque la tomografía axial computarizada de abdomen suele proporcionar el diagnóstico, puesto que permite observar imágenes hipodensas características de un infarto esplénico2,3,8. Kaushik et al.26 evidenciaron que el 2,8% de los pacientes con SAF presentaba infartos esplénicos en la tomografía abdominal. En la tomografía las lesiones en forma «de cuña» dirigida hacia la cápsula, así como el ápex dirigido hacia el hilio, son sugestivas de infarto20. Ante una necrosis extensa por licuefacción no solo puede presentarse la lesión hipodensa hipocaptante en forma de cuña, sino que también puede existir neumatosis26. En el caso presentado, las lesiones se ubican en el polo superior y comprometen el 40% del volumen del bazo.
El tratamiento de elección del infarto esplénico depende de las etiologías y normalmente es conservador. Las opciones terapéuticas todavía son objeto de discusión, aunque en general se acepta la anticoagulación oral prolongada7,8,27,28. Los infartos esplénicos no suelen requerir ninguna intervención quirúrgica, y la esplenectomía solamente está justificada ante la aparición de complicaciones como abscesos esplénicos, rotura de bazo, hemoperitoneo o persistencia del dolor26.
Los pacientes con infarto esplénico pueden llegar a desarrollar asplenia funcional, dependiendo de su extensión, la cual estaría sugerida por la presencia de los cuerpos de Howell Jolly y hematíes vacuolados en el frotis de sangre periférica, y se confirmaría con los estudios gammagráficos de eritrocitos marcados con radioisótopos (99mTc) con tomografía computarizada por emisión de fotón único (SPECT)29,30. Ante dicha confirmación, se debe considerar complementar el esquema vacunal y proteger contra microorganismos capsulados29.
En conclusión, el caso demuestra la necesidad de incluir al infarto esplénico asociado con SAF en el diagnóstico diferencial del dolor abdominal agudo en pacientes con enfermedades autoinmunes. Si bien es raro, un infarto esplénico puede ser un indicio de la presencia de SAF, especialmente en pacientes con SAF catastrófico.
Aspectos éticosEl presente reporte de caso cuenta con el consentimiento informado de la paciente y sus datos fueron tratados confidencialmente en la descripción del manuscrito. A su vez, se cuenta con la aprobación del comité de ética institucional del Hospital Nacional Hipólito Unanue, Lima, Perú. Carta n.° 045-2022-CIEI-HNHU.
FinanciaciónNinguna.
Contribuciones de autoríaJA y AS participaron en la génesis de la idea. JA, LC y AS participaron en la atención clínica de la paciente y la recolección de la información de la historia clínica. Todos los autores participaron en la elaboración del manuscrito y su revisión crítica y aprobaron su versión final.
Conflicto de interesesLos autores declaran no presentar conflicto de intereses para la elaboración de este artículo.