Los fármacos antirreumáticos modificadores de la enfermedad y los medicamentos biológicos buscan controlar la inflamación y evitar la progresión del daño articular en artritis reumatoide. Aún es controvertido si éstos aumentan la incidencia de infecciones en esta entidad.
MétodosEstudio de cohorte retrospectivo en una población de pacientes de consulta externa y hospitalización, de un hospital universitario de referencia de reumatología, de cuarto nivel de complejidad, del noroccidente colombiano. Se incluyeron 383 pacientes según los criterios del American College of Rheumatology de 1987: 83 en el grupo de terapia con biológicos y 300 en el grupo de fármacos modificadores, para establecer la incidencia y factores de riesgo para infecciones no serias y serias a los 12 meses de seguimiento.
ResultadosLa mayoría de la población fue femenina (85%). El grupo de biológicos presentó un mayor riesgo para infecciones no serias [HR 1.73 (IC 95% 1.07–2.77; p=0.023)] y serias [HR 2.56 (IC 95% 1.09–6.01; p=0.030)]; este hallazgo se mantuvo al ajustar los resultados por otras variables asociadas a infección (número de fármacos modificadores recibidos, uso de metotrexate, esteroides y leflunomida, diabetes mellitus) HR para infección no seria [(1.67, IC 95% 1.05–2.70; p=0.030)] y HR para infección seria [(2.67, IC 95% 1.12–6.34; p= 0.026)]. La enfermedad pulmonar crónica [HR 5.11 (IC 95% 1.18–22.08; p=0.029)] fue factor de riesgo adicional para infecciones serias.
ConclusionesLa terapia con biológicos aumenta el riesgo de infecciones serias y no serias a 12 meses, en comparación con fármacos modificadores, en un grupo de pacientes con artritis reumatoide. También se aumenta el riesgo de infecciones serias con la presencia de enfermedad pulmonar crónica.
Disease modifying anti-rheumatic drugs and biological disease modifying drugs are used to control inflammation and prevent progression of joint damage in rheumatoid arthritis. It is still controversial whether these drugs increase the incidence of infection in this disease.
MethodsA retrospective cohort study was conducted on a population sample of 383 inpatients and outpatients from a university hospital and referral rheumatology tertiary hospital complex in northwestern Colombia. They were classified according to American College of Rheumatology 1987 classification criteria, with 83 in the biological therapy group, and 300 in the disease modifying antirheumatic drugs group, in order to establish the incidence and risk factors for serious and non-serious infections at 12 months follow-up.
ResultsThe majority were females (85%). The biological therapy group presented a greater risk for non-serious [HR 1.73 (95% CI 1.07–2.77; P=.023)] and serious infections [HR 2.56 (95% CI 1.09–6.01; P=.030)]. This finding remained when adjusting for other variables associated with infection (number of disease modifying antirheumatic drugs received, methotrexate, leflunomide and steroids use, diabetes mellitus), with HR for non-serious infection [(1.67, 95% CI 1.05–2.70; P=.030)], and HR for serious infection [(2.67, 95% CI 1.12–6.34; P=.026)]. Chronic lung disease [HR 5.11 (95% CI 1.18–22.08; P=.029)] was an additional risk factor for serious infections.
ConclusionsBiological therapy increases the risk of serious and non-serious infections at 12 months, compared to disease modifying drugs, in a group of patients with rheumatoid arthritis. The risk of serious infections also increases with the presence of chronic lung disease
La artritis reumatoide (AR) es una enfermedad inflamatoria crónica, caracterizada por una respuesta inmune anormal y que se manifiesta clínicamente con dolor e inflamación articulares, con posterior destrucción de las diferentes estructuras, siendo causa de discapacidad grave y permanente, además de mortalidad temprana1,2. Se calcula que esta entidad afecta 1–2% de la población general, principalmente al sexo femenino, sin una clara predominancia por grupos étnicos particulares3. Los fármacos modificadores de la enfermedad (en adelante DMARD, por sus siglas en inglés disease modifying antirheumatic drugs) pueden controlar o retrasar la progresión del daño articular; de ellos, metotrexate es la piedra angular en el tratamiento, por demostrar el mayor potencial protector de daño irreversible al ser comparado con las demás mo léculas2.
En los últimos años, gracias a la mejor comprensión de los mecanismos fisiopatológicos de la enfermedad y a los avances biotecnológicos, ha sido posible el diseño de agentes moduladores de la respuesta biológica (en adelante biológicos), dirigidos a la restauración de la respuesta inmune y a la suspensión de mecanismos de daño tisular. El blanco terapéutico de los agentes biológicos incluye células: T, B, complemento, citoquinas y receptores, razón por la cual la interacción de estos medicamentos con estas células y sustancias, puede intervenir con la respuesta inmunológica ante procesos infecciosos, aumentando la susceptibilidad del individuo al desarrollo de los mismos4–6.
Aún es controvertido si los medicamentos biológicos aumentan la tasa de infecciones en comparación con los DMARD. Se calcula que, aproximadamente, un tercio de los pacientes tratados con inhibidores de citoquinas tiene una infección menor (bronquitis, sinusitis, faringitis, infección urinaria), incidencia similar a los pacientes que reciben placebo7. Por otra parte, se calcula que alrededor de 0.12% de ellos se complican con el desarrollo de infecciones serias8. La susceptibilidad para el desarrollo de estos procesos infecciosos parece ser mayor en las primeras 16 semanas, después del inicio del medicamento9, aunque otros autores consideran que el periodo de riesgo se extiende hasta los 6 primeros meses10.
Algunos estudios sugieren que los individuos con AR tienen mayor susceptibilidad a sufrir infecciones durante la terapia con biológicos, comparados con pacientes con otras enfermedades reumáticas, al parecer por el mayor número y tiempo de exposición a esteroides y otros DMARD11–15.
El objetivo de este estudio fue evaluar la incidencia y factores de riesgo para el desarrollo de eventos infecciosos serios y no serios, durante el primer año de seguimiento en pacientes colombianos con AR, tratados con biológicos y DMARD, en una institución de referencia de cuarto nivel de complejidad; además, se pretendió describir las características clínicas basales de estos sujetos, determinar las infecciones específicas, órganos comprometidos y gérmenes aislados.
MétodosDiseño del estudioEstudio de cohorte retrospectivo, en el cual se evaluaron los registros de consulta externa y hospitalización de los pacientes que asistieron a control por Reumatología, en un hospital universitario de cuarto nivel de complejidad y centro de referencia del noroccidente colombiano, entre marzo de 2009 y marzo de 2012. Los criterios de elegibilidad que se tuvieron en cuenta fueron: Inclusión: a) Diagnóstico de artritis reumatoide, según los criterios del American College of Rheumatology de 198716; b) Edad entre 18 y 80 años; c) Tratamiento con biológicos o DMARD. Exclusión: Pacientes con: a) Otras enfermedades reumáticas; b) Con enfermedades neoplásicas que recibían concomitantemente tratamiento con quimioterapia u otros inmunosupresores y c) Cuyos registros clínicos tenían información dudosa y que no fue posible verificar la veracidad y calidad de la información suministrada en éstos. Se conformaron dos grupos: biológicos (grupo expuesto): individuos que recibieron: adalimumab, abatacept, etanercept, rituximab, tocilizumab o infliximab. El otro grupo se denominó DMARD (grupo no expuesto): sujetos que recibieron tratamiento, por lo menos, con un DMARD (metotrexate, leflunomida, sulfasalazina, antimaláricos, azatioprina) y que nunca habían recibido biológicos.
Definición de variables del estudioSe consideraron las siguientes variables: edad, sexo, diabetes mellitus, enfermedad pulmonar crónica (definida como diagnóstico por espirometría con patrón obstructivo o restrictivo, imagen del tórax o confirmación histológica de enfermedad pulmonar obstructiva crónica o de neumopatía intersticial asociada a AR), tabaquismo activo, consumo crónico de licor (definido como una ingesta diaria superior a 50 gramos en la mujer y 70 gramos en el hombre), falla renal crónica, duración de AR (en años), positividad de factor reumatoide o anticuerpos anticitrulina (valores por encima del límite superior de referencia del laboratorio para ambos autoanticuerpos, según cada lugar de realización), tiempo de exposición a DMARD, número de DMARD recibidos, biológico utilizado, número de biológicos previos, uso de DMARD específico, uso de esteroides y dosis empleada, uso de medidas para prevención y tamización de infecciones (prueba de tuberculina, tratamiento de tuberculosis (TB) latente, radiografía del tórax, vacunación previa para influenza y neumococo), infección específica, número de infecciones, infección seria, órgano comprometido, germen, tiempo de aparición posterior al inicio del tratamiento. Se definió infección como un episodio de presunta etiología viral, bacteriana, fúngica o parasitaria, con confirmación microbiológica, imaginológica o alta sospecha clínica. Se definió infección seria como aquella que requirió hospitalización, empleo de antibióticos intravenosos o que desencadenara la muerte.
Proceso de recolección de la informaciónSe recolectó la información basal y del primer año de seguimiento de los pacientes a partir de fuentes secundarias como las historias clínicas, registros de laboratorio y de hospitalización, además de documentos escaneados; para ello se utilizó un formulario de recolección físico, cuya información fue ingresada, posteriormente, a una base de datos construida en Microsoft Excel.
Para contrarrestar los posibles sesgos de información inherentes a este diseño, las historias clínicas fueron revisadas por una sola persona. Una vez recolectados todos los datos, se hizo una prueba piloto seleccionando las historias clínicas correspondientes al 10% de la muestra para revisar los datos recolectados e identificar posibles errores de digitación o información.
Análisis estadísticoLas variables cualitativas se describieron por medio de frecuencias absolutas y relativas y las variables cuantitativas mediante mediana y rango intercuartílico (RIQ). Se calculó la tasa de incidencia global del primer episodio infeccioso y la tasa de infección seria al año de seguimiento, para lo cual se realizó un análisis de tiempo al evento utilizando el método Kaplan-Meier. Para el análisis de tiempo al primer evento infeccioso, se consideraron, como datos censurados, la ausencia de cualquier infección y las pérdidas durante el seguimiento. En el análisis de tiempo para infección seria, además de lo anterior, se consideraron las infecciones no serias como datos censurados.
Para comparar las características basales entre pacientes tratados con biológicos y DMARD se utilizó, para las variables cualitativas, la prueba Chi cuadrado de Pearson o la prueba exacta de Fisher, cuando fue necesario, (en caso de frecuencias esperadas menores de cinco) y, en el caso de variables cuantitativas, la prueba Mann-Whitney, debido al no cumplimiento del supuesto de normalidad de los datos.
Se determinó el riesgo de aparición de un primer evento infeccioso o una infección seria al año de seguimiento en cada uno de los grupos de exposición y se estimaron las razones de riesgo cruda (HR), con sus respectivos intervalos de confianza del 95% mediante el modelo de regresión de Cox. Además, se realizaron análisis multivariados independientes para evaluar el efecto de las terapias en el desarrollo, tanto de un primer episodio de infección como de una infección seria, ajustando por las siguientes variables potenciales confusoras: uso de metotrexate, esteroides y leflunomida, antecedente de diabetes mellitus, enfermedad pulmonar crónica, tiempo de exposición a DMARD en años (categorizado así: menos de 2, entre 2 y 5, entre 5 y 10 y más de 10, según la distribución de los valores según cuartiles) o número de DMARD recibidos (modelos paralelos). No se incluyó, en este análisis, la edad de inicio de los síntomas ni el tiempo de evolución de la enfermedad. El criterio de inclusión de las variables en el análisis multivariado fue un valor de p<0.05 en el análisis bivariado o aquellas variables de relevancia clínica, sin importar el resultado del análisis bivariado. Un valor de p menor de 0.05 se consideró estadísticamente significativo. Todos los análisis se llevaron a cabo en el programa estadístico IBM SPSS 19.0.
ResultadosDurante el período del estudio 383 sujetos cumplieron criterios de elegibilidad: 83 en el grupo de biológicos y 300 en elgrupo DMARD. De éstos, 60 (15.6%) pacientes tenían un seguimiento menor a un año, siendo similar el número de pérdidas entre los dos grupos evaluados [grupo biológicos: 12 (14.5%) y grupo DMARD: 48 (16%); p= 0.732].
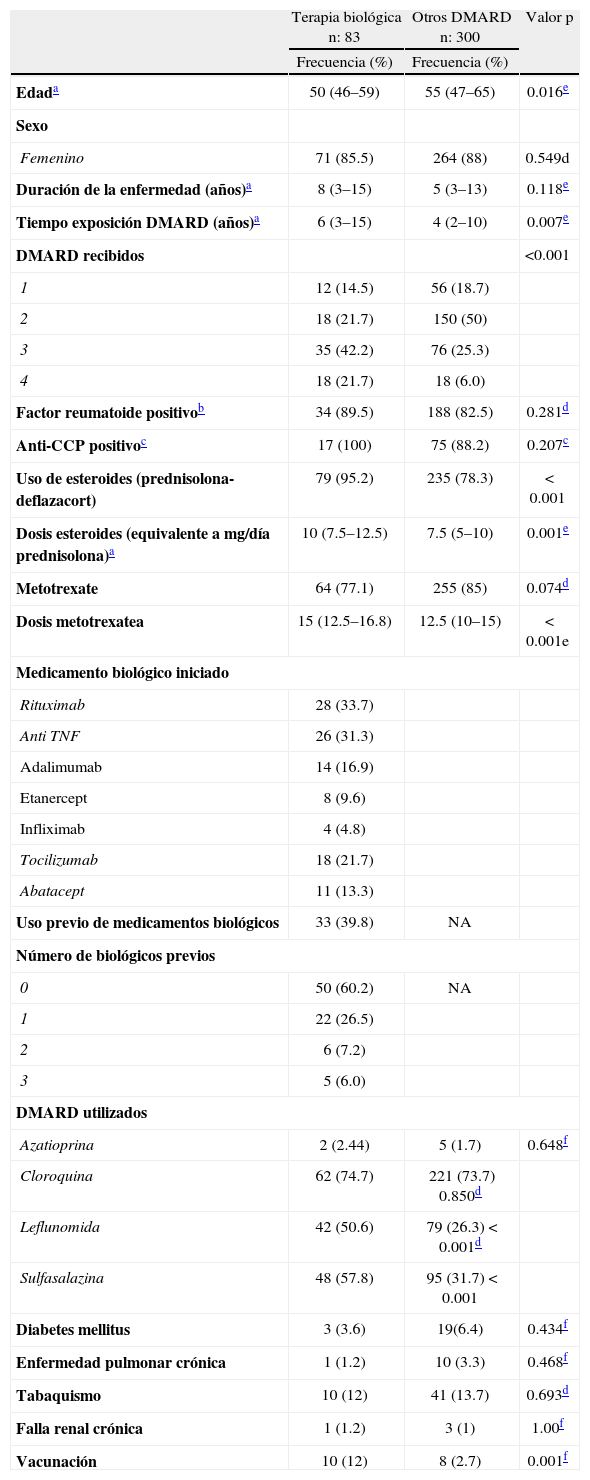
Características basalesEn la tabla 1 se muestran las características basales según el tipo de terapia recibida, así como la distribución de los pacientes según el tipo de biológico o DMARD utilizado.
Características clínicas basales de pacientes con artritis reumatoide
| Terapia biológica n: 83 | Otros DMARD n: 300 | Valor p | |
| Frecuencia (%) | Frecuencia (%) | ||
| Edada | 50 (46–59) | 55 (47–65) | 0.016e |
| Sexo | |||
| Femenino | 71 (85.5) | 264 (88) | 0.549d |
| Duración de la enfermedad (años)a | 8 (3–15) | 5 (3–13) | 0.118e |
| Tiempo exposición DMARD (años)a | 6 (3–15) | 4 (2–10) | 0.007e |
| DMARD recibidos | <0.001 | ||
| 1 | 12 (14.5) | 56 (18.7) | |
| 2 | 18 (21.7) | 150 (50) | |
| 3 | 35 (42.2) | 76 (25.3) | |
| 4 | 18 (21.7) | 18 (6.0) | |
| Factor reumatoide positivob | 34 (89.5) | 188 (82.5) | 0.281d |
| Anti-CCP positivoc | 17 (100) | 75 (88.2) | 0.207c |
| Uso de esteroides (prednisolona-deflazacort) | 79 (95.2) | 235 (78.3) | < 0.001 |
| Dosis esteroides (equivalente a mg/día prednisolona)a | 10 (7.5–12.5) | 7.5 (5–10) | 0.001e |
| Metotrexate | 64 (77.1) | 255 (85) | 0.074d |
| Dosis metotrexatea | 15 (12.5–16.8) | 12.5 (10–15) | < 0.001e |
| Medicamento biológico iniciado | |||
| Rituximab | 28 (33.7) | ||
| Anti TNF | 26 (31.3) | ||
| Adalimumab | 14 (16.9) | ||
| Etanercept | 8 (9.6) | ||
| Infliximab | 4 (4.8) | ||
| Tocilizumab | 18 (21.7) | ||
| Abatacept | 11 (13.3) | ||
| Uso previo de medicamentos biológicos | 33 (39.8) | NA | |
| Número de biológicos previos | |||
| 0 | 50 (60.2) | NA | |
| 1 | 22 (26.5) | ||
| 2 | 6 (7.2) | ||
| 3 | 5 (6.0) | ||
| DMARD utilizados | |||
| Azatioprina | 2 (2.44) | 5 (1.7) | 0.648f |
| Cloroquina | 62 (74.7) | 221 (73.7) 0.850d | |
| Leflunomida | 42 (50.6) | 79 (26.3) < 0.001d | |
| Sulfasalazina | 48 (57.8) | 95 (31.7) < 0.001 | |
| Diabetes mellitus | 3 (3.6) | 19(6.4) | 0.434f |
| Enfermedad pulmonar crónica | 1 (1.2) | 10 (3.3) | 0.468f |
| Tabaquismo | 10 (12) | 41 (13.7) | 0.693d |
| Falla renal crónica | 1 (1.2) | 3 (1) | 1.00f |
| Vacunación | 10 (12) | 8 (2.7) | 0.001f |
La mayoría de los pacientes en ambos grupos eran mujeres (85%), con una mediana de edad de 50 años (RIQ 46–59) en el grupo de biológicos y 55 años (RIQ: 47–65) en el grupo DMARD (p= 0.016). La mediana de tiempo de exposición a DMARD fue mayor en el grupo de biológicos (6 años; RIQ: 3–14.75) versus el grupo DMARD (4 años; RIQ: 2–10); p= 0.007). Igualmente, el número de DMARD recibidos también fue mayor en el grupo de biológicos (p<0.001). Un mayor número de individuos en el grupo de biológicos: 79 (85%) vs. 235 (78.3%) (p<0.001) usaron esteroides; la dosis en miligramos de prednisolona por día o su equivalente también fue mayor en los pacientes del grupo de biológicos: 10 (7.5–12.5) vs. 7.5 (5–10); p= 0.001.
Los pacientes de ambos grupos recibían metotrexate en proporciones similares: 64 (77.1%) en el grupo de biológicos vs. 255 (85%) en el grupo DMARD (p=0.074); sin embargo, la dosis fue mayor en el grupo de biológicos: 15 mg semanales (12.5–16.8) vs. 12.5 (10–15) en el grupo DMARD (p< 0.001). Proporcionalmente, más pacientes en el grupo de biológicos habían recibido leflunomida y sulfasalazina. En el grupo de biológicos, sólo 10 individuos (12%) recibieron vacunación contra influenza y neumococo previo al inicio del tratamiento; en el grupo DMARD, sólo 8 sujetos (2.7%) estaban vacunados. Las demás características fueron similares entre ambos grupos (tabla 1).
Tamización y tratamiento para tuberculosis latente en el grupo de biológicosA 62 de los 83 pacientes (74.7%) del grupo de biológicos se les realizó tamización para TB latente con prueba de tuberculina. La mediana de induración fue 0 mm (RIQ 0–6.5); 17 individuos tuvieron una tuberculina mayor de 5 mm; de éstos sólo 8 recibieron tratamiento para TB latente con isoniazida, 300mg/día, por 9 meses, iniciando el biológico 4 semanas después. De los 9 pacientes restantes, 2 tenían antecedente personal de tuberculosis (uno miliar y el otro en oído medio) y los 7 restantes no recibieron tratamiento para TB latente porque recibieron rituximab y abatacept; para la fecha de inicio de terapia, las recomendaciones vigentes no consideraban necesario realizar esta tamización, por la baja probabilidad de reactivación de TB asociada a estos fármacos. Adicionalmente, a 69 (79.5%) de los pacientes en el grupo de biológicos se les realizó radiografía del tórax; 4 (6.1%) tenían hallazgos compatibles con TB latente y fueron tratados.
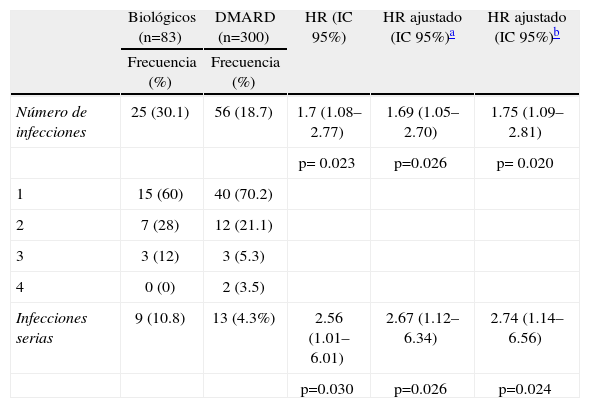
InfeccionesDurante el período de seguimiento, se presentaron infecciones en 25 pacientes (30.1%) del grupo de biológicos y en 56 sujetos (18.7%) en el grupo DMARD [HR 1.73 (IC 95%, 1.08–2.77; p= 0.023)]. La mayor parte de los pacientes tuvo un único episodio de infección: 15 (60%) en el grupo de biológicos vs. 40 (70.2%) en el grupo DMARD. Nueve pacientes (10.8%) en el grupo de biológicos y 13 individuos (4.3%) en el grupo DMARD desarrollaron una infección seria [HR 2.56, (IC 95% 1.01–6.01; p=0.030) (tabla 2).
Infecciones en pacientes con artritis reumatoide durante un año de seguimiento
| Biológicos (n=83) | DMARD (n=300) | HR (IC 95%) | HR ajustado (IC 95%)a | HR ajustado (IC 95%)b | |
| Frecuencia (%) | Frecuencia (%) | ||||
| Número de infecciones | 25 (30.1) | 56 (18.7) | 1.7 (1.08–2.77) | 1.69 (1.05–2.70) | 1.75 (1.09–2.81) |
| p= 0.023 | p=0.026 | p= 0.020 | |||
| 1 | 15 (60) | 40 (70.2) | |||
| 2 | 7 (28) | 12 (21.1) | |||
| 3 | 3 (12) | 3 (5.3) | |||
| 4 | 0 (0) | 2 (3.5) | |||
| Infecciones serias | 9 (10.8) | 13 (4.3%) | 2.56 (1.01–6.01) | 2.67 (1.12–6.34) | 2.74 (1.14–6.56) |
| p=0.030 | p=0.026 | p=0.024 |
DMARD: fármacos antirreumáticos modificadores de la enfermedad; HR: hazard ratio; IC: intervalo de confianza.
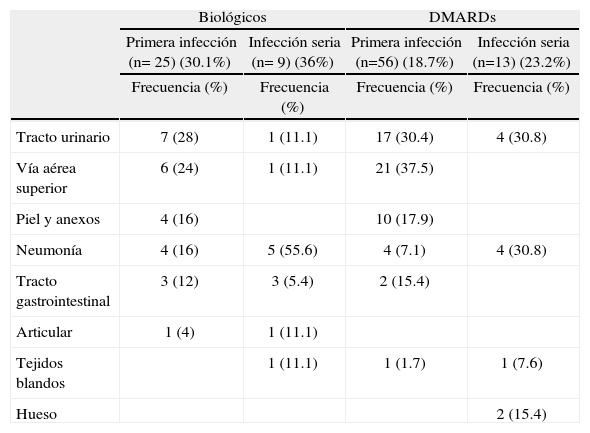
Durante el primer episodio de infección, en la mayoría de los pacientes no fue posible identificar el germen asociado, debiéndose utilizar criterios clínicos, paraclínicos e imaginológicos. La distribución de los sistemas u órganos comprometidos según el grupo estudiado se muestra en la tabla 3.
Órgano o sistema comprometido en primera infección/infección seria en un grupo de pacientes con artritis reumatoide durante 12 meses de seguimiento
| Biológicos | DMARDs | |||
| Primera infección (n= 25) (30.1%) | Infección seria (n= 9) (36%) | Primera infección (n=56) (18.7%) | Infección seria (n=13) (23.2%) | |
| Frecuencia (%) | Frecuencia (%) | Frecuencia (%) | Frecuencia (%) | |
| Tracto urinario | 7 (28) | 1 (11.1) | 17 (30.4) | 4 (30.8) |
| Vía aérea superior | 6 (24) | 1 (11.1) | 21 (37.5) | |
| Piel y anexos | 4 (16) | 10 (17.9) | ||
| Neumonía | 4 (16) | 5 (55.6) | 4 (7.1) | 4 (30.8) |
| Tracto gastrointestinal | 3 (12) | 3 (5.4) | 2 (15.4) | |
| Articular | 1 (4) | 1 (11.1) | ||
| Tejidos blandos | 1 (11.1) | 1 (1.7) | 1 (7.6) | |
| Hueso | 2 (15.4) | |||
En el grupo de biológicos, 11 infecciones (44%) se presentaron en pacientes con tratamiento anti-TNF [adalimumab (n=8); etanercept (n=3)]; el resto de las infecciones se distribuyeron así: rituximab (n=6; 24%), tocilizumab (n=5; 20%) y abatacept (n=3; 12%). El tiempo para la ocurrencia del primer episodio de infección se distribuyó, en este grupo, de la siguiente manera: 10 infecciones (40%) después de 6 meses de inicio, 8 (32%) entre 3 y 6 meses, 5 (20%) entre 1 y 3 meses y 2 episodios (8%) durante el primer mes de terapia.
Infecciones seriasOcurrieron 9 episodios en el grupo de biológicos: neumonía (n=4), infección de tracto urinario, sinusitis, infección de tejidos blandos, tuberculosis y artritis séptica (cada una en un paciente); 6 gérmenes no pudieron ser identificados, y se presentó infección por Staphylococcus aureus, Mycobacterium tuberculosis y Klebsiella pneumoniae (cada una en un paciente). En cuanto al grupo DMARD, de las 13 infecciones serias, 4 (30.7%) fueron infecciones de tracto urinario, seguidas de 2 episodios (15.3%) de osteomielitis e infecciones de tracto gastrointestinal. Se documentaron 4 (30.7%) infecciones por Escherichia coli; en 3 episodios, el germen no pudo ser identificado; 2 infecciones por Staphylococcus aureus; una infección por Mycobacterium tuberculosis, Pseudomonas aeruginosa, Proteus mirabilis y Entamoeba histolytica (cada una en un paciente) (tabla 3).
En el grupo de biológicos, las infecciones serias se desarrollaron, principalmente, 6 meses después de iniciado el medicamento (n=6); el resto ocurrieron: durante el primer mes, entre 1 y 3 meses y entre 3 y 6 meses (un episodio en cada período).
Las infecciones específicas se presentaron así: neumonía (n=1) en el primer mes; infección de tejidos blandos (n=1) entre 1 y 3 meses; neumonía (n=1) entre 3 y 6 meses; neumonía (n=2), sinusitis, tuberculosis pulmonar, artritis séptica e infección de tracto urinario (cada una un caso) después de los 6 meses. Según el biológico específico, los episodios ocurrieron así: tocilizumab (n=3), adalimumab (n=2), rituximab (n=2), etanercept (n=1), abatacept (n=1). Los pacientes que recibieron infliximab no tuvieron infecciones serias o no serias.
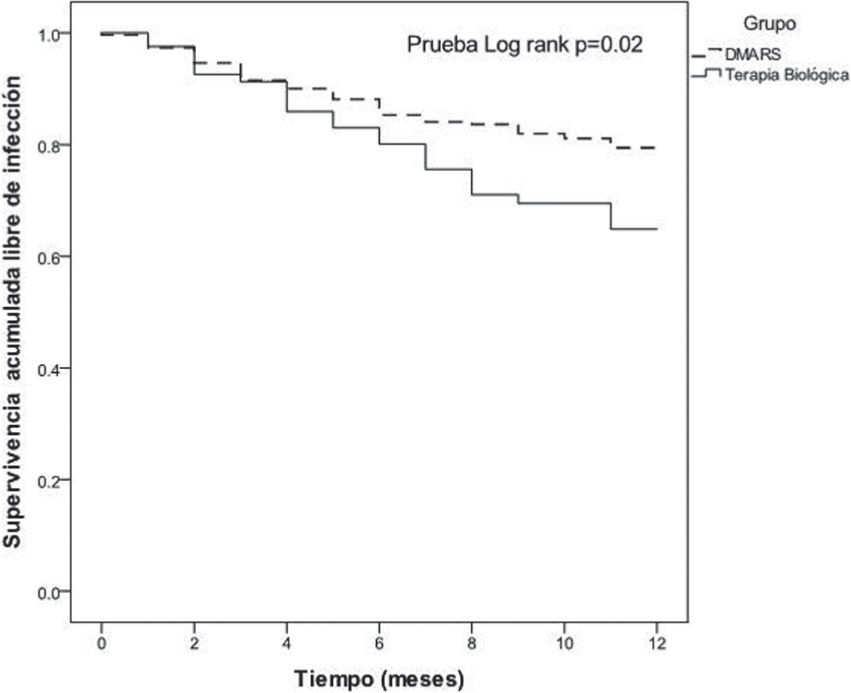
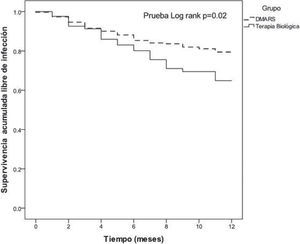
Durante el año de seguimiento, la supervivencia libre de infección fue de 64.8% en los pacientes del grupo de biológicos y de 78.8% en el grupo DMARD (Log Rank: 0.02) (fig. 1). La supervivencia libre de infección seria para los sujetos en el grupo de biológicos fue de 86.9% y 94.9% en el grupo DMARD (Log Rank: 0.058). No se demostró diferencia en la supervivencia libre de infección en los individuos que utilizaron leflunomida, esteroides, diabéticos, ni con enfermedad pulmonar crónica.
Otros factores clínicos asociados a infecciónEn la cohorte completa, 22 pacientes tenían diabetes mellitus; de éstos, 5 (22.7%) presentaron infección, versus 75 sujetos (20.8%) de los pacientes no diabéticos (p= 0.790). Los sujetos con enfermedad pulmonar crónica y tabaquismo activo no presentaron más eventos infecciosos que los pacientes sin estas comorbilidades.
Al momento de la inclusión, 121 de los 383 individuos recibían tratamiento con leflunomida, siendo proporcionalmente mayor en el grupo de biológicos (50.6% vs. 26.3%; p<0.001). Treinta y tres de los pacientes con uso de este medicamento (27.3%) versus 48 de los que no lo habían recibido (18.3%), presentaron alguna infección (p= 0.046).
Utilizando el modelo de regresión de Cox, el uso de biológicos fue un factor de riesgo independiente para el desarrollo de la primera infección [HR 1.69 (IC 95%1.05–2.7; p= 0.026)] ajustando por el uso de metotrexate, leflunomida, esteroides, antecedentes de diabetes, enfermedad pulmonar y por el número de DMARD recibidos o ajustando por los mismos factores, incluyendo el tiempo de exposición a DMARD [HR 1.75 (IC 95%1.09–2.81; p= 0.020)]. Cuando se evaluó la relación entre el uso de biológicos y la aparición de infecciones serias ajustando por estas mismas variables, se observó un comportamiento similar (tabla 2); sin embargo, se identificó la presencia de enfermedad pulmonar crónica como factor de riesgo asociado a infección seria [HR 5.11 (IC 95% 1.18–22.08; p=0.029)], siendo este hallazgo independiente de la terapia utilizada.
DiscusiónEl principal hallazgo de este estudio fue que la terapia con biológicos aumenta el riesgo de infecciones serias y no serias a 12 meses, en comparación con fármacos modificadores, en un grupo de pacientes con artritis reumatoide de un centro de alta complejidad de reumatología del noroccidente colombiano; además, se encontró aumento del riesgo de infecciones serias con la presencia de enfermedad pulmonar crónica.
Concordante con el comportamiento epidemiológico de la AR, la mayor parte de los pacientes en ambos grupos eran de sexo femenino, con una edad promedio similar. La mayor parte de las características clínicas basales de los pacientes fueron similares. Los pacientes en el grupo de biológicos tenían mayor duración de la enfermedad, habían estado expuestos a un mayor número de DMARD, usaron más esteroides a dosis más altas y utilizaban una dosis mayor de metotrexate. Lo anterior puede explicarse porque, en general, los biológicos se indican a los pacientes con enfermedad más grave y refractaria.
La vacunación contra influenza y neumococo fue baja en ambos grupos de pacientes, hecho que debe generar una alerta y reflexión al respecto, para buscar estrategias para mejorar en este tópico, no sólo en los individuos con biológicos, sino en todos los pacientes con AR, teniendo en cuenta que la enfermedad per se aumenta el riesgo de infección. Las recomendaciones de la Liga Europea contra el Reumatismo (EULAR) para vacunación en pacientes adultos con enfermedades reumatológicas inflamatorias autoinmunes17 recomiendan fuertemente el uso de estas dos vacunas, ya que está demostrado el mayor riesgo de muerte por estas infecciones pulmonares en este subgrupo de pacientes, comparados con la población general, además de reducir las admisiones hospitalarias por estas causas en pacientes adultos mayores; además, su eficacia está demostrada en estos individuos aun cuando reciban tratamiento con biológicos o DMARDs. Otros autores, por el contrario17, sostienen que el uso de vacunas en estos sujetos genera riesgo de activación de la enfermedad; por este hecho, algunos proponen que la vacunación en individuos con enfermedades autoinmunes debe hacerse cuando exista quiescencia clínica17.
Similar a lo observado en estudios anteriores7, un tercio de los pacientes (30.1%) en tratamiento con terapias biológicas anticitoquinas presentó un episodio de infección; y, semejante a lo observado en estas cohortes, predominaron las infecciones respiratorias, urinarias y cutáneas. Se encontró que el tratamiento con biológicos aumenta 1.73 veces el riesgo de un primer episodio de infección y 2.56 veces el riesgo de infección seria, en comparación con la terapia con DMARD.
Ventura-Ríos et al.18 reportaron, en 2012, la sobrevida al tratamiento y los eventos adversos relacionados con la terapia biológica en pacientes mexicanos, a través de un estudio multicéntrico ambispectivo de 2.047 pacientes; los pacientes con AR representaron 79.09% del total; el evento adverso más frecuente fue la presencia de infecciones (43.40%), observándose un incremento en el riesgo (RR 2,05; IC del 95%, 1,5–2,7; p < 0,0001) en los pacientes que recibieron terapia biológica, comparados con un grupo control; en 71,96% el germen no fue identificado.
Komano et al.19 compararon el riesgo de infecciones graves en pacientes japoneses con AR usuarios de anti-TNF comparados con DMARD, pertenecientes a un registro prospectivo de una cohorte hospitalaria de 1.144 sujetos; encontraron que el riesgo relativo crudo de infecciones graves en el primer año, en el grupo de biológicos, fue superior que en el grupo de DMARD: 2.43 (95% CI 1.27–4.65); el uso de anti-TNF fue un factor independiente para este desenlace (RR 2.37, 95% CI 1.11–5.05, p = 0.026).
Aunque en el presente estudio se observó una relación entre el uso de biológicos y el desarrollo de infecciones, no es posible establecer cuál biológico en particular aumenta más el riesgo de infección, debido a las limitaciones del diseño retrospectivo y del número reducido de pacientes tratados con cada uno de los agentes. Es motivo de controversia en cuál periodo posterior al inicio de terapia biológica se aumenta el riesgo de infección; a diferencia de observaciones previas9,10, la mayoría de las infecciones e infecciones serias en esta serie se presentaron 6 meses después de iniciada la terapia con biológicos.
Los pacientes con terapia biológica recibían proporcionalmente más leflunomida que los pacientes tratados con DMARD y el análisis univariado sugirió que este medicamento se asociaba a más episodios de infección, pero este hallazgo no se confirmó en la regresión de Cox; la supervivencia libre de infección y de infección seria no se modificaron luego de ajustar por esta variable. Un estudio realizado en Corea del Sur ya había sugerido el aumento de infecciones en pacientes tratados con leflunomida, asociados a edad más avanzada y con historia de diabetes mellitus20.
Las variables clínicas identificadas en la literatura como factores de riesgo para infección no fueron asociadas de manera significativa con los desenlaces de este estudio, excepto la enfermedad pulmonar crónica, la cual se asoció con aumento de riesgo de infecciones serias. Este hallazgo fue descrito por Gottenberg et al.21, quienes encuentran que la enfermedad pulmonar crónica y la insuficiencia cardíaca (OR 3.0 [IC 95% 1.3–7.3]; p=0.01), el compromiso extraarticular y los bajos niveles de IgG antes del inicio de rituximab, se asociaron significativamente al riesgo de infecciones graves. Desafortunadamente, no pudimos obtener información de manifestaciones extraarticulares, porque no aparecían de ma nera explícita en los registros.
Este estudio tiene las limitaciones propias de un estudio retrospectivo, como son: los posibles sesgos de información, ya que se pretende reconstruir la historia de una cohorte de pacientes a partir de información que en su momento fue registrada para otros fines ajenos a este estudio, lo que afecta la disponibilidad y calidad de los datos, incrementando las pérdidas de información. Sin embargo, se utilizaron estrategias y un control estricto en el proceso de revisión de registros para disminuir en cierta forma estos sesgos. Una de estas estrategias fue analizar las infecciones durante el primer año de seguimiento, tiempo en el que, aunque hubo pérdidas, éstas fueron menores al 20% y similares entre los grupos evaluados. Aunque sólo fue posible evaluar esta cohorte por un año, la población es similar a otras cohortes de AR establecida con una enfermedad de larga evolución.
En conclusión, el uso de terapia biológica confiere un aumento del riesgo de infecciones serias y no serias, significativamente mayor que los DMARD, en una población colombiana con artritis reumatoide establecida y de larga evolución. Las infecciones serias más frecuentes en el grupo de biológicos fueron la neumonía y las infecciones urinarias y en el grupo de DMARD las infecciones urinarias. Las infecciones por gérmenes oportunistas fueron poco frecuentes; la enfermedad pulmonar crónica confiere un riesgo adicional de desarrollar infecciones en los pacientes con AR.
FinanciaciónRecursos propios. Este trabajo no fue soportado por alguna beca o por fondos de la industria farmacéutica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosHospital Pablo Tobón Uribe. Escuela de Ciencias de la Salud Universidad Pontificia Bolivariana. Medellín, Colombia.