La alopecia areata (AA) es una enfermedad autoinmune que genera pérdida no cicatrizal de cabello con diferentes grados de afectación, incluyendo la pérdida total de los tallos pilosos. A pesar de ser una entidad benigna, tiene un gran impacto en el ámbito emocional y psicosocial de los pacientes. En la actualidad, se dispone de una amplia variedad de tratamientos tanto tópicos como orales. Se presenta el caso de una paciente de 24 años, con alopecia areata recurrente severa, sin respuesta a múltiples tratamientos previamente prescritos, en quien se descartó una causa secundaria y se confirmó diagnóstico histológico con biopsia. Se inició tratamiento con tofacitinib, un inhibidor de la JAK, con una excelente respuesta clínica al mes de iniciado el tratamiento.
Alopecia areata (AA) is an autoimmune disease that generates non-scar loss of hair with varying degrees of involvement, including total loss of hair follicles. Despite being a benign entity, it has a great impact on the emotional and psychosocial life of patients. A wide variety of topical and oral treatments are currently available. We present the case of a 24-year-old patient with severe recurrent alopecia areata without response to multiple previous treatments, in which a secondary cause was ruled out and the histological diagnosis was confirmed with biopsy. Treatment with tofacitinib, a JAK inhibitor, was started, showing an excellent clinical response after one month of treatment.
La alopecia areata (AA) es una enfermedad autoinmune que genera una pérdida no cicatrizal de cabello, puede comprender desde la afectación de áreas circunscritas de cabello (alopecia en parches), la pérdida total en la piel cabelluda (alopecia totalis), hasta la pérdida total de tallos pilosos terminales (alopecia universalis). Afecta del 1 al 2% de la población mundial, con igual predilección por hombres o mujeres1. Se considera que tiene una etiología multifactorial y se ha reportado su asociación con múltiples entidades mediadas por inflamación, como el liquen plano, la esclerosis sistémica, el vitíligo, la dermatitis atópica, la rinitis alérgica, la colitis ulcerativa, la tiroiditis de Hashimoto y el lupus eritematoso sistémico, entre otras2–4, y con trastornos psiquiátricos, principalmente del estado de ánimo y ansiedad5.
Aunque se considera una entidad benigna, puede tener un alto impacto emocional y en la esfera psicosocial6. El tratamiento depende de la extensión de la enfermedad; en la actualidad se cuenta con múltiples ayudas farmacológicas como corticosteroides tópicos, orales o intralesionales, minoxidil tópico y, en casos más severos, inmunoterapia tópica o inhibidores de la cinasa Janus (JAK) como el tofacitinib, el ruxolitinib y el baricitinib7. Se presenta el caso de una paciente con AA severa tratada con tofacitinib, quien mostró una notable mejoría en el primer mes de tratamiento.
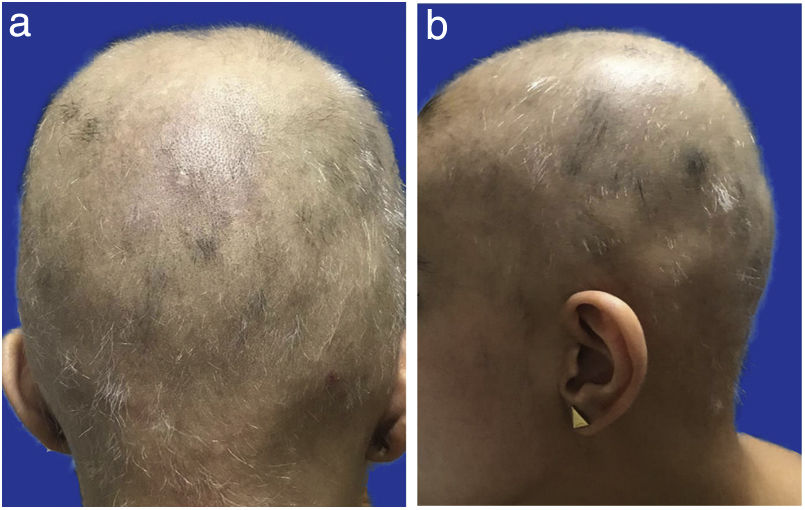
Presentación del casoPaciente femenina, de 24 años, quien se presenta a la consulta de reumatología con cuadro clínico de cuatro años de zonas alopécicas mal definidas que se extienden por todo el cuero cabelludo, recurrentes, manejadas con múltiples tratamientos que incluyen minoxidil loción 5%, clobetasol loción 0,05%, corticoides orales a dosis variables entre 5 y 20mg/día, corticoides intralesionales durante dos años, finasterida 1mg/día y crioterapia tres sesiones, sin mejoría y con rápida progresión hasta comprometer la totalidad del cuero cabelludo (fig. 1a y b). La piel subyacente era lisa, sin cambios de color o consistencia ni cicatrices; no había compromiso de cejas ni del resto de los tallos pilosos corporales. A la revisión por sistemas, la paciente manifestó episodios de inyección conjuntival con epífora, poliartralgias sin sinovitis, debilidad muscular, parestesias en manos y pies, e insomnio de conciliación; negó úlceras orales, fenómeno de Raynaud, síntomas gastrointestinales, urinarios o lesiones en piel.
No había antecedentes familiares de AA ni enfermedades reumatológicas. Durante el examen físico de la consulta se observaron zonas alopécicas mal definidas que se extendían por todo el cuero cabelludo, no se documentó compromiso ungular, debilidad muscular, compromiso ocular, otorrinolaringológico, déficit neurológico ni otros hallazgos. Los exámenes de laboratorio, que incluyeron hemograma, transaminasas, glucemia, uroanálisis, proteína C reactiva (PCR), vitamina B12, perfil de ferrocinética, creatina-cinasa (CPK), hormona estimulante de tiroides (TSH), serología para hepatitis B, C, VIH, VDRL, anticuerpos extractables del núcleo (ENA), anticuerpos antifosfolípidos, radiografía de tórax y huesos largos, tomografía de cráneo y cultivo de hongos de cuero cabelludo, fueron normales, mientras que se documentaron anticuerpos antinucleares (ANA) positivos 1:160 patrón moteado.
Se sospechó AA de origen primario, se tomó biopsia de cuero cabelludo por parte de dermatología, y se encontró una disminución en el conteo de folículos terminales, con infiltrados inflamatorios linfoides alrededor del segmento inferior de los folículos pilosos (figs. 2 y 3), lo que confirma el diagnóstico. Debido a la severidad del compromiso y los tratamientos previos fallidos, se prescribió tofacitinib a dosis de 11mg por día (presentación de liberación extendida), y al mes de tratamiento se observó una notable mejoría, con repoblamiento del 80% del cuero cabelludo con tallos terminales sanos y de grosor normal (figs. 4–6). Después de seis meses de tratamiento, tomando la medicación actual, la paciente persistía sin zonas alopécicas.
La AA es una entidad que a pesar de no tener una amplia prevalencia y sí un curso benigno, su importancia radica en la alta carga emocional y social que se asocia a los pacientes que la presentan6,8. En la mayoría de los casos su origen es primario, aunque también se ha documentado como manifestación clínica de otras entidades patológicas mediadas por inflamación y endocrinas2–4; por tanto, con fines terapéuticos, ante su presencia, y solo si la anamnesis o el examen físico lo sugieren, se deberá estudiar una posible causa secundaria subyacente. En nuestra paciente, a pesar de que había algunos síntomas relatados en la revisión por sistemas, no se logró documentar una causa secundaria, no presentaba hallazgos al examen físico que la sugirieran y los estudios de extensión fueron normales. Como único hallazgo, se registró una elevación de los ANA, los cuales se ha reportado en la literatura que pueden estar elevados en esta población, inclusive a títulos como los de nuestra paciente, fenómeno que se ha observado especialmente en mujeres4,9,10.
Existen múltiples opciones terapéuticas para esta entidad, varias de ellas utilizadas por la paciente, sin mejoría alguna. Dentro de los tratamientos actuales se cuenta con corticoides tópicos, especialmente de alta potencia; orales a dosis altas; e intralesionales, preferibles en aquellos pacientes con alopecia en parches limitada o con afectación menor del 50% del cuero cabelludo. Para aquellos pacientes con mayor extensión comprometida, se prefiere inmunoterapia tópica con agentes como el dinitrobenzeno (DNCB), el ácido escuárico dibutilester (SADBE) o difenilciclopropenona (DPCP), los cuales han mostrado buena efectividad en pacientes con alopecia en parches extensa, aunque dichos beneficios son menores en pacientes con alopecia totalis7,11.
Gracias a que se entiende mejor la fisiopatología de esta entidad, como también al descubrimiento del importante papel que desempeña la activación de los linfocitos T citotóxicos – CD8+, los cuales son necesarios y suficientes para desencadenar la enfermedad mediante vías inflamatorias que implican respuesta a interferón gamma y señalización a través de JAK12, se han estudiado los inhibidores de JAK, dentro de los que se encuentran el tofacitinib, el ruxolitinib y el baricitinib, usados especialmente en pacientes con casos severos13. La eficacia de estos medicamentos ha sido reportada en diferentes casos y estudios hasta la fecha, con el más reciente metaanálisis con revisión sistémica que incluyó 30 estudios y 289 casos de pacientes tratados con inhibidores de JAK, en los que se observó un 72,4% de respuesta y un 45,7% de los pacientes con una respuesta mayor del 50%, así como un promedio de 2,2 meses de tratamiento para obtener dicha respuesta. En los pacientes con alopecia totalis o universal14 se requirió mayor duración, dato que concuerda con el caso de nuestra paciente, la cual presentó una respuesta mayor del 80% en el primer mes de tratamiento.
En cuanto al tofacitinib, en el 2014 se reportó el primer caso exitoso de tratamiento en un paciente con psoriasis15. En un estudio de 66 pacientes tratados con 5mg de tofacitinib, en el 32% de estos se observó una mejoría superior al 50%16. En otro estudio, de 90 pacientes con diversos grados de afectación, el 77% tuvo respuesta al tratamiento con tofacitinib, y de estos el 58% tuvo una respuesta mayor del 50%17. En el 2018, en un estudio abierto de 12 pacientes con alopecia moderada y severa, se administró tofacitinib 5mg, y la dosis aumentó hasta 10mg en aquellos no respondedores; se observó respuesta en 11 de los pacientes, ocho de ellos con una respuesta mayor del 50%18. En nuestro caso, este sería el primer reporte en Colombia sobre el uso de tofacitinib en un paciente con AA.
ConclusiónLa AA y sus variantes son una patología con un alto impacto en la calidad de vida de los pacientes y en ocasiones puede presentarse resistencia y recaídas a pesar del uso de múltiples tratamientos. Hoy existe importante evidencia sobre el uso de los inhibidores de la JAK en esta entidad, especialmente en casos de difícil control. Nuestro caso es el primero reportado en la literatura sobre el uso exitoso de tofacitinib en una paciente con AA en Colombia.
Consideraciones éticasSe solicitó el consentimiento informado y la investigación cumple con la normativa vigente de bioética.
FinanciaciónNinguna.
Conflicto de interesesNinguno.
A la Dra. Julia Inés Mesa Villegas, médica especialista en Dermatología y Dermatopatología, por la realización de las imágenes histológicas y por su interpretación de estas.