La esclerosis de Monckeberg es una enfermedad de baja prevalencia y causa desconocida, en la cual arterias de mediano y pequeño calibre sufren calcificación de la capa media generándose una reducción de la luz.
Suele manifestarse por la aparición de úlceras de tipo arterial en la piel de extremidades superiores e inferiores. Su diagnóstico requiere de estudios histopatológicos, con diagnósticos diferenciales como la poliarteritis nodosa y la arteritis de células gigantes. No existen guías de tratamiento, se han propuesto quelantes de calcio como el tiosulfato de sodio, pero los pocos estudios disponibles no han logrado demostrar resultados significativos.
Monckeberg's sclerosis is a rare and low prevalence disease of unknown cause in which small and medium size arteries suffer calcification of the middle layer, leading to a reduction in calibre.
Clinically, the disease manifests by the appearance of arterial type ulcers on the skin of upper and lower extremities. Its diagnosis is difficult, and requires histopathological studies. Some rheumatic conditions, such as polyarteritis nodosa and giant cell arteritis may mimic this process. Treatment of the disease is not well established. Although the use of calcium chelators such as sodium thiosulfate has been proposed, the few available studies have failed to show significant results.
Descrita por primera vez en 1903 por Johann Georg Mönckeberg1, se trata de una enfermedad de etiología desconocida, que consiste en la calcificación media de las arterias. Esta calcificación generalmente es circunferencial y puede afectar el vaso de forma focal o difusa2. Su incidencia es mayor en diabéticos y en personas de edad avanzada, y su aparición predice el riesgo de enfermedades vasculares cardíacas y periféricas, aumentando el índice de amputaciones de extremidades3.
Su fisiopatología es poco clara, se cree que la lesión se produciría por degeneración grasa de las células musculares lisas de la capa media, formando una masa que sufre una degeneración hialina y luego se calcifica. En general, la repercusión clínica es escasa porque la reducción de la luz es mínima, a menos que se sobreponga junto a un proceso de aterosclerosis, donde las manifestaciones clínicas se hacen más evidentes y graves4,5.
A continuación se reporta el caso de una paciente con múltiples complicaciones de la esclerosis de Monckeberg, que simula una vasculitis de medianos vasos, y se realiza una revisión de la literatura.
Reporte de casoMujer de 46 años con antecedente de hipertensión arterial y DM tipo 2 desde los 22 años, con mal control metabólico demostrado por una HbA1C de 11%, sin adecuada adherencia al tratamiento médico y seguimiento clínico, y además con enfermedad renal crónica estadio 5, en los últimos 4 años, con requerimiento de terapia de reemplazo renal tipo hemodiálisis, sin antecedente de dislipidemia asociada.
Ingresó a hospital de tercer nivel de complejidad de la ciudad de Medellín, Colombia, por 6 meses de alteración de la sensibilidad de las 4 extremidades, fenómeno de Raynaud, pérdida de peso y dolor abdominal, con fiebre subjetiva previa al ingreso. Se encontraron úlceras necróticas en falanges distales de miembros superiores y un soplo cardíaco holosistólico en foco aórtico. De relevancia presentaba serologías para hepatitis B, hepatitis C, VIH y VDRL negativos, anticuerpos antinucleares, anti-dsDNA, anticuerpos anticitoplasma de neutrófilos, anticuerpos antinucleares extractables, IgG e IgM anticardiolipina, anti-B2 glicoproteína y factor reumatoide negativos. El complemento y la electroforesis de proteínas eran normales. El calcio corregido era de 9,6mg/dl y el fósforo sérico de 5,4mg/dl, para lo cual recibía manejo con carbonato de calcio 1.800mg al día.
Se realizó electromiografía más velocidades de conducción de las 4 extremidades, evidenciando una polineuropatía sensitivo-motora axonal crónica, denervación con potenciales de acción de unidades motoras de amplitud aumentada y reclutamiento neuropático en músculos distales. Se realizó ecocardiograma transesofágico que reportó trastornos segmentarios de la contractilidad y valvas sin presencia de vegetaciones, pero con múltiples placas ateromatosas en todo el trayecto de la aorta.
Se llevó a cateterismo cardíaco por la alta sospecha de vasculitis de medianos vasos con compromiso miocárdico, encontrando una estenosis del tercio medio y tercio distal de la arteria descendente anterior con estenosis del 65% en su ramificación larga, por lo cual cardiología consideró de manejo médico.
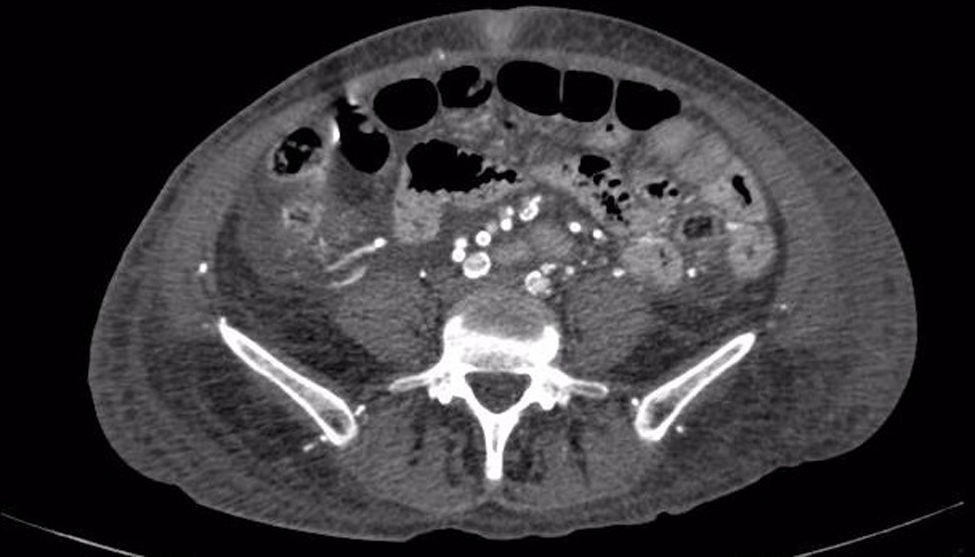
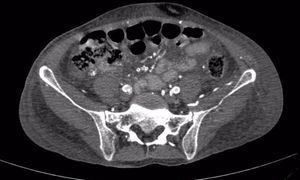
La paciente se deterioraba clínicamente, con inestabilidad hemodinámica a pesar del manejo, empeoramiento de las lesiones digitales asociadas a mayor necrosis y dolor intenso, requiriendo infusión de fentanilo para el control sintomático; se realizaron estudios vasculares evidenciando severos cambios ateroscleróticos bilaterales con picos de velocidad entre 50-60cm/s, con mayor compromiso infrapoplíteo, llegando hasta los 18cm/s en doppler de miembros inferiores, con angiotomografía de vasos de tórax y abdomen que evidenciaron importantes calcificaciones en arterias coronarias, aorta abdominal y sus ramas, evidenciadas en la figura 1. Se decidió iniciar tratamiento con bosentán para el manejo de fenómenos vasoespásticos distales y por compromiso multisistémico; se iniciaron pulsos de metilprednisolona ante la sospecha de vasculitis de medianos vasos. Se realizaron biopsias de nervio sural y músculo adyacente, que fueron reportados como normales. Hubo poca respuesta clínica con el manejo, y posteriormente la paciente inició con dificultad respiratoria súbita descartando TEP, pero con hipotensión y fiebre persistente por lo que se realizaron hemocultivos que evidenciaron bacteriemia por Klebsiella pneumoniae, necesitando estancia en unidad de cuidados intensivos para soporte vasopresor y antibióticos dirigidos. La paciente continuó inestable hemodinámicamente, con isquemia importante de miembros inferiores, muy posiblemente empeorado por el uso de vasopresores y estado de hipoperfusión, por lo que requirió finalmente amputación infracondílea del miembro inferior izquierdo.
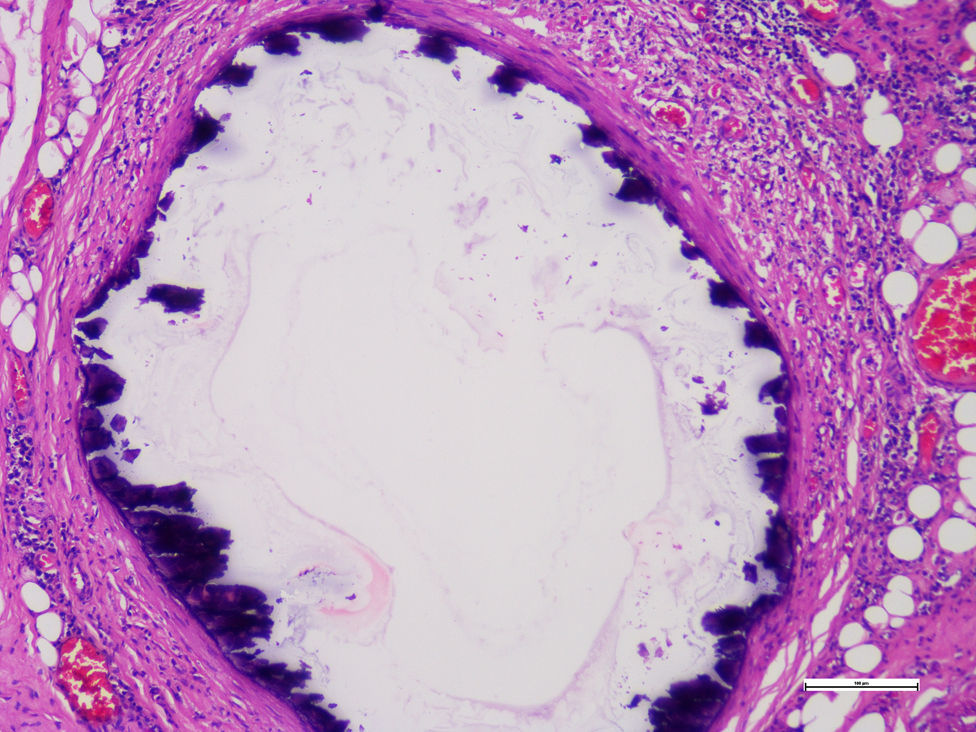
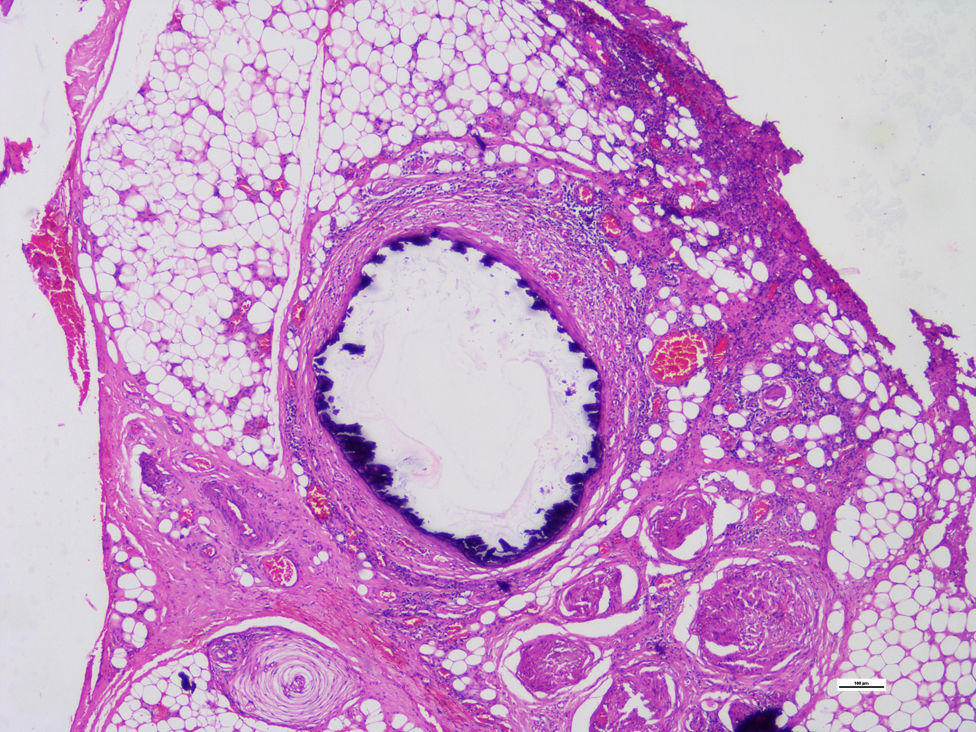
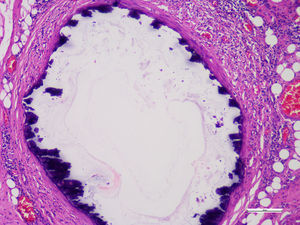
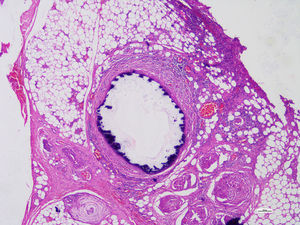
Se realizaron estudios histopatológicos de la extremidad amputada describiendo, en cortes de vasos, células musculares lisas de la capa media, reemplazadas focalmente por tejido fibroso hialinizado que presentaba calcificación distrófica concéntrica y metaplasia ósea asociada a cambios compatibles con enfermedad de Monckeberg (figs. 2 y 3).
La paciente luego de una estancia prolongada en la unidad de cuidados intensivos fue trasladada a hospitalización, donde se inició desmonte de esteroide y 8 días después falleció por falla ventilatoria, para lo que no se realizó necropsia clínica confirmatoria.
DiscusiónLas vasculitis sistémicas son patologías graves y potencialmente mortales, sin embargo, la heterogeneidad de sus manifestaciones clínicas hace difícil un diagnóstico preciso. Es aquí donde cobra importancia una gran lista de etiologías que pueden simular sus características clínicas al momento de hacer diagnósticos diferenciales, dado que de ello dependerá su tratamiento y pronóstico6.
La esclerosis de Monckeberg se encuentra dentro de los diagnósticos diferenciales de las vasculitis, sin embargo, su relevancia clínica ha sido subvalorada por el bajo impacto clínico que se le atribuye y la baja incidencia reportada, considerándose como una condición secundaria a un proceso de depósito de calcio inerte7,8. La amplia relación entre la enfermedad renal crónica y la hiperfosfatemia, en cuanto al depósito de cristales de fosfato cálcico9,10, ocasiona la acumulación de estos minerales en los vasos sanguíneos a nivel de las capas íntima o media1,11. Esto se convierte en una importante comorbilidad para la enfermedad vascular12,13, la cual suele acelerarse a medida que progresa la enfermedad renal14 y aumenta con el requerimiento de hemodiálisis como terapia de reemplazo renal2,15-17. Por esta razón se ha propuesto tradicionalmente que la calcificación vascular media es una consecuencia de un simple depósito de cristales con endurecimiento vascular.
A pesar de lo anterior, estudios fisiopatológicos recientes han sugerido que existen alteraciones inflamatorias y genéticas estrechamente relacionadas con la calcificación media vascular. Se ha descrito cómo el depósito de estos nanocristales es capaz de inducir una plasticidad fenotípica de las células mesenquimales derivadas de las células de músculo liso vasculares, llevándolas a una transdiferenciación tanto in vitro como in vivo, ganando características osteogénicas que se relacionan directamente con calcificación vascular media18. Se ha descrito también cómo la deficiencia de CD73, causada por la mutación del gen CD73 que genera pérdida de su actividad, ocasiona un aumento de la actividad de la fosfatasa alcalina tisular no específica, una proteína clave en la formación ósea y principal conductora de la calcificación vascular media19.
Lo anterior sugiere que la esclerosis de Monckeberg podría ser la manifestación de un compromiso vascular mediado por alteraciones genéticas inmunológicas e inflamatorias que complementan una enfermedad conocida como la aterosclerosis, dado que a nivel vascular puede cursar con calcificación de la capa íntima y esto asociarse con placas ateroscleróticas, que resultan de la acumulación de lípidos modificados, citoquinas proinflamatorias y apoptosis celular, comprometiendo el flujo sanguíneo20,21. La calcificación de la túnica media favorece episodios de remodelación y mineralización, con la consecuente disminución de la elasticidad vascular22-24.
Existen 2 teorías para explicar el fenómeno descrito, la primera propone la pérdida de expresión de proteínas relacionadas con la inhibición de la calcificación como son: GLA, osteoprotegerina, fibrilina I y la anhidrasa carbónica. La segunda teoría plantea que la calcificación es consecuencia de cambios metabólicos por lesión necrobiótica de la pared del vaso. Es a partir de estos datos que muchos autores consideran el proceso como una calcifilaxis o calcinosis que puede ir de forma concomitante con fibrosis endovascular; sin embargo, para otros, la esclerosis de Monckeberg es una etapa avanzada de arteriosclerosis sin evidencia clara para definir que es un estado completamente independiente23,25,26. En la actualidad, aún hay desacuerdos sobre el compromiso asociado por calcificación de la lámina elástica interna, el cual no fue descrito en el artículo original del doctor Monckeberg, pero según estudios histopatológicos, pareciera estar igualmente implicado4,27.
Clínicamente las manifestaciones son amplias, todas derivadas de la oclusión vascular que se genera y que incluye vasos coronarios, aorta y sus ramas, con especial énfasis en vasos periféricos. Es frecuente encontrar úlceras de tipo arterial en extremidades superiores e inferiores de predominio distal, tan graves en ocasiones que pueden requerir amputación de la extremidad para control de síntomas23,28.
Los diagnósticos diferenciales están dados principalmente por vasculitis que afectan estos vasos, entre ellas, la poliarteritis nodosa y la arteritis de células gigantes29. La sintomatología puede llegar a ser tan similar que, ante la incapacidad de determinar las alteraciones en el metabolismo calcio-fósforo, se debe recurrir a la biopsia de tejido como medio para lograr el diagnóstico definitivo8,29.
En la actualidad no se dispone de medidas específicas para el tratamiento de la esclerosis de Monckeberg y solo se realizan medidas con el objetivo de optimizar el metabolismo del calcio, incluyendo quelantes de calcio como el tiosulfato de sodio17.
ConclusiónEl desarrollo de calcificación de las arterias es un proceso normal de la senectud; factores de riesgo como diabetes mellitus y la enfermedad renal crónica están directamente relacionados con su desarrollo y progresión30. Lo anterior causa en estos grupos una forma de presentación más temprana y más grave, lo que representa la aparición de eventos cardiovasculares como principal causa de muerte en estos pacientes1,2.
La esclerosis de Monckeberg debe sospecharse en aquellos pacientes con los factores de riesgo descritos; con signos y síntomas de enfermedad arterial periférica o signos de obstrucción crítica o aguda en los que se descarta un fenómeno aterosclerótico, embólico o autoinmune31. Considerando, además, que su diagnóstico sigue siendo un hallazgo incidental en muestras histopatológicas y no existen ayudas diagnósticas de laboratorio o imágenes específicas de la enfermedad. La sospecha clínica es la piedra angular del diagnóstico y manejo médico, para evitar una progresión acelerada de la enfermedad y tratamientos innecesarios.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.