La artritis reumatoide (AR) es una de las patologías crónicas de origen autoinmune más frecuentes. Su prevalencia varía del 0,5 al 1%, con un compromiso primario a nivel articular, generando gran discapacidad por las deformidades secundarias derivadas de un estado inflamatorio persistente. Considerando el alto impacto en la calidad de vida de quienes la padecen, sumado al alto costo de las intervenciones terapéuticas, se vuelve imperativo para el personal de salud sumar todos los esfuerzos para promover un diagnóstico temprano y reconocer las potenciales complicaciones con el fin de impactar positivamente en los desenlaces clínicos. Alrededor del 50% de los pacientes con AR pueden tener compromiso extraarticular, siendo el pulmón uno de los órganos más afectados. En época de pandemia por el virus SARS-CoV-2 es necesario recordar los tipos de compromiso pulmonar en pacientes con AR y tener en cuenta la susceptibilidad de estos pacientes a cuadros infecciosos que pueden generar una gran morbimortalidad.
Rheumatoid arthritis (RA) is one of the most frequent chronic autoimmune pathologies. It's prevalence varies from 0.5 to 1%, with a primary involvement at the joint, generating disability due to deformities secondary to persistent inflammation. Considering the high impact on the quality of life of those who suffer it, added to the high cost of therapeutic interventions, it becomes imperative for health personnel to join forces to promote early diagnosis and recognize potential complications, in order to impact positively on clinical outcomes. Around 50% of patients with RA may have extra-articular involvement, the lung being one of the most affected organs. In times of SARS-CoV-2 pandemic, it's necessary to remember the types of lung involvement in patients with RA and take into account the susceptibility of these patients to infectious conditions that can generate great morbidity and mortality.
La artritis reumatoide (AR) es una enfermedad autoinmune sistémica con compromiso articular y extraarticular1. Aunque su afectación central está a nivel articular, otros órganos pueden involucrarse, siendo el pulmón uno de los más comprometidos, principalmente en pacientes con compromiso articular severo y títulos elevados de factor reumatoide (FR)2,3. Las manifestaciones pulmonares están presentes hasta en el 40% de los pacientes, afectando el tejido intersticial, la pleura, la vía aérea y estructuras vasculares4. La aparición del compromiso respiratorio usualmente se da durante los primeros 5años del diagnóstico, pero su presencia se enmascara por el impacto funcional que ocasiona la AR a nivel sistémico5. En algunos casos se puede presentar un compromiso agudo1. Por otra parte, los pacientes con compromiso pulmonar por AR tienen susceptibilidad a procesos infecciosos, tanto de agentes bacterianos como virales hasta cuadros fúngicos y parasitarios6. Por lo mencionado, se requiere una mayor difusión entre los clínicos de estas alteraciones, con el fin de impactar en su diagnóstico y manejo oportuno, siendo necesaria una revisión de la literatura con el fin de abarcar de una manera práctica las manifestaciones que tiene la AR a nivel pulmonar, especialmente en época de pandemia, donde el compromiso por SARS-CoV-2 es particular en este órgano y requiere una vigilancia especial por las terapias actualmente utilizadas para la AR.
Materiales y métodosSe realizó una búsqueda ampliada de la literatura en las bases de datos PubMed, Google Scholar, estableciendo un límite de tiempo de 10años sin restricción idiomática (desde el 1 de enero de 2010 hasta el 3 de octubre de 2020). Las palabras clave utilizadas fueron: Airway obstruction; Rheumatoid arthritis; Interstitial lung disease; Pulmonary nodule; Lung involvement; Lung cancer; Tuberculosis; Respiratory infections; SARS-CoV-2; Vascular disease, y fueron combinadas con el término booleano «AND». De la búsqueda previamente mencionada se tomaron un total de 82 artículos, los cuales incluían en su título principal o en su resumen las palabras clave. Se excluyeron los artículos que no tuvieran disponible el texto completo o no tuvieran relación con el objetivo de esta revisión. Además, estudios duplicados, descriptivos y reportes de casos.
EpidemiologíaLa prevalencia de la AR es de aproximadamente el 1%, siendo una de las enfermedades del tejido conectivo más prevalentes a nivel mundial7. La AR puede tener manifestaciones a nivel extraarticular, dentro de las cuales destaca el compromiso pulmonar, con una frecuencia de presentación del 15 hasta el 58%1.
Las numerosas formas de afectación pulmonar por AR, dentro de las cuales se destaca el compromiso intersticial6, son importantes porque podrían ser la primera manifestación de la enfermedad. El impacto en la calidad de vida para estos pacientes es relevante, dada la morbimortalidad asociada, posicionándose como una de las principales causas de muerte en pacientes con AR5.
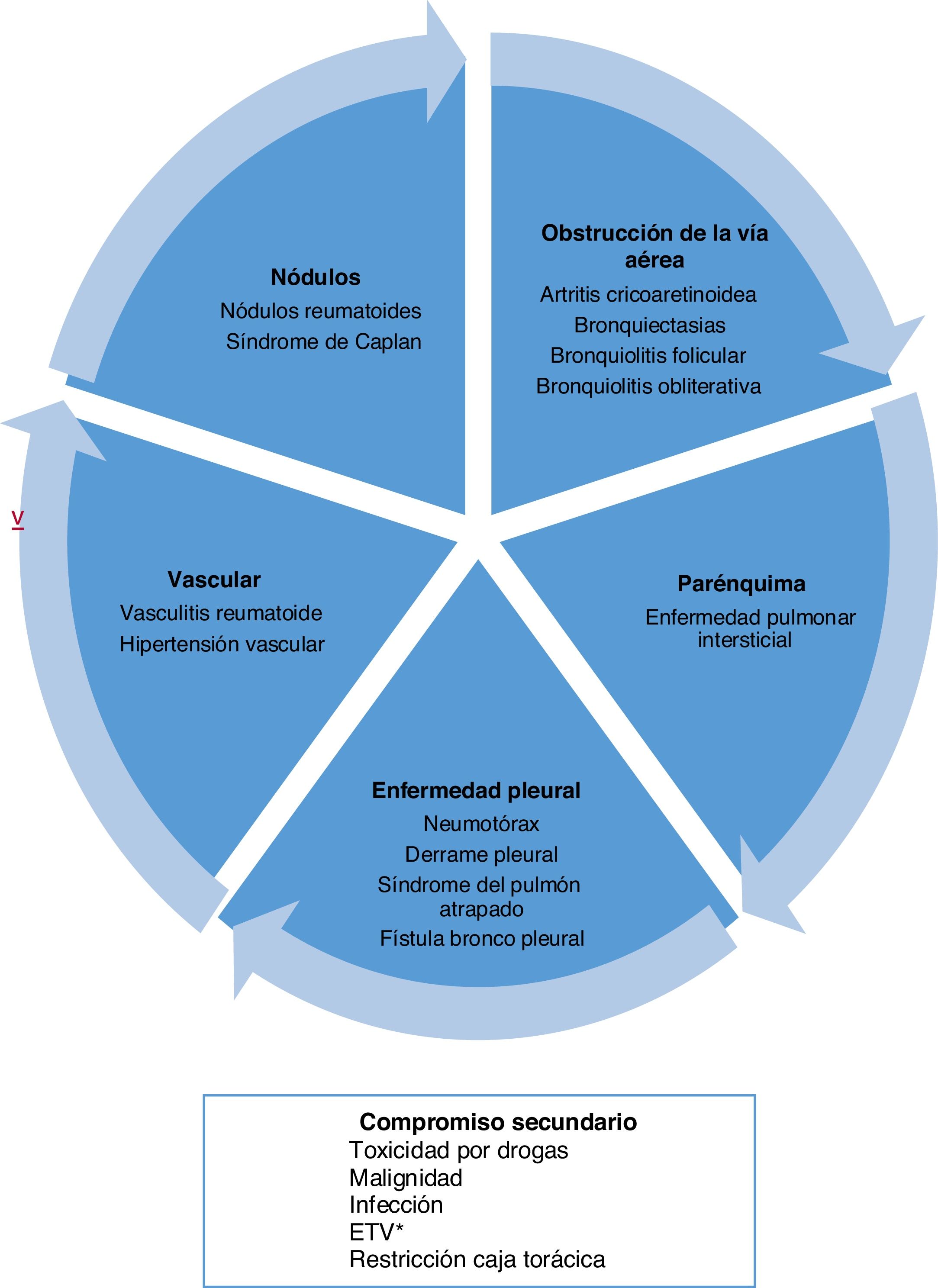
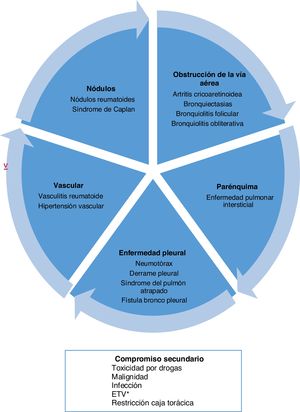
Tipos de compromiso a nivel pulmonarLa AR puede comprometer el pulmón de diferentes formas. Por una parte, generar un compromiso primario o lesión directa en las estructuras de este órgano, dentro de las cuales destaca la afectación del parénquima, pleura y vasos sanguíneos. Por otro lado, presentar manifestaciones secundarias o indirectas, derivadas del tratamiento o de la susceptibilidad a ciertas patologías, como la asociación con cáncer, enfermedad tromboembólica y procesos infecciosos (fig. 1)5.
Tipos de compromiso a nivel pulmonar por artritis reumatoide.
* Enfermedad tromboembólica venosa.
Tomado y adaptado de Shaw et al.6.
La enfermedad pulmonar intersticial difusa (EPID) es una de las manifestaciones pulmonares más frecuentes en la AR, la cual puede ir desde el 4 al 50% dependiendo de la población estudiada8. Este compromiso genera un gran impacto en la historia natural de la enfermedad, con una mediana de supervivencia de 7,8años, relacionándose con una muerte prematura entre el 7 al 13% de las defunciones asociadas a AR9,10. La EPID suele estar asociada a una larga duración de la AR. Sin embargo, esta puede ser la manifestación inicial de la AR hasta en el 10 al 30% de los pacientes6,11.
El desarrollo de compromiso intersticial depende de distintos factores: genéticos, demográficos, ambientales e inmunológicos que interactúan entre sí. Algunas variantes del complejo mayor de histocompatibilidad (HLA-B54, HLA-DQB1*0601, HLA-B40 y HLA-DR4) han sido asociadas con una mayor respuesta inmune hacia las proteínas citrulinadas a nivel pulmonar, configurando un importante factor de predisposición genética para el desarrollo de EPID-AR12,13. Aunque no se conoce claramente esta asociación, los hombres presentan una afectación pulmonar más frecuente (9,8% hombres vs 6,8% mujeres), especialmente con una edad mayor de 60años6,7. El cigarrillo se ha determinado como el principal factor ambiental asociado a EPID-AR, dado que pacientes fumadores con AR y un índice paquete año (IPA) mayor a 25 presentan un odds ratio (OR) de 3,8 de desarrollar un compromiso intersticial14,15. Lo anterior, posiblemente asociado a inflamación de la mucosa pulmonar, favorece la desaminación de la arginina a citrulina, desencadenando alteración de la tolerancia inmunitaria16.
Los valores elevados (sin un punto de corte manifiesto) tanto de FR como de los anticuerpos contra péptidos citrulinados (ACPA) se han asociado con mayor compromiso intersticial17. Recientemente se han descrito anticuerpos dirigidos contra proteínas carbamiladas (anti-CarP) en el 36 al 45% de pacientes con AR. La carbamilación es una modificación postraduccional como resultado de la conversión del aminoácido lisina en homocitrulina, mecanismo documentado a nivel articular, el cual se asocia con una grave progresión articular en la población con AR y ACPA negativos18. La importancia de los anti-CarP en la EPID-AR radica en la descripción de niveles elevados de estos anticuerpos, en comparación con la población sin EPID (OR: 3,42; IC95%: 1,13-10,40), con mayor seroprevalencia en fumadores y pacientes de edad avanzada. Por lo tanto, este anticuerpo puede tener un papel en el desarrollo de EPID-AR19,20.
Para el diagnóstico de EPID-AR, la tomografía de alta resolución (TACAR) de tórax y las pruebas de función pulmonar (PFP) desempeñan un papel importante en la evaluación de estos pacientes. Dentro de las PFP, la difusión de monóxido de carbono (DLCO) es el parámetro más sensible para evaluar la progresión y la gravedad de la enfermedad21. En la TACAR de tórax el patrón predominante es el de neumonía intersticial usual (NIU) que se presenta hasta en el 66% de los casos, y la neumonía intersticial no específica (NINE), entre el 19 y el 57%. También se han documentado (aunque en menor porcentaje) la presencia de bronquiolitis respiratoria con EPID, hasta en el 42%, y neumonía organizante (OP) o daño alveolar difuso hasta en al 11%22.
El tratamiento de EPID-AR aún es limitado y se recomienda en pacientes con una rápida progresión de la enfermedad, evaluando los beneficios y riesgos de la terapia a elegir. En pacientes sin síntomas o estables se recomienda monitorizar la progresión de la enfermedad con DLCO cada 3 a 6meses. Se ha establecido el uso de esteroides, en combinación con algunos inmunosupresores y algunos agentes convencionales modificadores de la enfermedad (cDMARD), como la primera línea de manejo. Los agentes biológicos (bDMARD) se han considerado como segunda línea de tratamiento13.
Anteriormente se usaban los esteroides junto con la azatioprina y ciclofosfamida, particularmente en pacientes con patrón de NINE y OP23. Sin embargo, el aumento de la morbimortalidad, secundario al riesgo de infecciones, sin un claro impacto en la progresión, ha llevado al desuso de esta combinación24,25.
Dentro de los cDMARD de primera línea se encuentra el metotrexato (MTX), el cual se ha asociado con una disminución en la progresión de la enfermedad, discapacidad y mortalidad, derivado de mecanismos antiinflamatorios e inmunosupresores directos a nivel pulmonar26,27. Sin embargo, el uso de MTX aún tiene limitaciones en la práctica clínica, por la asociación con el desarrollo de EPID en el 7,6% de los usuarios13. Estudios recientes no han demostrado asociación del uso de MTX con un incremento en el riesgo de EPID a 5años (HR: 1,00; IC95%: 0,78-1,27)28.
Entre los bDMARD destaca el uso de rituximab (RTX), el cual se ha asociado con mejoría clínica valorada por PFP y retraso en la progresión de EPID-AR29. El abatacept (ABT) mejoró la disnea evaluada por la escala Modified Medical Research Council (MMRC) y ciertos parámetros PFP en 16 pacientes con EPID-AR30. Se debe tener precaución con ciertos bDMARD, entre ellos los inhibidores del factor de necrosis tumoral (anti-TNF) y los antagonistas del receptor de IL-6, para los cuales se ha mencionado una probable asociación con el desarrollo de EPID. Sin embargo, la mayor parte de la evidencia que los implica proviene de informes o series de casos en los que la causalidad no puede ser determinada31,32.
Nódulo pulmonarEl nódulo pulmonar reumatoide es la única manifestación pulmonar específica de la AR2. Su presentación puede ser única o múltiple6, con una localización típicamente subpleural3 y un tamaño que puede variar desde milímetros hasta varios centímetros de diámetro5. Usualmente los pacientes con presencia de estos nódulos son asintomáticos4. Sin embargo, estos pueden complicarse y debutar como cuadros infecciosos sobreañadidos o manifestarse mediante la aparición de fístulas broncopleurales o derrames pleurales enfisematosos6.
No está claramente definida la prevalencia de esta manifestación, pero puede estar presente en el 32% de los pacientes con AR5. Entre los principales factores de riesgo para el desarrollo de estos nódulos se encuentran el género masculino, una alta actividad de la AR, historia de tabaquismo, presencia de nódulos subcutáneos y títulos positivos altos de FR33. Además, puede coexistir con otras alteraciones pulmonares, por ejemplo hasta en el 30% con EPID-AR4 y en pacientes con neumoconiosis secundaria a exposición a carbón, sílice y asbesto2,5.
No hay claridad fisiopatológica acerca del desarrollo de estos nódulos. Sin embargo, se ha encontrado a nivel histológico una similitud con los nódulos subcutáneos de pacientes con AR, los cuales se caracterizan por la presencia de lesiones granulomatosas, con un centro necrótico rodeado de linfocitos, células plasmáticas, mononucleares, células gigantes y fibroblastos3,5,34.
La mayoría de estos nódulos no precisa un manejo específico, pero su presencia debe hacer consciente al clínico de un mayor riesgo de vasculitis, hospitalizaciones y mortalidad asociada a AR. Se deben descartar enfermedades infecciosas y granulomatosas y, en casos de aparición de un único nódulo, deben descartarse entidades neoplásicas2,4. En algunos casos se ha documentado una disminución del tamaño con RTX5. No obstante, puede existir un comportamiento paradójico correspondiente al aumento de tamaño o la aparición de múltiples nódulos pulmonares con el uso leflunomida y anti-TNF2.
Enfermedad pleuralDentro del compromiso pleural destaca la presencia de derrame pleural, que es más frecuente en la población masculina y se asocia con una edad mayor de 45años, nódulos subcutáneos y la presencia de títulos altos de FR. La mayoría de estos pacientes son asintomáticos, y solo el 3% pueden cursar con síntomas como fiebre y dolor pleurítico6,35. El derrame asociado a AR se presenta como un exudado, obligando al clínico a descartar en primer lugar una etiología infecciosa. En general, el líquido es estéril con predominio celular linfocítico y ciertas características en el citoquímico, como un pH <7,3, niveles bajos de glucosa (<60mg/dl) y lactato deshidrogenasa elevada, con un punto de corte >700UI/l. Finalmente, si se han descartado otras etiologías y se confirma un derrame pleural asociado a AR, este no requerirá manejo específico36,37.
Enfermedad vascular pulmonarLas enfermedades del tejido conectivo son las principales causas de hipertensión arterial pulmonar (HAP). Sin embargo, esta es una complicación poco frecuente en AR, que puede ser explicada probablemente por la variabilidad de estudios existentes, en los que se ha determinado una prevalencia estimada por medio de ecocardiografía transtorácica, entre el 0,8% y el 21-27,5% de los casos4,38,39.
Esta vasculopatía es la principal forma de presentación, y algunos autores afirman que puede ocurrir en el 20% de los pacientes con AR40,41. Como en otras enfermedades del tejido conectivo, la HAP puede estar asociada a otros mecanismos fisiopatológicos, donde destaca la HAP asociada a hipoxemia (desarrollo de EPID-AR) y la enfermedad tromboembólica venosa, dada la asociación con un estado protrombótico derivado de la inflamación crónica5,42. El diagnóstico y el estudio de esta HAP asociada a AR se basan en las recomendaciones actuales de las sociedades internacionales de cardiología43,44.
Otro tipo de afectación es la vasculitis reumatoide, la cual compromete vasos de pequeño y mediano calibre tanto a nivel precapilar como poscapilar, con posterior desarrollo de necrosis y obstrucción vascular2. Esta manifestación aparece en enfermos con AR de larga evolución o formas severas de la enfermedad, principalmente en presencia de seropositividad. Sin embargo, es una manifestación rara45. Esta puede presentarse como una hemorragia alveolar, para la cual se recomienda la realización temprana de una fibrobroncoscopia y el tratamiento con esteroides a altas dosis46.
Obstrucción de la vía aéreaLas vías respiratorias altas y bajas pueden verse comprometidas de forma diversa por la AR. A nivel superior, la afectación se da principalmente a nivel cricoaritenoideo, y en la parte inferior tiene predilección por la vía aérea pequeña con un patrón obstructivo; asimismo, puede generar desde bronquiectasias hasta bronquiolitis, ya sea constrictiva o de tipo folicular47.
Vía aérea superiorSobre el cartílago cricoaritenoideo se genera un estado inflamatorio similar al que ocurre a nivel articular, con afectación de la sinovia localizada entre el cartílago cricoides y aritenoides47. Esta afección es más frecuente en mujeres y se presenta clínicamente como cuadros de disfonía o disfagia. Además, pueden observarse otros tipos de compromiso: en cuerdas vocales por la presencia de nódulos reumatoides y a nivel del nervio laríngeo recurrente por vasculitis. La presencia de estas complicaciones se asocia con estadios avanzados de la enfermedad; por lo tanto, un manejo oportuno con DMARD puede evitar la aparición de estas manifestaciones6,47.
Vía aérea inferiorLas lesiones por AR tienen predilección por la vía aérea pequeña, con un compromiso que puede ir del 8 al 65%, variabilidad dada por la diversidad de estudios y de la población estudiada. Es común encontrar un patrón obstructivo sutil en las pruebas de función pulmonar en pacientes asintomáticos, sin historia de tabaquismo, por lo cual este compromiso puede tener impacto y reflejarse en estadios avanzados de la enfermedad48. Otra importante condición es la susceptibilidad a infecciones, que pueden favorecer un deterioro del patrón obstructivo y la presencia de bronquiectasias, las cuales se han demostrado hasta en el 30% por medio de una TACAR del tórax48,49.
Compromiso secundario a nivel pulmonar en pacientes con artritis reumatoideAlgunas condiciones se pueden desarrollar en la AR sin estar asociadas a un compromiso directo. Entre ellas destacan la asociación con cáncer de pulmón y la susceptibilidad a cuadros infecciosos.
Artritis reumatoide y malignidadEs conocido que la AR incrementa el riesgo de malignidades o puede presentarse como un síndrome paraneoplásico, con una importante predisposición al desarrollo de cáncer de pulmón en comparación con la población general y otras neoplasias como linfoma de Hodgkin y no Hodgkin37.
Respecto al cáncer de pulmón, la AR se ha asociado con un incremento en la tasa de incidencia estandarizada de 1,63 (IC95%: 1,43-1,87). Sin embargo, aún no hay claridad con determinados factores para el desarrollo de esta condición. Entre las probables asociaciones destaca la presencia de EPID-AR y el tabaquismo50,51. Esta predisposición se ha asociado con una desregulación de citocinas y quimiocinas que son liberadas por células inflamatorias en el contexto de la AR, que promueven la expresión de ciertos factores de transcripción, favoreciendo la proliferación de células tumorales. Finalmente, el pronóstico de estos pacientes se ve afectado por una disminución en la supervivencia, comparada con los pacientes sin AR52,53.
Infecciones en pacientes con artritis reumatoideLos agentes infecciosos siempre se deben considerar en estos pacientes, sobre todo con el advenimiento de terapias biológicas. Por una parte, existe un riesgo elevado de presentar infecciones respiratorias, documentándose mayor susceptibilidad en pacientes con EPID-AR, dado que el 55,6% de estos requieren hospitalización por cuadros infecciosos, comparado con el 27,8% de pacientes en los cuales no se documenta compromiso intersticial54,55. Por otra parte, la inmunomodulación terapéutica puede generar que algunos microorganismos latentes se reactiven, entre ellos tuberculosis (TB), hepatitisB y hepatitisC, por lo cual, antes de iniciar un manejo inmunomodulador específico, es prudente realizar un tamizaje para la detección de estos agentes56,57.
Respecto a la reactivación de TB latente (TBL), los pacientes con AR tienen un riesgo 2,28 a 4 veces mayor en comparación con la población general58. Este riesgo está presente principalmente en los usuarios de bDMARD, en los cuales se ha documentado un OR de reactivación de 4,68 (IC95%: 1,18-18,6; p=0,028)59. Los bDMARD que pueden ocasionar esto pueden dividirse en anti-TNF y no anti TNF. Los anti-TNF se han asociado con un mayor riesgo de reactivación, debido a que pueden inhibir la formación granuloma y favorecer la liberación de micobacterias viables60. Infliximab, golimumab y el certolizumab pegol son los que se han asociado con esta condición59,61. Por otro lado, dentro de los no anti-TNF, anakinra (antagonista de IL-1) y tofacitinib (inhibidor JAK) a altas dosis son los bDMARD que se han asociado con un mayor riesgo de reactivación59,62. Respecto al tocilizumab, RTX y ABT se ha considerado que pueden representar una opción segura, puesto que no se han asociado con un incremento en TBL. Por lo tanto, podría no ser necesario realizar tamizajes para TB previo al inicio de estos agentes59,61,63,64.
Con base en lo anterior, se recomienda que antes de iniciar estos medicamentos se individualice a cada paciente evaluando el riesgo de reactivación de una TBL relacionado con el fármaco y considerar la realización bien sea de una prueba de tuberculina (PPD) o un ensayo de liberación de interferón gamma (IGRA), con el fin de dar tratamiento a una TBL al menos un mes antes del inicio de determinado biológico, o retrasar su inicio incluso hasta que se termine el tratamiento de una TB activa55.
Infección por SARS-COV-2 y artritis reumatoideLa infección por SARS-CoV-2 conduce, entre otras manifestaciones, al desarrollo de neumonía grave y de síndrome de dificultad respiratoria aguda, generando altas tasas de morbimortalidad65,66. La lesión pulmonar se fundamenta en la capacidad citopática del virus (piroptosis) y la respuesta inflamatoria medida por el sistema inmune innato y adquirido. Se ha propuesto el término tormenta de citocinas, haciendo referencia a la expresión aumentada de factor de necrosis tumoral alfa, interleucina1 beta e interleucina-6, los cuales reclutan macrófagos y célulasT, con un daño severo de la vía respiratoria, falla orgánica múltiple y muerte67,68.
Pocos estudios han investigado una relación entre las infecciones virales respiratorias y el desarrollo de AR69. Sin embargo, se ha descrito asociación entre los picos epidémicos de algunas cepas de coronavirus y el aumento de nuevos casos de AR70. Los datos de la COVID-19 Global Rheumatology Alliance muestran a la AR como la enfermedad reumática más frecuente entre los enfermos por SARS-CoV-2, aunque su presencia no se asocia a una mayor severidad de la infección por coronavirus71. Los pacientes con EPID-AR, específicamente, podrían tener un mayor riesgo de infección por este virus, dado el compromiso pulmonar preexistente y la inmunosupresión relacionada con el manejo farmacológico72.
El SARS-CoV-2 produce alteraciones en el parénquima pulmonar que son evidentes en la tomografía de tórax de forma temprana, incluso antes de la aparición de síntomas y la positividad de las pruebas diagnósticas moleculares o antigénicas73,74. Eventualmente puede existir dificultad en la diferenciación entre las manifestaciones radiológicas de la neumonía por SARS-CoV-2 y los hallazgos pulmonares por AR, puesto que los hallazgos radiológicos típicos de la primera pueden verse solapados en la heterogeneidad de lesiones preexistentes por AR en el pulmón. La tabla 1 resume algunos puntos clave en el reconocimiento de dichas diferencias radiológicas, aunque son consideraciones que pueden tener limitaciones puesto que no hay datos exactos sobre la incidencia de SARS-CoV-2 en EPID-AR22,73-79.
Diferencias en la TACAR de tórax entre compromiso por SARS-CoV-2 en pacientes con AR sin EPID previa y pacientes con EPID asociada a AR sin infección por SARS-CoV-2
| SARS-CoV-2 con AR sin EPID | EPID-AR preexistente sin SARS-CoV-2 | |
|---|---|---|
| Temporalidad | Compromiso agudo, grave y limitante75,76 | Compromiso progresivo, sin deterioro agudo75 |
| Hallazgos tomograficos | • Según el tiempo de enfermedad por estadios (similar a población sin AR):1. Ultra temprano: asintomático, 1 a 2 semanas postexposición al SARS-CoV-2 (vidrio esmerilado único o múltiple, consolidación parcheada, predominio en lóbulo inferior y segmentos posteriores)2. Temprano: 1 a 3 DD (vidrio esmerilado con afectación bilateral y distribución periférica más engrosamiento de septos interlobulillares crazy paving)3. Progresión rápida: 3 a 7 DD (consolidaciones confluentes y broncograma aéreo)4. Consolidación: 7 a 14 DD (reducción de consolidaciones)5. Disipación: > 14 DD (consolidación en parches, engrosamiento disperso bronquial y septal)73,74• Otras manifestaciones (rara vez documentadas en pacientes sin AR y con SARS-CoV-2): derrame pleural o lesiones pleurales77 | • Predominan los siguientes patrones, los cuales pueden ocurrir en cualquier momento de la historia natural de la AR:1. Patrón de NIU (8 a 66% de los casos EPID-AR), con distribución periférica subpleural y basal2. Patrón de NINE (19 a 57% de los casos EPID-AR), distribución periférica basal y simétrica22 |
| Progresión | • La mayoría de casos, tienden a recuperarse en un año76 | |
| • Algunos casos (infección por SARS-CoV-2 de mayor duración) pueden presentar fibrosis pulmonar progresiva y mortalidad asociada o requerir terapia antifibrótica a largo plazo78,79 | • Estable o progresión en el tiempo según el control de la AR76 |
AR: artritis reumatoide; DD: días después del inicio de las manifestaciones clínicas; EPID: enfermedad pulmonar intersticial difusa; NINE: neumonía intersticial no específica; NIU: neumonía intersticial usual.
Se ha llegado a considerar que continuar el manejo convencional de la AR aumentaría el riesgo de infección por SARS-CoV-2. No obstante, el control de la actividad de la AR es fundamental, puesto que un mayor nivel de actividad de esta enfermedad se relaciona con mayor riesgo de infección y de progresión hasta formas graves de enfermedad por este coronavirus. Además, algunos fármacos comúnmente utilizados en el tratamiento de la AR se han propuesto como posibles terapias para SARS-CoV-268. Por otro lado, existe la preocupación de la suspensión del tratamiento, que podría condicionar una marcada reactivación inflamatoria de la enfermedad80,81.
El Colegio Americano de Reumatología ha dispuesto algunas recomendaciones respecto al tratamiento de las enfermedades reumáticas, entre las cuales destacan el mantenimiento de los esteroides en las menores dosis posibles y la continuidad de los DMARD sintéticos y biológicos como de otros inmunosupresores, según la necesidad del control de la AR, en ausencia de infección por coronavirus. En caso de sospecha de infección por este virus, los DMARD sintéticos o biológicos diferentes a la hidroxicloroquina, la cloroquina y la sulfasalazina pueden ser suspendidos de manera temporal hasta obtener los resultados negativos de las pruebas diagnósticas de SARS-CoV-2 o hasta alcanzar un periodo de 2semanas de observación. En caso contrario, cuando se confirma la infección por este virus, deben mantenerse suspendidos dichos medicamentos hasta 7 a 14días después de la resolución de síntomas en infecciones leves. El reinicio de la medicación en formas severas de infección deberá considerarse de manera individualizada82.
ConclusionesLa AR es una de las enfermedades inflamatorias crónicas que generan un impacto importante en la calidad de vida de los pacientes que la presentan. La mayoría de clínicos centran su abordaje en las manifestaciones articulares, omitiendo en muchos casos el importante compromiso extraarticular. La afectación pulmonar se puede observar entre una variabilidad de manifestaciones clínicas, destacándose los compromisos intersticial y vascular. El diagnóstico diferencial es amplio e incluye entidades infecciosas y tumorales, entre otras. El seguimiento clínico periódico por un grupo multidisciplinario en el que han de participar médicos generales, reumatólogos, neumólogos e internistas, entre otros, se hace plenamente necesario para lograr una oportuna intervención, con la suspensión del tabaquismo y un inicio temprano de los DMARD con el fin de evitar la aparición de estas complicaciones y/o mitigar las secuelas derivadas de su presencia. En época de pandemia por SARS-CoV-2 las medidas encaminadas a prevenir las complicaciones por compromiso pulmonar de AR posiblemente favorezcan mejores desenlaces entre quienes padecen formas severas de este cuadro. Aún existe incertidumbre en cuanto a si el compromiso preexistente por AR puede llevar a un grave compromiso por SARS-CoV-2. Finalmente, los DMARD pueden ayudar a controlar la progresión de la enfermedad pulmonar. No obstante, pueden generar una importante condición de inmunosupresión y susceptibilidad a infecciones, entre ellas el SARS-CoV-2.
Conflicto de interesesLos autores manifiestan no tener conflicto de intereses.