Los pacientes con enfermedades reumáticas tienen un aumento del riesgo cardiovascular debido a inflamación sistémica y disfunción endotelial, lo que promueve una acelerada aterosclerosis. Una de las formas de medir el riesgo cardiovascular es a través del grosor de la íntima-media, evaluada por ultrasonido carotídeo, el cual es un predictor de acontecimientos cardiovasculares de bajo costo y naturaleza no invasiva.
ObjetivoRevisar la evidencia que describe la utilidad y valor del diagnóstico ecográfico de aterosclerosis subclínica en enfermedades reumáticas, evaluadas mediante el grosor de la íntima-media carotídea (GIMc).
Materiales y métodosSe realizó una revisión de la literatura de la base de datos electrónica PubMed. Se incluyeron artículos desde enero de 2005 a mayo de 2015, sin restricción de idioma. Se incluyeron estudios observacionales de cohorte que evaluaron la prevalencia de aterosclerosis subclínica mediante la medición del GIMc y estudios de metaanálisis. Se verificó la calidad metodológica de los artículos y se extrajo la información relevante de cada uno.
ResultadosSe identificaron 56 artículos que cumplieron los requisitos. El 95,7% coincidió con el aumento del GIMc en relación con el grupo control, como marcador predictivo de aterosclerosis subclínica.
ConclusionesLos pacientes con enfermedades reumáticas tienen un aumento del riesgo cardiovascular medido a través del GIMc, como lo muestran varios estudios. Esta medición realizada por ultrasonido carotídeo podría ayudar a detectar el riesgo de enfermedad cardiovascular subclínica en estas poblaciones, lo que permitiría al clínico implementar medidas terapéuticas para reducir el riesgo de morbimortalidad en estos pacientes.
Patients with rheumatic diseases have an increased cardiovascular risk due to systemic inflammation and endothelial dysfunction, which promotes accelerated atherosclerosis. One way to measure cardiovascular risk, is through the carotid intima-media thickness which is an inexpensive and non-invasive predictor of cardiovascular events.
ObjectiveTo examine the evidence to determine the usefulness of ultrasound in the diagnosis of sub-clinical atherosclerosis in rheumatic diseases assessed by carotid intima-media thickness (IMT).
Material and methodsA systematic literature search was performed, using electronic databases of PubMed, for articles published from January 2005 to May 2015, with no language restriction. Observational cohort studies that assessed the prevalence of sub-clinical atherosclerosis using the IMT were included.
ResultsA total of 56 studies were identified for analysis, with almost all (95.7%) reporting an increased IMT in relation to the control group.
ConclusionsPatients with rheumatic diseases have an increased cardiovascular risk assessed using IMT. This measurement, assessed by carotid ultrasound, may help detect the risk of sub-clinical cardiovascular disease in these populations, allowing to establish a therapeutic strategy to reduce the risk of morbidity and mortality in these patients.
La aterosclerosis es considerada una alteración patológica de las arterias caracterizada por el depósito anormal de lípidos y tejido fibroso en la pared arterial, que desorganiza la arquitectura, la función de los vasos y reduce, en forma variable, el flujo sanguíneo al miocardio1,2. Es un proceso progresivo que comienza en la adolescencia, llegando a ser clínicamente manifiesto a una edad tardía o, por el contrario, presentarse de manera subclínica3.
Las enfermedades autoinmunes sistémicas están relacionadas con un estado inflamatorio crónico, un incremento en el riesgo cardiovascular y, por consiguiente, con un aumento en la tasa de morbimortalidad, tanto por la enfermedad activa, como por el uso prolongado de esteroides4. Muchos de los factores de riesgo cardiovascular, tales como: tabaquismo, hipertensión arterial, dislipidemia y alteración en la homeostasis vascular, contribuyen a la activación endotelial durante las primeras etapas del desarrollo de la aterosclerosis, lo que resulta en un aumento en la expresión de moléculas de adhesión en la célula endotelial, tales como P-selectina, E-selectina, molécula de adhesión intercelular-1 y molécula de adhesión celular vascular-1 en la superficie de la célula endotelial, lo que lleva a la unión y, por último, promueve la adhesión de monocitos5,6. Después de la transmigración en la pared del vaso, los monocitos se convierten en macrófagos y posteriormente en células espumosas. El proceso continúa con la acumulación de lípidos, liberación de citoquinas y la proliferación de células musculares lisas, generando la formación de placa ateromatosa7,8.
La activación endotelial, común en las enfermedades reumáticas como artritis reumatoide (AR), lupus eritematoso sistémico (LES), síndrome de Sjögren (SS), esclerosis sistémica (ES), gota, osteoartritis (OA) y vasculitis, entre otras, es probablemente inducida por autoanticuerpos. Para el caso específico de las vasculitis, los anticuerpos contra el citoplasma de neutrófilos (ANCA) y, en particular, los dirigidos a la proteinasa 3 (PR3-ANCA), pueden activar las células endoteliales como se ha demostrado in vitro9. También ocurre in vivo, por el aumento de los niveles séricos de molécula de adhesión vascular-1 y E-selectina que están implicados en el proceso de inflamación sistémica, contribuyendo a la progresión de daño cardiovascular10. En el caso de LES se propone que una alteración en la oxidación de lípidos juega un papel importante en la aterogénesis, contribuyendo a la activación del sistema inmune, desencadenando marcadores inflamatorios involucrados en la formación de la placa ateromatosa11. En la AR se ha documentado un número variable de factores para el desarrollo de aterogénesis, tales como la homocisteína, los niveles séricos alterados de lipoproteínas y el tratamiento farmacológico prolongado. Hallazgos recientes indican que la inflamación sistémica puede contribuir al desarrollo de la aterosclerosis y conferir un riesgo adicional para la muerte cardiovascular en los pacientes con AR. La proteína C reactiva, se ha considerado como un marcador pronóstico independiente para la enfermedad cardiovascular en estos pacientes12. Para tal efecto, los estudios han demostrado una estrecha asociación entre los marcadores de inflamación como proteína C reactiva, velocidad de eritrosedimentación globular y los marcadores de enfermedad cardiovascular ateromatosa (disfunción endotelial y el aumento en el grosor de la íntima-media de la arteria carótida) en pacientes con estas enfermedades autoinmunes sistémicas, lo que incrementa significativamente la prevalencia de la enfermedad cardiovascular, como se ha reportado en AR en un 50%, similar a LES con un riesgo de enfermedad coronaria, en mujeres entre 35 y 44 años, 50 veces mayor que entre los sujetos de control de la misma edad y para las vasculitis asociadas a ANCA con un riesgo mayor a lo esperado de 2,1 (IC 1,4-3,0), para eventos cardiovasculares en los primeros 5 años de diagnóstico13,14.
El objetivo de la presente revisión pretende examinar la evidencia que describe la utilidad y valor del diagnóstico ecográfico de aterosclerosis subclínica en enfermedades reumáticas evaluadas mediante el GIMc.
Medición de grosor íntima-mediaUna de las formas de medir el riesgo cardiovascular, es a través del grosor de la íntima-media por ultrasonografía, el cual es un predictor de acontecimientos cardiovasculares15. El ultrasonido modo B es una técnica no invasiva que permite la visualización de las paredes de las arterias superficiales como las ramas de la carótida15. El GIMc se ha utilizado ampliamente en la evaluación de la progresión aterosclerótica; se ha demostrado que el incremento de su grosor está asociado con una mayor prevalencia y gravedad de enfermedades coronarias y cerebrovasculares16,17.
Estudios epidemiológicos y trabajos clínico-terapéuticos de regresión con hipolipemiantes han establecido que el GIMc es un marcador sensible al cambio, válido para evaluar la progresión y regresión de enfermedad aterosclerótica, el cual sería el método más adecuado para evaluar la eficacia de las intervenciones farmacológicas y no farmacológicas, debido a que proporciona datos objetivos sobre los cambios de la pared arterial, datos de riesgo y salud de una población determinada, para favorecer la toma de medidas preventivas para disminuir la morbimortalidad y mejorar el pronóstico y, por consiguiente, la calidad de vida de los pacientes18,19.
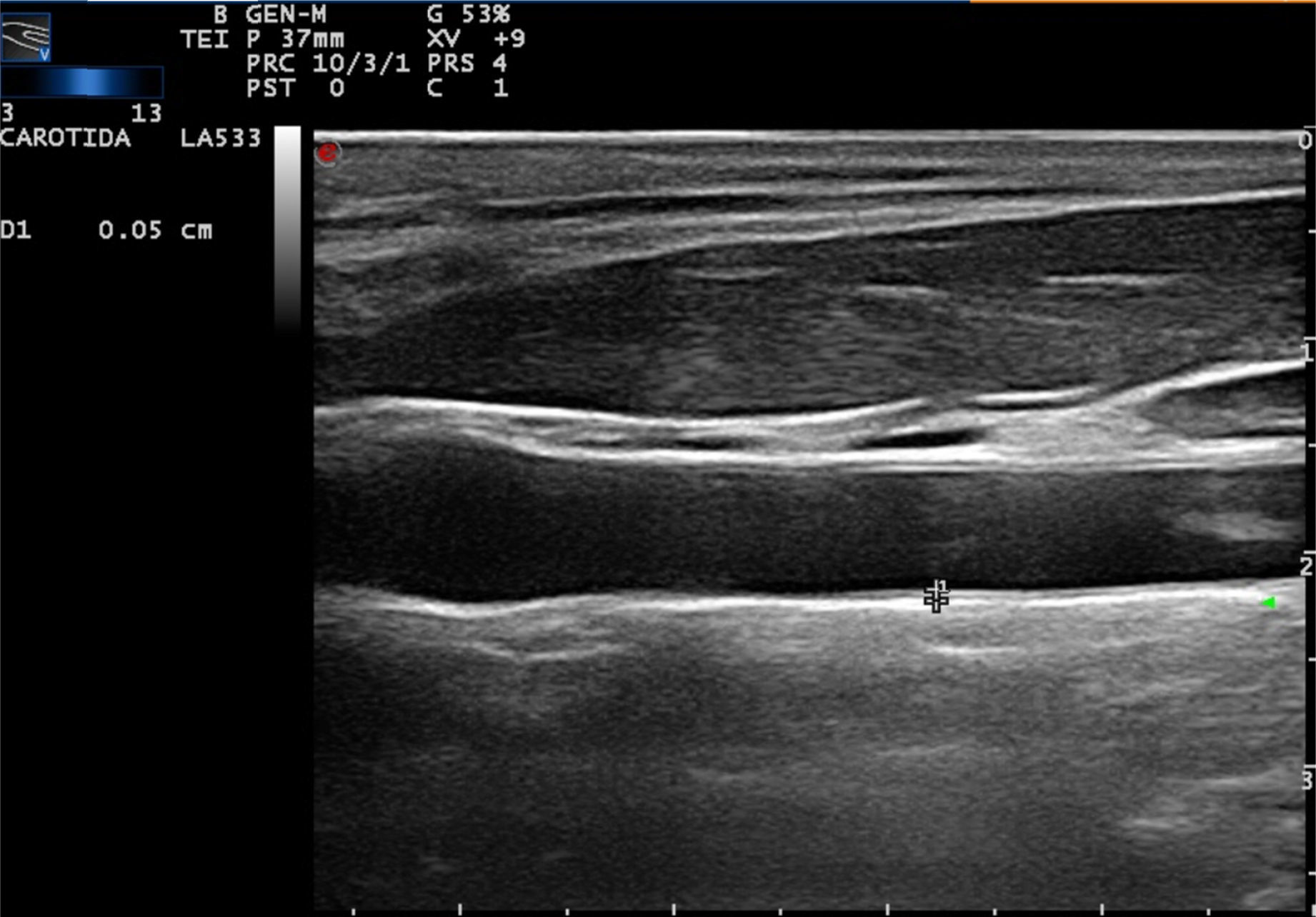
Ultrasonido carotídeo basado en radiofrecuenciaConvencionalmente, la medición del grosor de la íntima-media se lleva a cabo por el trazado manual de las interfaces entre las capas de tejido arterial (fig. 1). Cabe destacar que este método requiere alta competencia, una formación adecuada y un nivel de especialización en la técnica. Por lo general, principalmente los cardiólogos o radiólogos realizan este tipo de examen. A pesar del enfoque convencional para evaluar el GIMc todavía hay algunos aspectos que deben ser superados, como la amplia variabilidad intra- e interobservador, la cual depende del juicio de los expertos y del tiempo que tarda en realizar las mediciones del GIMc20.
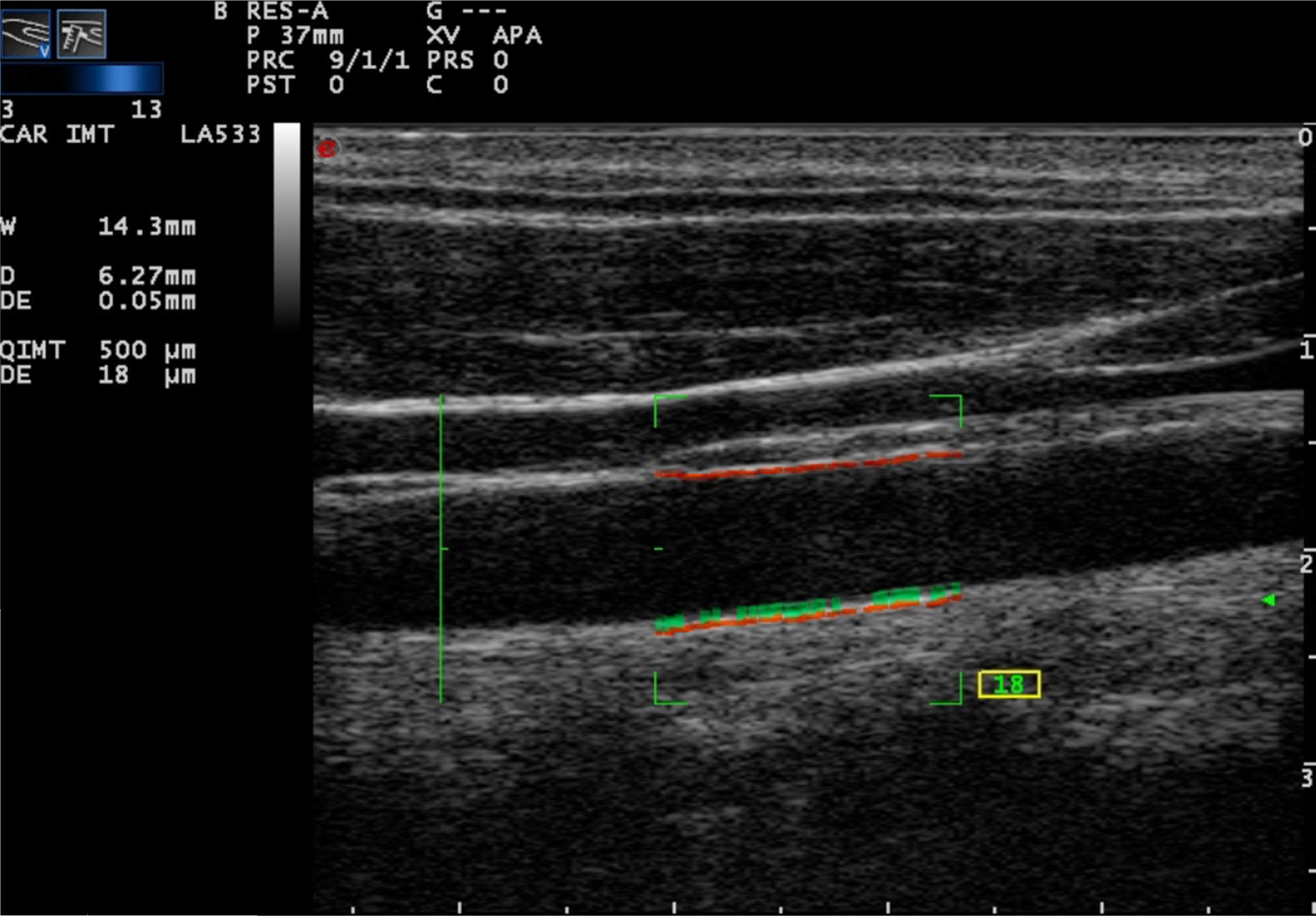
Recientemente, la técnica de ultrasonido carotídeo basado en radiofrecuencia ha sido aplicada (fig. 2). Este método parece ser menos dependiente de la experiencia del operador del ultrasonido vascular, ya que proporciona una medida automática del grosor de las interfaces de la pared arterial. Naredo et al., realizaron un estudio que tuvo como objetivo evaluar la fiabilidad del ultrasonido automatizado basado en radiofrecuencia, comparándolo con el modo B del método convencional, en pacientes con AR, demostrando que la técnica es válida, reproducible y confiable (intraobservador 0,61 y 0,85 interobservador) para evaluar el riesgo cardiovascular por el reumatólogo21.
Por su parte Di Geso et al., también compararon ambos métodos en 32 pacientes con enfermedades reumáticas inflamatorias crónicas. Un cardiólogo experto empleó el método manual convencional y un reumatólogo utilizó el método automatizado para medir el grosor de la íntima-media. Se observó una buena concordancia entre los dos métodos (0,69 y 0,77, para la carótida común derecha e izquierda, respectivamente). Sustancialmente se identificaron buenas concordancias entre los evaluadores que adoptaron la técnica manual convencional y el software automatizado22.
Más recientemente, Naredo et al., realizaron un estudio longitudinal, prospectivo, multicéntrico, para comparar el GIMc, evaluado por el método automatizado en 94 pacientes con AR tratados con drogas modificadoras de la enfermedad (DMARD) sintéticos vs. DMARD biológicos, en comparación con 94 controles. El GIMc fue significativamente mayor en los pacientes con AR tratados solo con DMARD sintéticos que en los controles (591,4 frente a 562,1; p=0,035) y en pacientes tratados con DMARD sintéticos más biológicos vs. controles (591,4 vs. 558,8; p=0,040). Los resultados sugieren que el ultrasonido carotídeo puede mostrar diferencias significativas entre los pacientes con AR dependiendo del tratamiento que reciben23. La ventaja del método automatizado es que es más rápido que el convencional. La variación interobservador para la detección de placas es variable, depende del nivel de preparación del ecografista y de la calidad de la imagen ecográfica24.
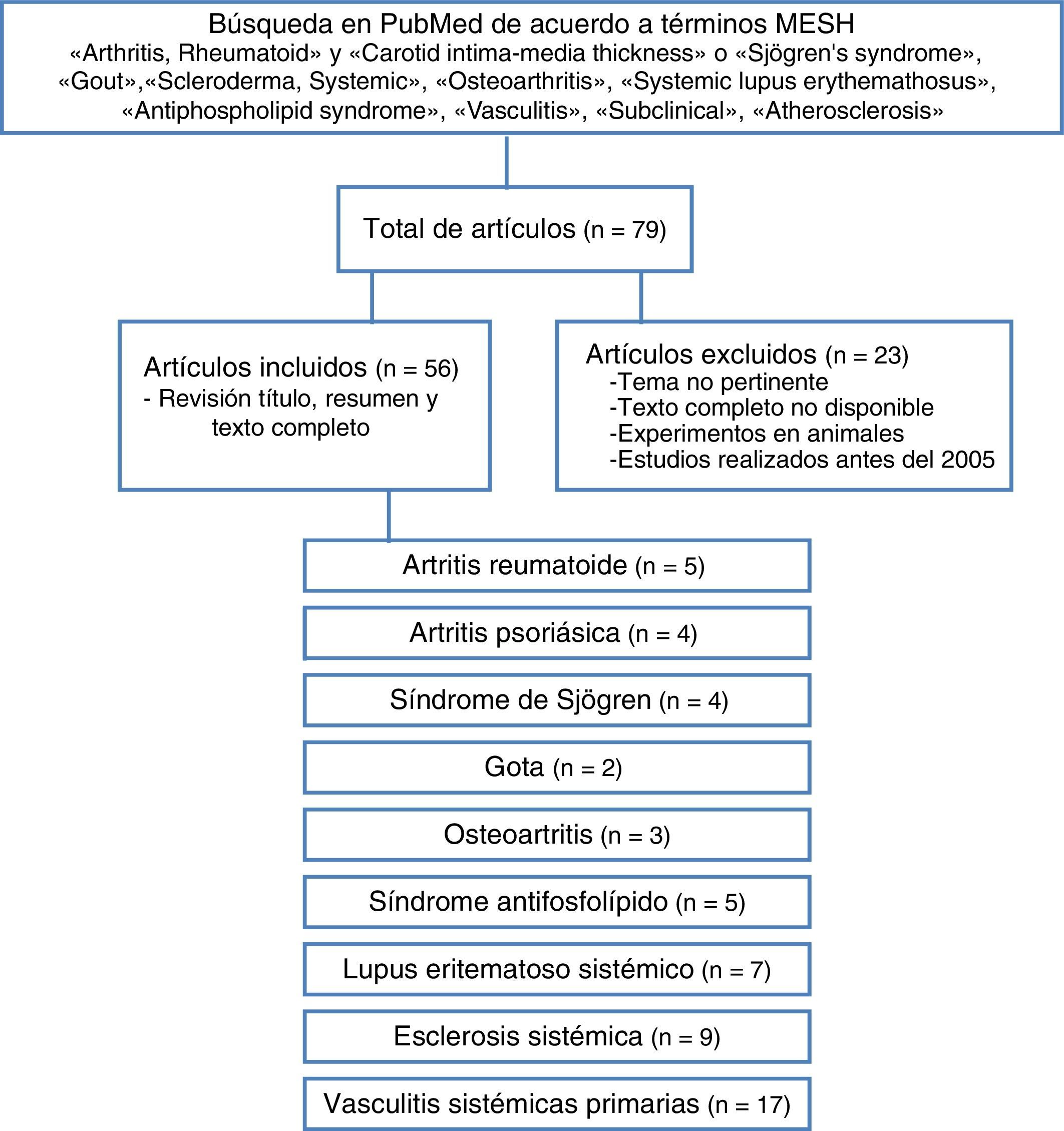
Materiales y métodosSe realizó una revisión de la literatura en la base de datos PubMed, de estudios observacionales de cohorte y metaanálisis publicados entre enero de 2005 y mayo de 2015, sin restricción de idioma, incluyendo finalmente aquellos en español, inglés y portugués. Se verificó la calidad metodológica de los artículos y se extrajo la información relevante de cada uno. Se excluyeron artículos en los cuales los estudios no fueran realizados en humanos, el tema no fuera pertinente, el texto completo no estuviera disponible o hubieran sido publicados antes del 2005. Para la búsqueda se utilizaron términos MESH que incluyeron «arthritis, rheumatoid» y «carotid intima-media thickness» o «Sjogren's syndrome», «gout», «scleroderma, systemic», «osteoarthritis», «systemic lupus erythemathosus», «antiphospholipid syndrome», «vasculitis», «subclinical», «atherosclerosis.
Se seleccionaron artículos por título y resumen, se verificó si era pertinente y se realizó la revisión del artículo completo. De los artículos seleccionados, mediante un formato de recolección se obtuvieron datos relevantes respecto al GIMc y formación de placas ateromatosas en cada una de las diferentes patologías reumáticas, comparados con el grupo control (fig. 3). Las citas bibliográficas de cada artículo se revisaron en busca de literatura no recuperada en la búsqueda inicial.
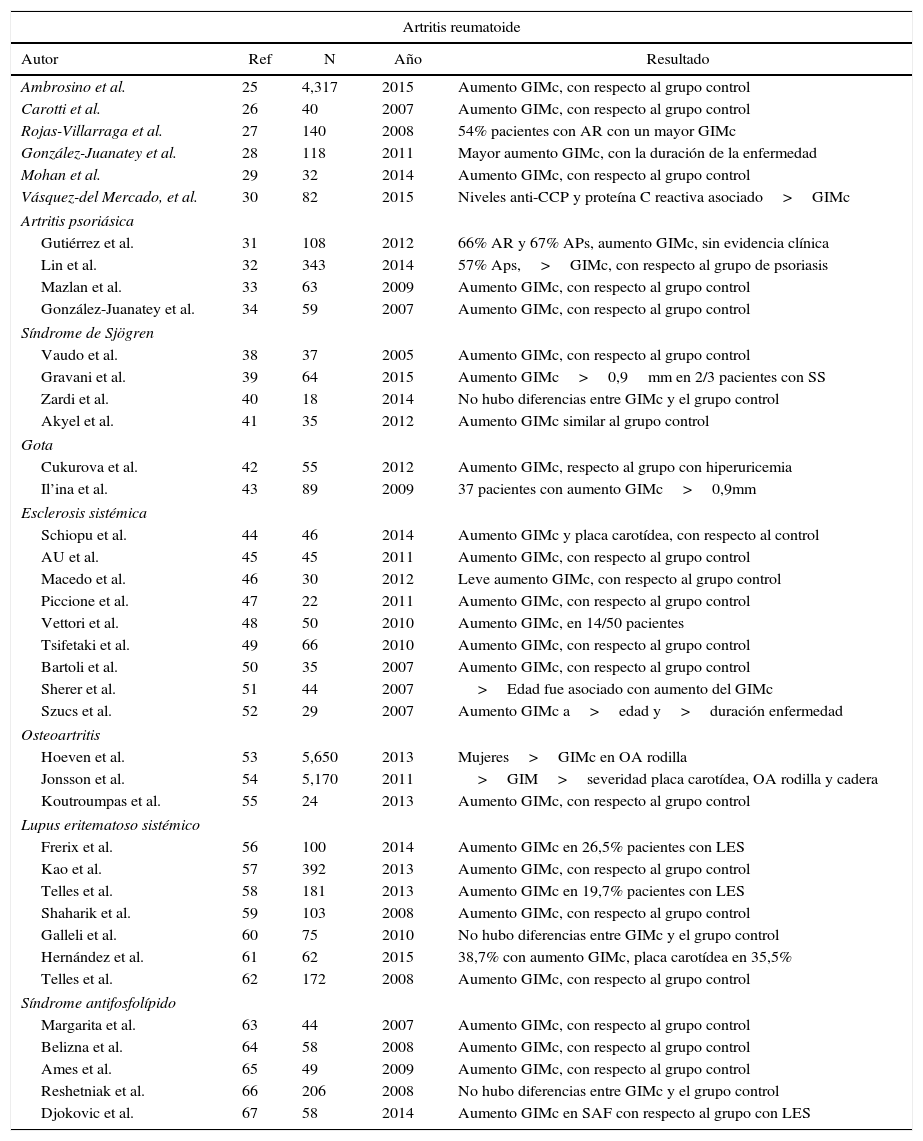
Grosor de la íntima-media carotídea en enfermedades reumáticasExisten pocos estudios en la literatura en cuanto a la medición del GIMc en pacientes con enfermedades reumáticas, publicados en los últimos 10 años (tabla 1).
Revisión de la literatura médica de los últimos 10 años sobre la medición del grosor de la íntima-media carotídea (GIMc) como valor predictivo de aterosclerosis subclínica en pacientes con enfermedades reumáticas
| Artritis reumatoide | ||||
|---|---|---|---|---|
| Autor | Ref | N | Año | Resultado |
| Ambrosino et al. | 25 | 4,317 | 2015 | Aumento GIMc, con respecto al grupo control |
| Carotti et al. | 26 | 40 | 2007 | Aumento GIMc, con respecto al grupo control |
| Rojas-Villarraga et al. | 27 | 140 | 2008 | 54% pacientes con AR con un mayor GIMc |
| González-Juanatey et al. | 28 | 118 | 2011 | Mayor aumento GIMc, con la duración de la enfermedad |
| Mohan et al. | 29 | 32 | 2014 | Aumento GIMc, con respecto al grupo control |
| Vásquez-del Mercado, et al. | 30 | 82 | 2015 | Niveles anti-CCP y proteína C reactiva asociado>GIMc |
| Artritis psoriásica | ||||
| Gutiérrez et al. | 31 | 108 | 2012 | 66% AR y 67% APs, aumento GIMc, sin evidencia clínica |
| Lin et al. | 32 | 343 | 2014 | 57% Aps,>GIMc, con respecto al grupo de psoriasis |
| Mazlan et al. | 33 | 63 | 2009 | Aumento GIMc, con respecto al grupo control |
| González-Juanatey et al. | 34 | 59 | 2007 | Aumento GIMc, con respecto al grupo control |
| Síndrome de Sjögren | ||||
| Vaudo et al. | 38 | 37 | 2005 | Aumento GIMc, con respecto al grupo control |
| Gravani et al. | 39 | 64 | 2015 | Aumento GIMc>0,9mm en 2/3 pacientes con SS |
| Zardi et al. | 40 | 18 | 2014 | No hubo diferencias entre GIMc y el grupo control |
| Akyel et al. | 41 | 35 | 2012 | Aumento GIMc similar al grupo control |
| Gota | ||||
| Cukurova et al. | 42 | 55 | 2012 | Aumento GIMc, respecto al grupo con hiperuricemia |
| Il’ina et al. | 43 | 89 | 2009 | 37 pacientes con aumento GIMc>0,9mm |
| Esclerosis sistémica | ||||
| Schiopu et al. | 44 | 46 | 2014 | Aumento GIMc y placa carotídea, con respecto al control |
| AU et al. | 45 | 45 | 2011 | Aumento GIMc, con respecto al grupo control |
| Macedo et al. | 46 | 30 | 2012 | Leve aumento GIMc, con respecto al grupo control |
| Piccione et al. | 47 | 22 | 2011 | Aumento GIMc, con respecto al grupo control |
| Vettori et al. | 48 | 50 | 2010 | Aumento GIMc, en 14/50 pacientes |
| Tsifetaki et al. | 49 | 66 | 2010 | Aumento GIMc, con respecto al grupo control |
| Bartoli et al. | 50 | 35 | 2007 | Aumento GIMc, con respecto al grupo control |
| Sherer et al. | 51 | 44 | 2007 | >Edad fue asociado con aumento del GIMc |
| Szucs et al. | 52 | 29 | 2007 | Aumento GIMc a>edad y>duración enfermedad |
| Osteoartritis | ||||
| Hoeven et al. | 53 | 5,650 | 2013 | Mujeres>GIMc en OA rodilla |
| Jonsson et al. | 54 | 5,170 | 2011 | >GIM>severidad placa carotídea, OA rodilla y cadera |
| Koutroumpas et al. | 55 | 24 | 2013 | Aumento GIMc, con respecto al grupo control |
| Lupus eritematoso sistémico | ||||
| Frerix et al. | 56 | 100 | 2014 | Aumento GIMc en 26,5% pacientes con LES |
| Kao et al. | 57 | 392 | 2013 | Aumento GIMc, con respecto al grupo control |
| Telles et al. | 58 | 181 | 2013 | Aumento GIMc en 19,7% pacientes con LES |
| Shaharik et al. | 59 | 103 | 2008 | Aumento GIMc, con respecto al grupo control |
| Galleli et al. | 60 | 75 | 2010 | No hubo diferencias entre GIMc y el grupo control |
| Hernández et al. | 61 | 62 | 2015 | 38,7% con aumento GIMc, placa carotídea en 35,5% |
| Telles et al. | 62 | 172 | 2008 | Aumento GIMc, con respecto al grupo control |
| Síndrome antifosfolípido | ||||
| Margarita et al. | 63 | 44 | 2007 | Aumento GIMc, con respecto al grupo control |
| Belizna et al. | 64 | 58 | 2008 | Aumento GIMc, con respecto al grupo control |
| Ames et al. | 65 | 49 | 2009 | Aumento GIMc, con respecto al grupo control |
| Reshetniak et al. | 66 | 206 | 2008 | No hubo diferencias entre GIMc y el grupo control |
| Djokovic et al. | 67 | 58 | 2014 | Aumento GIMc en SAF con respecto al grupo con LES |
| Vasculitis sistémicas primarias | ||||
|---|---|---|---|---|
| Enfermedad de Behçet | ||||
| Autor | Ref | N | Año | Resultado |
| Ozturk et al. | 68 | 65 | 2015 | Aumento GIMc, con respecto al grupo control |
| Messedi et al. | 69 | 50 | 2011 | Aumento GIMc, con respecto al grupo control |
| Hong et al. | 70 | 40 | 2008 | Aumento GIMc, con respecto al grupo control |
| Ozturk et al. | 71 | 21 | 2008 | Aumento GIMc, con respecto al grupo control |
| Rhee et al. | 72 | 11 | 2007 | Aumento GIMc con>edad |
| Ozturk et al. | 73 | 34 | 2006 | Aumento GIMc, con respecto al grupo control |
| Keser et al. | 74 | 114 | 2005 | Aumento GIMc, con respecto al grupo control |
| Enfermedad de Kawasaki | ||||
| Wu et al. | 75 | 35 | 2014 | Aumento GIMc, con respecto al grupo control |
| Meena et al. | 76 | 27 | 2014 | Aumento GIMc, con respecto al grupo control |
| Noto et al. | 77 | 18 | 2012 | Aumento GIMc, con respecto al grupo control |
| Cheung et al. | 78 | 72 | 2007 | Aumento GIMc, se asocia con rigidez arterial sistémica |
| Arteritis de Takayasu | ||||
| Alibaz-Oner et al. | 79 | 32 | 2014 | Aumento GIMc, con respecto al grupo control |
| Schinkel et al. | 80 | 14 | 2014 | 50% presentó aumento GIMc |
| Seth et al. | 81 | 56 | 2006 | Aumento GIMc, con respecto al grupo control |
| Granulomatosis con poliangitis (GPA-Wegener) | ||||
| Nienhuis et al. | 82 | 28 | 2007 | Aumento GIMc, con respecto al grupo control |
| De Leeuw et al. | 83 | 29 | 2005 | Aumento GIMc, con respecto al grupo control |
| Arteritis de células gigantes | ||||
| Hafner et al. | 84 | 41 | 2014 | Aumento GIMc en los pacientes con polimialgia reumática |
APs: artritis psoriásica; GIMc: grosor íntima-media carotídea; LES: lupus eritematoso sistémico; OA: osteoartritis; SS: síndrome de Sjögren.
Los pacientes con AR tienen una esperanza de vida reducida y una alta morbimortalidad cardiovascular en comparación con la población general. Un metaanálisis analizó la AR en relación con los marcadores de riesgo cardiovascular y la presencia de placas carotídeas, encontrando 51 estudios con datos del GIMc (3.600 pacientes con AR y 3.020 controles) y 35 estudios que informaron sobre la prevalencia de placas ateromatosas (2.859 pacientes con AR y 2.303 controles). Los pacientes con AR mostraron un incremento significativo del GIMc respecto a los controles. Los hombres tuvieron un estado inflamatorio más grave25. Por otro lado, Carotti et al., encontraron una acelerada aterosclerosis por aumento del GIMc en 40 pacientes con AR, mayor que en el grupo control26. Un estudio colombiano demostró que el 54% de los pacientes con AR presentaba un GIMc mayor de 0,91mm correlacionándolo con aterosclerosis subclínica severa, al igual que los estudios realizados por González-Juanatey, Mohan y Vázquez-Del Mercado, en los cuales también se demuestra un aumento en el GIMc en esta patología reumática27–30.
Artritis psoriásicaGutiérrez et al., determinaron la prevalencia de aterosclerosis carotídea subclínica en 216 pacientes con AR o artritis psoriásica, utilizando el método automatizado, observaron que un 66% con AR y un 67% con artritis psoriásica tuvieron un incremento marcado en el GIMc sin evidencia clínica31. En otro estudio, se evaluó la relación del síndrome metabólico y el GIMc entre 343 pacientes con psoriasis o artritis psoriásica. El 42,2% de pacientes con psoriasis y el 57% con artritis psoriásica tuvieron mayor prevalencia de síndrome metabólico y mediciones mayores del GIMc que los pacientes con psoriasis, lo que contribuye a un mayor riesgo de enfermedad cardiovascular32.
Mazlan et al., estudiaron el GIMc y los factores de riesgo cardiovascular en una población de 63 pacientes con artritis psoriásica, usando el método convencional, demostrando una asociación significativa entre el riesgo cardiovascular con el incremento del GIMc, sin embargo, no hubo asociación con el estado de actividad de la enfermedad33. González-Juanatey et al., demostraron una mayor prevalencia de aterosclerosis subclínica en 59 pacientes con artritis psoriásica, con respecto a los controles34.
Síndrome de SjögrenExisten algunos datos sobre el riesgo de eventos cardiovasculares en el SS, en relación con la presencia de valvulopatías, derrame pericárdico, hipertensión pulmonar, pero pocos con medición del GIMc35. Bartoloni et al., analizaron retrospectivamente una cohorte de 1.343 pacientes que fue comparada con un subgrupo de 788 pacientes de género femenino, en edades comprendidas entre 35-74 años y 4.774 mujeres sanas de la misma edad, encontrando mayor prevalencia de factores de riesgo cardiovascular como hipertensión arterial sistémica e hipercolesterolemia36. De igual manera lo demuestra el estudio realizado por Kang et al., donde la hiperlipidemia y las arritmias cardiacas son las principales causas de comorbilidad en los pacientes con SS37.
Se han reportado 4 estudios en los últimos 10 años con respecto a la medición del GIMc. Los 2 primeros realizados por Vaudo et al., y Gravani et al., quienes demostraron un incremento en el GIMc con respecto al grupo control38,39. En contraposición con 2 estudios realizados por Zardi et al., y Akyel et al., en los cuales no hubo diferencia significativa en cuanto al GIMc con respecto al grupo control40,41.
GotaEn lo que respecta a la artritis gotosa solo existen 2 reportes en la literatura relacionados con la evaluación del GIMc y la aterosclerosis subclínica. Cukurova et al., estudiaron 55 pacientes con gota, encontrando un incremento en el GIMc con respecto al grupo de pacientes con hiperuricemia asintomática. Il’ina et al., en una población de 89 pacientes con gota, demostraron que 37 tenían placas ateromatosas42,43.
Esclerosis sistémicaLos pacientes con ES tienen mayor prevalencia de formación de placas ateromatosas con respecto al grupo control, tal como lo demostraron Schiopu et al. En contraste, en otro estudio se demostró un leve incremento del GIMc, pero sin significación estadística con respecto al grupo control44.
En una revisión sistemática, se incluyeron 14 estudios que evaluaron el GIMc, reportando una alta prevalencia de aterosclerosis subclínica en estos pacientes45–47. En los últimos 10 años, se han reportado en la literatura varios estudios que analizan el incremento del GIMc en pacientes con ES, como marcador predictivo de aterosclerosis subclínica. Un estudio realizado por Vettori et al., reportó aterosclerosis subclínica en 14/50 pacientes, correlacionando el GIMc con la edad avanzada y el uso prolongado de corticosteroides48. Tsifetaki et al., también describieron, en una población con 60 pacientes de ES, mayor prevalencia del GIMc comparado con el grupo control49. Bartoli et al., demuestran que el GIMc es indicador de enfermedad cardiovascular subclínica en su población de 35 pacientes con ES, donde el GIMc es mayor al compararlo con el grupo control, al igual que en el estudio realizado por Sherer et al50,51.
Szucs et al., demostraron que la edad y la duración de la enfermedad son directamente proporcionales al aumento del GIMc52.
OsteoartritisSe encontraron 3 estudios, 2 de ellos con una muestra representativa. En el estudio ROTTERDAM que incluyó 2.372 hombres y 3.278 mujeres, se observó aumento del GIMc particularmente en mujeres con OA de rodilla, también mayor formación de placas carotídeas en pacientes con OA de metacarpofalángicas e interfalángicas distales53. El estudio AGES-REYKJAVIK analizó una población de 2.195 hombres y 2.975 mujeres con OA de cadera y rodilla, encontrando que los pacientes con reemplazo total de la articulación tuvieron mayor severidad en cuanto a la formación de placas carotídeas54. Finalmente, un estudio pequeño realizado por Koutroumpas et al., demostró en 24 pacientes incremento del GIMc en OA erosiva55.
Lupus eritematoso sistémicoExisten varios estudios realizados que valoran el aumento del GIMc en esta enfermedad, la mayoría de ellos han demostrado su incremento con respecto a los controles. El estudio realizado por Frerix et al., con una población incluyente de 100 pacientes con LES y 90 con ES, revela la existencia de aterosclerosis subclínica medida por el GIMc en 26,5% de los pacientes con LES, frente al 28,9% de ES56. Kao et al., demuestran que los pacientes que han tenido incidentes cardiovasculares tienen mayor GIMc y formación de placas carotídeas en comparación con la población lúpica sin eventos previos cardiovasculares57.
Telles et al., evaluaron la progresión de la aterosclerosis en una cohorte de 181 pacientes lúpicos, de los cuales 157 fueron reevaluados después de 39 meses, demostrando en el 19,7% un aumento del GIMc58. El aumento en el GIMc también fue detectado en 15,4% en pacientes con nefritis lúpica59. Solo un estudio no mostró diferencias significativas en cuanto al GIMc versus el grupo control60. En cuanto a la formación de placas ateromatosas, 2 estudios reportaron su incremento, siendo el más reciente de ellos realizado por Hernández et al., el cual mostró que el 35,5% de la población con LES presentaba placas carotídeas61,62.
Síndrome antifosfolípidoEn lo que respecta a este síndrome, solo se encontraron 5 publicaciones, 3 de ellas reportaron un incremento marcado en el GIMc con respecto al grupo control, en contraposición con el estudio de Reshetniak et al., que no mostró diferencias significativas63–66. En un estudio comparativo entre síndrome antifosfolípido y LES, se evidenció que el síndrome antifosfolípido presenta mayor incremento del GIMc (48,3%) que el LES, sin embargo no se estableció ninguna relación significativa entre el tipo de anticuerpos antifosfolípidos con los cambios del GIMc67.
Vasculitis sistémicas primariasEn relación a las vasculitis sistémicas primarias, los estudios son pocos. Las patologías más estudiadas en los últimos 10 años, por orden de frecuencia, son: enfermedad de Behçet68–74, enfermedad de Kawasaki75–78, arteritis de Takayasu79–81, GPA-Wegener y, finalmente, arteritis de células gigantes82,83. Para la arteritis de Takayasu, un estudio realizado por Seth et al., sugiere que el GIMc puede ser un posible marcador de actividad de la enfermedad. En este estudio se evaluaron 74 arterias carótidas comunes en 37 pacientes con arteritis de Takayasu y 28 controles sanos, correlacionando sus datos con la presencia de actividad según criterios clínicos. Los resultados encontrados fueron mayor GIMc en 59% de la población estudiada, siendo prevalente en los pacientes que presentaban actividad de la enfermedad, teniendo la medición del GIMc una sensibilidad de 82% y una especificidad de 60%, como marcador de actividad77.
No se encuentran estudios con vasculitis de pequeños vasos asociada a ANCA del tipo granulomatosis eosinofílica con poliangeítis (Churg-Strauss) y poliangeítis microscópica. En todos los estudios analizados existe un marcado incremento en el GIMc con respecto al grupo control84.
ConclusiónLos pacientes con enfermedades reumáticas tienen un aumento del riesgo cardiovascular evaluado a través del GIMc, como lo demuestran varios estudios. Esta medición podría ayudar a detectar el riesgo de enfermedad cardiovascular subclínica en estas poblaciones, lo que permitiría al reumatólogo, en práctica clínica, implementar medidas terapéuticas oportunas para reducir la morbimortalidad, que ya de por sí está incrementada. La técnica ultrasonográfica automatizada por radiofrecuencia es todavía poco utilizada en reumatología, sin embargo, se ha demostrado que es útil, válida, accesible, reproducible y confiable, por lo que se espera que en el futuro la evaluación del riesgo cardiovascular en los pacientes reumáticos forme parte de la evaluación cotidiana.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.