El síndrome de anticuerpos antifosfolípidos es una condición de reciente descripción, cuyo diagnóstico se basa en la presencia de eventos trombóticos sin predisposición previa, con positividad de anticuerpos antifosfolípidos. Su presentación clínica incluye gran variedad de patrones, algunos de ellos no incluidos dentro de los criterios clínicos de diagnóstico, pero que deben ser conocidos. El compromiso dérmico es usual como livedo, sin embargo, la necrosis dérmica no es usual. Se presenta un caso de síndrome de anticuerpos antifosfolípidos con necrosis dérmica como manifestación primaria de la enfermedad.
Antiphospholipid antibodies syndrome is a recently described condition. The diagnosis of this condition is based on the presence of thrombotic events without previous predisposition and the positivity of anti-phospholipid antibodies. Its clinical presentation includes a variety of patterns, some of which are not included within the clinical criteria of the diagnosis, but must be known. Dermal involvement as livedo reticularis is common. However, dermal necrosis is not usual. Thus, a case of antiphospholipid syndrome with dermal necrosis is presented as a primary manifestation of the disease.
El síndrome de anticuerpos antifosfolípidos (SAF) es una condición descrita inicialmente por Hughes en 1986 como síndrome anticardiolipina1. Obtuvo su actual nombre un año después, acuñado por Harris et al.2.
Corresponde a un complejo de fenómenos trombóticos con historia de pérdidas gestacionales en mujeres en presencia de anticuerpos antifosfolípidos3. En su aproximación inicial las manifestaciones de trombosis venosa profunda y tromboembolia pulmonar suelen ser las más comunes4, e incluso forman parte de los criterios para su diagnóstico. Sin embargo, existen otras manifestaciones clínicas menos comunes que no forman parte de los criterios diagnósticos, pero que pueden llegar a ser sugestivas, como las lesiones dermatológicas, neurológicas, renales y hematológicas, de las que se debe tener conocimiento ya que en muchas oportunidades son la primera manifestación del síndrome o la única presentación de los casos denominados seronegativos4,5.
A continuación, presentamos un caso cuya primera manifestación del SAF fue el compromiso dérmico con progresión a necrosis, un compromiso poco usual dentro del espectro de esta enfermedad.
Presentación del casoSe presenta el caso de una mujer de 66 años de edad, de raza mestiza, de ocupación cesante, quien ingresa referida de un centro de atención primaria por cuadro clínico de 2 meses de evolución caracterizado por presencia de lesiones inicialmente livedoides, con algunas pápulas y costras localizadas predominantemente en extremidades inferiores, con compromiso de planta de pies, no dolorosas, que los últimos 10 días evolucionan con la formación de úlceras con fondo necrótico acompañadas de malestar general y fiebre. Inicialmente recibió tratamiento con acetaminofén y sultamicilina, con deterioro progresivo, por lo cual la remiten a mayor nivel de complejidad para estudio.
Al interrogatorio de la revisión por sistemas, indicaba que presentaba desde hace 4 años lesiones similares de menor severidad que relacionaba especialmente con el frío y que resolvían de forma espontánea. El único antecedente patológico conocido era hipotiroidismo en suplencia.
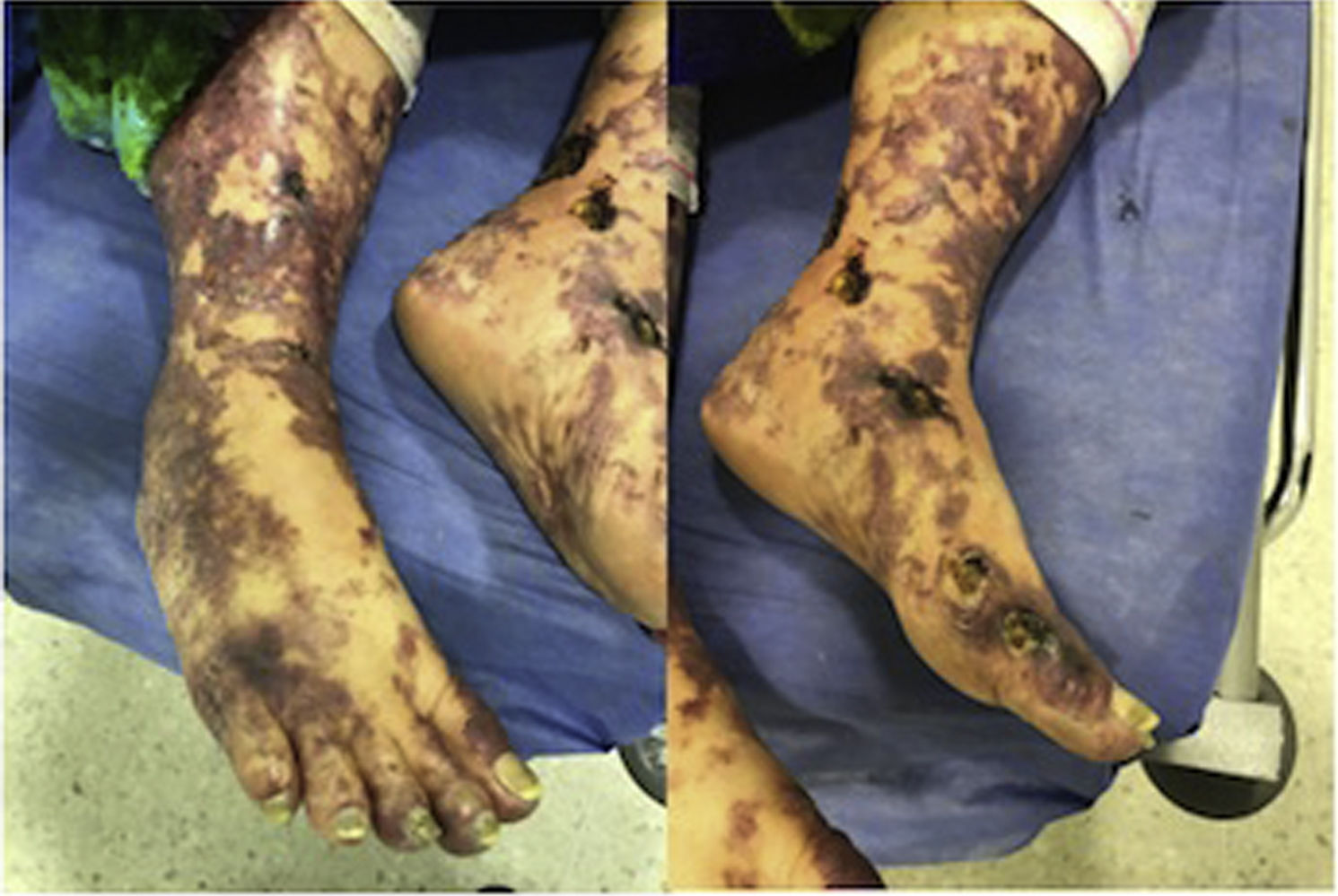
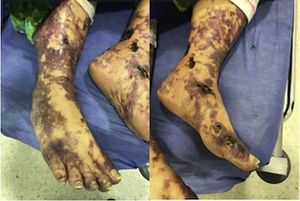
Al examen físico de ingreso se encontraba febril con compromiso livedoide de aspecto racemoso, con lesiones ulceradas de fondo necrótico que se localizaban predominantemente en extremidades inferiores en regiones perimaleolares y tibial anterior del tercio distal (fig. 1), que se extendían de forma proximal respetando abdomen y tórax; en el tercio distal de las extremidades superiores se apreciaba compromiso similar de menor severidad. Las mucosas y estructuras articulares no presentaban ninguna alteración.
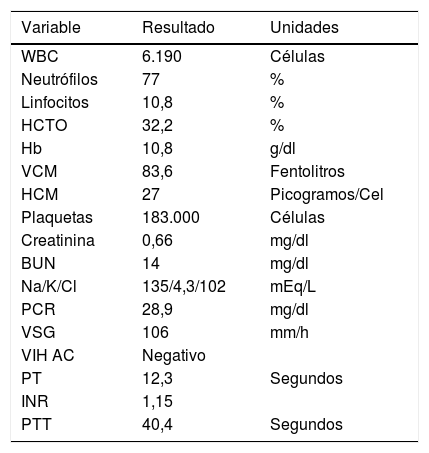
Los laboratorios de ingreso evidenciaban elevación de reactantes de fase aguda (VSG y PCR), sin reacción leucocitaria, con anemia leve de volúmenes normales. La función renal, electrólitos plasmáticos y bioquímica hepática fueron reportados como normales. Se documentó, además, alteración en tiempo de tromboplastina (PTT), que se repitió y en el que persistió esta alteración (tabla 1).
Laboratorios de ingreso
| Variable | Resultado | Unidades |
|---|---|---|
| WBC | 6.190 | Células |
| Neutrófilos | 77 | % |
| Linfocitos | 10,8 | % |
| HCTO | 32,2 | % |
| Hb | 10,8 | g/dl |
| VCM | 83,6 | Fentolitros |
| HCM | 27 | Picogramos/Cel |
| Plaquetas | 183.000 | Células |
| Creatinina | 0,66 | mg/dl |
| BUN | 14 | mg/dl |
| Na/K/Cl | 135/4,3/102 | mEq/L |
| PCR | 28,9 | mg/dl |
| VSG | 106 | mm/h |
| VIH AC | Negativo | |
| PT | 12,3 | Segundos |
| INR | 1,15 | |
| PTT | 40,4 | Segundos |
En la aproximación inicial, se consideró primero cuadro de vasculitis, teniendo en cuenta tanto condiciones primarias como secundarias. Sin descartar etiología infecciosa, se inició terapia empírica de amplio espectro, se solicitaron hemocultivos, procalcitonina, perfil inmunológico, radiografía de tórax y ecografía de abdomen. En los resultados (tabla 2) se observaba procalcitonina negativa, marcadores de autoinmunidad negativos, excepto para los anticuerpos anticitoplasma de neutrófilos, que fueron reportados en diluciones de 1/40 tanto para C-ANCA como para P-ANCA. Los resultados se confirmaron mediante inmunoanálisis (ELISA) para mieloperoxidasa (MPO) y proteinasa (P3), con resultados positivos.
Durante la hospitalización se documentaron algunas adenopatías cervicales y se planteó la posibilidad de que el cuadro correspondiese a compromiso paraneoplásico. Se tomaron imágenes de tomografía de tórax y abdomen, con evidencia de más adenopatías. Se indicó biopsia y estudio de médula ósea, y se obtuvieron los 2 reportes de histopatología negativos para malignidad.
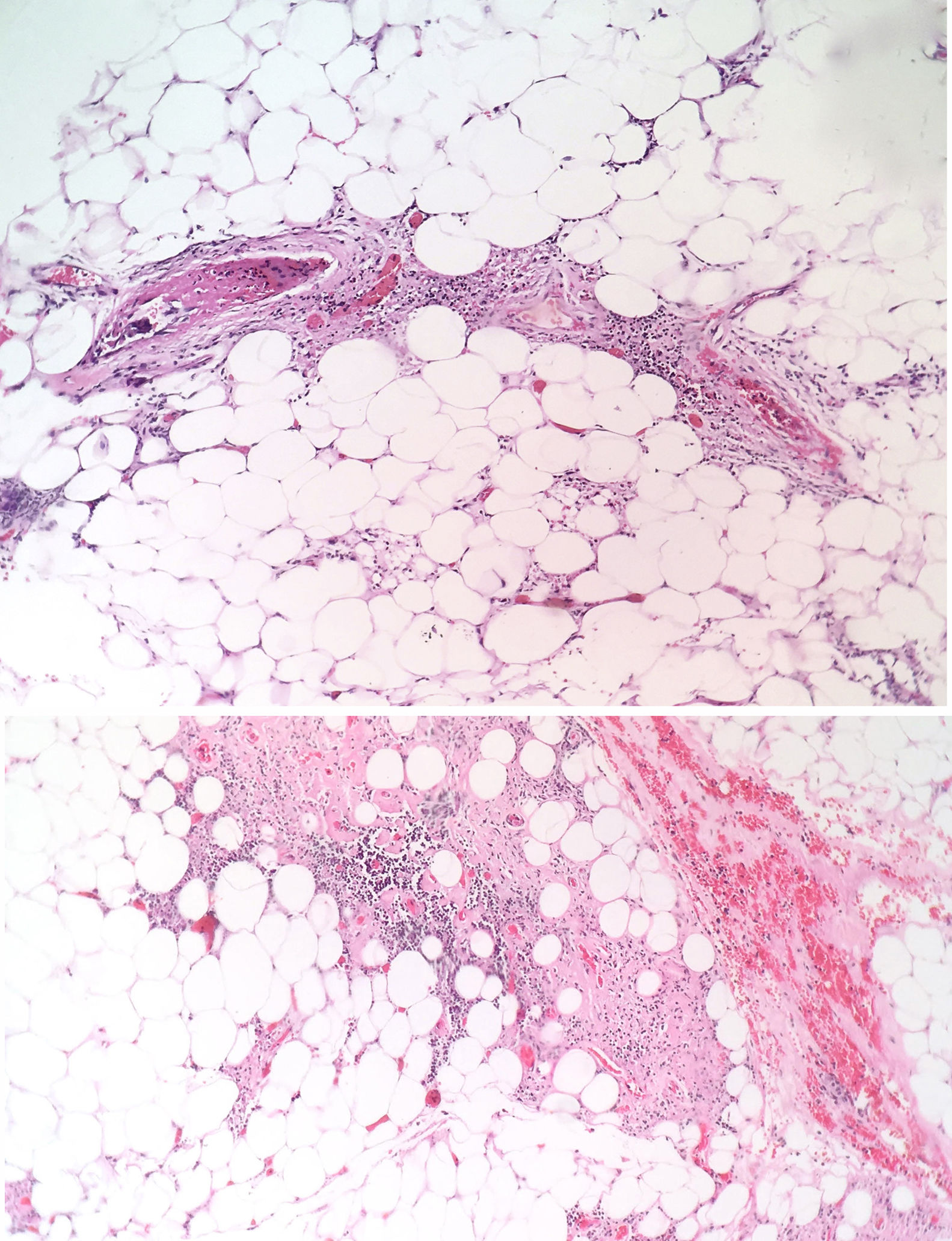
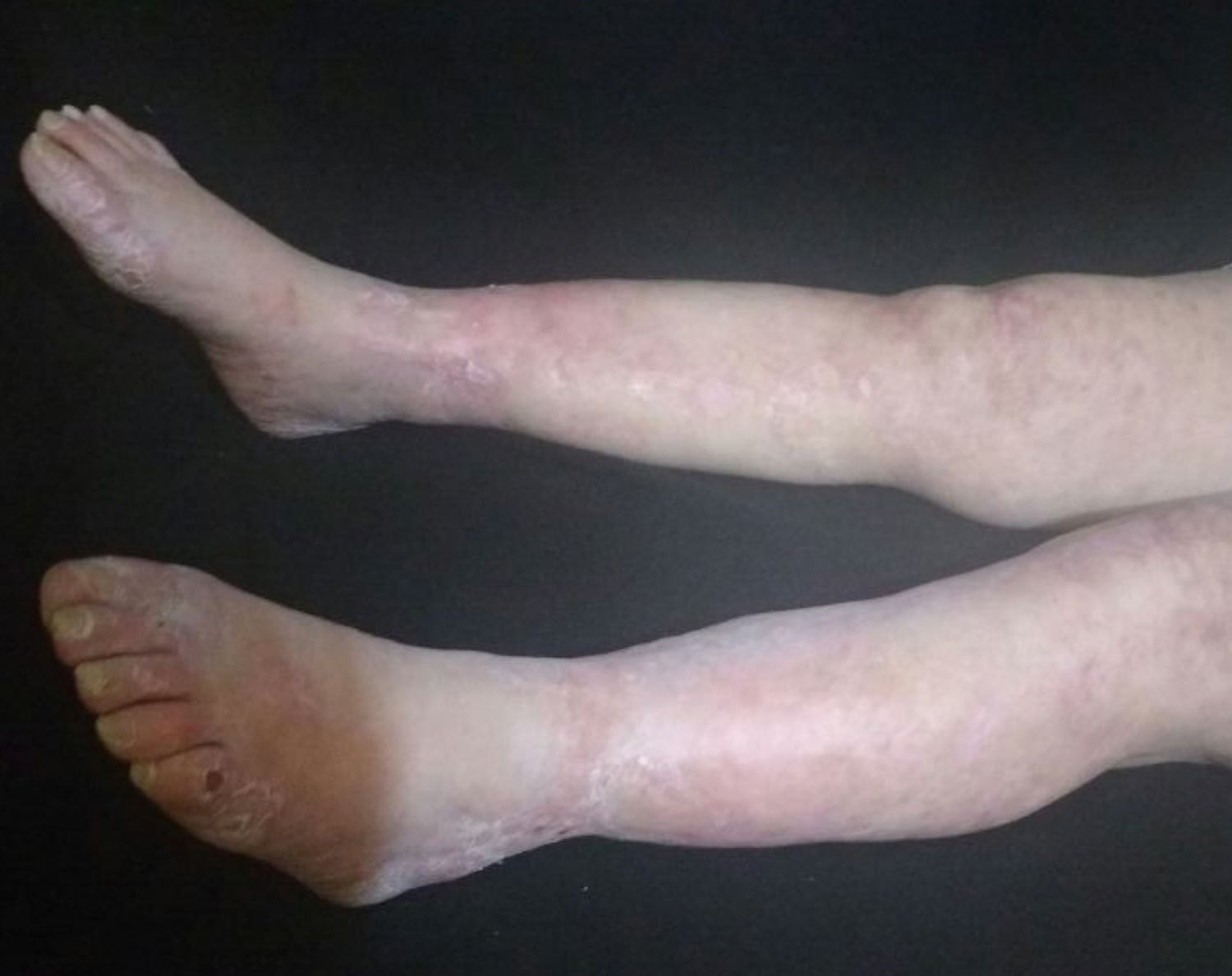
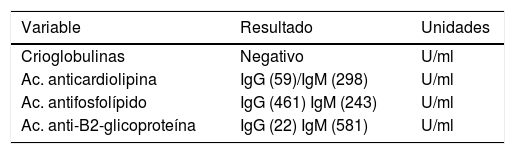
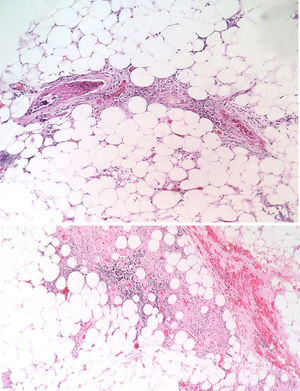
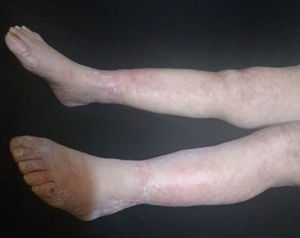
La paciente fue evaluada por el grupo de Dermatología, que describió patrón de púrpura retiforme que indicaba compromiso por trombosis, con persistencia de alteración del PTT. Se realizó biopsia de piel y pesquisa de anticuerpo antifosfolípidos (tabla 3). Los resultados obtenidos indicaban compromiso de vasculopatía oclusiva (fig. 2), con positividad de anticuerpos antifosfolípido, con anticuerpos antinucleares (ANA) y anti-ADN negativos. Se realizó diagnóstico de SAF primario con necrosis dérmica y se inició tratamiento con anticoagulación plena, terapia de inmunomodulación con esteroide más azatioprina, con respuesta clínica favorable. La paciente egresó, con mejoría del 90% en lesiones, y continuó tratamiento inmunomodulador sin nuevas lesiones durante su seguimiento ambulatorio (fig. 3). Los anticuerpos antifosfolípidos fueron analizados nuevamente a las 12 semanas del evento inicial como lo indican los lineamientos, y persistía la positividad (tabla 4).
Control anticuerpos tomados a las 12 semanas del evento inicial
| Variable | Resultado | Unidades |
|---|---|---|
| Perfil ENA(Anti-SSB-LA, anti-SM, anti-RNP, anti-SSA-RO) | Negativos | U/ml |
| Ac. anti-ADN | <12,3 (negativo) | U/ml |
| ANA | 1/160 (negativo) | Diluciones |
| Ac. anticardiolipina | IgG (24,7) IgM (353) | U/ml |
| Ac. anti-B2-glicoproteína | IgG (2,5) IgM (301) | U/ml |
| Anticoagulante lúpico TVVR | Índice 1,8 (++) |
TVVR: tiempo veneno de víbora de Rusell.
El SAF es una condición presente en el 1-5% de la población6. Su diagnóstico se basa en los criterios de Sapporo7, que incluyen la presencia de uno o más eventos de trombosis arterial o venosa demostrados, con presencia de 3 o más abortos (antes de la semana 10 de gestación), partos prematuros (antes de la semana 34) u óbitos en presencia de anticuerpos antifosfolípidos (anticoagulante lúpico, anticardiolipina y anticuerpo anti-B2-glicoproteína 1 en 2 mediciones con 12 semanas de diferencia entre las tomas).
Dentro de las posibles manifestaciones, es la trombosis venosa profunda sin factor desencadenante la de más frecuente presentación (31,9%). Sin embargo, existen otras manifestaciones no incluidas dentro de los criterios, pero igualmente frecuentes tales como trombocitopenia (21,9%), manifestaciones neurológicas (corea, esclerosis múltiple like), nefropatía asociada a anticuerpos antifosfolípidos o compromiso valvular cardiaco, que deben tenerse en cuenta al momento de suscitar la sospecha diagnóstica5,6. Para este caso en particular, es el patrón de presentación dérmico el que puede dificultar el diagnóstico, pues es bien conocido que la afección dérmica en paciente con SAF está presente en un 20% aproximadamente como livedo, que puede ser regular (lesiones de aspecto circular, cerradas) o racemoso (lesiones circulares rotas e irregulares), este último es el más distintivo y considerado factor de riesgo independiente para trombosis8,9. La presencia de estas lesiones debe dar lugar a la sospecha diagnóstica, ya que este patrón semiológico deriva de procesos de microtrombosis en la red vascular dérmica.
Los mecanismos de los fenómenos trombóticos están poco dilucidados: estudios en modelos animales han demostrado que la administración de anticuerpos antifosfolípidos no necesariamente ocasionan fenómenos trombóticos espontáneos, lo que da lugar a una hipótesis que involucra múltiples fenómenos predisponentes, como las infecciones o lesiones vasculares10,11. Los anticuerpos anti-B2 glicoproteína parecen tener un rol fundamental y conferir un riesgo especial para los fenómenos trombóticos. Estos han demostrado activar plaquetas, células endoteliales y monocitos mediante su unión a complejos toll-like receptor 2 (TLR2), TLR4, anexina A2, y generan la activación de señales intracelulares que se traduce en mayor fenotipo trombótico12.
Adicionalmente, los anticuerpos antifosfolípidos también han mostrado un rol en los fenómenos trombóticos. Estos compiten con la proteína C activada por la unión a los fosfolípidos, limitando la acción de esta proteína en su sustrato13.
Las lesiones en piel son el producto de fenómenos trombóticos con oclusión vascular completa, lo que conduce a daño vascular en la piel. Las figuras anguladas reflejan la arquitectura vascular superficial trombosada, con aspecto hemorrágico por extravasación de células rojas14,15. Si esto progresa, se pueden apreciar fenómenos necróticos como sucedió en este caso particular; esta manifestación es menos frecuente y su presencia hace difícil el diagnóstico por la necesidad de confirmar otras hipótesis diagnósticas. En series grandes como la de Cervera et al.8, que evaluaron más de 1.000 pacientes con SAF, la necrosis dérmica fue vista solo en el 2,1% de los pacientes y similar distribución de frecuencia fue observada en el estudio de Pinto-Almetida et al.9.
Respecto a la clasificación de SAF en primario o secundario, se ha visto que cerca de la mitad son primarios y, del restante 50% secundario, la mayoría se asocia a lupus eritematoso sistémico8. Esta razón es la justificación para la pesquisa con autoanticuerpos tipo ANA y anti-ADN en estos pacientes; la negatividad no excluye un caso secundario de SAF, pero sí resta la principal condición asociada (lupus eritematoso sistémico).
En el reporte presentado, las diluciones para anticuerpos anticitoplasma de neutrófilo (ANCA) (C-ANCA y P-ANCA) fueron positivas. Al respecto, se rescata que estos estudios pueden estar positivos en enfermedades reumatológicas (lupus eritematoso sistémico; esclerosis sistémica, miositis inflamatoria, SAF, síndrome de Sjögren), especialmente el patrón P-ANCA, debido a errores en la interpretación por la presencia ANA, ya que en la confirmación por inmunoanálisis (ELISA), los resultados para mieloperoxidasa (MPO) y proteinasa 3 (PR3) fueron negativos. Así fue reportado en un estudio realizado por Merkel et al.16. En este caso en particular la confirmación de los ANCA fue positiva, sin encontrar evidencia histopatológica de compromiso por vasculitis. Al respecto, no encontramos información adicional que respaldara el hallazgo, por cuanto se interpretó como un patrón no usual de presentación.
Por último, se debe resaltar la importancia del compromiso necrótico en el tratamiento, ya que se considera fenómeno trombótico mayor, lo que configura la necesidad de anticoagulación plena indefinida5,9.
ConclusiónEl SAF es una condición con una gran variedad de manifestaciones clínicas que, por lo general, representan un estado protrombótico característico; sin embargo, algunas de sus manifestaciones no forman parte de los criterios, pero deben ser conocidas ya que pueden corresponder a la manifestación inicial del síndrome. El compromiso dérmico por SAF es usual en la presentación de livedo reticularis; sin embargo, otras como la necrosis dérmica, digital o las lesiones subungueales en astilla no lo son, por lo que estos patrones se deben tener siempre en mente para encauzar el proceso diagnóstico de forma temprana.
Conflicto de interesesLos autores del presente manuscrito declaran no tener ningún conflicto de interés.
Agradecimientos al Servicio de Patología del Hospital Militar Central, en especial a la Dra. María Janeth Vargas Manrique por su colaboración en la preparación, adquisición e interpretación de las imágenes de histopatología.