El lupus eritematoso sistémico (LES) es una enfermedad crónica, autoinmune, de etiología desconocida, que afecta a cualquier órgano o tejido. La nefritis lúpica (NL) es la causa más frecuente de compromiso renal en LES. Aproximadamente el 50% de los pacientes con LES presentan NL en algún momento de su enfermedad, siendo un factor de riesgo para morbimortalidad.
ObjetivoProveer información actualizada sobre la NL, evaluando la fisiopatología y las manifestaciones clínicas, como también poniendo especial énfasis en el diagnóstico y las estrategias terapéuticas utilizadas en la práctica clínica.
Materiales y métodosSe realizó una revisión narrativa con respecto a pacientes con LES que desarrollaron NL, en las bases de datos Google Scholar, Embase, SciELO, Scopus y Medline, utilizando los términos MeSH nefritis lúpica, biopsia, lupus eritematoso sistémico y tratamiento.
ResultadosSe escogieron 54 estudios que llenaban los requisitos de la búsqueda, 18 fueron artículos originales, 13 revisiones de temas, 9casos y controles, 7 estudios de cohorte y 7 estudios experimentales. La fisiopatología es heterogénea y los factores genéticos y ambientales contribuyen a ella. Entre las principales manifestaciones clínicas se encuentran la proteinuria, la hematuria y las anormalidades tubulares. No existe una forma exclusiva de tratar la NL, varía según la gravedad de la enfermedad y el riesgo de daño renal progresivo, de acuerdo con el resultado de la biopsia renal estandarizada por la clasificación de ISN/RPS.
ConclusionesEl objetivo del tratamiento es mejorar la función renal, disminuir la proteinuria y corregir marcadores inmunológicos, evitando así la aparición de complicaciones. Para mejorar el pronóstico deben desarrollarse nuevas técnicas que permitan evaluar el inicio temprano de la actividad de la enfermedad renal o su recaída para dar inicio al manejo temprano, de manera que se genere una reducción en la mortalidad y que la calidad de vida mejore.
Systemic lupus erythematosus (SLE) is a chronic, autoimmune disease of unknown aetiology that affects any organ or tissue. Lupus Nephritis (LN) is the most common cause of kidney involvement in SLE. Approximately 50% of patients with SLE suffer LN at some point in their disease, being a risk factor for morbidity and mortality.
ObjectiveTo provide updated information on LN, evaluating the pathophysiology, clinical manifestations and placing special emphasis on the diagnosis and therapeutic strategies used in clinical practice.
Materials and methodsA narrative review was carried out regarding patients with SLE who developed LN in the Google Scholar, Embase, SciELO, Scopus and Medline databases using the MeSH terms lupus nephritis, biopsy, systemic lupus erythematosus, treatment.
ResultsA total of 50 studies were chosen that met the search requirements. These included 18 original articles, 11 reviews, 9 cases and controls, 7 cohort studies, and 5 experimental studies. The pathophysiology is heterogeneous and genetic and environmental factors contribute to it. Proteinuria, haematuria, and tubular abnormalities are among the main clinical manifestations. There is no single way to treat LN, it varies according to the severity of the disease and the risk of progressive kidney damage; according to the renal biopsy result, standardized by the ISN / RPS classification.
ConclusionsThe purpose of treatment is to improve kidney function, decrease proteinuria, correct immunological markers, avoiding the appearance of complications. To improve the prognosis, new techniques must be developed that will allow us to evaluate the onset of kidney disease activity or its relapse to initiate early management, generating a reduction in mortality and improving quality of life.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune de etiología desconocida que se caracteriza por la producción de autoanticuerpos contra un amplio rango de autoantígenos, entre los cuales se encuentran el ADN, el ARN, las histonas y otros componentes nucleares. Es una enfermedad multisistémica, con amplia variabilidad clínica, que afecta a cualquier órgano o sistema, como la piel, las mucosas, las articulaciones, el cerebro, el corazón, el riñón, el pulmón y el tracto gastrointestinal1.
Los heterogéneos síntomas de la enfermedad hacen muy difícil su caracterización en los pacientes, pues no existen los mismos patrones entre ellos, lo que complica su diagnóstico. Por tal razón, la prevalencia de la enfermedad es variable, yendo desde uno por cada 100.000 en la población danesa hasta 8,7 por cada 100.000 en Brasil2. Geográficamente, existe una versatilidad en la presentación inicial del LES, de tal manera que en los pacientes europeos hay mayor manifestación cutánea y en los pacientes africanos suelen presentarse con mayor frecuencia manifestaciones a nivel renal2. En Colombia, en el año 2016, los registros reportaban 41.804 pacientes con LES, para una prevalencia estimada de 91,9/100.000 sujetos (con base en una población total de 47.663.162 habitantes), siendo más frecuente en mujeres (89% de los casos), con una relación 7,9:1, más alta en el grupo de edad de 45 a 49 años3.
Dentro de los órganos comúnmente afectados por esta enfermedad se encuentran los riñones: hasta el 60% de las personas con LES puede tener compromiso renal y entre el 25 y el 30% tiene manifestaciones renales en el momento del diagnóstico, que puede asociarse o no con compromiso general4. La nefritis lúpica (NL) ocurre aproximadamente en el 50% de los pacientes con LES y es la causa más común, pero no la única, de lesión renal en esta patología. La NL es una de las manifestaciones más graves del LES, la cual suele presentarse en los 5primeros años de la enfermedad y es uno de los factores predictores de morbimortalidad, incluso puede estar presente en el diagnóstico inicial5.
Esta revisión tiene como objetivo hacer una descripción de la NL, evaluando su fisiopatología y manifestaciones clínicas, y poniendo especial énfasis en el diagnóstico y las estrategias terapéuticas utilizadas en la práctica clínica que impactan tanto en la severidad de la enfermedad como en la calidad de vida de los pacientes.
MétodosBúsqueda de la literaturaSe realizó una búsqueda sistemática de artículos hasta diciembre del 2020, con el fin de evaluar los avances del tratamiento de NL y su impacto en la remisión de la enfermedad. Se buscaron estudios primarios, revisiones sistemáticas y metaanálisis en las principales bases de datos científicas Google Scholar, Embase, SciELO, Scopus y Medline, utilizando los términos MeSH «Lupus nephritis», «Treatment», «Biopsy» y «Systemic lupus erythematosus», enlazados con el conector booleano AND, para cada uno de los componentes de la pregunta PICO (problema, intervención, comparador, resultados). La búsqueda se restringió a artículos en español y en inglés.
Selección de artículos y extracción de informaciónTras finalizar la búsqueda, los artículos fueron recopilados en una base de datos construida en Microsoft Excel; se excluyeron aquellos que se encontraban duplicados y se seleccionaron los que cumplieran con los criterios de inclusión, que incluyeran las palabras claves en el título o en el abstract. Finalmente, para la selección de los artículos relevantes se hizo un consenso entre todos los autores para unificar y revisar la base de datos.
Criterios de elegibilidadSe incluyeron artículos originales, estudios de cohorte, casos y controles, revisiones de temas y estudios experimentales que abarcaran pacientes adultos con LES que hayan desarrollado NL. La intervención consistió en estudios que describieran la fisiopatología, las manifestaciones clínicas, la clasificación y las indicaciones de biopsia, así como una aproximación diagnóstica-terapéutica de la NL. Además de esto, también fueron elegibles los estudios que informaran los resultados clínicos de pacientes con NL. En los estudios analíticos se incluyeron todos los que contemplaban la exposición, la población objeto y las estrategias de control de sesgo.
Se excluyeron artículos duplicados, sin acceso a texto completo, reportes de caso y series de casos; también se descartaron estudios que no se hubieran realizado en la población de interés o que no presentaran resultados relevantes para dicha población por separado de los de otras poblaciones.
Extracción de datosLos estudios que cumplieron con los criterios de inclusión se analizaron para la extracción de datos. Los datos fueron extraídos de manera independiente por 2de los autores (MCMA y JDRB). Posteriormente, los resultados fueron revaluados por otros autores (AJAH, TRY) a efectos de analizar la consistencia de los datos, para lo cual se revisaron todos los títulos o resúmenes de las publicaciones encontradas y se llevó a cabo la evaluación de elegibilidad. Después de esto, otro autor (RDA) recopiló la información en Microsoft Excel con respecto a la población, el diseño del estudio, las características clínicas, el tratamiento y los resultados de todos los estudios incluidos. Los artículos recuperados se rechazaron si no cumplían los criterios de elegibilidad. Finalmente, otro investigador (GAM) verificó la información extraída. Cualquier discrepancia o información faltante se resolvió por consenso. No se realizó metaanálisis debido a la alta heterogeneidad de los estudios.
ResultadosDespués de la búsqueda inicial con los términos de búsqueda se encontraron 2.754 artículos, la mayoría en Scopus y Google Scholar. Luego se eliminaron los duplicados, se procedió a examinar los títulos y los resúmenes, y se excluyeron 1.590 artículos. Adicionalmente, en la fase de selección se excluyeron 10 estudios que no incluían desenlaces en criterios de remisión. Se aplicaron los criterios de elegibilidad de 184 textos completos. Asimismo, se excluyeron 134 artículos cuyos títulos contenían los términos de búsqueda porque no fue posible conocer los textos completos. Finalmente, se escogieron 54 estudios que llenaban los requisitos de la búsqueda, 18 fueron artículos originales, 13 revisiones de temas, 9casos y controles, 7 estudios de cohorte y 7 estudios experimentales. A continuación, se describen los aspectos más relevantes hallados en la revisión de la literatura.
Epidemiología y fisiopatologíaAlrededor del 74% de los pacientes con LES desarrollaran NL en algún momento durante el curso de su enfermedad6. La prevalencia de NL es variable en diferentes regiones: en Estados Unidos y Canadá es del 4,8 al 78,5% por cada 100.000 habitantes; en Europa, del 25 al 91% por cada 100.000 habitantes; en Australia, del 19 al 63% por cada 100.000 habitantes; en China, del 30 al 50% por cada 100.000 habitantes; en Japón, del 8 al 18% por cada 100.000 habitantes3. En Colombia, del 50 al 55% de los adultos7 y el 75% de los niños8 con LES presentan NL en algún momento de su evolución.
La heterogénea fisiopatología de la NL es consecuencia de la interacción entre factores genéticos, ambientales y sociodemográficos que influyen en las manifestaciones clínicas y el compromiso renal9. Este compromiso va desde una nefritis silente hasta un síndrome nefrótico con deterioro del filtrado glomerular. Este último tiene una progresión rápida a enfermedad renal terminal, lo que determina la necesidad de un diagnóstico temprano.
En relación con los datos sociodemográficos, los hombres con LES suelen tener una enfermedad más agresiva, con mayor compromiso renal y cardiovascular, así como mayor probabilidad de desarrollar insuficiencia renal crónica terminal (IRCT) que las mujeres. Factores como el ingreso económico, el nivel de educación y el acceso a los servicios de salud son variables importantes en el pronóstico del LES10,11. Entre los factores de riesgo para el desarrollo de NL se encuentran el sexo masculino, la edad temprana en el momento del diagnóstico, la pobreza y el difícil acceso al sistema de salud12.
Hay una enorme expresión racial que condiciona la aparición o la evolución de la NL. En un estudio multicéntrico norteamericano, la incidencia de NL y progresión a IRCT es mayor en afroamericanos (51%), seguidos de hispanos (43%) y asiáticos (35%), en comparación con pacientes caucásicos (14-23%)13. Se ha observado que los afroamericanos y los hispanos desarrollan una enfermedad más severa y de peor evolución que los caucásicos14-16, con una caracterización histopatológica que se expresa mediante formas proliferativas y niveles más elevados de creatinina sérica y proteinuria en el momento del diagnóstico de NL, lo que lleva a una mayor probabilidad a IRCT17.
La supervivencia renal a un plazo de 10 años a partir del diagnóstico es significativamente mayor en pacientes hispanos y caucásicos que en afrodescendientes (68% vs. 31%)18. Sin embargo, lograr una respuesta clínica completa al tratamiento es fundamental para preservar la salud renal a largo plazo. La mortalidad por NL ocurre entre el 5 y el 25% de los pacientes con NL proliferativa dentro de los 5años posteriores al inicio.
Estudios de asociación genómica han demostrado la presencia de más de 50 polimorfismos genéticos que influyen en la aparición de NL, entre ellos la apolipoproteína L1, el receptor alfa del factor de crecimiento derivado de plaquetas y la hialuronano sintasa 219. Modificaciones en los alelos que corresponden al complejo mayor de histocompatibilidad, particularmente HLA-DR4 y HLA-DR11, generan un factor protector contra la NL, mientras que DR3 y HLA-DR15 conllevan un mayor riesgo20. Se presentan además otras asociaciones, como las del STAT4, el PTPN 22 y el ITGAM21. Otros estudios relacionan variantes alélicas en receptores de inmunoglobulina (Ig) G que probablemente contribuyan a las disparidades raciales y étnicas del LES y la NL. Es necesario llevar a cabo más estudios para explicar la relación y la contribución genética al desarrollo y el riesgo de NL22.
La NL se desarrolla en individuos con una desafortunada combinación de variantes genéticas que predisponen y comprometen el mantenimiento de la tolerancia inmunitaria al material nuclear endógeno. La producción de alteraciones anómalas en la inmunidad innata y adaptativa influye en la patogenia de la enfermedad; la aparición de autoanticuerpos constituye un requisito indispensable. Los autoanticuerpos dirigidos contra antígenos nucleares celulares, como DNA, Ro, Smith, C1q, alfa actinina, antianexina, proteína ribosomal y antinucleosoma, llevan a la formación de inmunocomplejos que se acumulan en diferentes estructuras renales, como la membrana basal glomerulal, las células mesangiales, las células epiteliales del túbulo proximal, los podocitos, las células endoteliales y epiteliales glomerulares; también pueden formarse in situ23. Las células T y B contribuyen a la progresión de la enfermedad, en tanto que la producción de autoanticuerpos nefritógenos restringidos por clonación, el reclutamiento de macrófagos y la producción de citocinas proinflamatorias interleucina (IL)-2, IL-8 e interferón alfa conducen a la formación de complejos inmunes que llevan a inflamación, infiltración, lesión intrarrenal y desarrollo de proteinuria24.
La consecuencia de la pérdida de tolerancia es la autovacunación y la persistencia de anticuerpos antinucleares (ANA) elevados durante toda la vida, lo que indica clones de células T y B autorreactivos persistentemente activos. Solo un subgrupo de pacientes desarrolla síntomas clínicos, a menudo con infecciones (virales) o influencias hormonales que proporcionan un estímulo inespecífico para la expansión de estos clones de linfocitos autorreactivos25.
Los adultos pierden continuamente los podocitos, los cuales no son reemplazados, lo que lleva inicialmente a una glomerulopatía focal-segmentaria que puede progresar más adelante a glomeruloesclerosis focal-global. Esta es una causa de envejecimiento, pérdida de nefronas y aumento de la incidencia de IRCT en la población anciana. Un solo episodio de NL en los primeros años de vida, incluso si es bien tratado y controlado, puede llevar a una pérdida significativa de podocitos y nefronas, lo que sinergiza con la pérdida de nefronas relacionada con el envejecimiento en el futuro. Así, una historia de NL es un factor de riesgo mayor para IRCT y mortalidad cardiovascular exagerada décadas antes del final de la vida normal25.
La actividad de nefritis por lupus no controlada acelera la pérdida de nefronas y potencia el riesgo de enfermedad renal en etapa terminal temprana y muerte. Dada la hipertrofia que se produce en las nefronas restantes, la tasa de filtración glomerular (TFR) sobrestima significativamente el número de nefronas. Esto implica que una creatinina sérica levemente aumentada de 1,3mg/dl, que representa una TFR de 45ml/min, puede ser generada por solamente el 35% de las nefronas originales, es decir, una pérdida más avanzada de masa renal causada por la autoinmunidad sistémica que se asocia con pérdida de la reserva renal e hiperfiltración persistente. La pérdida de autorregulación de la perfusión renal, que es particularmente importante en pacientes con hipertensión arterial, población en la que en la actualidad se utilizan como biomarcadores la proteinuria, las células y los sedimentos urinarios, no refleja el número de nefronas. La aplicación clínica de un biomarcador que identifique el número de nefronas queda por identificar y validar25.
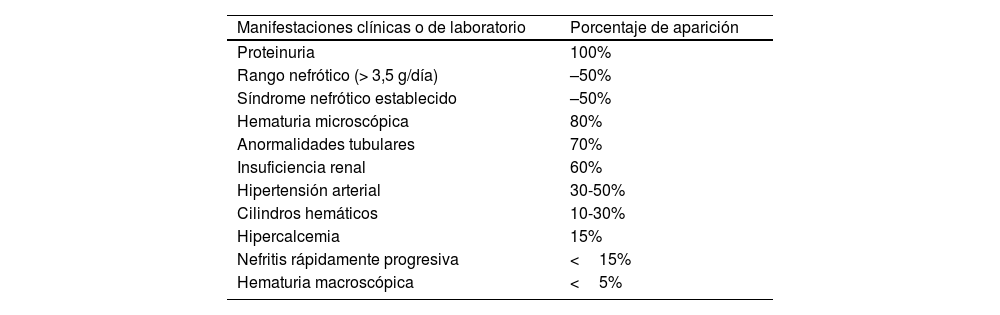
Manifestaciones clínicas y diagnósticoLa NL se presenta en pacientes con LES conocido; no obstante, en algunos casos se presenta como manifestación aislada de la enfermedad, sin signos evidentes de LES, los cuales son en estos casos un desafío médico en la aproximación diagnóstica. Las características clínicas más comúnmente encontradas en la NL (tabla 1) son la proteinuria, el sedimento urinario anormal debido a hematuria microscópica y cilindros hemáticos, la lesión renal y la hipertensión arterial4,26.
Manifestaciones clínicas de la nefritis lúpica
| Manifestaciones clínicas o de laboratorio | Porcentaje de aparición |
| Proteinuria | 100% |
| Rango nefrótico (> 3,5 g/día) | –50% |
| Síndrome nefrótico establecido | –50% |
| Hematuria microscópica | 80% |
| Anormalidades tubulares | 70% |
| Insuficiencia renal | 60% |
| Hipertensión arterial | 30-50% |
| Cilindros hemáticos | 10-30% |
| Hipercalcemia | 15% |
| Nefritis rápidamente progresiva | <15% |
| Hematuria macroscópica | <5% |
Fuente: elaboración propia.
La proteinuria es la manifestación principal de la NL y debe estar presente para el diagnóstico clínico de NL. Se presenta en el 50% en rango nefrótico y el otro 50% asociada con un síndrome nefrótico establecido. En los pacientes con síndrome nefrótico ya establecido, el riesgo de complicaciones derivadas de la NL es mayor y se asocia con hipercolesterolemia y trombosis de la vena renal. La hipertensión arterial es más común en aquellos que presentan formas más severas de NL.
En cuanto a la lesión renal, esta se mide por disminución de la TFR y aumento de la creatinina sérica. La presencia de 5leucocitos o eritrocitos (piuria o hematuria aislada) en una muestra de orina tomada en la mitad del chorro urinario, especialmente en presencia de trazas de albúmina, es indicativa de NL activa27. Generalmente, la magnitud del daño renal no es proporcional a la cantidad o intensidad de síntomas extrarrenales27.
El curso característico de la NL lo constituyen episodios de brotes o exacerbaciones de la enfermedad seguidos por un periodo de quiescencia. Es importante evaluar la actividad lúpica ante la sospecha de NL, valorando la autoinmunidad y el compromiso sistémico: sistema nervioso central, cardiaco, pulmonar o hematológico con anemia hemolítica o trombocitopenia severa y derrame pericárdico severo. Asimismo, se deben evaluar índices de actividad validados como el Systemic Lupus Erythematosus Disease Activity Index (SLEDAI) o el del National Institute of Health (NIH)4,28.
Los criterios diagnósticos del American College of Rheumatology (ACR)29 y las recomendaciones de la European League Against Rheumatism and European Renal Association-European Dialysis and Transplant Association (EULAR/ERA-EDTA)30 se definen como la presencia de proteinuria persistente> 500mg/24h o 3+en muestra de orina ocasional o la presencia de cilindros celulares (hemáticos, granulosos, tubulares o mixtos). El grupo Systemic Lupus Erythematosus International Collaboratiing Clinics (SLICC)31 la define por la presencia de proteinuria ≥ 500mg/24h o proteinuria/creatinuria (UPCR) ≥ 50mg/mmol o cilindros eritrocitarios, y propone que la presencia de una biopsia renal compatible con NL más la presencia de ANA o anti-DNA son criterio suficiente para clasificar un paciente con NL.
Si bien la clínica y las pruebas de laboratorio orientan el diagnóstico de NL, la biopsia renal percutánea (BRP) da certeza y permite su caracterización. De tal manera, la BRP posee valor diagnóstico, pronóstico y terapéutico. La BRP es importante para el diagnóstico diferencial con enfermedades como la microangiopatía trombótica (TMA), el síndrome antifosfolipídico, la enfermedad de cambios mínimos, la glomeruloesclerosis focal y segmentaria, y la nefropatía por IgA32. Es el estándar de oro para determinar el diagnóstico y la clasificación del grado de compromiso de inflamación renal y cicatrización, es fundamental para su manejo terapéutico y pronóstico; sin embargo, al ser un procedimiento invasivo con posibles complicaciones, es inadecuada para la serie de seguimiento26.
La BRP está indicada ante la sospecha de compromiso renal, proteinuria confirmada mayor de 0,5g/día o cociente proteínas/creatinina en muestra matutina mayor de 0,5g/día, sedimento activo (microhematuria/leucocituria/cilindruria) o ante cambios en el curso clínico-evolutivo de una NL conocida33. Su pronta realización está asociada con un mejor pronóstico renal a mediano y largo plazo. Cuando el tratamiento es adecuado, sobre todo en pacientes con nefropatía clase iv, la sobrevida es del 90% a 5años. Es importante diagnosticar el lupus silencioso que en su mayoría es de clase ii, pero hay clases iv y v, formas mixtas que pueden tener este tipo de comportamiento34.
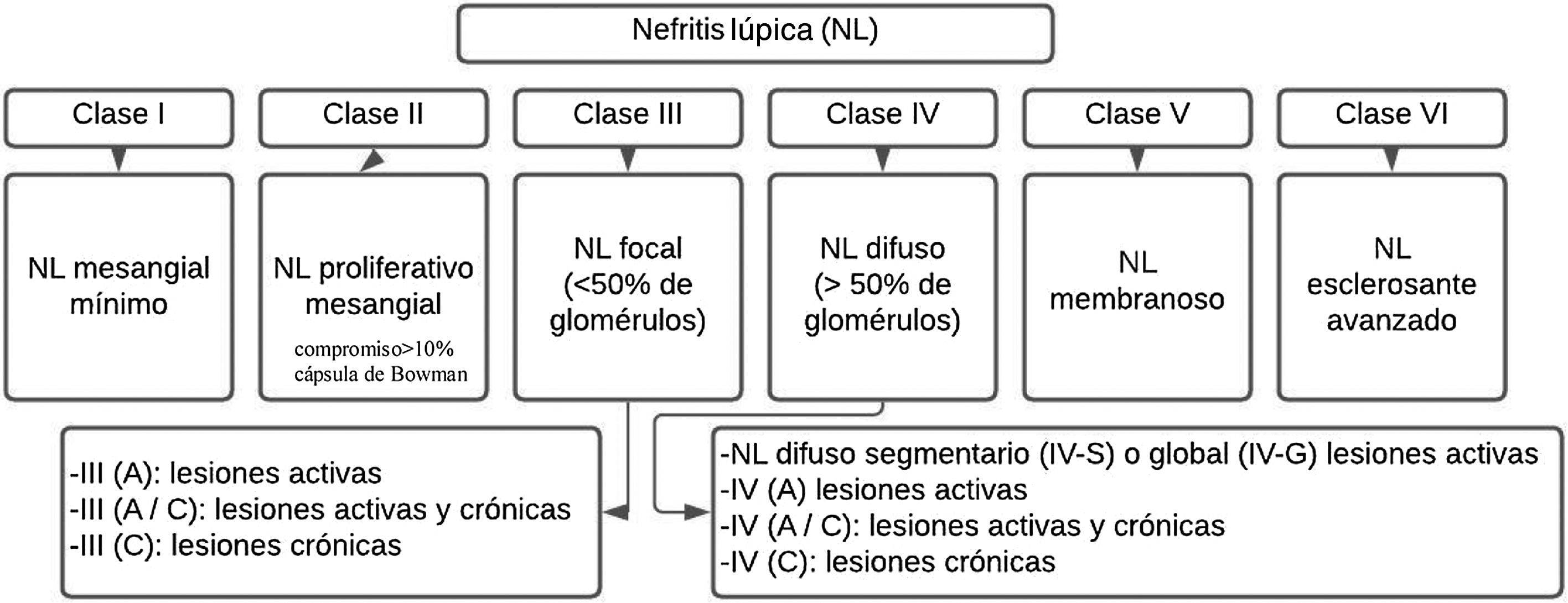
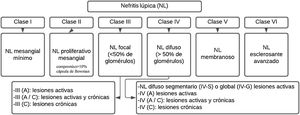
La NL se describe patológicamente utilizando la nomenclatura de la Sociedad Internacional de Nefrología/Sociedad de Patología Renal del 2003 (ISN/RPS)35 (fig. 1). Este sistema clasifica la NL de acuerdo con el sitio donde se acumulan los complejos inmunes en los glomérulos, mediante la presencia o ausencia de proliferación mesangial o endocapilar, la extensión general de la afectación glomerular (focal o difusa) y la lesión glomerular (global o segmentaria), y si la lesión glomerular es activa (inflamatoria) o crónica (esclerótica). De esta manera, se guían las decisiones de tratamiento.
Clasificación de la nefritis lúpica.
Adaptado de Weening et al.35.
Los pacientes con enfermedad limitada al mesangio (clase ii) generalmente no necesitan terapia específica para su enfermedad renal, pero pueden necesitar un tratamiento inmunosupresor para las manifestaciones extrarrenales del LES. Los pacientes con lesión principalmente crónica o daño en etapa terminal (clase vi) tampoco necesitan inmunosupresión para NL, pero pueden beneficiarse de medidas antiproteinúricas renoprotectoras. Las clases proliferativas (iii y iv) a menudo se tratan con inmunosupresión potente, mientras que la NL no proliferativa membranosa (clase v) se puede manejar de manera conservadora (terapia antiproteinúrica) si los pacientes tienen proteinuria subnefrótica, o inmunosupresión si los pacientes tienen proteinuria de rango nefrótico4.
Clases I y IIHistológicamente se propone un umbral de 3a 4células o áreas mesangiales sin incluir la región hiliar, recomendación que se alinea con la Clasificación de Oxford de Nefropatía por IgA I-IV, y debe especificarse que los núcleos de las células mesangiales estén rodeados de matriz28.
Clases III y IVLas recomendaciones actuales consideran que el término proliferación endocapilar es inapropiado y debe sustituirse por hipercelularidad endocapilar, el término medialuna debe utilizarse para una lesión consistente en hipercelularidad extracapilar, la cual se compone de una mezcla variable de células como fibrina y matriz fibrosa. Otro de los criterios es un compromiso de más del 10% de la capsula de Bowman. Por otra parte, el término medialuna celular se define por un compromiso mayor del 75% de las células y la fibrina, y menor del 25% de la matriz fibrosa28,36.
Por último, la medialuna fibrosa corresponde a cuando se presenta más del 75% de la matriz fibrosa y menos del 25% de las células y la fibrina, y el patrón mixto alude a cuando se posee entre el 25 y el 75% de células y fibrina, y el porcentaje restante está ocupado por matriz fibrosa. Se dice que hay adherencia cuando un área de continuidad aislada del material de la matriz extracelular se encuentra entre el penacho y la cápsula, incluso cuando el segmento subyacente no tiene esclerosis manifiesta35,36. La presencia de fibrina asociada con basamento glomerular, rotura de membrana o lisis de matriz mesangial se denomina necrosis fibrinoide y tiene como característica que no requiere de cariorrexis, al igual que la necrosis fibrinoide35,36.
Clases V y VISe recomienda su diagnóstico con base en la evidencia y se espera la realización de un estudio de fase 2 para su reclasificación; la dificultad se encuentra en la presencia de una extensión subendotelial permitida sin depósitos celulares y tendría que clasificarse como de clase iii. La clase vi rara vez se ve en nuestras biopsias renales; se ha propuesto una revaluación de esta clasificación dado que existen dificultades para diferenciar glomérulos globalmente escleróticos resultantes de lesiones activas de nefritis por lupus anteriores versus esclerosis global no específica asociada con otros factores (envejecimiento, hipertensión o lesiones de TMA curadas)28.
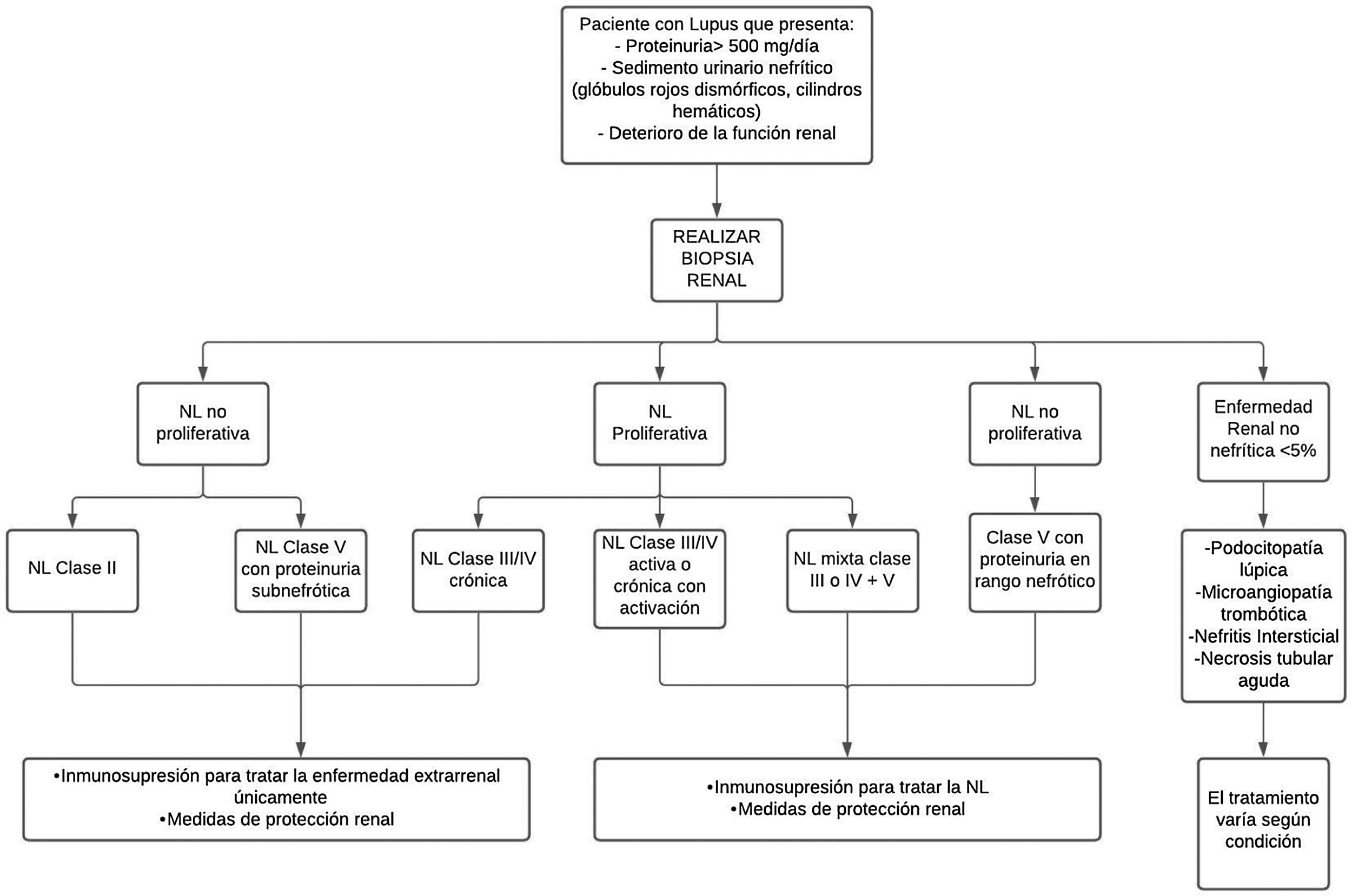
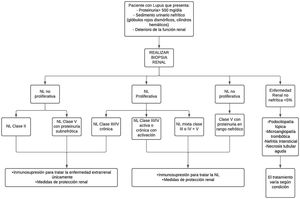
TratamientoEn cuanto al tratamiento, no existe una forma única de tratar la NL, varía según la gravedad de la enfermedad y el riesgo de daño renal progresivo, de acuerdo con el resultado de la biopsia renal estandarizada por la clasificación de ISN/RPS de la NL35 (fig. 2).
Aproximación diagnóstica y tratamiento de la nefritis lúpica.
NL: nefritis lúpica.
Adaptado de Parikh et al.37.
En pacientes con NL no proliferativa clase ii y clase v con proteinuria en rango no nefrótico, o proliferativa clase iii/iv solo crónica, el manejo se hace con terapia inmunosupresora para manejo extrarrenal de la enfermedad y medidas de protección renal. Esta terapia se utiliza para todos los pacientes con cualquier forma de NL37. Además de la terapia inmunológica, se incluyen estrategias antiproteinúricas.
El tratamiento con estatinas debe considerarse en función de los niveles de lípidos y la presencia de otros factores de riesgo cardiovascular. Es necesario hacer prevención primaria de trombosis según el riesgo cardiovascular a 10 años, recomendando el uso de aspirina en dosis bajas en presencia de alto riesgo. La protección y la prevención de la osteoporosis debe seguir estrategias no farmacológicas (ejercicio, mantenimiento del índice de masa), así como medidas farmacológicas, según el riesgo de fractura38. En mujeres en edad fértil se deben usar análogos de la GnRH para intentar conservar la función ovárica, principalmente en pacientes que reciben ciclofosfamida39.
Medidas generalesEntre las medidas generales, el bloqueo del sistema renina angiotensina-aldosterona con inhibidores de la enzima conversora de angiotensina o bloqueadores de los receptores de angiotensina es una estrategia útil para preservar la presión arterial con meta de 125/75-130/80mmHg37,38. Asimismo, se recomienda una dieta moderada, con restricción de sodio y proteínas, y corrección de alteraciones metabólicas, principalmente de riesgo cardiovascular. Es necesario evitar los antiinflamatorios no esteroideos, como también realizar vacunación que no contenga microrganismos vivos: influenza y Streptococcus pneumoniae.
Tratamiento inmunosupresorPara las NL proliferativas clase iii/iv activas o crónicas activas, el tratamiento debe ser mixto entre clase iii o iv+v, en tanto que para las no proliferativas clase v con proteinuria en rango nefrótico el manejo es con inmunosupresión37. Con el tratamiento para la NL se busca mejorar la función renal, disminuir la proteinuria, corregir los marcadores inmunológicos y prevenir o disminuir el daño orgánico acumulativo, con el fin de lograr la remisión completa (RC) o la remisión parcial (RP) a los 6meses, evitando así la IRCT, diálisis, trasplante y muerte, y preservando la calidad de vida30.
El micofenolato (MMF) o la ciclofosfamida, combinados con dosis elevadas de corticoides, se consideran el tratamiento estándar para la NL, ya que esta combinación mejora la supervivencia renal a largo plazo en comparación con los corticoides solos4,40. Estos regímenes de inducción son generalmente aceptados como estándar terapéutico y están respaldados por evidencia de ensayos controlados aleatorizados. Sin embargo, a pesar de la evidencia de apoyo, ninguno de estos medicamentos está aprobado por la Agencia de Alimentos y la Administración de Drogas (FDA, por sus siglas en inglés) y su uso en NL es considerado fuera de indicación (off label), con la excepción de los corticoides36.
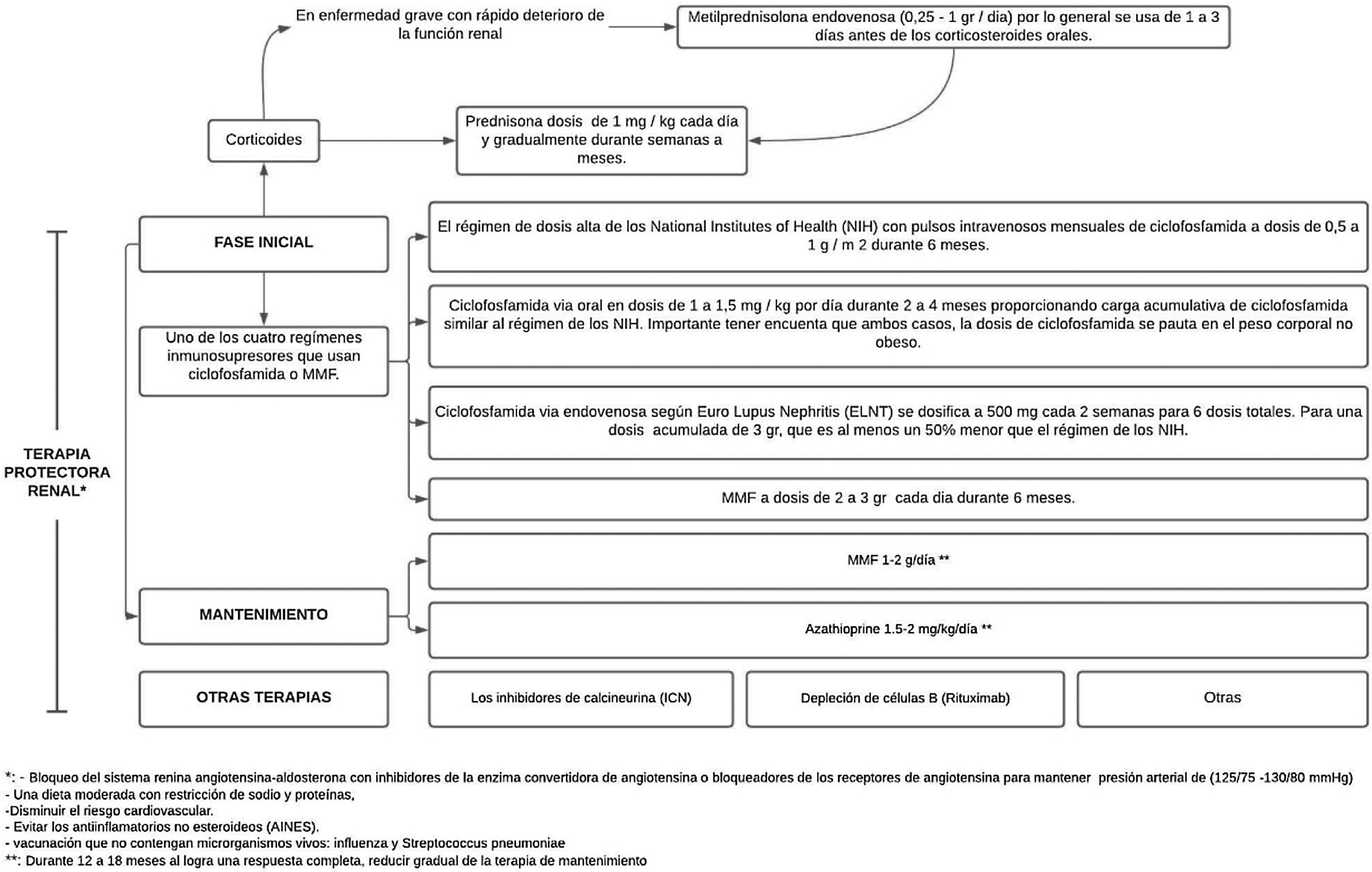
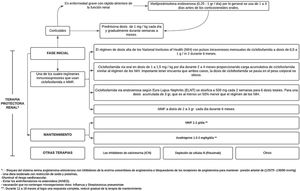
El tratamiento comprende 2fases, una inicial, que es mucho más intensa y dura de 3a 6meses, y la fase de mantenimiento con dosis de medicamentos más bajas, pero con una duración generalmente de varios años41 (fig. 3).
Tratamiento de la nefritis lúpica.
Adaptado de Parikh et al.37.
En un seguimiento hecho durante 41 meses a 90 pacientes de raza caucásica no se encontraron diferencias significativas en los 2grupos de tratamiento (régimen NIH o ELNT), lo que dejó serias dudas sobre la capacidad de generalizar estos resultados a otros grupos raciales42. En un estudio posterior se realizó un ensayo de terapia combinada de abatacept y ciclofosfamida para la NL, donde se inscribió a una población racial y étnica diversa, así: 37% afroamericana y 41% hispana, y a las 24 semanas se presentaron tasas de respuesta renal completa similares, lo que apoya el uso del régimen ELNT para el tratamiento inicial de la NL en diversos grupos raciales y étnicos41.
Luego de administrar la terapia de inmunosupresión de alta intensidad durante los primeros 3 a 6meses, esta se reemplaza por MMF (o una dosis más baja de MMF si se usó para la inducción) o azatioprina para mantener la supresión de la autoinmunidad y la inflamación y así prevenir el brote. El MMF es el tratamiento preferido para el mantenimiento de la remisión, pero sin tener datos sobre la duración óptima del tratamiento ni una definición de un estado de baja actividad de la enfermedad que prediga y permita la retirada segura del tratamiento, mediante la realización de biopsias repetidas a los 6-12 meses después de la inducción se ha tratado de investigar y se ha demostrado una discrepancia alarmante entre la respuesta clínica y la histológica40.
Los objetivos de la fase de mantenimiento son continuar el tratamiento inmunosupresor para lograr una respuesta renal completa y prevenir exacerbaciones renales mientras se minimiza la toxicidad potencial de la exposición a largo plazo a medicamentos inmunosupresores41, como se ha demostrado con la ciclofosfamida, que se asocia con una toxicidad significativa, específicamente aumentando el riesgo de insuficiencia ovárica prematura y malignidad futura37.
Las dosis utilizadas son MMF 1-2g/día o azatioprina 1,5-2mg/kg/día durante 12-18 meses. En caso de obtenerse una respuesta completa, se sebe reducir gradualmente la terapia de mantenimiento. Si se logra una respuesta parcial, es preciso continuar el tratamiento por tiempo indefinido, pero se deberá considerar repetir la biopsia para determinar si las lesiones activas todavía están presentes37. La IL-17 y la IL-23 pueden ser biomarcadores alternativos para diagnosticar NL, monitorizar la actividad y predecir la respuesta al tratamiento en pacientes con NL activa43.
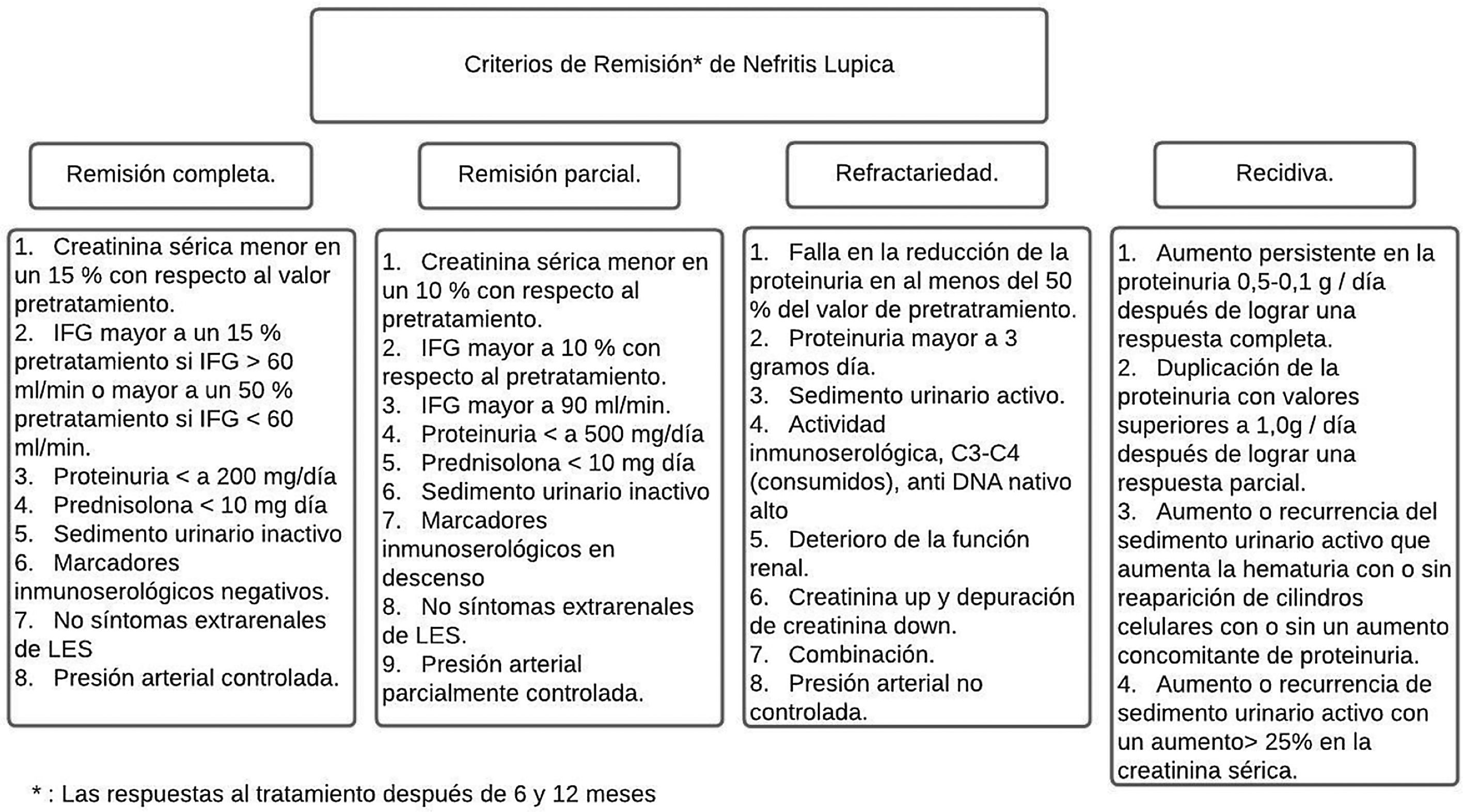
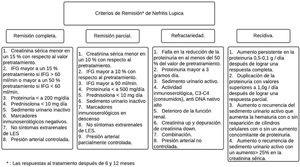
Entre el 20 y el 70% de los pacientes con NL son refractarios a la terapia inmunosupresora estándar43,44. La mayoría de los criterios para RC o RP son una combinación de índices clínicos que incluyen creatinina sérica, proteinuria y glóbulos rojos en orina (fig. 4). La directriz Kidney Disease and Improving Global Outcomes (KDIGO) sobre glomerulonefritis define RC como el retorno de la creatinina sérica a la línea de base previa y una disminución en la tasa de UPCR a <500mg/mmol. En la RP se evidencia estabilización (± 25%) o mejora de la creatinina sérica, pero no normalización, y una disminución> 50% en la UPCR. En la práctica clínica, se espera una RP a los 3 a 6meses, y los parámetros clínicos se suelen evaluar cada 4semanas en los primeros 6meses. Lo anterior con ciertas variables que es necesario contemplar, como la relación de la biopsia después de la remisión y lo que revela esta, la utilización de las terapias con inhibidores de calcineurina (ICN) y la falta de adherencia de los pacientes con los resultados finales37,45.
Criterios de remisión en nefritis lúpica de acuerdo con la American College of Rheumatology
Adaptado de Cervera et al.6.
Se consideran terapias alternativas como la multiterapia, que combina tacrolimús o ciclosporina+MMF: 0,05mg/kg/día de tacrolimús (nivel mínimo objetivo 4-6 ng/ml) o 3-5mg/kg/día de ciclosporina (el nivel no está bien establecido)+500-1.000mg de MMF 2veces al día por 6meses. Del rituximab por vía intravenosa se administran 1.000mg los días 1 y 14 por 2dosis37,44.
Los inhibidores de calcineurinaLos ICN atenúan la inflamación al evitar la liberación de citocinas inflamatorias de los leucocitos y también bloquean la activación de las células T, por lo que podrían tener un efecto para mantener la remisión. Se han utilizado como parte de un enfoque de múltiples objetivos para el tratamiento de la NL, añadidos a un régimen de MMF y corticoides, y se ha demostrado que son superiores a la ciclofosfamida para inducir la remisión a los 6meses. Los ICN más corticoides solos también se han utilizado para la inducción de LN y se ha encontrado que son tan eficaces como el MMF para la NL proliferativa. En este momento, los estudios de ICN deben considerarse con cautela. Inesperadamente, en el estudio de objetivos múltiples, los retiros de pacientes debido a eventos adversos fueron más altos en el grupo de ICN que en el grupo de ciclofosfamida. Por tanto, deben estudiarse los efectos de las infecciones respiratorias agudas en cohortes de mayor diversidad racial y étnica4.
Debido a que la proteinuria es el principal contribuyente a los criterios actuales de respuesta de NL y los ICN pueden afectar la proteinuria por mecanismos no relacionados con la modulación inmunitaria, no está claro que la proteinuria sea un criterio de valoración apropiado para comparar los ICN con fármacos con diferentes mecanismos de acción y deben interpretarse con cautela. Quizás sea preferible en este contexto considerar una biopsia de riñón para verificar la mejoría o resolución histológica4,37,44.
Según el estudio Aurora 1, un ensayo de fase 3, doble ciego, aleatorizado, multicéntrico, controlado con placebo, la voclosporina, un ICN, junto con MMF y dosis bajas de esteroides, condujo a una tasa de respuesta renal completa, clínica y estadísticamente superior que MMF y dosis bajas de esteroides solos, con un perfil de seguridad comparable, por lo que se convirtió en una opción de tratamiento prometedora en el contexto de NL activa45.
Depleción de células B en NLLas células B desempeñan un papel destacado en la patogenia de la NL, mediante una variedad de mecanismos que incluyen la producción de autoanticuerpos, la presentación de antígenos, la producción de citocinas y las interacciones con las células T. Por tanto, su selección se ha convertido en una estrategia terapéutica biológicamente formidable41,46.
El rituximab es un anticuerpo monoclonal anti-CD20 que agota las células B desde la célula pre-B hasta la etapa de células B de memoria. Es importante destacar que las células plasmáticas y las pro-B se salvan por la inexpresión de CD20. El ensayo de evaluación de la NL con rituximab fue un ensayo aleatorizado y controlado de 144 pacientes con NL proliferativa que evaluó la terapia de inducción con rituximab frente a placebo en un contexto de MMF y esteroides. Aunque el ensayo no pudo demostrar una diferencia estadísticamente significativa entre los 2grupos en la tasa de respuesta renal a las 52 semanas, más pacientes tratados con rituximab lograron una respuesta renal (57% versus 46%). En un análisis secundario, más pacientes tratados con este anticuerpo monoclonal lograron al menos una reducción del 50% en la proteinuria a las 78 semanas. Esta observación plantea la posibilidad de que se necesiten ensayos de mayor duración para discernir completamente las diferencias entre estos tratamientos46.
Rituxilup es el primer ensayo controlado, aleatorizado y a gran escala sobre la NL que estudia un régimen de tratamiento completamente libre de esteroides orales. Si se logra demostrar que un régimen libre de esteroides tiene éxito, los eventuales pacientes podrían olvidarse de las múltiples toxicidades bien descritas que tiene el uso de esteroides y sus efectos indeseados a largo plazo. Este sería un avance revolucionario en la comunidad de lupus41.
El obinutuzumab es un anticuerpo monoclonal anti-CD20 que, a diferencia del rituximab, tiene mayor citotoxicidad dependiente de anticuerpos y fagocitosis, mejores efectos de muerte directa a linfocitos B y menos sujeción a citotoxicidad dependiente del complemento. El ensayo Nobility demostró resultados positivos para el obinutuzumab como terapia adicional a los esteroides y el MMF cuando se administra por vía intravenosa cada 6meses durante un periodo de 76 semanas, con un tamaño del efecto del 22% para una respuesta renal completa47.
Finalmente, el belimumab, un anticuerpo humanizado anti-BAFF/BLYS que inhibe la maduración de las células B, se aprobó recientemente para su uso en NL. Un ensayo fase 3, multinacional, multicéntrico, aleatorizado, doble ciego, controlado con placebo, en el que participaron 448 pacientes con NL activa comprobada por biopsia, dio a conocer las fortalezas del belimumab, revelando una respuesta renal de eficacia primaria (43% versus 32%; OR 1,6; IC del 95%: 1,0-2,3; p=0,03) y una respuesta renal completa (30% versus 20%; OR 1,7; IC del 95%: 1,1-2,7; p=0,02), con lo que se demostró que pacientes que recibieron belimumab más la terapia estándar tuvieron una mejoría más notoria en los parámetros renales que aquellos que recibieron la terapia estándar sola48.
ConclusiónA pesar de la mejora general en la atención de pacientes con LES y un aumento en las tasas de supervivencia de NL de 5y 10años, su pronóstico sigue siendo insatisfactorio, especialmente en ciertos grupos étnicos como los afroamericanos y los hispanos49-51. Para mejorar el pronóstico deben desarrollarse nuevas técnicas que permitan evaluar el inicio temprano de la actividad de la enfermedad renal o su recaída, posibilitando así el inicio de un manejo oportuno52. El diagnóstico tardío de NL se asocia con una mayor frecuencia de insuficiencia renal y de terapia de reemplazo renal, lo que hace más importante aún el diagnóstico temprano53.
Los indicadores de laboratorio actuales para detectar y evaluar la NL, como proteinuria, cociente proteína/creatinina, anti-dsDNA, niveles de complemento y sedimento urinario activo, carecen de capacidad para diferenciar la actividad o el daño renal en la NL, que es un marcador cardinal para la planificación de una estrategia de tratamiento54. Un biomarcador es una sustancia biológica, bioquímica o molecular que se puede detectar cualitativa o cuantitativamente mediante técnica de laboratorio y que se correlaciona con la patogenia de la enfermedad en varios puntos. En el caso de NL, el biomarcador ideal debería tener las siguientes propiedades:
- 1.
Ser específico para la detección de afectación renal de pacientes con LES.
- 2.
Establecer correlación con la actividad o daño renal.
- 3.
Ser eficiente para la monitorización en serie del estado de la enfermedad longitudinalmente.
- 4.
Ser superior a los parámetros utilizados en la actualidad para predecir próximos eventos renales y así poder evitar el daño renal progresivo.
- 5.
Capaz de medir la severidad de la afectación renal.
- 6.
Ser validado en 2o más cohortes independientes.
- 7.
Fácil de realizar, necesidades mínimas de infraestructura y económico54.
El diagnóstico y el tratamiento oportunos disminuyen las secuelas a largo plazo, mejorando la calidad de vida y el pronóstico de la enfermedad, con un impacto positivo en la morbimortalidad de los pacientes. Se han estudiado diferentes moléculas para tratar de hacer una evaluación más temprana y eficaz de la NL. A pesar de la gran cantidad de biomarcadores nuevos que han sido explorados para predecir y evaluar la NL, pocos se han validado rigurosamente en estudios longitudinales a gran escala en diferentes poblaciones étnicas. Hasta el momento, ninguno de estos nuevos biomarcadores ha sido estandarizado para práctica clínica diaria o ha reemplazado a los biomarcadores convencionales para controlar la progresión de la enfermedad y predecir los brotes renales39. Es importante conocer las nuevas terapias alternativas, ya que en el futuro cercano estas se utilizarán de forma creciente y más precoz en los pacientes que no responden o presentan efectos colaterales en tratamiento consistente en esquemas basados en MMF o prednisona.
FinanciaciónNinguna.
Conflicto de interesesNinguno.