La poliangitis microscópica es una vasculitis sistémica, asociada a la positividad de anticuerpos anticitoplasma de neutrófilos, caracterizada por el compromiso necrosante de los vasos de pequeño calibre. Las manifestaciones clínicas de la poliangitis microscópica son variadas y las formas más severas se manifiestan con glomerulonefritis rápidamente progresiva y capilaritis pulmonar. El compromiso nervioso afecta principalmente el sistema periférico. La afectación a nivel central no es común, y hallazgos clínicos de psicosis y alteración del comportamiento son bastante infrecuentes en el contexto de estas enfermedades autoinmunes.
Microscopic polyangiitis is a systemic anti-neutrophil cytoplasmic antibody-associated vasculitis, and is associated with the necrotising small calibre vessels. Its clinical manifestations are varied, and the most severe forms manifest with rapidly progressive glomerulonephritis and pulmonary capillaritis. In the nervous system, it mainly involves the peripheral system. Involvement of the central nervous system is not common, and clinical findings of psychosis and behaviour alterations are infrequent.
Aun cuando se considera que la poliangitis microscópica (PAM) puede comprometer cualquier órgano y tejido, no son comunes los casos en que el sistema nervioso central se vea afectado de forma considerable1. Es más infrecuente aún el hallazgo de alteraciones en la sensopercepción como rasgo clínico cardinal. Los reportes de caso que han asociado la PAM con alteraciones como el brote psicótico han correlacionado el cuadro con la administración de altas dosis de esteroides2.
En las vasculitis asociadas a la positividad de anticuerpos anticitoplasma de neutrófilos (ANCA positivos) el compromiso nervioso involucra con mayor frecuencia al sistema periférico dando lugar a entidades como la polineuropatía periférica sensitiva o motora y la mononeuritis múltiple3. Se han documentado, adicionalmente, algunos casos en la literatura de vasculitis cerebral asociada a isquemia o hemorragias3. Las necropsias de gran porcentaje de pacientes con vasculitis ANCA positivos evidencian áreas de isquemia ante mortem con cambios fibróticos en la sustancia blanca cerebral4, por consiguiente, su inusual aparición no implica la ausencia de riesgo o la inexistencia de procesos subclínicos.
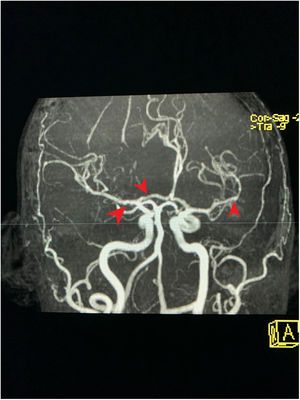
Caso clínicoPaciente de 35 años, femenina, sin antecedentes relevantes, quien a principios del año 2017 ingresó a servicio de urgencias por cuadro clínico de 2 semanas de evolución consistente en disnea a pequeños esfuerzos, edema generalizado, adinamia y astenia. Al examen físico se documentaron signos de dificultad respiratoria, disminución de murmullo vesicular en bases pulmonares y anasarca. Se encontraron azoados elevados e hipercalemia con cambios electrocardiográficos asociados. Al documentarse urgencia dialítica requirió inicio de terapia de reemplazo renal. Se consideró que la etiología de la falla renal podría ser de origen autoinmune por lo cual se iniciaron pulsos de esteroide (metilprednisolona 1.000mg/día por 3 dosis). Indicaron realización de perfil inmunológico el cual mostró positividad de MPO/ANCA, sin otros hallazgos (tabla 1). Se tomó biopsia renal que mostró glomerulonefritis necrosante pauciinmune en fase esclerosante con 58% de esclerosis glomerular global y 10% de proliferación extracapilar. Fue confirmado el diagnóstico de vasculitis de pequeño vaso asociado a ANCA sin manifestaciones granulomatosas, por lo cual se sospechó que se tratara de PAM. Con este diagnóstico se inició esquema con ciclofosfamida (15mg/kg, 3 dosis quincenales y luego 3 pulsos cada 3 semanas) y esteroide oral (a dosis de 50mg/día). Se indicó inducción de forma intrahospitalaria y se dio egreso con prescripción de siguientes dosis. La paciente abandonó el esteroide oral y no recibió las siguientes dosis de citostático. En enero de 2018 reingresó al servicio de urgencias con cuadro clínico de 12h de evolución compatible con episodio psicótico agudo: agitación psicomotora, desorientación, lenguaje desorganizado y alucinaciones auditivas. Al momento del ingreso, el acompañante de la paciente manifestó que no estaba recibiendo medicación alguna y que no había estado en contacto con sustancias alucinógenas. En el servicio de urgencias se administró dosis de benzodiacepina con resolución de la agitación psicomotora. A pesar de la medicación, persistió con alucinaciones e ideas delirantes. Se tomaron datos paraclínicos de ingreso, con tomografía axial de cráneo sin hallazgos anormales, azoados elevados (TFG: 21ml/min/1,73m2 por fórmula Cockroft-Gault), hemograma y perfil hepático sin alteraciones, perfil toxicológico, serología y ELISA para VIH negativos (tabla 2). Fue valorada por un psiquiatra quien evidenció síntomas maniformes y psicóticos de inicio abrupto, sin antecedentes psiquiátricos personales o familiares. Al ser valorada por neurología en primera instancia sospecharon psicosis por esteroides, no obstante, la paciente llevaba varios meses sin recibirlos. Solicitaron resonancia magnética nuclear de cerebro simple por enfermedad renal que contraindicaba uso de medios de contraste intravenoso. La resonancia magnética cerebral evidenció hiperintensidades supratentoriales subcorticales no específicas sin otros hallazgos relacionados. Se realizó punción lumbar, obteniendo una muestra sin alteraciones macroscópicas, bioquímica normal, cultivos para bacterias, micobacterias y hongos negativos, VDRL no reactivo, film array sin reportes positivos. Se complementaron los estudios con videotelemetría que no evidenció actividad epileptiforme. Tras administración de protocolos de nefroprotección, fue llevada a angiorresonancia de cerebro en la cual se observaron cambios sugestivos de vasculitis o fenómenos de vasoconstricción (figs. 1 y 2). Se describió deterioro de la función renal, razón que contraindicó angiografía cerebral. Se administraron pulsos de esteroide (500mg/día por 3 dosis) y se reinició protocolo con ciclofosfamida (a dosis previamente descritas), evidenciando posterior resolución de la sintomatología y recuperación completa del estado neurológico. Un año tras el episodio, la paciente no manifiesta síntomas de enfermedad mental y su estado neurológico es óptimo. En sus controles por psiquiatría no se han detectado anormalidades y los episodios de psicosis no se han presentado nuevamente. Adicionalmente, la función renal ha tenido una considerable mejoría con una tasa de filtración actual de 35,4ml/min.
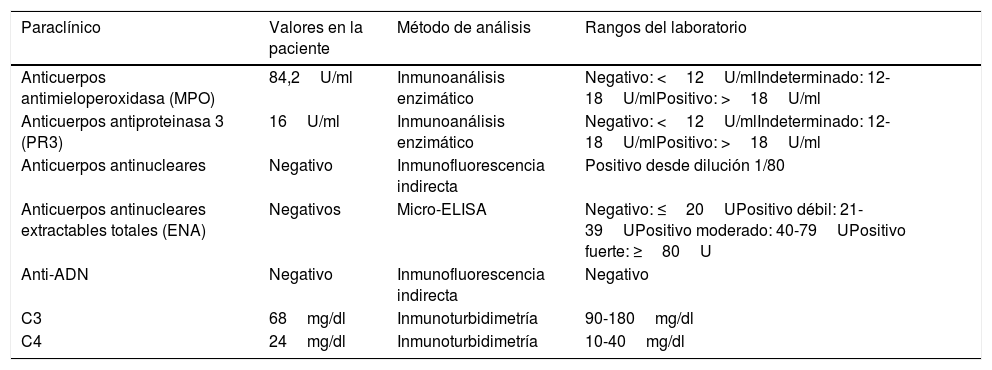
Perfil inmunológico de la paciente en su primera hospitalización
| Paraclínico | Valores en la paciente | Método de análisis | Rangos del laboratorio |
|---|---|---|---|
| Anticuerpos antimieloperoxidasa (MPO) | 84,2U/ml | Inmunoanálisis enzimático | Negativo: <12U/mlIndeterminado: 12-18U/mlPositivo: >18U/ml |
| Anticuerpos antiproteinasa 3 (PR3) | 16U/ml | Inmunoanálisis enzimático | Negativo: <12U/mlIndeterminado: 12-18U/mlPositivo: >18U/ml |
| Anticuerpos antinucleares | Negativo | Inmunofluorescencia indirecta | Positivo desde dilución 1/80 |
| Anticuerpos antinucleares extractables totales (ENA) | Negativos | Micro-ELISA | Negativo: ≤20UPositivo débil: 21-39UPositivo moderado: 40-79UPositivo fuerte: ≥80U |
| Anti-ADN | Negativo | Inmunofluorescencia indirecta | Negativo |
| C3 | 68mg/dl | Inmunoturbidimetría | 90-180mg/dl |
| C4 | 24mg/dl | Inmunoturbidimetría | 10-40mg/dl |
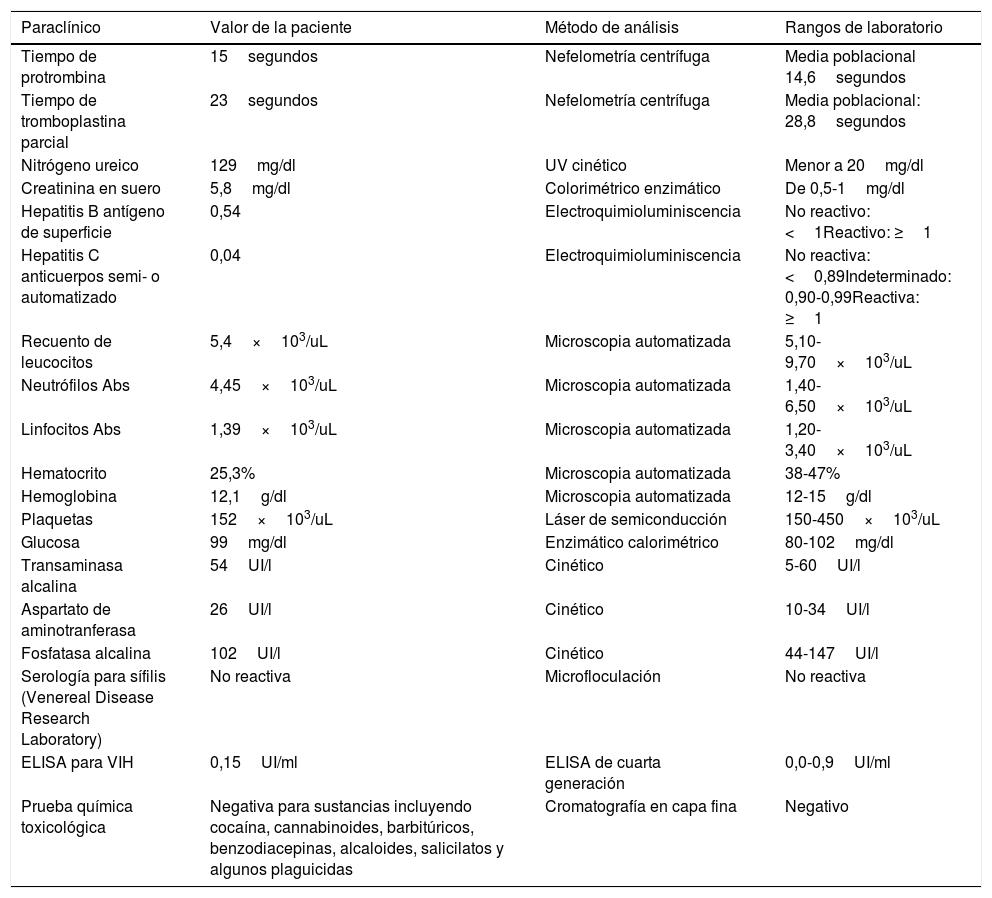
Datos paraclínicos de la paciente en segunda hospitalización
| Paraclínico | Valor de la paciente | Método de análisis | Rangos de laboratorio |
|---|---|---|---|
| Tiempo de protrombina | 15segundos | Nefelometría centrífuga | Media poblacional 14,6segundos |
| Tiempo de tromboplastina parcial | 23segundos | Nefelometría centrífuga | Media poblacional: 28,8segundos |
| Nitrógeno ureico | 129mg/dl | UV cinético | Menor a 20mg/dl |
| Creatinina en suero | 5,8mg/dl | Colorimétrico enzimático | De 0,5-1mg/dl |
| Hepatitis B antígeno de superficie | 0,54 | Electroquimioluminiscencia | No reactivo: <1Reactivo: ≥1 |
| Hepatitis C anticuerpos semi- o automatizado | 0,04 | Electroquimioluminiscencia | No reactiva: <0,89Indeterminado: 0,90-0,99Reactiva: ≥1 |
| Recuento de leucocitos | 5,4×103/uL | Microscopia automatizada | 5,10-9,70×103/uL |
| Neutrófilos Abs | 4,45×103/uL | Microscopia automatizada | 1,40-6,50×103/uL |
| Linfocitos Abs | 1,39×103/uL | Microscopia automatizada | 1,20-3,40×103/uL |
| Hematocrito | 25,3% | Microscopia automatizada | 38-47% |
| Hemoglobina | 12,1g/dl | Microscopia automatizada | 12-15g/dl |
| Plaquetas | 152×103/uL | Láser de semiconducción | 150-450×103/uL |
| Glucosa | 99mg/dl | Enzimático calorimétrico | 80-102mg/dl |
| Transaminasa alcalina | 54UI/l | Cinético | 5-60UI/l |
| Aspartato de aminotranferasa | 26UI/l | Cinético | 10-34UI/l |
| Fosfatasa alcalina | 102UI/l | Cinético | 44-147UI/l |
| Serología para sífilis (Venereal Disease Research Laboratory) | No reactiva | Microfloculación | No reactiva |
| ELISA para VIH | 0,15UI/ml | ELISA de cuarta generación | 0,0-0,9UI/ml |
| Prueba química toxicológica | Negativa para sustancias incluyendo cocaína, cannabinoides, barbitúricos, benzodiacepinas, alcaloides, salicilatos y algunos plaguicidas | Cromatografía en capa fina | Negativo |
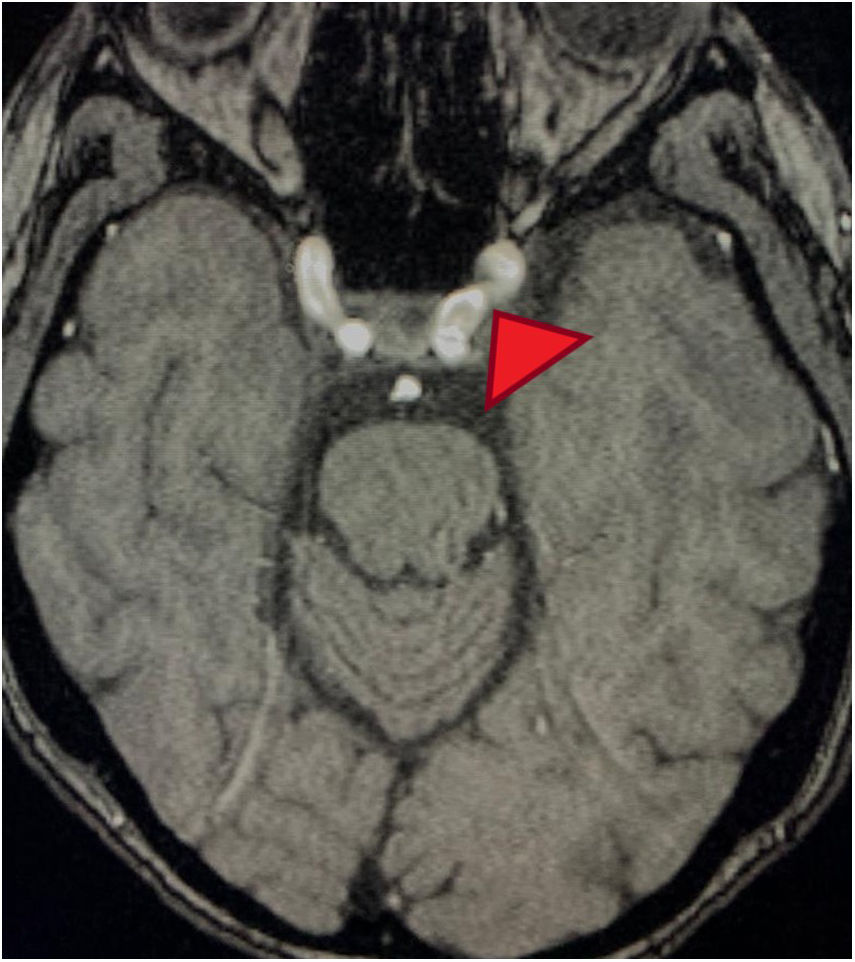
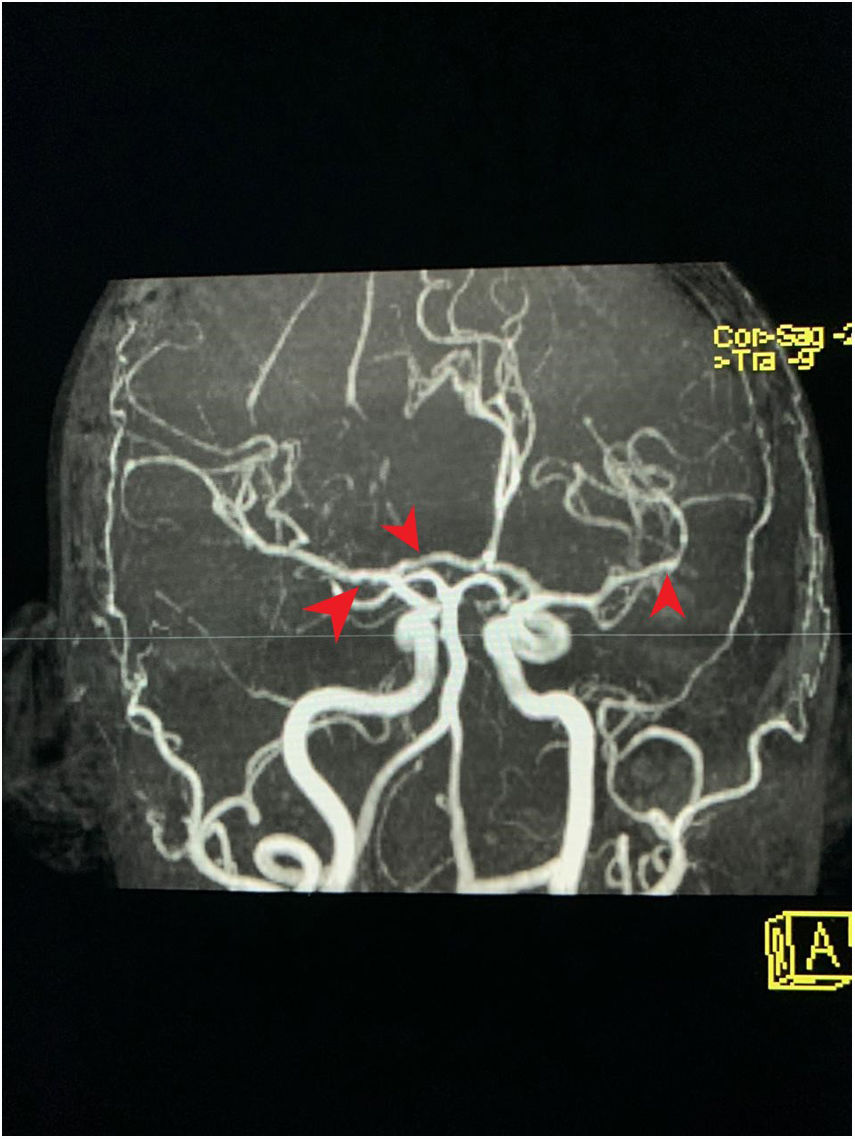
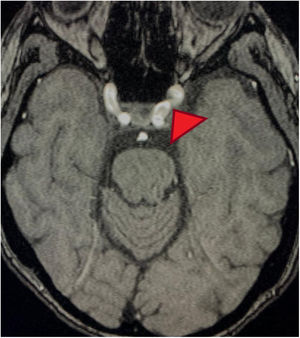
Corte transversal en angiorresonancia de cerebro. Angiorresonancia cerebral de la paciente que evidencia alteraciones en la morfología de las paredes de los vasos sanguíneos. Se observan cortes arteriales, áreas de estrechamiento e irregularidades. Pérdida de definición y la tortuosidad de las paredes de los vasos con márgenes borrosos en estructuras de distintos calibres y afectación segmentaria.
La PAM, al igual que las otras vasculitis de vaso pequeño ANCA positivos, es una enfermedad severa con un curso evolutivo variable: puede abarcar un espectro clínico que oscila entre cuadros de manifestación insidiosa con muchos años de evolución hasta escenarios fulminantes de rápida instauración5,6. El desarrollo fisiopatológico de las vasculitis de pequeño vaso no ha sido completamente dilucidado y, del mismo modo que en gran parte de las enfermedades reumatológicas, parece ser producto de la interacción de factores genéticos con exposiciones ambientales. Esta conjunción da lugar a una respuesta inmunológica generada por la desregulación de linfocitos T y la producción de anticuerpos con la capacidad de activar neutrófilos para inducir daño en el endotelio7. Es por esto por lo que en el consenso de Chapel Hill se le definió como una vasculitis necrosante con pocos complejos inmunes depositados8.
Se ha sugerido que los ANCA aparecen de forma transitoria durante la respuesta inmune asociada a infecciones. Su posterior conversión en el sustrato inmunológico de la enfermedad está relacionado con un proceso de mimetismo molecular9. Se ha descrito en pacientes infectados y con hallazgo de ANCA positivos, sin presencia de vasculitis, como respuesta a la terapia antibiótica que reduce los niveles de anticuerpos10. Es llamativa la correlación entre infecciones por S. aureus y vasculopatías como la poliangitis granulomatosa11.
Los estudios indican que los anticuerpos anticitoplasma pueden estimular a neutrófilos a través de la unión con antígenos como la proteinasa 312. Esta interacción promueve un escenario inflamatorio en el que la activación de la vía alternativa del complemento amplifica y perpetúa la respuesta por medio del estímulo sobre linfocitos y monocitos13. En este contexto, el neutrófilo sufre cambios en su morfología que facilitan su interacción con el endotelio para la liberación de enzimas que provocan necrosis fibrinoide y destrucción de vasos pequeños14. La exposición de las membranas basales estimula la agregación plaquetaria14. Se ha evidenciado en modelos de flujo capilar con neutrófilos expuestos a ANCA el incremento de la transmigración15. En asociación, estos fenómenos de adhesión y transmigración se perpetúan con la liberación de quimiotácticos que atraen mayor número de células blancas16. Ratones infundidos con IgG PR3-ANCA desarrollan glomerulonefritis rápidamente progresiva y hemorragia alveolar17. Cuando existe interacción entre los ANCA y los neutrófilos se desencadenan vías de señalización intracelular que dan lugar a la actividad de la molécula p21RAS: proteína fundamental en la actividad metabólica de esta célula18,19.
El compromiso del sistema nervioso en la PAM predomina a nivel periférico y el del central es de menor frecuencia. El compromiso del sistema nervioso central en las vasculitis suele asociarse a mayor severidad en la presentación clínica de la enfermedad y a una relación con la refractariedad al manejo y las complicaciones secundarias a este20. El compromiso nervioso no es el principal determinante en la mortalidad de estas enfermedades y la mayoría de los decesos se relacionan con el deterioro renal y pulmonar21. En la serie de casos analizada en el 2009 por el departamento de reumatología del Peking Union Medical College Hospital, en Beijing, el 36% de los pacientes con vasculitis sistémicas estudiados cursó con compromiso del sistema nervioso. La neuropatía periférica fue la condición neurológica de mayor asociación en la PAM con importante prevalencia de la mononeuritis múltiple y la polineuropatía simétrica distal22,23. A nivel de sistema nervioso central, la hemorragia aracnoidea y los accidentes isquémicos fueron las condiciones clínicas con mayor relevancia24. Con las investigaciones de los últimos años se ha podido concertar que las afecciones en un sistema u órgano particular cambian radicalmente desde el punto de vista demográfico. Al comparar las poblaciones de Norteamérica con países asiáticos (que son aquellas en quienes se han practicado la mayor cantidad de estudios), varía notablemente el porcentaje de manifestaciones según el tejido estudiado. En un estudio realizado en Corea se puede evidenciar una alta prevalencia de manifestaciones del sistema nervioso (43,6%)22.
Se describen 3 áreas primarias de compromiso central en la PAM: la pituitaria, las paquimeninges y la vasculatura3,21. Se han reportado casos de alteración hormonal de larga duración por déficit pituitario incluso en pacientes que han respondido a administración de corticoide y han logrado resolución clínica casi completa de sus síntomas1,3,21. La hipertrofia de meninges puede evidenciarse en formas sistémicas de la enfermedad en asociación con anti-PR3 o en formas limitadas en relación con anti-MPO3,21.
La vasculitis cerebral y espinal es una entidad rara que puede abarcar diversos aspectos sindrómicos y se manifiesta con anormalidad focal o generalizada1,22,23. Se ha propuesto que los eventos isquémicos son causados por angitis necrosante y las hemorragias por la rotura de los vasos necrosados1,21,22. Las complicaciones isquémicas son las más comunes y pueden causar encefalopatía, déficit motor o sensitivo, mielopatía isquémica, convulsiones, entre otros3,22. Los hallazgos en el sistema nervioso central generalmente aparecen como manifestación tardía de la enfermedad tras el inicio de síntomas sistémicos. Sin embargo, existen reportes en la literatura en los cuales la PAM ha comenzado con manifestaciones como cefalea, convulsiones y eventos isquémicos sin presencia de otra sintomatología sistémica25. Las secuelas a largo plazo son más frecuentes cuando el compromiso central está dado por lesiones isquémicas y paquimeningitis espinal25,26.
Aunque el compromiso del sistema nervioso central se relaciona con mal pronóstico, existen series de casos en los que un porcentaje de pacientes responden a la combinación de esteroides con citostáticos en pautas de administración similares a las usadas en otros escenarios como el síndrome pulmón-riñón26,27. Asimismo, existen reportes de caso en los que pacientes con hemorragia subaracnoidea han respondido parcialmente al manejo combinado de esteroides y ciclofosfamida27. Generalmente la condición nerviosa se presenta concomitante a manifestaciones potencialmente mortales como la hemorragia alveolar, la glomerulonefritis activa o la hemorragia gastrointestinal; razón por la cual el protocolo terapéutico establecido con esteroides, citostáticos e, inclusive, biológicos, es el tratamiento indicado.
La relación entre psicosis y PAM no está establecida. No encontramos en la literatura reportes de caso que incluyan la psicosis como manifestación clínica de esta vasculitis. El único escenario en el cual encontramos relación entre estas 2 entidades es en los reportes de alteración mental secundaria al uso de esteroides (que no parece ser el caso que expusimos previamente dado que la paciente llevaba varios meses sin consumirlos). No obstante, la relación entre cuadros psicóticos y vasculopatía sí se ha dilucidado. El estado de alteración de la realidad secundario a la vasculitis en nuestra paciente con PAM podría explicarse a partir de mecanismos fisiopatológicos similares a los que acaecen en otras entidades clínicas que comparten similitudes. Hubo una completa resolución del cuadro tras la administración de metilprednisolona y el protocolo con citostático. La angiorresonancia no es el método ideal para diagnosticar vasculitis cerebral, aunque la función renal y el estado de la paciente imposibilitaban una angiografía. Los hallazgos sugestivos, el descartar otras causas de demencia y la resolución del cuadro con el manejo descrito, son el sustento de nuestra experiencia clínica en el presente caso.
FinanciaciónNo se obtuvieron fuentes de financiación para la realización del presente artículo.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.