Los pacientes con lupus eritematoso sistémico (LES) tienen mayor frecuencia de factores de riesgo cardiovascular (RCV) tradicionales, esto sumado a la presencia de factores de RCV no tradicionales, aumenta la probabilidad de eventos cardiacos hasta 5 veces.
ObjetivoDeterminar la frecuencia de los factores de RCV en una población de pacientes con LES.
Materiales y métodosSe realizó un estudio descriptivo, transversal, observacional, en 51 pacientes con diagnóstico de LES.
ResultadosSe reportó el patrón lúpico de dislipoproteinemia ya que el 52,9% presentó hipoalfalipoproteinemia, 49% hipercolesterolemia, 35,3% hipertrigliceridemia y 19,6% elevación de c-LDL. Con respecto a las comorbilidades el 31,4% presentó obesidad, 27,5% hipertensión arterial y 6% diabetes mellitus. Los factores de RCV no tradicionales que predominaron fueron los asociados con la actividad de la enfermedad, el 90,1% tomaba glucocorticoides, 70,6% presentó niveles bajos de C3, 66,7% tuvo PCR>2mg/l, 56,9% tenía más de 4 puntos de SLEDAI-2K, 41,2% presentó niveles bajos de C4, 29,4% tenía más de 10 años de duración de la enfermedad, 25,5% tenía nefritis lúpica. Con lo que respecta a la presencia de anticuerpos asociados a RCV el 58,8, 9,8, 74,8 y el 3,9% presentaron anti-Smith, anticoagulante lúpico, anti-beta 2 glicoproteína I, anticardiolipinas positivas, respectivamente.
ConclusionesLos pacientes con LES presentan un estado proinflamatorio y aterogénico, aumentando el riesgo de desarrollar enfermedades cardiovasculares tanto por mayor incidencia de los factores de riesgo tradicionales, como por la presencia de factores que promueven una inflamación crónica.
Patients with systemic lupus erythematosus (SLE) have a higher frequency of traditional cardiovascular risk factors (CVR). This, combined with the presence of non-traditional cardiovascular risk factors, increases the probability of cardiac events by five times.
ObjectiveTo determine the prevalence of CVR factors in a population of patients with SLE.
Material and methodsA descriptive, cross-sectional, observational study in 51 patients with the diagnosis of SLE.
ResultsA lupus dyslipoproteinaemia pattern was reported, of which 52.9% had hypo-alpha-lipoproteinaemia, 49% hypercholesterolaemia, 35.3% hypertriglyceridaemia, and 19.6% with an elevated c-LDL. The comorbidities found were, 31.4% with obesity, 27.5% with high blood pressure, and 6% suffered from diabetes mellitus. Predominant non-traditional CVR factors were associated with disease activity, with 90.1% taking glucocorticoids, 70.6% had low levels of complement C3, 41.2% had low levels of complement C4, 66.7% had a CRP>2mg/l, 56.9% had a SLEDAI-2K score greater than 4 points, 29.4% had more than 10 years of disease duration, and 25.5% had lupus nephritis. As regards the presence of antibodies associated with CVR, 58.8, 9.8, 74.8 and 3.9% had anti-Smith antibodies, lupus anticoagulant, anti-beta2glycoprotein I, and positive anticardiolipin, respectively.
ConclusionsPatients with SLE have a pro-inflammatory and atherogenic state, increasing the risk of developing cardiovascular diseases, and therefore a higher incidence of traditional risk factors, such as the presence of factors that promote chronic inflammation.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune de etiología desconocida que se caracteriza por la activación de linfocitos T y B policlonales, producción de autoanticuerpos y la formación de complejos inmunes que ocasionan daño en tejidos y órganos1.
Los pacientes con LES presentan una incidencia de aterosclerosis más elevada que la población en general2, así como mayor riesgo de infarto agudo al miocardio y tienen de 5-6 veces mayor riesgo cardiovascular (RCV) que la población en general3.
Los pacientes con LES presentan mayor frecuencia de factores de RCV tradicionales4,5. Presentan dislipidemia con un perfil lipídico aterogénico denominado «patrón lúpico de dislipoproteinemia», caracterizado por niveles elevados de colesterol total, triglicéridos, lipoproteína de baja densidad (c-LDL), y lipoproteína A, así como niveles disminuidos de lipoproteína de alta densidad (c-HDL)6. Los pacientes con LES también presentan con mayor frecuencia diabetes mellitus (DM) debido a la disminución significativa de la sensibilidad a la insulina y a la alta prevalencia de síndrome metabólico7,8. De igual manera, tienen mayor frecuencia de hipertensión arterial sistémica (HAS), tabaquismo y sedentarismo6.
Pese a lo anterior, el alto RCV no se puede explicar únicamente con los factores de riesgo tradicionales. Es bien conocido el efecto de la inflamación crónica en el desarrollo de la placa de ateroma y en el de aterosclerosis acelerada, por lo que se considera la presencia de otros factores de RCV asociado a la enfermedad, a la actividad de la enfermedad y al tratamiento empleado, conocidos como factores de riesgo no tradicionales. Entre ellos se encuentran los niveles elevados de proteína C reactiva (PCR) que se han asociado a la presencia de placas de ateroma carotídeas9. Niveles basales elevados de PCR son predictores de mortalidad y se ha observado que niveles mayores a 2mg/l son un factor de RCV independientemente de otros factores de riesgo10.
La actividad de la enfermedad se ha asociado con mayor RCV, esta puede ser medida por el Systemic Lupus Erythematosus Disease Activity Index (SLEDAI), el cual consiste en una revisión sistemática (examen físico, interrogatorio y análisis de laboratorio), determina con cierta certeza el grado de actividad en un momento dado y precisa manifestarse al menos 10 días antes de su realización11. Un incremento de 6 puntos en el índice de SLEDAI durante un año se correlaciona con un aumento del 5% del RCV. Se ha encontrado relación entre mayor hipertrigliceridemia, hipercolesterolemia e hipoalfalipoproteinemia a mayor índice de actividad6.
La nefritis lúpica se ha asociado con aterosclerosis acelerada6,12. Hasta el 40% de las muertes en los pacientes con nefritis lúpica se debe a causas cardiovasculares13, lo que puede obedecer a la mayor tendencia a HAS y a dislipidemia con patrón aterogénico.
Se ha encontrado que los pacientes con LES que tienen placa de ateroma presentan mayor frecuencia de anticuerpos anti-Smith (anti-Sm), antirribonucleoproteína y anticardiolipina (aCL) comparados con aquellos pacientes sin placa de ateroma6, así como de aterosclerosis14. Los aCL se han asociado con una reacción cruzada frente a apoA-1 la cual es un componente importante del complejo c-HDL, aumentando así el riesgo aterogénico15,16. La beta-2 glicoproteína I (B2GPI) impide la captación del c-LDL oxidado por los macrófagos, evitando así la formación de células espumosas, por lo que la presencia de anticuerpos frente a esta facilita la formación de la placa de ateroma17. El anticoagulante lúpico (AL) aumenta el RCV al asociarse con mayores eventos trombóticos y mayor riesgo de infartos agudos al miocardio, los cuales se incrementan con la presencia de otros factores de RCV18.
Los pacientes que emplean glucocorticoides, debido a su incremento en las cifras tensionales y la resistencia a la insulina, aumentan el RCV19.
El grado de actividad lúpica y el riesgo de desarrollar nefropatía, con el consiguiente aumento de la tensión arterial y el RCV, se pueden determinar mediante los niveles de complemento C3 y C420. La actividad lúpica casi siempre implica enfermedad renal activa con niveles de complemento C3 y C4 disminuidos, de tal manera que los niveles bajos de complemento C3 y C4 pueden relacionarse de manera indirecta con un mayor RCV.
El LES es por sí solo un factor de riesgo para el desarrollo de enfermedades cardiovasculares. Existe un incremento de la incidencia de los factores de riesgo tradicionales en estos pacientes, sin embargo, también existen otros factores de riesgo no tradicionales que condicionan un proceso inflamatorio crónico, haciendo que sistemas como la escala de riesgo Framingham no refleje adecuadamente el RCV. En los pacientes con LES existe una sinergia entre los factores de RCV tradicionales y no tradicionales, por lo que es necesario conocer y tener un control estricto de estos factores, por tal motivo esta investigación tuvo como objetivo determinar los factores de riesgo tradicionales y no tradicionales en pacientes con LES, y su asociación con la escala de riesgo Framingham.
Materiales y métodosSe realizó un estudio descriptivo, transversal, observacional y retrospectivo. El universo estuvo conformado por los pacientes con el diagnóstico de LES según los criterios de clasificación Systemic Lupus Erythematosus International Collaboratiing Clinics21 2012, que acudieron a la consulta externa del servicio de Reumatología del Hospital Regional de Alta Especialidad Dr. Gustavo A Rovirosa Pérez, entre junio de 2014 y junio de 2015, para un total de 65 pacientes, de los cuales solo 51 cumplieron con los criterios de inclusión. Se revisaron los expedientes clínicos, excluyéndose aquellos pacientes con el diagnóstico de una enfermedad cardiovascular previa (cardiopatía isquémica, enfermedad cerebrovascular, trombosis venosa profunda, tromboembolia pulmonar e insuficiencia cardiaca). Se registraron como variables los factores de RCV tradicionales (DM, HAS, tabaquismo, obesidad, colesterol total, c-HDL y c-LDL y triglicéridos), así como factores asociados al LES (duración de la enfermedad, actividad de la enfermedad mediante SLEDAI-2K, niveles de PCR ultrasensible, uso de glucocorticoides, niveles de complemento C3 y C4, presencia de nefritis lúpica, presencia de anticuerpos anti-Sm, aCL, AL y anti-B2GPI).
Cada paciente firmó un consentimiento informado en el cual autorizaba su participación en el estudio, previa aprobación por el Comité de Bioética del Hospital.
Medición de variables antropométricasCon el paciente descalzo y con ropa ligera, se procedió a determinar el peso con una balanza, marca Health o Meter con capacidad máxima de 227kg, previamente calibrada (según las especificaciones del manufacturador), los resultados se expresaron en kg. Con los pacientes en posición de bipedestación se midió la estatura por medio de un tallímetro integrado a la balanza con altura máxima de 213cm, los resultados fueron expresados en metros. Con estos resultados se calculó el índice de masa corporal (IMC) utilizando la fórmula peso/talla2 (kg/m2), clasificando los resultados en los rangos de bajo peso: <18,5kg/m2; normal: 18,5-24,9kg/m2; sobrepeso: 25-29,9kg/m2; obesidad tipo I: 30-34,9kg/m2; obesidad tipo II: 35-39,9kg/m2; obesidad tipo III: ≥40kg/m2.
Con el paciente sentado, después de un reposo de 20 min, se tomó la tensión arterial con un esfigmomanómetro de columna de mercurio marca American Diagnostic Corporation, adecuado al grosor del brazo de cada paciente.
Determinación de los parámetros bioquímicosCon ayuno previo de 8 h, se tomaron por la mañana (8:00-9:00 h) muestras de sangre venosa (10ml) en la región antecubital, para medir los valores de triglicéridos, colesterol total, c-HDL, glucosa, PCR ultrasensible. Las muestras se analizaron en el equipo automatizado ILab 350 (instrumentation laboratory). Los niveles de c-LDL se obtuvieron de manera indirecta a través de la fórmula de Friedewald.
Se consideraron como factores de riesgo positivos niveles de glucosa >100mg/dl, debido a la relación que existe entre el RCV y los niveles glucémicos de prediabetes22, las concentraciones de lípidos considerados por la guía ATP III23 como altos o bajos en caso de c-HDL, es decir, triglicéridos >200mg/dl, c-LDL >160mg/dl, c-HDL <40mg/dl; y las concentraciones de PCR ultrasensible >2mg/l10.
Determinación de factores relacionados con la enfermedadSe registró el tiempo de duración de la enfermedad, se evaluó la actividad de la enfermedad mediante el SLEDAI-2K clasificándose como inactividad o actividad leve <4 puntos, moderada de 4 a 8 puntos y grave >8 puntos11, se determinó la presencia de nefritis lúpica según la definición del grupo SLICC21: presencia de proteinuria ≥500mg/24 h o proteinuria/creatinina ≥50mg/mmol, presencia de cilindros eritrocitarios o la presencia de biopsia renal compatible con nefropatía lúpica más la presencia de anticuerpos antinucleares (ANA) o anti-DNA-ds.
La determinación de los anticuerpos se realizó por medio de la técnica de ELISA (Orgentec Diagnostika, Alemania), expresando como valores de corte normales los recomendados por el fabricante, los cuales fueron para anti-Sm, ANA, AL negativos, anti-DNA-ds de 0-5,2 UI/ml, aCL IgG 0-23 e IgM 0-11, anti B2GPI IgG 0-20 e IgM 0-15. Las concentraciones séricas de las proteínas del complemento se determinaron por medio de la técnica de nefelometría (Beckman Coulter Izasa, California, Estados Unidos) considerándose como rangos normales, C3 de 90-180mg/dl, C4 10-40mg/dl y CH50 200-288 U/ml.
Determinación de riesgo cardiovascularSe calculó el RCV mediante el score de Framingham modificado24, el cual evalúa el riesgo que tiene una persona de padecer un evento cardiovascular en los próximos 10 años, teniendo como variables la edad, el género, los niveles de colesterol total y c-HDL, tabaquismo, la presencia o no de DM, los niveles de presión arterial sistólica y el empleo de medicamentos antihipertensivos. Considerando como riesgo bajo valores <1%, moderado 1-5% y alto >5%.
Análisis estadísticoSe realizó un análisis estadístico por medio del paquete SPSS 22.0 para Windows. Considerando como resultado significativo un valor de p ≤0,05. Se evaluó la distribución normal de las variables continuas mediante la prueba de Kolmogórov-Smirnov. Las variables continuas con distribución normal se presentaron como media y desviación estándar, y las que no presentaban distribución normal se presentaron como mediana y rango intercuartil.
Las variables categóricas se presentaron como frecuencias y porcentajes, y fueron comparadas con la prueba de Chi cuadrado. Finalmente, se realizó la razón de momios para determinar el peso específico que tenían los factores de riesgo tradicionales y no tradicionales significativos sobre el RCV.
ResultadosDurante el periodo establecido acudieron a la consulta externa de reumatología 65 pacientes con el diagnóstico de LES, solo 51 cumplieron los criterios de inclusión. El 92,1% de la población estudiada era de género femenino.
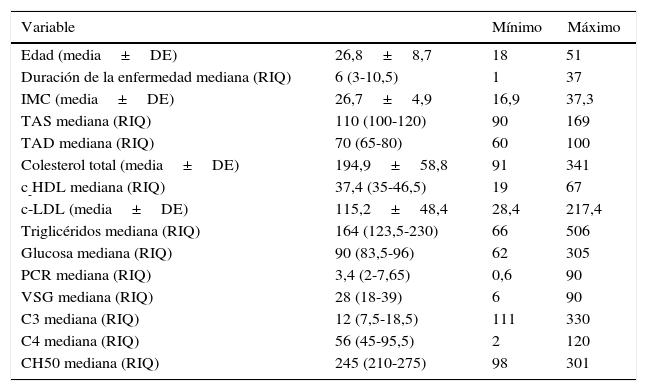
Las características generales se observan en la tabla 1. La media de la edad de diagnóstico fue de 26,84±8,8 años. Con respecto al IMC predominó el peso normal con 39,2%, seguido del sobrepeso con 31,5%, 23,5% presentó obesidad tipo I, 3,9% obesidad tipo II y 1,9% presentó bajo peso. El 15,7% presentó tensiones arteriales sistólicas mayores de 140mmHg, y el 7,8%, presentó tensiones arteriales diastólicas mayores de 90mmHg.
Características generales de los pacientes con lupus eritematoso sistémico estudiados
| Variable | Mínimo | Máximo | |
|---|---|---|---|
| Edad (media±DE) | 26,8±8,7 | 18 | 51 |
| Duración de la enfermedad mediana (RIQ) | 6 (3-10,5) | 1 | 37 |
| IMC (media±DE) | 26,7±4,9 | 16,9 | 37,3 |
| TAS mediana (RIQ) | 110 (100-120) | 90 | 169 |
| TAD mediana (RIQ) | 70 (65-80) | 60 | 100 |
| Colesterol total (media±DE) | 194,9±58,8 | 91 | 341 |
| c-HDL mediana (RIQ) | 37,4 (35-46,5) | 19 | 67 |
| c-LDL (media±DE) | 115,2±48,4 | 28,4 | 217,4 |
| Triglicéridos mediana (RIQ) | 164 (123,5-230) | 66 | 506 |
| Glucosa mediana (RIQ) | 90 (83,5-96) | 62 | 305 |
| PCR mediana (RIQ) | 3,4 (2-7,65) | 0,6 | 90 |
| VSG mediana (RIQ) | 28 (18-39) | 6 | 90 |
| C3 mediana (RIQ) | 12 (7,5-18,5) | 111 | 330 |
| C4 mediana (RIQ) | 56 (45-95,5) | 2 | 120 |
| CH50 mediana (RIQ) | 245 (210-275) | 98 | 301 |
c-HDL: lipoproteína de alta densidad; c-LDL: lipoproteína de baja densidad; C3: complemento C3; C4: complemento C4; CH50: complemento hemolítico 50; DE: desviación estándar; IMC: índice de masa corporal; PCR: proteína C reactiva; RIQ: rango intercuartil; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica; VSG: velocidad de sedimentación globular.
Con lo que respecta al complemento C3, el 70,6% tuvo concentraciones bajas, el 27,5% fue normal y el 1,9% fue elevado. Un 56,9% presentó complemento C4 normal, 41,2% bajo y 1,9% elevado. Finalmente, el 76,5% presentó concentraciones normales de CH50, un 13,7% elevado y 9,8% bajo.
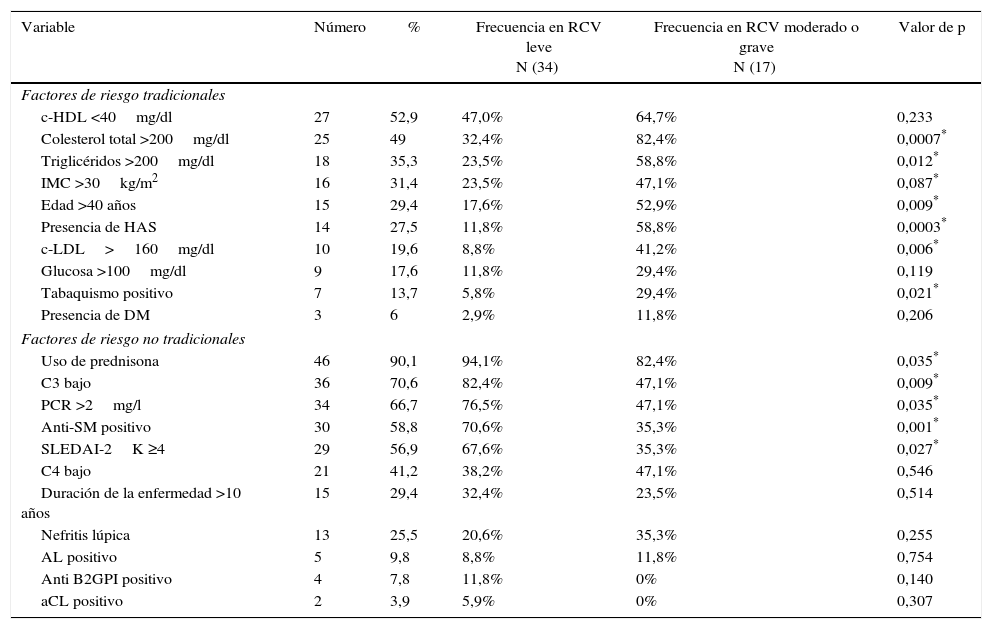
En la tabla 2, se pueden observar la frecuencia de los factores de riesgo tradicionales y no tradicionales, así como su relación con el RCV <1% (leve) o >1% (moderado o grave). Los factores de riesgo tradicionales que predominaron fueron, por orden de frecuencia, hipoalfalipoproteinemia, hipercolesterolemia, hipertrigliceridemia y obesidad. Un 68,6% de los pacientes estudiados presentó dislipidemia. Los factores de riesgo no tradicionales que predominaron fueron el uso de glucorticoides, 53% empleaba más de 20mg/día de prednisona, en segundo lugar se encontraron niveles bajos de C3, seguido de PCR >2mg/l y anti-Sm positivo. Según el índice de actividad el 43,1% de los pacientes se encontraba con actividad leve, 27,5% tenía actividad moderada, y 29,4% grave. Un 78,4% presentó ANA positivos y 47% anti-DNA-ds positivos.
Frecuencia de los factores de riesgo tradicionales y no tradicionales presentes en los pacientes con LES y su relación con el riesgo cardiovascular
| Variable | Número | % | Frecuencia en RCV leve N (34) | Frecuencia en RCV moderado o grave N (17) | Valor de p |
|---|---|---|---|---|---|
| Factores de riesgo tradicionales | |||||
| c-HDL <40mg/dl | 27 | 52,9 | 47,0% | 64,7% | 0,233 |
| Colesterol total >200mg/dl | 25 | 49 | 32,4% | 82,4% | 0,0007* |
| Triglicéridos >200mg/dl | 18 | 35,3 | 23,5% | 58,8% | 0,012* |
| IMC >30kg/m2 | 16 | 31,4 | 23,5% | 47,1% | 0,087* |
| Edad >40 años | 15 | 29,4 | 17,6% | 52,9% | 0,009* |
| Presencia de HAS | 14 | 27,5 | 11,8% | 58,8% | 0,0003* |
| c-LDL>160mg/dl | 10 | 19,6 | 8,8% | 41,2% | 0,006* |
| Glucosa >100mg/dl | 9 | 17,6 | 11,8% | 29,4% | 0,119 |
| Tabaquismo positivo | 7 | 13,7 | 5,8% | 29,4% | 0,021* |
| Presencia de DM | 3 | 6 | 2,9% | 11,8% | 0,206 |
| Factores de riesgo no tradicionales | |||||
| Uso de prednisona | 46 | 90,1 | 94,1% | 82,4% | 0,035* |
| C3 bajo | 36 | 70,6 | 82,4% | 47,1% | 0,009* |
| PCR >2mg/l | 34 | 66,7 | 76,5% | 47,1% | 0,035* |
| Anti-SM positivo | 30 | 58,8 | 70,6% | 35,3% | 0,001* |
| SLEDAI-2K ≥4 | 29 | 56,9 | 67,6% | 35,3% | 0,027* |
| C4 bajo | 21 | 41,2 | 38,2% | 47,1% | 0,546 |
| Duración de la enfermedad >10 años | 15 | 29,4 | 32,4% | 23,5% | 0,514 |
| Nefritis lúpica | 13 | 25,5 | 20,6% | 35,3% | 0,255 |
| AL positivo | 5 | 9,8 | 8,8% | 11,8% | 0,754 |
| Anti B2GPI positivo | 4 | 7,8 | 11,8% | 0% | 0,140 |
| aCL positivo | 2 | 3,9 | 5,9% | 0% | 0,307 |
AAL: anticoagulante lúpico; aCL: anticardiolipinas; Anti-SM: anti-Smith; B2GPI: beta-2-glicoproteína-I; c-HDL: lipoproteína de alta densidad; c-LDL: lipoproteína de baja densidad; C3: complemento C3; C4: complemento C4; DM: diabetes mellitus; HAS: hipertensión arterial sistémica; IMC: índice de masa corporal; PCR: proteína C reactiva; SLEDAI-2K: Systemic Lupus Erythematosus Disease Activity Index 2000.
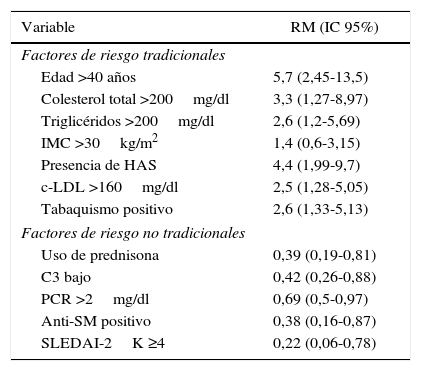
Con lo que respecta al RCV un 66,7% presentó riesgo bajo, 25,5% moderado y 7,8 grave. Se estableció la relación de momios para determinar el peso específico que tiene cada factor de riesgo en el RCV grave, lo cual se resume en la tabla 3.
Peso específico de los factores de riesgo tradicionales y no tradicionales en el riesgo cardiovascular moderado-grave, en pacientes con lupus eritematoso sistémico
| Variable | RM (IC 95%) |
|---|---|
| Factores de riesgo tradicionales | |
| Edad >40 años | 5,7 (2,45-13,5) |
| Colesterol total >200mg/dl | 3,3 (1,27-8,97) |
| Triglicéridos >200mg/dl | 2,6 (1,2-5,69) |
| IMC >30kg/m2 | 1,4 (0,6-3,15) |
| Presencia de HAS | 4,4 (1,99-9,7) |
| c-LDL >160mg/dl | 2,5 (1,28-5,05) |
| Tabaquismo positivo | 2,6 (1,33-5,13) |
| Factores de riesgo no tradicionales | |
| Uso de prednisona | 0,39 (0,19-0,81) |
| C3 bajo | 0,42 (0,26-0,88) |
| PCR >2mg/dl | 0,69 (0,5-0,97) |
| Anti-SM positivo | 0,38 (0,16-0,87) |
| SLEDAI-2K ≥4 | 0,22 (0,06-0,78) |
Anti-SM: anti-Smith; c-LDL: lipoproteína de baja densidad; C3: complemento C3; HAS: hipertensión arterial sistémica; IC: intervalo de confianza; IMC: índice de masa corporal; PCR: proteína C reactiva; RM: razón de momios; SLEDAI-2K: Systemic Lupus Erythematosus Disease Activity Index 2000.
Debido al alto riesgo de enfermedad cardiovascular en LES, es esencial una correcta valoración del RCV, la puntuación de riesgo Framingham evalúa una serie de factores de RCV para estimar la posibilidad de desarrollar enfermedad coronaria a 10 años. Esta puntuación es de gran utilidad en la práctica diaria, en la población en general, para estratificar riesgo y determinar intervención terapéutica, sin embargo, en los pacientes que presentan inflamación crónica, como es el caso de los pacientes con LES, estas escalas subestiman el RCV. Esto quedó demostrado en nuestro estudio, como era de esperarse los factores tradicionales tuvieron mayor frecuencia y diferencias significativas para un RCV moderado-grave, sin embargo, lo que llama la atención es que los pacientes que presentaron riesgo leve, tenían mayor frecuencia de factores de RCV no tradicionales, siendo significativo para uso de prednisona, C3 bajo, PCR >2mg/dl, anti-SM positivo y SLEDAI-2K ≥4 puntos. La importancia de esto se debe a que los factores no tradicionales aumentan la morbimortalidad por causas cardiovasculares en pacientes con enfermedades autoinmunes o inflamatorias. Al establecer una relación de momios entre estos factores y el RCV grave, se encontró asociación negativa, con lo que se confirma la poca utilidad de este tipo de escalas de riesgo, al no incluir factores asociados a la enfermedad y a la inflamación, los cuales incluso se encuentran más frecuentes en pacientes con RCV estadificado como leve. Sin embargo, los resultados del presente estudio deben ser analizados con cautela, dado el tamaño de la muestra y el tipo de estudio transversal.
Esto debido a que el análisis de los OR como de protección o de riesgo en este tipo de estudios se deben realizar de manera precavida, ya que si se tuviera un tiempo de seguimiento, así como un tamaño de muestra mayor pudieran ser diferentes a los presentemente observados.
En nuestra población al determinar el riesgo de Framingham encontramos resultados semejantes a los reportados por O¿Neil et al.25 donde solo el 3,57% de las pacientes con LES presentó riesgo grave. Este riesgo subestimado, ya que a pesar de que los eventos cardiovasculares son hasta 5 veces más frecuentes y menos del 5% se clasifican con alto riesgo de padecer un evento a 10 años, se debe a la presencia de factores de RCV no tradicionales, los cuales no forman parte de las variables estudiadas en estas escalas. Por tal motivo la European League Against Rheumatism recomienda multiplicar por 1,5 el valor de RCV en pacientes con LES26.
Existen otras escalas empleadas en este tipo de población como es el caso de Renolds Risk Score27, la cual, además de los factores de riesgo tradicionales, también emplea niveles elevados de PCR, sin embargo, a pesar de que se ha observado que estima un riesgo mayor que la Escala de Framingham, la mayoría continúa quedando por debajo del 10% de riesgo, lo cual sigue sin ser de gran significación ya que este corte es el que se emplea para el inicio del tratamiento.
Otro método es la ecuación de riesgo cardiovascular de LES (SLE cardiovascular risk equation)28, el cual se ha observado que estima mucho mejor el riesgo a 10 años en los pacientes con LES comparado con la Escala de Framingham, esto debido a que emplea variables que se asocian a la actividad de la enfermedad como es el caso de SLEDAI, niveles bajos de C3, e historia de anticoagulante lúpico que, como observamos en nuestro estudio, son factores frecuentes y que incluso pueden tener mayor presentación en pacientes con riesgo bajo calculado por Framingham.
En nuestra población de estudio se observó el patrón lúpico de dislipoproteinemia. En un estudio realizado en nuestro país se encontró que el 48,4% de la población adulta presenta hipoalfalipoproteinemia, el 42,3% hipertrigliceridemia y el 27,1% hipercolesterolemia29. La hipoalfalipoproteinemia y la hipercolesterolemia encontrada en nuestra población fue mayor que la reportada en la población en general, esto puede deberse a que la población mexicana se encuentra entre las que presentan mayor frecuencia de este tipo de alteraciones lipídicas, así como mayor síndrome metabólico30. El porcentaje de dislipidemia en los pacientes de nuestro estudio fue menor que el reportado por Wijaya et al.31 (75,3%) en pacientes indonesias con LES, esto se debe a que los valores empleados en este estudio como corte de dislipidemia fueron menores que los empleados por nosotros, ya que consideramos los valores altos de corte según ATP III. La dislipidemia en nuestra población fue mayor a la encontrada por Amaya et al.32 en Colombia (18,1%), como se mencionó previamente la población mexicana tiene mayor frecuencia de hipoalfalipoproteinemia e hipertrigliceridemia, comparada con otras poblaciones de Latinoamérica30.
En un estudio realizado por Bravo et al.33, en 24 pacientes con LES encontraron un IMC promedio de 26,7kg/m2, el 50% tenía peso normal, el 20,8% sobrepeso y el 29,2% obesidad, en un estudio realizado por Navarro et al.20 el promedio del IMC fue 28,2kg/m2, el 40,9% presentó peso normal, el 40,9% obesidad y el 18,2% sobrepeso, las medias de estos dos estudios coincidieron con lo reportado en nuestra población.
Los pacientes con LES presentan mayor resistencia a la insulina. Esto debido a la alta incidencia de síndrome metabólico en esta población, la inflamación crónica y el empleo de glucocorticoides, sin embargo, solo el 5% de los pacientes con LES desarrolla DM34. Esta frecuencia coincide con lo reportado en nuestra población.
Entre el 30-48% de los pacientes con LES presentan HAS, una prevalencia mayor en comparación con la población en general. Esto se debe probablemente al empleo de glucocorticoides y al desarrollo de nefritis lúpica35. La frecuencia de HAS en nuestra población se encontró por debajo de lo esperado.
Como parte del tratamiento de control de la actividad de la enfermedad, los pacientes con LES emplean glucocorticoides, lo cual también se observó en nuestro estudio donde más del 90% lo recibían, esto puede deberse a que nuestra población presentaba altos datos de actividad, ya que el 56,9% tenía actividad leve o moderada, así como el 66,7% tenía PCR elevada. En nuestra población el factor de RCV no tradicional que predominó fue el uso de glucocorticoides, este favorece el desarrollar aterosclerosis debido a que aumenta la frecuencia de HAS, dislipidemia, hiperglucemia y obesidad central con aumento del IMC19.
Existió una alta frecuencia de PCR >2mg/dl en nuestra población, esto aumenta el RCV, debido a que participa en el proceso aterogénico, ya que induce la producción de células inflamatorias y disminuye la expresión de óxido nítrico sintetasa36.
Con lo que respecta a los anticuerpos, la frecuencia de anti-Sm encontrada en nuestra población fue mucho mayor a la reportada en la literatura, la cual es de 25%37, sin embargo, con respecto a los anticuerpos antifosfolípidos, lo reportado en nuestra población se encontró muy por debajo de lo esperado ya que la frecuencia de AL en pacientes con LES es del 25%, el 23% presenta aCL y el 20% anti B2GPI positivos37.
Otro factor de RCV no tradicional que predominó en nuestra población fue el tiempo de evolución de la enfermedad mayor de 10 años, ya que casi el 30% lo presentaba, este aumenta el riesgo de aterosclerosis acelerada, debido a que existe mayor exposición a la inflamación secundaria a la actividad de la enfermedad, con el subsecuente daño endotelial.
La frecuencia de nefritis lúpica encontrada en nuestra población coincide con la esperada que es del 27%37. Nuestra población presentó una alta frecuencia de hipocomplementemia y de actividad de la enfermedad, lo cual habla de una inflamación crónica y de un mayor RCV.
Con los resultados obtenidos en nuestro estudio, resalta la importancia del adecuado control de la enfermedad, lo cual disminuye los factores de riesgo no tradicionales, de igual manera es importante el uso moderado de glucocorticoides para disminuir sus efectos indirectos sobre los riesgos tradicionales, así como primar el uso de medicamentos en los cuales se ha observado un factor benéfico en el RCV, como es el caso de la hidroxicloroquina, la cual mejora el perfil de lípidos, disminuye la actividad de la enfermedad y el riesgo de nefritis lúpica38. Con lo que respecta al uso de estatinas, se ha observado que en enfermedades reumáticas como la artritis reumatoide, el empleo de estos hipolipemiantes reduce los parámetros clínicos y biológicos de la inflamación y se relaciona con mejoría en la disfunción endotelial39. Tal como establecen las guías para el tratamiento del colesterol de la ACC/AHA publicadas en 201340, los pacientes diabéticos con c-LDL entre 70-189mg/dl y un RCV ≥7,5% deberían recibir tratamiento con estatinas, si tenemos en cuenta que los pacientes con enfermedades reumáticas presentan el mismo RCV que los pacientes con DM, podría considerarse el empleo de estatinas en ellos.
Entre las limitaciones de nuestro estudio se encuentra el número de pacientes incluidos, de igual manera con respecto al uso de glucocorticoides el determinar una dosis promedio empleada hubiese tenido mejor traducción en los resultados, sin embargo, la estricta selección de los pacientes sin eventos cardiovasculares previos, así como el determinar las frecuencias de todos los factores no tradicionales conocidos en este tipo de población, deben ser consideradas como una fortaleza del estudio.
ConclusiónCon el empleo de medicamentos que permiten un adecuado control de la enfermedad y con el uso moderado de los glucocorticoides, lo cual ha disminuido los procesos infecciosos; la enfermedad cardiovascular se ha convertido en uno de los principales problemas en los pacientes con LES. Los métodos tradicionales para estimar el RCV en la población general, subestiman el riesgo en pacientes con enfermedades inflamatorias o autoinmunes. Por lo cual es importante diseñar estrategias para reducir los factores de riesgo no tradicionales y, con ello, disminuir la morbimortalidad por complicaciones cardiovasculares.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflictos de interesesLos autores declaramos que no existen conflictos de intereses en la publicación de este trabajo y hemos seguido los protocolos establecidos en nuestra institución para la publicación de este material.