Se han propuesto varios estudios que sugieren que el grupo de vitaminas B posee un rol en la fisiología ósea. Se realizó una revisión bibliográfica sobre la interacción de este con la homocisteína y la relación de ambos con el metabolismo óseo y la osteoporosis. Algunos estudios han sugerido que los niveles de vitamina B, sobre todo las vitaminas B12 y B9, se han asociado a una baja densitometría ósea y a un aumentado riesgo a fractura, y que estos, a su vez, intervienen en el metabolismo de la homocisteína, por lo que su déficit puede ocasionar un estado de hiperhomocisteinemia. Publicaciones recientes proponen que la hiperhomocisteinemia se encuentra asociada a desmineralización ósea, baja calidad de masa ósea y aumento de biomarcadores de recambio óseo, dado que influye en la actividad osteoclástica y en los enlaces cruzados de colágeno. Por lo tanto, la hiperhomocisteinemia puede ser un factor que reduce la densidad y la calidad ósea. Se necesita más información para determinar el papel que tiene cada vitamina directamente en la salud ósea, o si estas solo influyen a través de las concentraciones séricas de homocisteína.
Several studies have suggested a role for B-vitamins in bone physiology. A systematic review is presented on the interaction of B-vitamins with homocysteine and the relationship of both in bone metabolism and osteoporosis. The levels of vitamin-B, particularly B12 and B9, have been associated with a low bone mineral density and an increased risk of fracture. At the same time, its deficit affects the metabolism of homocysteine, which can then result in a high serum homocysteine. Recent findings have proposed that high serum homocysteine is linked to bone demineralisation, low quality of bone mass, and an increase in bone turnover biomarkers, given the influence over the osteoclastic activity and the cross-linking of collagen molecules. Therefore, high serum homocysteine could be a factor that reduces bone density and quality. More information is needed to determine whether there is a direct role of each vitamin in bone health, or if they are just influenced by homocysteine serum concentrations.
La osteoporosis es una enfermedad esquelética sistémica, que se caracteriza por desmineralización ósea progresiva y deterioro de la microarquitectura que originan un mayor riesgo de fractura1. Su diagnóstico se basa en el T-score para densitometría mineral ósea (DMO) valorada por DXA en el cuello femoral y la columna, y se define por un valor de DMO igual o inferior a 2,5 desviaciones estándar de la media de una joven adulta. Diversos factores de riesgo contribuyen significativamente al riesgo de fractura, como la edad, el sexo, índice de masa corporal (IMC), las fracturas previas por fragilidad, el tratamiento con glucocorticoides, el tabaco y el consumo de alcohol2, y al acompañarse de factores de riesgo modificables como el peso, la actividad física, el consumo de fármacos y la deficiencia de nutrientes puede acelerarse la pérdida de hueso y aumentar la fragilidad ósea1,3. Los biomarcadores como el propéptido N-terminal del procolágeno tipo i (s-PINP) y telopéptido C-terminal del colágeno tipo i (CTX) funcionan como marcadores de formación ósea y de resorción ósea, y han tenido significación pronóstica para fractura2.
El FRAX® específico por país utiliza muchos de estos factores de riesgo, junto con la DMO medida por absorciometría de rayos-X de energía doble para calcular la probabilidad de fractura en 10 años. Cuando la DMO no está disponible se puede utilizar FRAX® sin el valor de la DMO2.
El calcio y la vitamina D han sido ampliamente estudiados como los nutrientes esenciales en la fisiología ósea; sin embargo, varias revisiones han informado de que otras sustancias pueden también desempeñar importantes funciones fisiológicas en la promoción de la salud ósea, tales como la vitamina B y la homocisteína4,5. Se ha establecido que la hiperhomocisteinemia incrementa el riesgo de fracturas, pero sus efectos son menos significativos en la DMO; muchos datos fundamentan sus efectos adversos en la calidad del hueso por resorción ósea y alteración de los enlaces cruzados del colágeno5,6.
Cada vez hay más publicaciones que relacionan los altos niveles de homocisteína a bajas concentraciones de vitamina B en adultos con osteoporosis. La investigación de los mecanismos que intervienen en la salud ósea es indispensable para proponer nuevas alternativas de prevención para dicha enfermedad. Esta revisión bibliográfica busca proveer una visión en conjunto de la información científica al respecto para esclarecer la relación de estos factores.
MetodologíaEstrategia de búsquedaSe realizó una búsqueda bibliográfica exhaustiva utilizando las bases de datos PubMed, Cochrane y Google Scholar. El objetivo era identificar la mayor cantidad de estudios publicados acerca de la relación entre vitamina B12 y niveles de homocisteína en el metabolismo óseo. Los términos Medical Subject Headings fueron: Folato, Vitamina B9, Cobalamina, Vitamina B12, Vitamina B, Riboflavina, Vitamina B6, Osteoporosis, Salud ósea, Homocisteína en humanos y estudios in vitro. Como técnica de búsqueda avanzada se utilizó PubMed para identificar los artículos más recientes y, a su vez, los más citados. La última revisión sistematizada se realizó en octubre de 2018. La selección de los artículos fue realizada en 2 pasos, el primero basado en el título y contenido del resumen, y el segundo por selección de texto completo del artículo, sin límite de tiempo.
Selección de estudios y recolección de la informaciónTodos los artículos acerca del rol de la vitamina B y homocisteína fueron revisados en texto completo (full text). Los idiomas de selección fueron español, inglés y portugués. La recolección de los datos fue hecha por un investigador y revisada por otros 2 especialistas e incluyó: primer autor, revista, año de publicación, país de origen, tipo y diseño del estudio, número de pacientes incluidos, criterios de inclusión y exclusión, datos demográficos, asociaciones y resultados.
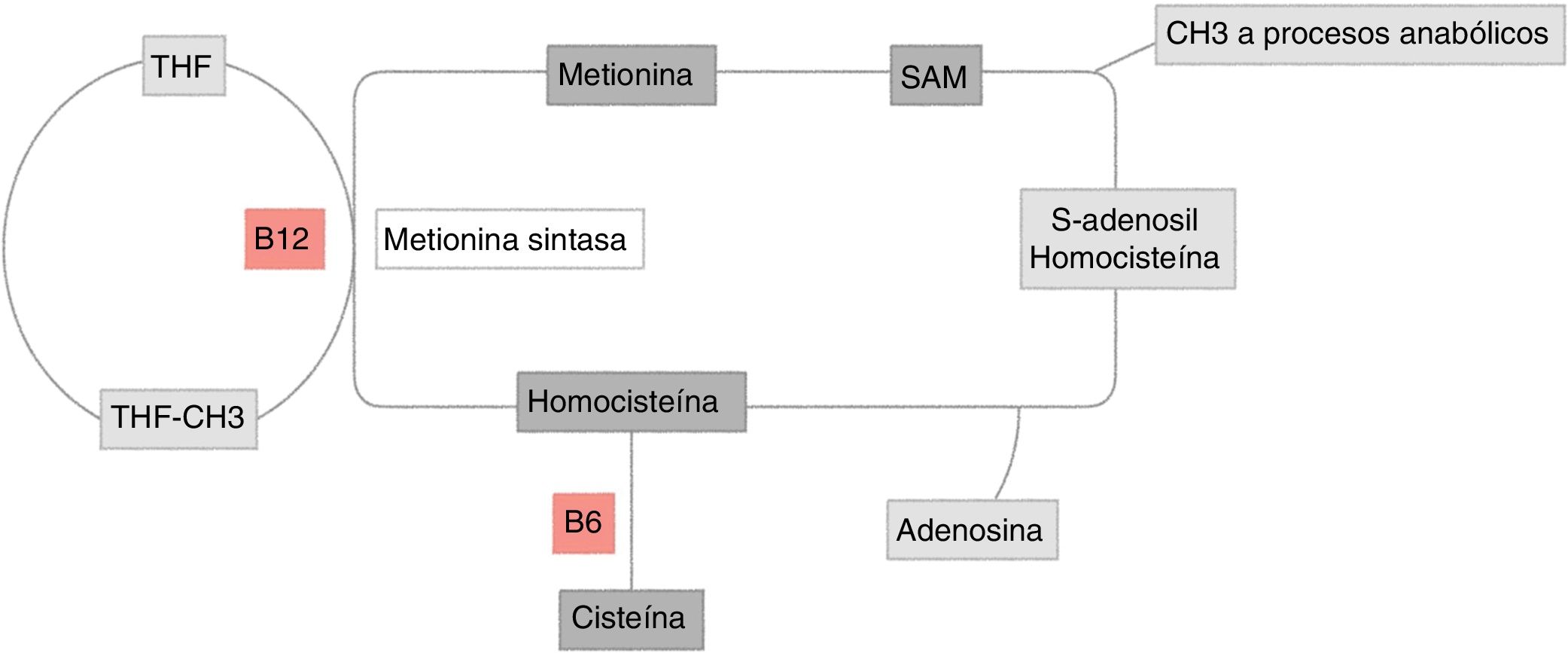
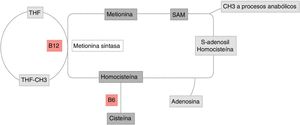
Metabolismo de la homocisteínaLa homocisteína es un aminosulfuro, producto del metabolismo de metionina. Su eliminación se puede dar a través de 2 vías (fig. 1):
Metabolismo de la homocisteína. Vía de la remetilación de la metionina: aminoácido esencial obtenido a través de la alimentación. Su reacción es catalizada por la metionina sintetasa, dependiente de vitamina B12 y donde la vitamina B9 es donante del grupo metilo. Esta reacción está regulada por S-adenosilmetionina (SAM) como inhibidor alostérico. La segunda vía de la transulfuración de la homocisteína es regulada por la activación SAM y depende de la vitamina B6 para obtener como resultado final cisteína.
THF: tetrahidrofolato.
Figura original realizada por Maldonado.
Vía de la remetilación de la metionina: esta reacción es catalizada en el hígado por metionina sintetasa, la cual requiere vitamina B9, donante del grupo metilo metiltetrahidrofolato (MTHF), forma activa y circulante del ácido fólico, que depende de la vitamina B12 como cofactor. Existe una vía alterna a esta reacción a través de la betaína, que dona un grupo metilo para la metilación de la homocisteína, reacción que es catalizada por la betaína homocisteína metiltransferasa5.
Vía de transulfuración: la homocisteína es convertida a cistationina y posteriormente a cisteína por la enzima cistationina b-sintetasa, que requiere piridoxal-5’-fosfato, una de las formas activas de la vitamina B65.
Estas 2 vías se encuentran coordinadas por S-adenosilmetionina (SAM), la cual actúa como inhibidor alostérico de la reacción metilenetetrahidrofolato reductasa y como activador de la cistationina beta-sintetasa5,6(fig. 1).
El folato (vitamina B9), y las vitaminas B12 (cobalamina), B6 (piridoxina) y B2 (riboflavina) desempeñan un papel importante en el metabolismo de la homocisteína7,8; como resultado, la homocisteína plasmática se eleva con bajos niveles de vitamina B.
Por lo tanto, esta puede ser utilizada como un biomarcador funcional, aunque inespecífico, de los niveles de vitamina B.
La definición de hiperhomocisteinemia varía entre estudios7, sin embargo, se ha llegado a un consenso en el cual se define como una condición médica a niveles plasmáticos por encima de los 15μmol/l8. La concentración normal de homocisteína en plasma se clasifica de la siguiente manera:
- ∘
Normal: 0-15μmol/l medida por cromatografía líquida de alto rendimiento, o 5-12μmol/l por inmunohistoquímica.
- ∘
Moderado: 16-30μmol/l.
- ∘
Intermedio: 31-100μmol/l.
- ∘
Síndrome o hiperhomocisteinemia severa:≥100μmol/l.
Existen 2 tipos de hiperhomocisteinemia:
- ∘
Causas comunes: factores ambientales, deficiencias nutricionales (folato, vitamina B6 y B12), disfunción tiroidea, cáncer, psoriasis, diabetes mellitus, ingestas elevadas de alcohol, drogas, café y niveles elevados de creatinina7–9.
- ∘
Causas genéticas: polimorfismo en la metilentetrahidrofolato reductasa (MTHFR), enzima que regula el metabolismo de la homocisteína6,10,11 o por el déficit de cistationina b-sintetasa, entidad poco común, asociada a discapacidad intelectual, infarto cerebral ateroesclerótico y osteoporosis6.
Se ha demostrado que la homocisteína plasmática>15μmol/l puede doblar el riesgo de padecer demencia, enfermedad de Alzheimer, enfermedades crónicas no transmisibles y riesgo cardiocerebrovascular10,11. La relación de la homocisteína y el riesgo cardiovascular ha sido estudiado en profundidad en los últimos años, demostrando que niveles elevados de homocisteína genera daño endotelial, disminuye la flexibilidad de los vasos sanguíneos y altera el proceso de homeostasis, generando así un factor de riesgo para infarto agudo de miocardio y accidentes cerebrovasculares.
Homocisteína y metabolismo óseoEstudios in vitro han mostrado que la hiperhomocisteinemia puede modular el proceso de remodelado óseo, principalmente al incrementar la actividad de los osteoclastos y su diferenciación12–14, induciendo la apoptosis de células madre mesenquimales en la médula ósea15–17, los osteocitos18 y los osteoblastos19, y en menor medida al inhibir la diferenciación de los osteoblastos20, efectos que se proponen como consecuencia del aumento intracelular de especies reactivas al oxígeno y que contribuyen a la resorción ósea13,14,21. Además, se ha asociado a la alteración de la irrigación ósea afectando directamente a la matriz extracelular; igualmente, la homocisteína se une directamente a la matriz extracelular, desorganizando los enlaces cruzados de colágeno, perjudicando la fuerza ósea14,22–24.
Herrmann et al. analizaron el efecto de niveles elevados de homocisteína en la actividad de los osteoclastos. Utilizaron como referencia 4 niveles de homocisteína (0, 10, 50 y 100μmol/l) después de 20 días de cultivo de los osteoclastos. Los autores observaron un aumento de la función de la fosfatasa ácida resistente a tartrato (TRAP) en un 20% en el grupo de 10μmol/l, 15% en el grupo de 50μmol/l y 42% en el grupo de 100μmol/l, además de un incremento en la actividad resortiva en niveles entre 50-100μmol/l de homocisteína13.
Hiperhomocisteinemia y densitometría óseaLos datos sobre la relación entre los niveles de homocisteína plasmática y la DMO son dispersos. En un estudio con mujeres croatas entre 45 y 65 años no se encontró ninguna correlación significativa entre la homocisteína, el folato o la vitamina B12 y la DMO de los sitios esqueléticos medidos5, datos que fueron replicados por otros autores25–28. Cagnacci et al., en su estudio, observaron que los niveles de homocisteína no tuvieron relación con la DMO y solamente el folato se relacionó independientemente con la DMO (r=0,254, p<0,011). Sin embargo, cuando estratificaron la DMO por cuartiles de folato sérico se mostró incremento progresivo de la DMO desde el menor al más alto cuartil (1,025±0,03g/cm2 vs. 1,15±0,03g/cm2, p<0,01); como también a mayor nivel de folato, mayor nivel de vitamina B12 y menor homocisteinemia26.
Varios estudios han encontrado una correlación significativa y negativa entre la homocisteinemia y la DMO. Gram Gjesdal et al. concluyeron que la hiperhomocisteinemia y los bajos niveles de folato se asocian significativamente a la reducción de la DMO en mujeres (p<0,001) pero no en hombres, sugiriendo que estos podrían ser factores de riesgo modificables para osteoporosis29. Ouzzif et al. también demostraron que los valores de homocisteinemia eran significativamente mayores en el grupo osteoporótico (p=0,017) y que estaban inversamente relacionados con la DMO en la columna lumbar y cadera total30. Estos datos han sido validados en otras poblaciones31–36, confirmando la hiperhomocisteinemia como un factor de riesgo independiente para osteoporosis.
Hiperhomocisteinemia y riesgo de fracturasLa hiperhomocisteinemia ha sido propuesta como un factor de riesgo tratable para las fracturas osteoporóticas. En 2 estudios de cohorte se ha calculado el riesgo relativo de los niveles de homocisteína ajustado a la edad e IMC para fractura de cadera; y se ha reportado que la homocisteinemia está asociada a un incremento del 1,9 en el riesgo de fractura (intervalo de confianza al 95% [IC 95%]: 1,4-2,6)25,37. Otro estudio prospectivo indicó una asociación positiva entre homocisteína plasmática y el riesgo de fractura en ambos sexos, aumentándolo en 2,42 en mujeres (IC 95%: 1,43-4,09) y 1,37 en hombres (IC 95%: 0,63-2,98); como también una asociación negativa entre folato sérico y riesgo de fractura solamente en mujeres38. Por otra parte, Kuroda et al. en 2013 analizaron factores de riesgo para fractura vertebral severa, observando por regresión múltiple que los niveles de homocisteína son un riesgo significativo (OR=1,27, IC 95% 1,04-1,58, p = 0,021) para fracturas moderadas a severas, al comparar las fracturas de grado 0 con las de grado 327.
La asociación constante de la hiperhomocisteinemia con el riesgo a fractura, que no se ve con la DMO, puede indicar el efecto de esta sobre la estructura y la calidad ósea, sugiriendo esto último la base del impacto de la homocisteína plasmática sobre el riesgo de fractura. Pocos estudios han indagado en la relación de los niveles de homocisteína y los marcadores de recambio óseo. El Estudio longitudinal de envejecimiento en Ámsterdam observó una asociación significativa entre niveles elevados de homocisteína sérica (>15μmol/l) y niveles bajos de vitamina B12 (<200pg/ml) con concentraciones elevadas de marcadores de recambio óseo como la desoxipiridolina urinaria (DPD) y la osteocalcina sérica (OC) en mujeres de edad avanzada, y que el riesgo relativo para fracturas en estos pacientes es 3,8 (IC 95%: 1,2-11,6)39. Los resultados de Herrmann et al. mostraron una correlación significativa entre homocisteína y DPD (p=0,022), pero no entre homocisteína y OC, u osteoprotegerina (OPG) en mujeres peri y posmenopáusicas40.
Un estudio interesante realizado por Gerdhem et al. analizó la relación de los niveles de homocisteína con biomarcadores de recambio óseo, DMO y riesgo de fractura. Sus resultados evidenciaron que las mujeres con el cuartil más alto de homocisteinemia tenían niveles mayores de CTX (p<0,001), DPD corregida para creatinina urinaria, OC y paratohormona (PTH). En cuanto a la DMO se observó una relación inversamente proporcional, que dejó de ser significativa cuando se ajustaron los resultados a factores de riesgo conocidos. Por último, no replicó los resultados de otros estudios25,27,37,38 sobre el riesgo de fractura por hiperhomocisteinemia41. Un estudio similar sí pudo relacionar la hiperhomocisteinemia a fracturas osteoporóticas, como también su correlación positiva con los niveles de CTX, sin encontrar asociación con la DMO42. Datos parecidos fueron obtenidos por Álvarez-Sánchez et al., que demostraron que la homocisteinemia tiene una relación independiente y positiva con CTX (B=0,22; IC 95%: 0,09-0,34; p=0,001), PTH y PINP (B=0,24; IC 95%: 0,09-0,39; p=0,002)43.
En 2017 Vijayan y Gupta indujeron un estado de hiperhomocisteinemia en ratones para observar la patogenia en el hueso cortical, mostrando que la homocisteína afectó la densidad mineral en los tejidos e indujo mineralización lacunar. El efecto es mediado por osteocitos a través de la expresión anómala de genes de mineralización como DMP1 y SOST que inducen la apoptosis, afectando la estabilidad biomecánica del hueso a largo plazo44.
Kuroda et al. analizaron el riesgo de fracturas en pacientes japoneses con deficiencias de vitaminas B, D y K, y demostraron que a pesar de que su población tiene la expectativa de vida más larga del mundo, se cree que la dieta es un factor importante para el riesgo de fracturas. Sin embargo, se cree que existen varios posibles factores de confusión, incluyendo el tratamiento de la osteoporosis. Debido a esto los autores realizaron el ajuste para los posibles confusores y demostraron que el número de deficiencias se asoció significativamente con el riesgo de fractura (cociente de riesgo 1,25; IC 95%: 1,04-1,50; p=0,018)45.
Tratamiento de la hiperhomocisteinemia: ¿disminuye el riesgo de fracturas?Los datos de tratamiento de la hiperhomocisteinemia para la reducción del riesgo de fractura son limitados. El estudio más grande relacionado con el tema se llama Women's Antioxidant and Folic Acid Cardiovascular Study, realizado por Bassk et al., en el que se estudiaron los efectos de la suplementación de ácido fólico (2,5mg/día), vitamina B6 (50mg/día) y vitamina B12 (1mg/día), y la reducción del riesgo de fracturas en mujeres con enfermedad cardiovascular preexistente o con 3 o más factores de riesgo coronario. El seguimiento de las pacientes fue de 7,3 años, y los autores no encontraron un efecto significativo entre la suplementación y la disminución del riesgo de fractura (cociente de riesgo=1,08; IC 95%: 0,88-1,34)46.
Stone et al. realizaron un estudio auxiliar con base en el Women's Antioxidant and Folic Acid Cardiovascular Study, y demostraron que no hubo efectos significativos de las vitaminas B6 y B12 en el riesgo de fractura entre las mujeres con niveles elevados de homocisteína en plasma, o niveles bajos de vitaminas B12 o B6, o folato al inicio del estudio. Además, el tratamiento con vitaminas B6 y B12 no tuvo efecto sobre el cambio en los marcadores del recambio óseo. No encontraron evidencia de que la suplementación diaria con vitaminas B reduzca el riesgo de fractura o las tasas de metabolismo óseo en mujeres de mediana edad y mayores con alto riesgo de enfermedad cardiovascular47.
López et al., en un metaanálisis, analizaron los datos del estudio de prevención de pólipos con ácido fólico y ácido acetilsalicílico (AFPPS) y un metaanálisis actualizado de ensayos controlados aleatorizados (ECA). El objetivo del trabajo fue demostrar si existe una asociación entre el tratamiento con vitamina B reductora de la homocisteína y el riesgo de fractura. El ensayo AFPPS se realizó entre 1994 y 2004 en 9 centros clínicos en los Estados Unidos, y 1.021 participantes fueron asignados al azar a una dosis diaria de ácido fólico de 1mg (n=516) o placebo (n=505)48. El resultado principal fue fractura de cualquier tipo. Además, analizaron el riesgo de fractura de cadera. En el estudio AFPPS no se encontró asociación estadísticamente significativa entre el tratamiento con ácido fólico y fracturas de ningún tipo (razón de riesgo [RR]=0,95; IC 95%: 0,61-1,48) o fractura de cadera (RR=0,98; IC 95%: 0,25-3,89). En el metaanálisis se incluyeron 6 ECA con un total de 36.527 participantes. Para las intervenciones que incluyen ácido fólico o vitamina B12 el RR agrupado para el tratamiento fue de 0,97 (IC 95%: 0,87 a 1,09) para fracturas de cualquier tipo (n=1.199) y 1,00 (IC 95%: 0,81 a 1,23) para fracturas de cadera (n=335). En conclusión, no se encontró asociación entre el tratamiento reductor de la homocisteína con vitaminas B (ácido fólico y vitamina B12) y el riesgo de fractura49.
Vitamina BSe ha reconocido que en pacientes con anemia perniciosa existe un aumento significativo del riesgo de fractura y osteoporosis (p<0,05)50. El grupo de vitaminas B es un factor importante en el metabolismo de la homocisteína y la suplementación con vitamina B12 y ácido fólico ha demostrado ser efectiva para normalizar los niveles de esta. La deficiencia de cualquiera de estas vitaminas va a resultar en el incremento de homocisteína51,52. También se cree que pueden influir en la actividad osteoblástica y la formación de hueso1,50. Por estas razones varios estudios observacionales y de intervención han examinado la relación que existe entre el grupo de vitaminas B, DMO, riesgo de fractura y marcadores de resorción ósea.
En un estudio realizado en pacientes con enfermedad celiaca se demostró que la vitamina B12 es un predictor significativo para la DMO en hombres, pero no en mujeres, dado que solo esta estuvo correlacionada significativamente con la DMO de cuello femoral (p=0,011) y cadera total (p=0,049)53. En 2004 Stone et al. observaron que en su estudio no hubo una tendencia significativa de cambio en la DMO a través de los quintiles de vitamina B12 sérica. Sin embargo, demostraron que las participantes con vitamina B12 sérica<280 pg/ml experimentaban un descenso anual del 1,6% (IC 95%: –2,4% a –0,8%) en la DMO de cadera total; un descenso más acelerado comparado con el de las participantes con niveles>280pg/ml de 0,2% (–0,5% a 0,2%) (p=0,003)54.
En 3 estudios realizados entre 2009 y 2013 se encontró una correlación positiva entre los niveles de vitamina B12 sérica y la DMO de cuello de fémur y lumbosacra, pero no encontraron la misma correlación con los niveles de folato35,36,55, resultados que han sido corroborados por 3 distintos estudios realizados en diferentes poblaciones54,56–58. Otros trabajos mostraron la asociación negativa del ácido metilmalónico, un indicador funcional de los niveles de vitamina B12, con la DMO en distintas poblaciones (p<0,01)58–60. Dos estudios reportaron la correlación positiva entre el folato sérico y la DMO de columna y fémur, pero no con vitamina B12 (p<0,02)26,34. Mientras que también se ha observado un mayor promedio de pérdida de DMO en el cuello femoral en participantes con concentraciones bajas de piridoxina (p<0,01)61, y un metanálisis no observó ninguna correlación entre ninguna de las vitaminas B y la DMO51. A pesar de que el mecanismo en el que interviene la vitamina B12 en la osteoporosis no es del todo claro, se ha sugerido en varios estudios in vitro que la actividad de los osteoclastos es estimulada por la deficiencia de cobalamina21,52.
Yazdanpanah et al. investigaron la influencia de la ingesta dietética de cobalamina, folato, piridoxina y riboflavina sobre la DMO y el riesgo de fractura, observando que la riboflavina y la piridoxina eran predictores fuertes para la DMO de cuello de fémur (p<0,002), y que solo la piridoxina, como variable continua, estaba inversamente asociada al riesgo de fracturas no vertebrales (p=0,005) y fracturas por fragilidad (p=0,0004)62. Posteriormente, este mismo autor en un trabajo con caracterización genética del MTHFR homocigoto sugirió que la riboflavina puede modificar el riesgo de fracturas en homocigóticos para el alelo T de MTHFR 677T, ya que las pacientes en el menor cuartil de riboflavina tienen un aumento de 1,8 (IC 95%: 1,1-2,9, p=0,01) veces de riesgo a fracturas osteoporóticas y 2,6 (IC 95%: 1,3-5,1, p=0,01) veces más de riesgo a fracturas por fragilidad, comparando con los pacientes con el genotipo 677-CC (p=0,0002)63.
Un estudio prospectivo publicado en 2013 que también valoró la ingesta dietética de las vitaminas B y su asociación con fractura de cadera durante un seguimiento de 13,8 años, identificó una correlación inversa entre la ingesta de piridoxina y el riesgo de fractura de cadera en mujeres, pero no en hombres (p=0,002), mientras que no se encontró relación con la ingesta de las otras vitaminas B. Comparando a las mujeres en el menor cuartil de ingesta de piridoxina (0,37-0,61mg/1.000kcal/día), las mujeres en el mayor cuartil (0,78-1,76mg/1.000kcal/día) tienen un 22% de reducción del riesgo de fractura de cadera (HR: 0,78; IC 95%: 0,66-0,93)64. Otros estudios han sugerido que la presencia de niveles bajos de vitamina B12 sérica tienen un riesgo relativo 2 veces mayor para fractura en mujeres, y si está asociada a hiperhomocisteinemia el riesgo relativo se vuelve 3 veces mayor para mujeres y hombres39,61. McLean et al. también asociaron el riesgo de fractura de cadera a la deficiencia de piridoxina (p<0,05)61. Por el contrario, Gjesdal et al. observaron que las mujeres dentro de la categoría más baja de folato tenían mayor riesgo de fractura de cadera, con un HR ajustado de 2,40 para menor (<2,9ng/ml) vs. mayor (>6,6ng/ml) concentración de folato, mientras que no se encontró relación entre riesgo de fractura y vitamina B1238.
En un metaanálisis realizado durante el 2013 por Van Wijngaarden et al., en el que se incluyó gran parte de los artículos citados, se pudo observar que el incremento de vitamina B12 de 50pg/ml tiende a descender el riesgo de fractura en un 4%, lo cual se encuentra en un límite significativo (RR=0,96; IC 95%: 0,92 a 1,00); por el contrario, la relación entre el folato y el riesgo de fractura se mantuvo heterogénea entre los estudios analizados51.
Se han realizado varios ECA para probar si la intervención con suplementación diaria de vitaminas B tiene influencia sobre el riesgo de fractura. Se han utilizado dosis de ácido fólico entre 2-2,5mg/día, vitamina B6 entre 25-50mg/día, vitamina B12 0,5-1mg/día con un seguimiento entre 3,4 a 7,3 años, sin identificar ningún efecto de las vitaminas B sobre el riesgo de fractura o marcadores de resorción ósea65,66, datos ratificados por el metaanálisis realizado por Chen et al. de los ECA sobre suplementación de vitaminas B en riesgo de fracturas y marcadores de resorción ósea67.
Entre los años 2006 y 2013 se han realizado 3 ECA para determinar si la suplementación de vitaminas B influye en los niveles de biomarcadores de recambio óseo68–70. El primero solo comparó entre dosis de ácido fólico de 0,4mg, 1mg, 5mg y placebo por 2 meses. El segundo suplementó dosis de 2,5mg de ácido fólico, 0,5mg de vitamina B12 y 25mg de B6 por un año. El último estudio comparó los niveles de biomarcadores de recambio óseo al suplementar 1.200UI de vitamina D3, 0,5mg de ácido fólico, 0,5mg de B12, 50mg de B6 y 456mg de carbonato de calcio vs. vitamina D3 vs. carbonato de calcio solo, durante un año. En los 2 primeros ensayos no se observó ninguna modificación en los niveles de marcadores de recambio óseo como DPD, CTX, OC y PINP68,69. En el último estudio disminuyeron los niveles de biomarcadores en ambos grupos, lo que indica que la disminución está dada por la influencia de vitamina D3 y calcio sobre la PTH61. Estos resultados van de la mano con lo que han encontrado otros autores en sus ensayos, en los que la suplementación solo logra disminuir los niveles plasmáticos de homocisteína65,67,71.
Holstein et al. realizaron un estudio en ratones para observar el impacto de la deficiencia de vitamina B12 y el folato en la regeneración del hueso posterior a una fractura, proporcionando al primer grupo una dieta pobre en vitamina B12 y folato, y al grupo control una dieta equicalórica. Transcurridas 4 semanas se midieron valores de vitamina B12, B9, homocisteína y osteocalcina, y se analizó la formación del callo óseo, sin encontrar diferencia de estas medidas entre ambos grupos, o en la composición del tejido y la formación del callo. Sin embargo, se encontró hiperhomocisteinemia en el grupo con la dieta deficiente en vitamina B72.
ConclusiónExiste suficiente información que demuestra la correlación entre la hiperhomocisteinemia con el riesgo de fractura y su asociación con una pobre DMO y elevación de biomarcadores de recambio óseo. Sin embargo, aunque parece existir un efecto protector de los niveles altos de vitaminas B sobre el riesgo de fractura; nulos han sido los intentos de demostrar la utilidad de la suplementación de vitaminas B para disminuir la fragilidad ósea, y aparenta tener el único beneficio de disminuir moderadamente los niveles de homocisteinemia, sin dejar una idea clara de los beneficios óseos que se obtienen de esto.
No existen estudios contundentes que sugieran una relación única entre las vitaminas B y la salud ósea, pero probablemente esta se encuentre en su intervención en el metabolismo de la homocisteína y su repercusión en los niveles plasmáticos, y se sugiere que los elevados niveles de homocisteína plasmática se pueden encontrar asociados a un mayor riesgo de osteoporosis. No se descarta la posibilidad de retrasar la aparición y progresión de la pérdida de minerales óseos si se modifican factores de riesgo como son la deficiencia de vitaminas y los niveles aumentados de homocisteína, factores que deben seguir siendo investigados, ya que pueden ser parte de un manejo integral de la salud ósea.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.