La enfermedad por coronavirus (COVID-19) producida por el SARS-CoV-2 ha sido un reto para los servicios de salud en todo el mundo. La pandemia se ha extendido ampliamente con más de 80 millones de casos confirmados y más de un millón de muertes a nivel mundial, por lo que ha estado bajo constante investigación para entender todos los aspectos de la enfermedad. Recientemente se han reportado varios casos de pacientes con síndrome de Guillain-Barré asociado a COVID-19 como manifestación principal, convirtiéndola en la primera enfermedad neurológica autoinmune desencadenada por SARS-CoV-2; sin embargo, es necesario obtener más información para entender completamente los mecanismos inmunopatogénicos implicados en esta asociación.
The coronavirus disease (COVID-19) caused by SARS-CoV-2 has been a challenge for health services around the world. The pandemic has spread widely, with more than 80 million confirmed cases and more than one million deaths globally. There have been many studies to understand all aspects of the disease. Recently, several cases have been reported of patients with Guillain-Barré syndrome associated with COVID-19 as the main manifestation. As it may be one of the first autoimmune neurological diseases triggered by SARS-CoV-2, it is necessary to obtain more information to fully understand the immunopathogenic mechanisms involved in this association.
La pandemia por COVID-19 ha tenido grandes repercusiones a lo largo del presente año en los servicios de salud a escala global; gran parte de los recursos sanitarios se han redirigido al manejo de este grupo de pacientes. El área de la reumatología también se ha visto enfrentada a grandes retos, principalmente con respecto a la decisión de continuar los tratamientos inmunosupresores e inmunomoduladores que muchos de los pacientes reciben para mantener estable su enfermedad1. Es sabido que la infección por SARS-CoV-2 puede cursar con formas asintomáticas o leves, pero también existe una pequeña proporción de pacientes que desarrolla formas graves y complicaciones. La evidencia más reciente también indica la presencia de manifestaciones extrapulmonares de COVID-19 con compromiso cardiaco, gastrointestinal, cutáneo, hepático, renal y neurológico como algunos de sus ejemplos2. Dentro de las manifestaciones del sistema nervioso periférico se ha reportado el síndrome de Guillain-Barré en pacientes con COVID-193. El presente artículo tiene como objetivo presentar un panorama actual de la pandemia por COVID-19, seguido de una breve mención de las manifestaciones neurológicas, haciendo hincapié en los aspectos más relevantes del síndrome de Guillain-Barré con la COVID-19 y los mecanismos inmunomediados propuestos de esta novedosa asociación.
Materiales y métodosSe realizó una búsqueda no sistemática de la literatura en las bases de datos PubMed, Science Direct y Scopus usando los términos de búsqueda «Guillain-Barré Syndrome», «COVID-19», «Coronavirus», «2019-nCoV», «SARS-CoV-2», «Severe Acute Respiratory Syndrome». No hubo restricciones de fechas durante la búsqueda. Se seleccionaron los artículos que cumplieran con los términos de búsqueda en el título o en el resumen y posteriormente se eligieron aquellos relevantes para la revisión, de donde se extrajo la información pertinente para los propósitos del artículo.
ResultadosLa búsqueda de la literatura arrojó un total de 192 artículos. Se excluyeron los artículos no relevantes para la revisión, aquellos duplicados y aquellos sin acceso a texto completo. Finalmente, se seleccionó un total de 71 artículos relevantes para la revisión de tema. En la figura 1 se presentan los resultados de la búsqueda y selección de los artículos.
Panorama general de la pandemiaLa enfermedad por el nuevo coronavirus (COVID-19) ocasionada por el SARS-CoV-2 se remonta a finales del año 2019, cuando surgieron cuadros de neumonía de origen desconocido en Wuhan, China4,5. La etiología de estas neumonías era un nuevo coronavirus llamado 2019-nCoV6. Dos características importantes pudieron establecerse hasta ese punto: el origen de la transmisión animal-humano y la posterior diseminación por el contacto humano-humano7. Tras la propagación global del virus, la Organización Mundial de la Salud (OMS) declaró al SARS-CoV-2 como una emergencia internacional8. Debido al número reproductivo promedio (R0) que puede ser de hasta un 3,589,10, el virus tuvo una fácil diseminación a más de 200 países en menos de 3 meses11. En el momento de la presente revisión se reportan más de 80 millones casos confirmados de COVID-19 a escala mundial, con más de un millón de muertes12. En Colombia, los casos confirmados ascienden a 1.626.461 y los fallecidos a 42.90913.
Para todos los países ha representado un reto hacer control de la propagación de la COVID-19, por lo que múltiples estudios han propuesto que uno de los pilares para realizar el control de brotes recae sobre una adecuada estrategia de identificación temprana de contactos de casos positivos14,15. Los síntomas más frecuentes son fiebre, tos y dificultad respiratoria, pero adicionalmente se ha descrito ageusia, anosmia, mialgias, fatiga, diarrea, congestión nasal y odinofagia16. La característica dificultad respiratoria se puede presentar a la semana de iniciar los síntomas hasta en un 50% de los casos, pudiendo evolucionar a un síndrome de dificultad respiratoria agudo17. No es despreciable el porcentaje de pacientes asintomáticos, pues puede oscilar entre el 2 y el 79%18. Los principales hallazgos en las imágenes de pacientes con COVID-19 son el patrón en vidrio esmerilado y las consolidaciones alveolares19. Existe mayor riesgo de mortalidad en los pacientes ancianos (≥65años) y aquellos con enfermedades crónicas como hipertensión arterial, enfermedad cardiovascular, diabetes, EPOC y cáncer20.
Compromiso neurológico de la COVID-19Espectro de manifestaciones clínicasLa COVID-19 es una patología que puede afectar en pequeña proporción el sistema nervioso central (SNC) y periférico (SNP), en comparación con la enfermedad respiratoria, pero debido a la muy apreciable cantidad de casos en el mundo, el número de aquellos con compromiso neurológico es elevado21. Esto afecta a personas de diferentes grupos de edad, con síntomas dentro de los cuales los más comunes a nivel del SNC son cefalea, mareo y alteraciones del estado de conciencia; a nivel del SNP se presentan alteraciones musculoesqueléticas, hiposmia e hipogeusia22–24. Estos síntomas pueden ser efectos directos del virus sobre el sistema nervioso o relacionarse con una respuesta inmunomediada parainfecciosa o postinfecciosa, y es posible que se presenten manifestaciones y complicaciones neurológicas de los efectos sistémicos de la COVID-19 como encefalopatía, meningoencefalitis, síndrome de Guillain-Barré y accidente cerebrovascular21,25.
Mecanismos de la neuroinvasiónExisten diferentes mecanismos sugeridos de invasión al sistema nervioso por parte del SARS-CoV-2, de acuerdo con los síntomas neurológicos presentados en COVID-19, entre los que se encuentran la propagación hematógena y la propagación axonal retrógrada. Los posibles mecanismos de daños neuronales son la infección del SNC y del SNP, la lesión cerebrovascular, la lesión hipóxica y la lesión inmunomediada.
La tormenta de citocinas es el mecanismo inmunomediado al que se atribuye la agresión cerebral, lo que implica la sobreproducción y liberación de cantidades excesivas de leucocitos y citocinas (principalmente IL-6), lo cual lleva a la activación de macrófagos, linfocitos y células endoteliales que activan excesivamente el sistema del complemento y la cascada de coagulación. Esto resulta en una hipercitocinemia potencialmente fatal y una coagulación intravascular diseminada subsiguiente, lo que conduce a una falla multiorgánica26,27.
Síndrome de Guillain-BarréEl síndrome de Guillain-Barré (GBS, por sus siglas en inglés) es un término usado para describir un grupo de trastornos autoinmunes que tienen en común la presencia de parálisis progresiva aguda/subaguda, aunque presenten patogénesis distintas28,29. La incidencia anual en los Estados Unidos y Europa oscila entre 0,81 y 1,89 (mediana 1,11) casos por cada 100.000 adultos al año, siendo más común en hombres30 y con mayor incidencia en invierno, relacionado posiblemente con los periodos prodrómicos de algunos agentes infecciosos29.
El GBS representa una enfermedad inmunomediada, relacionada frecuentemente con infecciones agudas previas cuyos síntomas comienzan a aparecer días a semanas después de una infección respiratoria o gastrointestinal31. Dentro de los agentes etiológicos más comúnmente implicados se encuentran el Campylobacter jejuni, el Mycoplasma pneumoniae, el Haemophilus influenzae, el citomegalovirus, el virus Epstein-Barr, el herpesvirus, la hepatitis A y E, el virus de la varicela zóster y el VIH31,32.
La fisiopatogenia del GBS se ha explicado por un mimetismo molecular entre el agente infeccioso y los gangliósidos (GM1, GD1, GT1, GQ1) en el axolema. Los anticuerpos (IgM e IgG) producidos contra los residuos de ácido siálico que hacen parte de los agentes infecciosos pueden unirse de igual manera al axolema y generar una reacción cruzada de anticuerpos. Los principales mecanismos efectores están determinados, en primer lugar, por la acción de macrófagos que atraviesan la membrana basal de las células de Schwann sanas y hacen contacto directo con las laminillas de mielina más externas, lo que lleva a la destrucción de la superficie de la vaina de mielina. Posteriormente, las células T que liberan citocinas y quimiocinas aumentan la permeabilidad vascular, lo que atrae más macrófagos, células T y, finalmente, las proteínas fijadoras del complemento31.
En el GBS típico se presenta debilidad bilateral ascendente rápidamente progresiva, que comienza en las extremidades inferiores distales y suele ser bilateral, con pérdida de reflejos tendinosos profundos y dolor significativo28,33. La enfermedad puede estar asociada con síntomas como sensación de malestar, náuseas, diarrea, letargo y ocasionalmente dolores de cabeza occipitales28. El diagnóstico es principalmente clínico. Los criterios propuestos por Asbury y Cornblath34 para el GBS típico se presentan en la tabla 1.
Criterios diagnósticos para GBS típico
| Características requeridas |
| Debilidad motora progresiva de más de un miembro (en algunos casos inicia solo en piernas) |
| Arreflexia o hiporreflexia |
| Características que apoyan fuertemente el diagnóstico |
| Características clínicas (en orden de importancia) |
| Progresión de los síntomas a lo largo de días hasta 4 semanas |
| Simetría relativa de los síntomas |
| Signos o síntomas sensoriales leves |
| Compromiso de los nervios craneales, especialmente debilidad bilateral de los músculos faciales |
| Recuperación (inicia 2-4 semanas después de que cesa la progresión) |
| Disfunción autonómica (taquicardia, hipotensión postural, hipertensión, etc.) |
| Ausencia de fiebre al inicio de los síntomas |
| Características del LCR |
| Aumento de proteínas en el LCR |
| Conteo de células ≤10cel/mm3 |
| Características electrodiagnósticas |
| Electrodiagnóstico anormal con conducción más lenta u ondas F prolongadas |
| Características que ponen en duda el diagnóstico |
| Debilidad asimétrica marcada y persistente |
| Disfunción vesical o intestinal al inicio |
| Disfunción vesical o intestinal persistente |
| Más de 50células/mm3 en LCR |
| Presencia de PMN en LCR |
| Nivel sensitivo agudo |
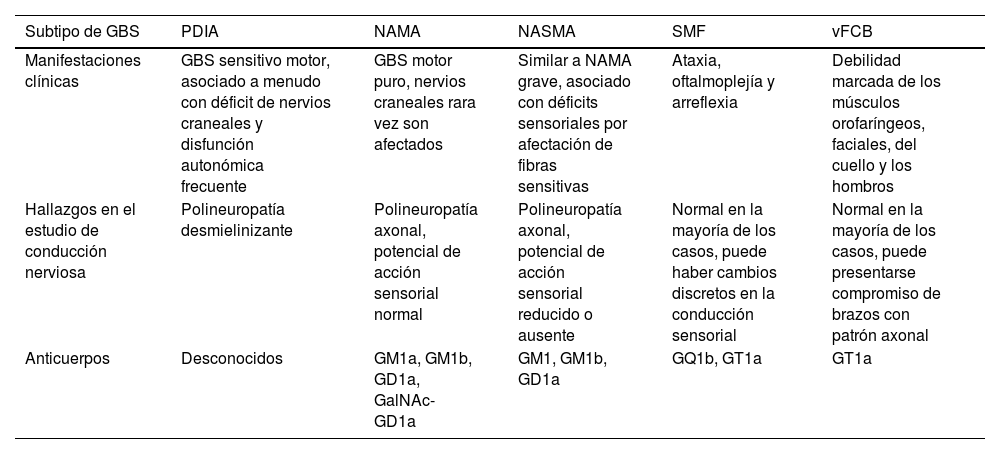
El GBS se clasifica en 5 grupos desde el punto de vista fisiopatológico35: polineuropatía desmielinizante inflamatoria aguda (PDIA), neuropatía axonal motora aguda (NAMA), neuropatía axonal sensitivo-motora aguda (NASMA), variante faríngea-cervico-braquial (vFCB) y síndrome de Miller Fisher (SMF). Las diferencias clínicas y serológicas entre los 5 grupos35,36 se detallan en la tabla 2.
Diferencias clínicas y paraclínicas de los subtipos de GBS
| Subtipo de GBS | PDIA | NAMA | NASMA | SMF | vFCB |
|---|---|---|---|---|---|
| Manifestaciones clínicas | GBS sensitivo motor, asociado a menudo con déficit de nervios craneales y disfunción autonómica frecuente | GBS motor puro, nervios craneales rara vez son afectados | Similar a NAMA grave, asociado con déficits sensoriales por afectación de fibras sensitivas | Ataxia, oftalmoplejía y arreflexia | Debilidad marcada de los músculos orofaríngeos, faciales, del cuello y los hombros |
| Hallazgos en el estudio de conducción nerviosa | Polineuropatía desmielinizante | Polineuropatía axonal, potencial de acción sensorial normal | Polineuropatía axonal, potencial de acción sensorial reducido o ausente | Normal en la mayoría de los casos, puede haber cambios discretos en la conducción sensorial | Normal en la mayoría de los casos, puede presentarse compromiso de brazos con patrón axonal |
| Anticuerpos | Desconocidos | GM1a, GM1b, GD1a, GalNAc-GD1a | GM1, GM1b, GD1a | GQ1b, GT1a | GT1a |
El manejo de los pacientes consiste en la monitorización respiratoria y cardiaca regular, idealmente en una UCI, con énfasis en el electrocardiograma para detectar arritmias tempranamente, medición de la presión arterial y oximetría de pulso. Además, en un 25% de los casos los pacientes requieren ventilación asistida por la debilidad de los músculos respiratorios36. De igual forma, se recomienda el uso profiláctico de heparina subcutánea y de medias de compresión como medidas para evitar la embolia pulmonar en aquellos pacientes que no pueden caminar32.
La inmunoterapia se basa en el uso de inmunoglobulina intravenosa (IGIV) o de plasmaféresis, y ambas presentan una eficacia comparable en la mejoría de los resultados clínicos cuando se administran de forma precoz en pacientes que no pueden caminar o presentan insuficiencia respiratoria37.
La fisioterapia también debe iniciarse tempranamente y la recuperación puede demorar varios meses. En general, un 80% de los pacientes se recupera de manera completa o presenta déficits leves36, en tanto que un 5% muere a causa de complicaciones como sepsis, neumonía o embolia pulmonar, o bien por paro cardiaco32.
Síndrome de Guillain-Barré en la pandemia por COVID-19El GBS constituye la primera enfermedad neurológica autoinmune desencadenada por el reciente SARS-CoV-2. La información reciente indica que en el contexto de la actual pandemia cualquier persona que curse con una enfermedad paralítica aguda similar a GBS, encefalitis o miositis, ello puede representar la primera manifestación de COVID-19, incluso en ausencia de síntomas sistémicos38.
El primer caso reportado, y el único en Wuhan, fue el de una mujer de 61 años que luego de llegar a Shanghái desde Wuhan presentó debilidad aguda de miembros inferiores, asociado con arreflexia, y 3 días después del ingreso los síntomas progresaron. El citoquímico de LCR reportó proteínas elevadas y la electromiografía mostró características de neuropatía desmielinizante, por lo que se confirmó GBS y se inició tratamiento con IGIV. Posteriormente, la paciente desarrolló fiebre, tos y neumonía a los 4 días; se le realizó la RT-PCR para SARS-CoV-2, la cual salió positiva, además de linfocitopenia y trombocitopenia. A las 3 semanas se encontraba estable y con mejoría clínica39, mas este fue solo el inicio de una serie de casos que fueron reportados con posterioridad.
Toscano et al. presentaron una serie de 5 pacientes en Italia, entre 23-77 años, que tuvieron fiebre, tos, anosmia, ageusia y dolor de garganta entre 5 y 10 días antes del inicio de los síntomas neurológicos, que consistieron en debilidad y parestesias en miembros inferiores en 4 de ellos y diplejía facial seguida de ataxia y parestesia en el paciente más joven. En 4/5 pacientes fue positiva la RT-PCR para SARS-CoV-2 en el hisopado nasofaríngeo y el quinto de ellos presentaba serología con IgG positiva para SARS-CoV-240. El LCR fue negativo para SARS-CoV-2 pero se encontraron proteínas elevadas en 3 de los casos y conteo de leucocitos menor de 5cel/mm3 en todos ellos. Los pacientes fueron tratados con IGIV, 2 recibieron un segundo ciclo y uno recibió plasmaféresis. A las 4 semanas de tratamiento, 2 de los pacientes continuaban en la UCI con ventilación mecánica, 2 se encontraban en fisioterapia por persistencia de paraplejía flácida y uno había sido dado de alta sin dificultades para la marcha.
Hallazgos similares de GBS también se han reportado en otras partes del mundo, con presencia de fiebre, anosmia y ageusia previamente a la clínica neurológica, compromiso de pares craneales, proteínas elevadas en el LCR, linfopenia en los laboratorios, realce en la resonancia magnética de nervios craneales, tronco encefálico y meninges, además de características consistentes en la electromiografía de neuropatía desmielinizante y mejoría con la IGIV en una gran parte de los pacientes41–63. También se han descrito asociaciones de COVID-19 con variantes menos frecuentes como el síndrome Miller-Fisher41,42,56,64–67. El GBS había sido asociado anteriormente con otras epidemias virales como H1N1, el virus del Nilo occidental, chikunguña, zika e incluso con otros coronavirus como el MERS-CoV y el SARS-CoV68,69.
Mackenzie et al. reportaron el primer caso en Colombia de GBS asociado con COVID-19, en una paciente femenina de 39 años admitida en un hospital universitario de Barranquilla, que cursó con un cuadro clínico de 6 días de evolución consistente en debilidad general progresiva, de predominio en miembros inferiores, con imposibilidad para la marcha, asociado con tos y mialgias. Además, la paciente reportó síntomas previos de ageusia, anosmia y cefalea en los 20 días antes del ingreso al hospital. Fue llevada a la unidad de cuidados intensivos debido a que desarrolló emergencia hipertensiva y debilidad diafragmática progresiva. Dentro de los hallazgos de laboratorio se encontró leucocitosis, neutrofilia, LDH y dímero-D elevados. Se realizó RT-PCR del hisopado nasal para SARS-CoV-2, con resultado positivo. En el LCR se encontró disociación albuminocitológica y la electromiografía confirmó el diagnóstico de GBS. La paciente fue manejada con medidas de soporte y plasmaféresis por 5 días y fue dada de alta a los 20 días de hospitalización con mejoría clínica70.
Abu-Rumeileh et al. llevaron a cabo una revisión sistemática de 73 casos de GBS en asociación con SARS-CoV-2 a lo largo de 52 publicaciones71, y encontraron que la edad media fue de 55 años, con predominio de hombres (68,5%). En la mayor parte de los casos hubo presencia de síntomas respiratorios o sistémicos y desarrollo de GBS posteriormente a la COVID-19, pero también se reportaron 2 casos asintomáticos de esta última enfermedad. Los síntomas más comunes fueron fiebre (73,6%), tos (72,2%), disnea o neumonía (63,8%), hipo/ageusia (22,2%) e hipo/anosmia (20,8%). La forma clínica más prevalente fue la variante sensitivo-motora clásica (70% de los casos), mientras que el 81,8% de los pacientes con estudios electrofisiológicos cumplía criterios para polineuropatía desmielinizante inflamatoria aguda (PDIA). No se encontró ARN del SARS-CoV-2 en el LCR, por lo que se podría plantear la ausencia de replicación intratecal o una infección directa de la raíz nerviosa, aunque falta más evidencia para soportar esta idea.
La disociación albuminocitológica clásica estuvo presente en el 71,2% de los casos, con un nivel de proteínas promedio de 100mg/dl. Con respecto al manejo, la mayoría de los pacientes recibió IGIV y en 10 de ellos se administró plasmaféresis, de los cuales 4 también recibieron IGIV y 2 recibieron esteroides. En el 21,4% y 7,1% de los pacientes se requirió ventilación mecánica por empeoramiento del GBS o de la COVID-19. De aquellos casos que contaban con datos sobre su evolución (n=68), el 72,1% presentó una mejoría clínica con remisión parcial o completa, el 10,3% no mostró mejoría, el 11,8% todavía necesitaba manejo en cuidados intensivos y el 5,8% había fallecido.
La mejoría clínica principalmente debida al manejo con IGIV y la presencia de anticuerpos anti-GD1b en un caso con SMF41 y anti-GM2, en un paciente de 84 años con GBS sensitivo-motor clásico72, puede sugerir una respuesta inmune desencadenada por el SARS-CoV-2 similar a la que se presenta en otros casos de GBS asociados con virus31.
En el momento no existe evidencia que indique que los pacientes con enfermedades neurológicas autoinmunes clínicamente estables (por ejemplo, polineuropatía desmielinizante inflamatoria crónica, miastenia gravis y miopatías inflamatorias) en manejo con inmunoterapia tengan un mayor riesgo de COVID-19 en comparación con la población general. Con respecto a las terapias biológicas, se ha observado que el uso inicial de terapias inmunomoduladoras no se asocia con peores resultados de COVID-19 con tasas de hospitalización similares a la población general73.
En relación con los mecanismos inmunopatogénicos planteados de esta asociación GBS-SARS-CoV-2, la evidencia sugiere que puede estar mediada por una respuesta autoinmune por mimetismo molecular y no por la invasión viral directa. Se conoce que la proteína viral S (Spike) no solo utiliza el receptor de la enzima convertidora de angiotensina-2 (ACE-2) para la entrada, sino también a las glicoproteínas y gangliósidos que contienen ácido siálico en las superficies celulares74. Como la proteína S de la COVID-19 interactúa con el residuo GalNAc de GM1 y los dímeros de gangliósidos para anclarse a los gangliósidos de la superficie celular, existe la probabilidad de reactividad cruzada entre los epítopos de los gangliósidos que portan la proteína S y los glucolípidos de los nervios periféricos75.
ConclusionesLa actual pandemia por COVID-19 ha implicado muchos cambios en la práctica médica habitual y las investigaciones continúan con el objetivo de conocer más aspectos sobre esta enfermedad. Es importante que los médicos tengan presente esta nueva asociación entre el SARS-CoV-2 y el GBS en aquellos pacientes que refieran síntomas respiratorios o sistémicos con posterior aparición de arreflexia y debilidad progresiva, con el fin de realizar un diagnóstico adecuado e iniciar el tratamiento de forma temprana y oportuna. A pesar de que el GBS asociado con COVID-19 parece compartir una gran parte de las características del GBS postinfeccioso clásico, es necesario llevar a cabo más estudios que arrojen evidencia suficiente para establecer con certeza que sí se comparten los mismos mecanismos inmunopatogénicos.
FinanciaciónNinguna.
Conflicto de interesesNo hay conflicto de intereses.