El síndrome de persona rígida afecta el sistema nervioso central. Los signos clínicos relevantes son la rigidez, los espasmos musculares y sensibilidad incrementada a los estímulos externos, que inducen las contracciones musculares. Las mujeres son afectadas de 2 a 3 veces más con relación a los hombres. Hay marcadores de tipo clínico y electrofisiológico característicos. La etiología se asocia con la mediación por anticuerpos y puede ser la expresión de un síndrome paraneoplásico. El tratamiento farmacológico se realiza con medicamentos relajantes musculares y medicamentos con mecanismo inmunomodulador o inmunosupresor. Adicionalmente, se requiere un plan complementario de rehabilitación.
El propósito del grupo es hacer una descripción del caso clínico, que consideramos es relevante por su baja frecuencia de presentación y realizar una actualización sobre el tema.
Stiff person syndrome affects the central nervous system. Relevant clinical signs are stiffness, muscle spasms, increased sensitivity with external stimuli that increase muscle contractions. Women are affected twice to three times more, in comparation with the men. There are characteristic clinical and electrophysiological type markers. The etiology is associated with mediation by antibodies and may be the expression of a paraneoplastic syndrome. Pharmacological treatment is focused on muscle relaxant-type medications, drugs with immunomodulatory or immunosuppressive mechanism. In adition, complementary rehabilitation treatment is required.
The purpose of the group is to make the description of the clinical case that is relevant due to the low frequency of presentation and to carry out an update of the topic.
El síndrome de persona rígida (SPR) es una enfermedad que afecta el sistema nervioso central que se manifiesta por rigidez, espasmos musculares e incrementada sensibilidad con estímulos externos que empeoran las contracciones. Hay marcadores de tipo clínico y electrofisiológico característicos, como es la contracción simultánea de músculos agonistas y antagonistas, la descarga involuntaria y continua de las unidades motoras en reposo1–4.
Los reportes realizados informan una prevalencia de 1-2 casos por millón, con incidencia de un caso por millón por año. La edad media de presentación varía entre los 20 y 50 años, la mujer se afecta más, de 2 a 3 veces en proporción al hombre3,4.
El propósito del grupo es hacer una descripción del caso clínico, que consideramos es relevante por su baja frecuencia de presentación y realizar una actualización sobre el tema.
Caso clínicoSe trata de una paciente de sexo femenino, quien para el año 2012 presentó una sintomatología variada, consistente en dolor tipo «corrientazo» en sus extremidades, además, con movimientos involuntarios faciales, dificultad para articular palabras, debilidad distal en los miembros inferiores asociada a rigidez, contracciones musculares focales dolorosas en varios grupos musculares que se intensificaban con estímulos ambientales; posteriormente el compromiso se generalizó hasta llegar a la incoordinación motora, enlentecimiento de la marcha y marcada sensación de cansancio. El examen físico reveló una disartria severa, lengua hipotónica con limitación para su protrusión, temblor cefálico, dismetría bilateral y marcha atáxica. De acuerdo con la presentación del cuadro clínico se consideró un probable diagnóstico de SPR y por ello se solicitaron los exámenes pertinentes para aclarar la posible etiología (tabla 1). Los estudios de perfil metabólico, infeccioso, nutricional, neoplasia oculta, inmunológico fueron reportados como normales; específicamente se buscó la presencia de anticuerpos contra descarboxilasa ácido glutámico, y el reporte fue negativo.
Estudios de extensión
| Cerebral | Pequeñas áreas de hiperintensidad de señal puntiformes en la sustancia blanca, de tipo no especificado |
| Espectroscopia cerebral | Se identifica alteración en el patrón espectral consistente en un aumento en las concentraciones de glicina o mioinositol que se encuentran en la misma posición espectral (3,56) a nivel de ganglio basal derecho, sin otras anormalidades en los patrones espectrales ni en las relaciones de los metabolitos evaluados |
| Columna | Cambios osteocondríticos leves en columna cervical, osteofito central en C3-C4, que oblitera parcialmente el espacio subaracnoideo anterior, hallazgos identificados también a nivel de T7-T8 y T8-T9 |
| Funcional del lenguaje | Dominancia del lenguaje izquierdo con activación muy leve con diferentes tipos de paradigma. Presenta activación motora para la lengua ubicada de manera habitual en giro precentral bilateral. Sin alteraciones de los tractos estudiados y el estudio de t1 volumétrico no evidenció cambios atróficos |
| Electroencefalograma | Normal |
| Ecocardiograma | Normal |
| Prueba de estimulación repetitiva muscular | Sin evidencia electrofisiológica de trastorno presináptico o postsináptico de la unión neuromuscular |
| Estudio de neuroconducciones en 4 extremidades | Neuroconducción motora y sensitiva en las 4 extremidades (nervios mediano, ulnar, tibial, peroneo y sural) encontrando latencias, amplitudes y velocidades de conducción dentro de límites normales |
El manejo integral de la paciente incluyó tratamiento farmacológico sintomático con buspirona, levodopa-carbidopa, pregabalina y un plan de rehabilitación con terapia del lenguaje para mejorar la deglución y la voz, terapia física con énfasis en hidroterapia para mejorar su movilidad y su independencia.
El seguimiento a 2 años mostró la pérdida progresiva en la independencia para las actividades básicas de la vida diaria y un mayor compromiso en la marcha, por lo cual requirió prescripción de una silla de ruedas. Para el año 2017, la condición clínica empeoró, requiriendo asistencia total para sus actividades básicas de la vida diaria, hasta que finalmente necesitó ser hospitalizada. En esa ocasión, al examen físico se encontró una paciente alerta, con una disartria severa y dificultad para nominar, no tenía sostén cefálico ni equilibrio en sedestación. El examen muscular reveló unos reflejos miotendinosos exaltados, grupos musculares hipertróficos, hipertónicos, con contracciones involuntarias, espasmos musculares sostenidos y marcada dificultad para la relajación, lo cual le producía mucho dolor.
El caso se analizó por parte del grupo médico tratante, encontrando:
- 1.
Una evolución constante y lentamente progresiva en años de la enfermedad, con progresión hacia la incapacidad funcional.
- 2.
Clínica de rigidez, espasmos musculares generalizados y dolorosos exacerbados por estímulos ambientales.
- 3.
Estudios electrodiagnósticos con registro de actividad muscular continua involuntaria, sin evidencia de compromiso del sistema nervioso periférico.
- 4.
Ausencia de caquexia o de otros signos de desnutrición.
- 5.
El grupo de hematooncología realizó estudios paraclínicos de extensión para neoplasia oculta incluida biopsia de médula ósea, citometría de flujo para formas inmaduras de linfocitos que fue negativa, se valoraron los niveles séricos de inmunoglobulinas que fueron normales; lo cual hacía poco probable el diagnóstico de cáncer y de síndrome paraneoplásico, por lo que no se consideró solicitar el perfil de los autoanticuerpos antineuronales.
Se concluyó que el cuadro clínico de la paciente correspondía probablemente a un SPR de posible etiología autoinmune.
Se actualizaron los estudios (tabla 2) y se propuso como tratamiento etiológico la plasmaféresis y manejo sintomático complementario con baclofeno. La paciente permaneció hospitalizada hasta cuando completó un total de 10 recambios plasmáticos, evidenciándose mejoría clínica desde el séptimo recambio. Esta mejoría se manifestó por disminución de la disartria, reducción de los espasmos musculares y del tono muscular, lo cual le permitió a la paciente mejorar la movilidad y el control del tronco. Adicionalmente se documentaron niveles bajos de vitamina D, pero a pesar de la suplencia, no se apreció mejoría de la rigidez muscular cuando se normalizaron los niveles.
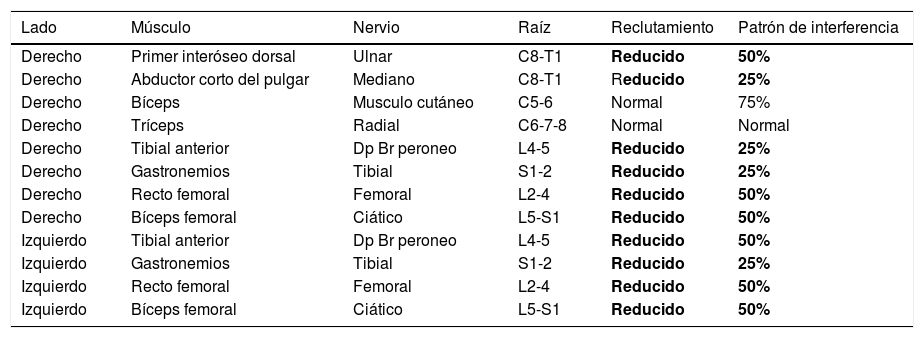
Electromiografía
| Lado | Músculo | Nervio | Raíz | Reclutamiento | Patrón de interferencia |
|---|---|---|---|---|---|
| Derecho | Primer interóseo dorsal | Ulnar | C8-T1 | Reducido | 50% |
| Derecho | Abductor corto del pulgar | Mediano | C8-T1 | Reducido | 25% |
| Derecho | Bíceps | Musculo cutáneo | C5-6 | Normal | 75% |
| Derecho | Tríceps | Radial | C6-7-8 | Normal | Normal |
| Derecho | Tibial anterior | Dp Br peroneo | L4-5 | Reducido | 25% |
| Derecho | Gastronemios | Tibial | S1-2 | Reducido | 25% |
| Derecho | Recto femoral | Femoral | L2-4 | Reducido | 50% |
| Derecho | Bíceps femoral | Ciático | L5-S1 | Reducido | 50% |
| Izquierdo | Tibial anterior | Dp Br peroneo | L4-5 | Reducido | 50% |
| Izquierdo | Gastronemios | Tibial | S1-2 | Reducido | 25% |
| Izquierdo | Recto femoral | Femoral | L2-4 | Reducido | 50% |
| Izquierdo | Bíceps femoral | Ciático | L5-S1 | Reducido | 50% |
La electromiografía de aguja mostró actividad muscular involuntaria sostenida, irregular y paroxística de múltiples grupos musculares, sin poder conseguirse reposo ni relajación absoluta, con ausencia de signos de inestabilidad de membrana y de descargas neuromiotónicas.
Negrita: se destacan los hallazgos anormales encontrados en el estudio de electromiografía.
Al egreso, se prescribió tratamiento farmacológico con baclofeno, buspirona, levodopa-carbidopa, pregabalina, vitamina D y plan de rehabilitación con terapia del lenguaje para mejorar deglución, disminuir su disartria y mejorar su nivel de comunicación, y terapia física y ocupacional para mantener sus arcos de movilidad articular, modular el tono muscular, mejorar el equilibrio, la coordinación y el control motor. Finalmente, se decidió suspender las plasmaféresis y continuar tratamiento con rituximab en forma ambulatoria –decisión que se sustentó por los reportes positivos de casos tratados en la literatura médica, la facilidad de dosificación y administración del producto–. Recibió la infusión intravenosa con 1.000mg y una dosis adicional a los 15 días; el esquema se repitió en los siguientes 4 meses, en total lleva 3 ciclos aplicados. Se realizó seguimiento clínico. Comparativamente con el estado clínico referido para el año 2017, la paciente mejoró en la intensidad de los espasmos musculares axiales y cervicales que le ocasionaban tanta disfagia, en el equilibrio en sedestación y la independencia en actividades básicas de la vida diaria, logró desplazarse con caminador y por ello actualmente tiene una mejor calidad de vida.
DiscusiónLa etiología del SPR se asocia con la mediación por anticuerpos que al unirse con antígenos generan un bloqueo funcional en las sinapsis de las neuronas –en cerebro y médula espinal– que usan como neurotransmisor ácido amino gammabutírico (GABA)1. Los anticuerpos mejor reportados, son: anticuerpos anti-GAD –ácido glutámico descarboxilasa–, anticuerpos antiglicina alfa 1 (anti-GlyR), anticuerpos antianfifisina y gefirin1. El proceso de síntesis para formar GABA tiene 2 isoformas, la formación de autoanticuerpos contra la isoforma GAD65 es la más reportada en los pacientes con SPR, localizada en la terminal presináptica y se «ancla» en forma reversible en las vesículas sinápticas de la membrana; el efecto patogénico de los anticuerpos anti-GAD65 es incierto, debido a la localización intracelular del antígeno que dificulta la acción de los anticuerpos y que se expresa con varios síndromes clínicos1–3. Los anticuerpos anti-GAD no son específicos para el SPR, la población normal lo expresa hasta en el 1% de los evaluados, son positivos hasta en el 5% en diferentes síndromes neurológicos, como son: la ataxia cerebelosa, la encefalitis límbica con mioclonos y la epilepsia del lóbulo temporal1,2. La severidad clínica de la enfermedad no tiene relación con el valor de los títulos de anticuerpos medidos en suero y líquido cefalorraquídeo; hay reportes de pacientes que desarrollan una enfermedad severa con títulos bajos y viceversa, mientras otros con la enfermedad tienen títulos séricos negativos1,5.
Los anticuerpos antianfifisina y antigefirin –proteínas sinápticas– se expresan en síndromes paraneoplásicos asociados con tumores de seno, ovario, carcinoma pulmonar de célula pequeña, carcinoma de célula renal, carcinoma tiroideo, cáncer de colon, timoma, linfoma de Hodgkin y no Hodgkin, colangiocarcinoma1,3. En el SPR como en los síndromes paraneoplásicos se forma una defectuosa endocitosis del neurotransmisor generada por el anticuerpo1. Para el SPR en personas con cáncer se propone un mecanismo patológico directo de los anticuerpos, lo que se demostró por experimentos de laboratorio con ratones que fueron infundidos con anticuerpos específicos antianfifisina, los cuales desarrollaron el síndrome clínico, con anormalidad en los estudios de electromiografía y positividad de los anticuerpos en el sistema nervioso central1. La participación de las células T y B en el SPR no es definida. Se propone que las células de la microglía y las células B funcionan como células presentadoras de antígenos (antígeno GAD65) al linfocito T, perpetuando su efecto en el sistema nervioso central, y las células B se vinculan con la generación de poblaciones oligoclonales de anticuerpos3,5.
Genéticamente, con el SPR hay expresión de diferentes genes del complejo mayor de histocompatibilidad (CMH) -en especial los alelos DQB1*0201 y DRB1 de CMH II-1,3.
La presentación clínica de la enfermedad se clasificó en subtipos; así3,4,6:
- •
SPR tipo clásica.
- •
Variantes de SPR:
- •
Focal o segmentaria.
- •
SPR con espasmos.
- •
Variante encefalomielitis progresiva con rigidez y mioclonos.
- •
SPR con ataxia, epilepsia, etc.
- •
Variante paraneoplásica.
La variante encefalomielitis progresiva con rigidez y mioclonos afecta a personas entre los 50 y 60 años, con inicio insidioso y una evolución con patrón en remisión y recaída, hay disfunción del tallo cerebral, signos de disautonomía y se relaciona con anticuerpos antiglicina alfa1r (anti-GlyR)3.
Para el diagnóstico de SPR –variante clásica- los criterios propuestos son3,6–8:
- •
Facies inexpresiva con rigidez en los músculos axiales y de extremidades, predominando en músculos abdominales y paravertebrales toracolumbares que generan una deformidad fija en hiperlordosis; con dificultad para respirar por el compromiso de músculos torácicos.
- •
Espasmos musculares dolorosos generados por estímulos ambientales como ruido, estrés emocional, táctiles. Son intermitentes y similares a los presentes en el tétano, duran varios minutos y pueden generar fracturas de huesos o luxaciones articulares.
- •
Por electromiografía hay registro de actividad motora continua en músculos agonistas y antagonistas.
- •
Debe descartarse el compromiso por otras enfermedades neurológicas.
- •
Los anticuerpos anti-GAD65 o antianfifisina positivos evaluados en suero.
- •
Mejoría clínica con benzodiacepinas.
El síntoma de fatiga en los pacientes se explica por el defecto presináptico en la unión neuromuscular demostrado por estudios electrofisiológicos9.
El SPR debe diferenciarse con patologías que comprometen tanto el sistema piramidal como extrapiramidal, por ejemplo: la encefalitis antirreceptor N-metil-D-aspartato, encefalitis límbica, epilepsia refractaria, mielopatías, distonías, la degeneración espinocerebelosa, la esclerosis lateral primaria, la neuromiotonía, tétano, miastenia gravis, diabetes tipo i (en el 35% de los casos coexiste con el síndrome), tiroiditis autoinmune, enfermedad de Graves, el síndrome autoinmune poliendocrino, vitíligo, retinopatía y escleritis autoinmune, el lupus, la anemia perniciosa y la enfermedad celiaca1–3.
Los métodos de diagnóstico incluyen resonancias de cerebro y médula espinal, electromiografías con los hallazgos arriba descritos y electroencefalogramas1–4. Debe realizarse un tamizaje completo de pruebas para cubrir el amplio diagnóstico diferencial, referenciado previamente. Para los pacientes con sospecha de la variante paraneoplásica deben evaluarse los anticuerpos paraneoplásicos anti-Ma, anti-Yo, anti-Hu, antianfifisina y gefirin, antirreceptor de acetilcolina, antirreceptor de glicina, antirreceptor GABA, antirreceptor GAD10.
El tratamiento se enfoca según la positividad del anticuerpo que se encontró positivo, existe evidencia de pacientes con anticuerpos positivos contra receptor GABA que responden mejor con inmunoglobulina, los anfifisina positivos responden mejor con esteroides, plasmaféresis y el tratamiento del cáncer primario; los anti-GAD positivos responden bien con inmunoglobulinas, diazepam, clónazepam y los anti-GlyR alfa 1 positivos tienen mejores resultados con inmunoterapias8.
En relación con la patogénesis del SPR hay las siguientes terapias3,4,7:
- •
Medicamentos GABAérgicos. Se utilizan: benzodiacepinas, toxina botulínica, baclofen vía intratecal con regulares resultados. Para modular los síntomas se proponen alternativas como gabapentina, tiagabina, valproato, levetiracetam7,8.
- •
Medicamentos con efecto inmunomodulador o inmunosupresor. Los mejores reportes descritos, son:
- o
Prednisona.
- o
Plasmaféresis: La Dra. Pagano et al. reportaron la experiencia con un grupo de 9 pacientes tratados con plasmaféresis que habían empeorado con terapias de primera línea, el 78% reportó leve mejoría clínica y el 56% tuvo mejoría significativa con buena tolerancia del tratamiento. El estudio del Instituto John Hopkins encontró resultados positivos con plasmaféresis en el 56% de los pacientes incluidos; otros trabajos reportan que la terapia es bien tolerada con solo el 4,75% de eventos adversos7,8.
- o
Inmunoglobulina intravenosa: la Federación Europea de Sociedades Neurológicas indica su aplicación para los casos que no mejoran con tratamientos de primera línea, en dosis de 2g/kg peso; se reportó mejoría significativa de la rigidez y la reducción de autoanticuerpos GAD8.
- o
Anticuerpos monoclonales contra células de linfocitos tipo B receptor cd20+, como rituximab: los trabajos realizados destacan la buena tolerancia, las remisiones clínicas son largas con mejoría en los espasmos y la rigidez muscular; pero no se reducen los títulos de anticuerpos circulantes y el beneficio global es bajo, explicado probablemente en los mecanismos de resistencia mediados por anticuerpos, la actividad inmune mediada por células T sensibilizadas y no por células B o autoanticuerpos. Se aplican dosis entre 350-375mg–m2, 2 dosis espaciadas por 7 a 14 días o semanalmente por 4 semanas8. En los casos que son GAD+ y tienen recaídas, se reporta el beneficio de dosis adicionales entre los 6-8 meses de la infusión inicial1,5,8.
En las pacientes con embarazo y el SPR debe evitarse tratarlas con benzodiacepinas en el primer trimestre por riesgo de teratogenicidad, es preferible el uso de baclofeno; las benzodiacepinas pueden administrarse en los últimos trimestres y vigilarse el riesgo de sedación, depresión respiratoria e hipotonía en el feto. El trabajo de parto puede asistirse con anestesia regional y controlar bien el dolor para evitar los espasmos musculares. No hay consenso en lo relacionado con la vía del parto –vaginal o por cesárea–11.
ConclusiónEl SPR es una patología con baja frecuencia de presentación que tiene un marco diferencial amplio, debe realizarse un tamizaje de estudios completo, evaluarse la presencia de autoanticuerpos para establecer diferencias entre un evento inmunológico primario o secundario relacionado con un síndrome paraneoplásico.
El tratamiento comprende el manejo sintomático y debe incluir esquemas con medicamentos inmunosupresores, inmunomoduladores.
El caso clínico presentado se consideró relevante para publicar por la baja frecuencia de presentación de esta patología, para destacar la buena respuesta clínica observada y la notoria mejoría en la calidad de vida de la paciente con los tratamientos de plasmaféresis y el anticuerpo monoclonal rituximab.
FinanciaciónNo se recibió apoyo financiero.
Conflicto de interesesNinguno.
Para el Dr. Jorge Karim Assis, director del Departamento de Investigación y Educación, Clínica de Occidente S.A., y colaboradores por permitirnos acceder al sistema de registro institucional de historias clínicas para la realización de este trabajo.
Para la educadora Adriana P. Henao Galindo, editora y correctora de estilo, por su aporte en la revisión del artículo.