La inmunoterapia con inhibidores de puntos de control (ICC) ha demostrado ser una de las nuevas estrategias más efectivas para tratar varios tipos de cáncer. Sin embargo, al detener la supresión ejercida por los puntos de chequeo, principalmente CTLA-4 y PD-1/PD-L1, algunos pacientes presentan diferentes reacciones inmunológicas (irAE) que pueden ir desde compromiso orgánico leve hasta grave, con riesgo de muerte. Esto hace importante que durante el tratamiento los pacientes sean evaluados cuidadosamente, para lograr detectar y entender este tipo de manifestaciones y encontrar herramientas para su manejo.
ObjetivosDeterminar la presencia de autoanticuerpos en un grupo de pacientes en tratamiento con ICC, con o sin clínica sugestiva de enfermedad reumatológica asociada a la terapia. Además, evaluar las características clínicas y demográficas de dichos pacientes.
MétodosEn este estudio transversal se reclutaron pacientes diagnosticados con cáncer y bajo tratamiento con ICC. En el suero se determinaron autoanticuerpos mediante kits comerciales. La presencia de irAE fue evaluada de acuerdo con las definiciones propuestas en las guías de la Sociedad Americana de Oncología Clínica.
ResultadosDe los 24 pacientes evaluados, 15 presentaron al menos un evento adverso inmunológico, siendo los dermatológicos y los musculoesqueléticos los más prevalentes. Respecto a la presencia de autoanticuerpos, de los 22 sueros analizados 19 presentaban al menos un autoanticuerpo, siendo los anticuerpos antinucleares y antimúsculo liso los más comunes.
ConclusiónLa seroprevalencia encontrada en nuestros pacientes nos sugiere que los autoanticuerpos podrían hacer parte de las irAE en pacientes tratados con ICC. Sin embargo, se requieren más estudios para lograr definir la utilidad de la determinación de autoanticuerpos en estos pacientes como predictores de manifestaciones clínicas.
Immunotherapy with checkpoint inhibitors has shown to be one of the most effective new strategies to treat some types of cancer. However, stopping the suppression induced by the checkpoints, mainly CTLA-4 and PD-1 / PD-L1, makes patients prone to develop different immune reactions that can range from mild organ involvement to life-threatening compromises. This highlights the importance that patients should be carefully evaluated during treatment in order to detect and understand these types of manifestations, and find tools for their management.
ObjectivesTo determine the autoantibody profile of patients under treatment with checkpoint inhibitors (ICI), with or without symptoms suggestive of rheumatological disease associated with the therapy. The clinical and demographical characteristics of such patients were also analysed.
MethodsPatients diagnosed with cancer and under treatment with ICI were recruited. Sera were evaluated with commercial kits to determine the presence of autoantibodies. The presence of immune-related adverse events (irAEs) was evaluated according to the definitions proposed in the guidelines of the American Society of Clinical Oncology.
ResultsOf the twenty-four patients evaluated, fifteen presented with at least one adverse immunological event, where dermatological and musculoskeletal were the most prevalent. Autoantibodies were obtained from the serum of 22 patients. Nineteen of them had at least one autoantibody, with antinuclear and anti-smooth muscle antibodies being the most prevalent.
ConclusionThe seroprevalence found in our study suggests that autoantibodies may be part of irAEs in patients treated with ICI. However, more studies are required to define the usefulness of autoantibody detection in these patients in order to predict clinical manifestations.
La presencia de antígenos tumorales facilita que el sistema inmune adaptativo tenga la capacidad de eliminar células malignas debido a una respuesta antígeno-específica. Sin embargo, las células tumorales han desarrollado diferentes métodos de evasión de la respuesta inmune, tales como la disminución en la expresión de antígenos —fenómeno también denominado inmunoedición tumoral— y la inhibición de la respuesta del sistema inmune por parte del tumor, específicamente de la respuesta mediada por linfocitos T.
Las células T tienen múltiples puntos de control para regular su activación y prevenir el desarrollo de respuestas autoinmunes. Dentro del abanico de moléculas asociadas a este proceso, resaltan por su importancia el antígeno del linfocito T citotóxico 4 (CTLA-4) y la molécula denominada muerte programada 1 (PD-1), por sus nombres en inglés, respectivamente. Ambas tienen una función inhibitoria de la respuesta inmune, y de hecho su expresión está alterada en diferentes enfermedades reumáticas1.
La inmunoterapia en cáncer con bloqueo de los puntos de control se basa en la inhibición de la supresión de respuestas inmunitarias contra el cáncer. Este tipo de tratamiento se ha consolidado como una opción prometedora de tratamiento para los pacientes con distintas neoplasias.
Los estudios clínicos han demostrado disminución en el crecimiento del melanoma y una mejora en la supervivencia mediante tratamientos que bloquean las vías PD-1 y CTLA-4. Asimismo, anticuerpos monoclonales para bloqueo de CTLA-4 y PD-1 han sido aprobados en el tratamiento de melanoma y cáncer de pulmón.
A pesar de su eficacia, la inmunoterapia en cáncer no está libre de problemas. Al desatar el potencial de las células del sistema inmune durante el tratamiento, su reactividad también se dirige hacia tejidos sanos. Tanto el bloqueo de CTLA-4 como el de PD-1 tienen efectos adversos asociados al sistema inmune que pueden afectar cualquier órgano.
Durante las primeras semanas del tratamiento se ha descrito, por ejemplo, la aparición de eritema y prurito en el tronco y las extremidades, en aproximadamente un 40% de los pacientes con terapia anti-CTLA-4, y en un 20% con terapia anti-PD-1. Las manifestaciones gastrointestinales también son comunes. En cuanto a las endocrinopatías, se presenta inflamación de la glándula pituitaria en pacientes tratados con inmunoterapia dirigida hacia CTLA-4, e hipotiroidismo en pacientes tratados con inmunoterapia dirigida hacia PD-12. También puede aparecer vitíligo, artralgias, sequedad de las mucosas y neumonitis como efectos adversos adicionales. Aun así, en general, los efectos son moderados y requieren tratamientos simples en la mayoría de los casos. Usualmente, el cesar la administración de la inmunoterapia o suministrar inmunosupresión suele resolver el problema. Por otro lado, las endocrinopatías no suelen resolverse. La persistencia de estas manifestaciones puede inducir una enfermedad autoinmune.
Las enfermedades autoinmunes tienen una larga etapa preclínica. Los tratamientos con inhibidores de punto de control (ICC) pueden considerarse un factor desencadenante en su desarrollo3. Por otro lado, los pacientes tratados con ICC no desarrollan efectos adversos inmunes con la misma frecuencia ni con análoga severidad, por lo cual se reconoce que hay unos pacientes más susceptibles que otros. Recopilar datos sobre estos pacientes puede proveer una mirada más profunda hacia la etiología de las enfermedades reumáticas4.
Aunque la mayoría de los estudios correspondientes a enfermedades reumatológicas específicas en pacientes con ICC suelen ser estudios retrospectivos con pocos pacientes, cabe resaltar que se han reportado casos en los cuales ninguno de los pacientes tiene diagnóstico de enfermedad autoinmune previamente al inicio de la inmunoterapia (específicamente anti-PD-1/PD-L1), y algunos de ellos han desarrollado artritis reumatoide, con marcadores serológicos como el factor reumatoide y anticuerpos antipéptidos citrulinados (anti-CCP) positivos5. También se ha reportado retrospectivamente la presencia de artritis inflamatoria y síndrome seco asociado a terapias anti-CTLA-4 y anti-PD-1, aunque los marcadores serológicos fueron negativos para los pacientes con artritis y la positividad de anticuerpos antinucleares y anti-SSB no estuvo presente en todos los pacientes con síndrome seco6.
Es importante comprender que los pacientes son un modelo in vivo que ayuda a entender la aparición de la enfermedad autoinmune secundaria a la inmunoterapia, y su correspondiente estudio clínico puede proporcionar herramientas valiosas para su tratamiento, entre ellas, la búsqueda de autoanticuerpos1.
Pacientes y métodosMuestraEn este estudio transversal se reclutaron pacientes con un diagnóstico de cáncer sometidos a inmunoterapia con ICC durante 2018-2019. El estudio fue aprobado por un comité de bioética (FR-310-45).
Efectos adversos inmunológicos (irAE)La evaluación clínica la realizó un reumatólogo para establecer la presencia de irAE, de acuerdo con las pautas de la Sociedad Americana de Oncología Clínica7, de la siguiente manera: en el dominio neurológico se valoró la presencia de neuropatía periférica, encefalitis, uveítis o meningitis aséptica. En el dominio digestivo se valoró la presencia de síntomas secos, mucositis, colitis, enteritis o hepatitis. En piel se valoró la presencia de rash o de vitíligo. Con respecto al dominio hematológico, se buscaron hallazgos de trombocitopenia o anemia. En el dominio endocrino se valoró en búsqueda de insuficiencia adrenal, hipofisitis, tiroiditis, hipo/hipertiroidismo, diabetes autoinmune o pancreatitis. Con respecto al dominio musculoesquelético, se valoraron las artralgias, la artritis o las mialgias. El sistema cardiovascular se valoró en búsqueda de miocarditis. En el sistema renal se valoró la búsqueda de glomerulonefritis. Finalmente, en el dominio respiratorio se valoró la búsqueda de neumonitis.
La búsqueda de dichas manifestaciones se basaba en la sospecha clínica, y se atribuía como presencia de irAE al descartar otras causas apoyados en historia clínica, examen físico, parámetros de laboratorio, imagenología e histopatología cuando fuese necesario.
Prueba de autoanticuerposSe analizó una muestra de suero para: anticuerpos antinucleares (ANA), células parietales gástricas (anti-GPC), antimitocondriales (AMA), antimúsculo liso (anti-SMA), en tanto que se evaluaron anticuerpos anti-ADN de doble cadena (anti-dsDNA) mediante inmunofluorescencia indirecta. Los anticuerpos antiperoxidasa tiroidea (anti-TPO) se evaluaron mediante quimioluminiscencia. Los péptidos citrulinados anticíclicos y los anticuerpos antígenos nucleares extraíbles se evaluaron mediante un ensayo inmunoabsorbente ligado a enzimas (ELISA). Los títulos del factor reumatoide se midieron mediante inmunoturbidimetría.
Este panel de autoanticuerpos se realizó en un laboratorio de diagnóstico de terceros, con técnicas comerciales estandarizadas. El personal del laboratorio fue cegado a la información clínica y terapéutica.
Análisis estadísticosSe calcularon estadísticas descriptivas. Las diferentes variables se presentan como media y desviación estándar (DE), o mediana y rango intercuartil, dependiendo de la naturaleza de la distribución de acuerdo con una prueba de Kolmogorov-Smirnov. Las variables cualitativas se presentan como porcentajes. El software utilizado fue Prism 5 (GraphPad Prism, California, EE. UU.).
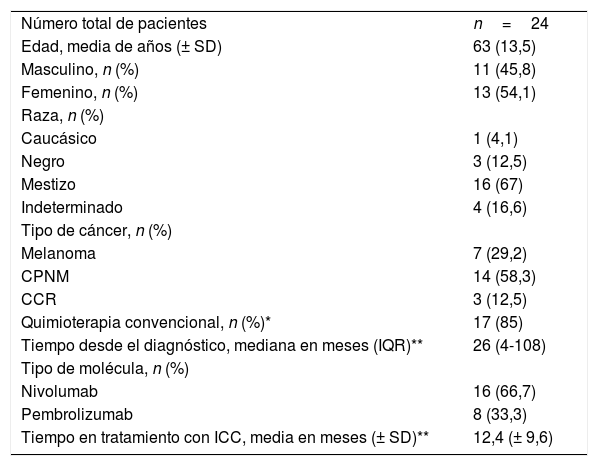
ResultadosCaracterísticas demográficas de los pacientesLas características demográficas de los pacientes se muestran en la tabla 1. Se reclutaron 24 pacientes con diagnóstico de cáncer en tratamiento con ICC. La edad media fue de 63 años (DE±13,5). Catorce pacientes (58,3%) fueron diagnosticados con cáncer de pulmón de células no pequeñas (CPNM), 7 (29,2%) con melanoma y 3 (12,5%) con carcinoma de células renales (CCR). Los datos de 22 pacientes mostraron una mediana de tiempo desde el diagnóstico de cáncer de 26 meses (RIC 4-108). Dieciséis pacientes (66,7%) estaban en tratamiento con nivolumab y 8 (33,3%) con pembrolizumab. El tiempo medio de tratamiento con ICC de 20 pacientes fue de 12,4 meses (DE±9,6).
Características demográficas
| Número total de pacientes | n=24 |
| Edad, media de años (± SD) | 63 (13,5) |
| Masculino, n (%) | 11 (45,8) |
| Femenino, n (%) | 13 (54,1) |
| Raza, n (%) | |
| Caucásico | 1 (4,1) |
| Negro | 3 (12,5) |
| Mestizo | 16 (67) |
| Indeterminado | 4 (16,6) |
| Tipo de cáncer, n (%) | |
| Melanoma | 7 (29,2) |
| CPNM | 14 (58,3) |
| CCR | 3 (12,5) |
| Quimioterapia convencional, n (%)* | 17 (85) |
| Tiempo desde el diagnóstico, mediana en meses (IQR)** | 26 (4-108) |
| Tipo de molécula, n (%) | |
| Nivolumab | 16 (66,7) |
| Pembrolizumab | 8 (33,3) |
| Tiempo en tratamiento con ICC, media en meses (± SD)** | 12,4 (± 9,6) |
CCR: carcinoma de células renales; CPNM: cáncer de pulmón de células no pequeñas.
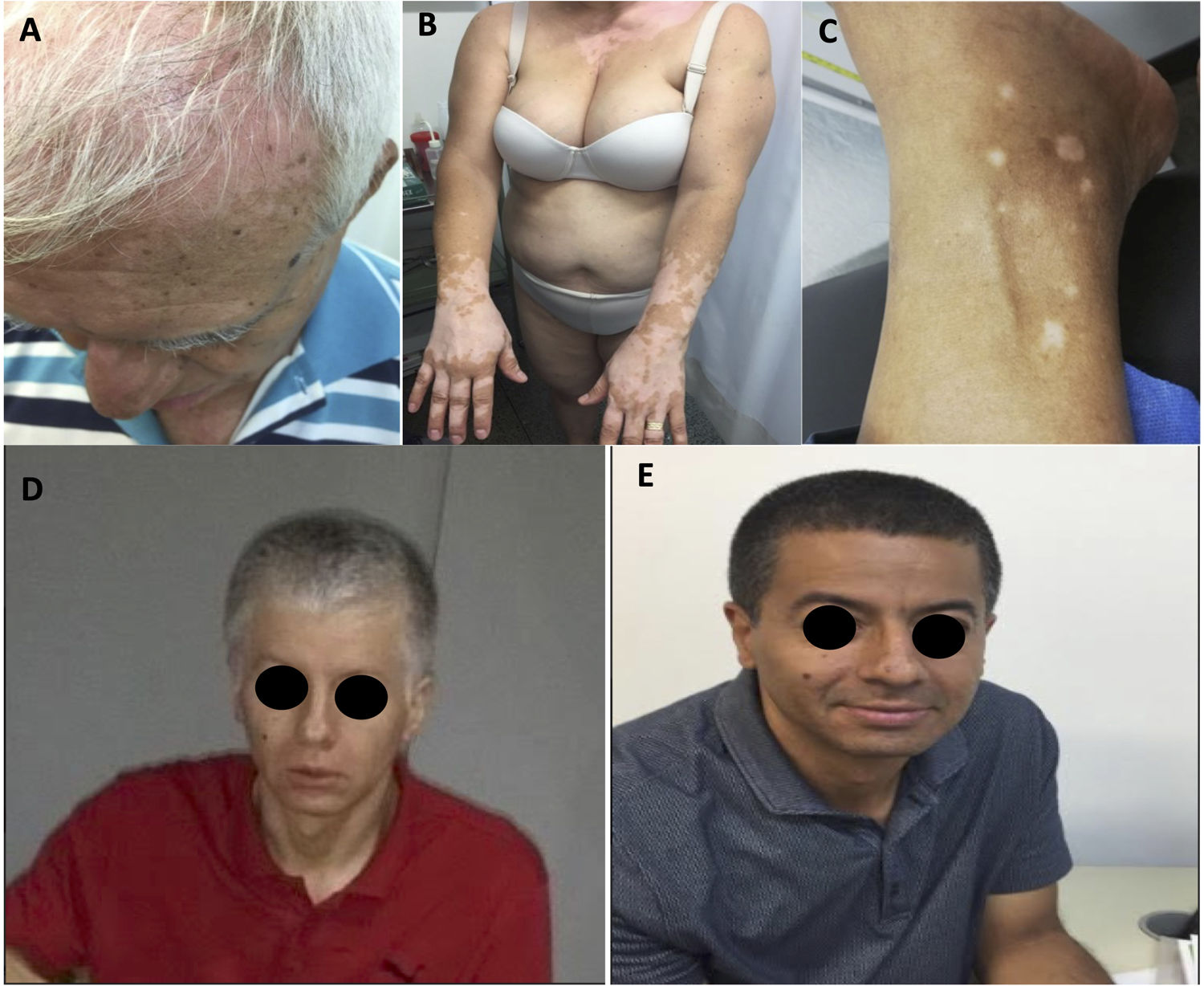
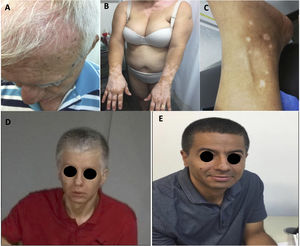
Un total de 15 pacientes tuvieron uno o más eventos adversos relacionados con el sistema inmune (irAE) (tabla 2). Los irAE más comunes fueron los dermatológicos y los musculoesqueléticos. Cinco pacientes presentaron erupción cutánea (20,8%), 3, vitíligo (12,5%), y otros 3, repigmentación de la piel y el cabello (12,5%) (fig. 1A-E). Cinco pacientes tuvieron artralgias (20,8%), 3 tuvieron mialgias (12,5%) y uno artritis (4,2%). Un paciente presentó una reacción similar a la del sarcoide cutáneo y pulmonar8. En la tabla 2 se enumeran otros irAE menos frecuentes.
Eventos adversos inmunológicos (irAE)
| Número de irAE, n (%) | |
| Ningún irAE | 9 (37,5) |
| Un irAEs | 7 (29,1) |
| Dos o más irAE | 8 (33,3) |
| Dermatológicos, n (%) | |
| Erupción cutánea | 5 (20,8) |
| Vitíligo | 3 (12,5) |
| Repigmentación de piel y cabello | 3 (12,5) |
| Musculoesqueléticos, n (%) | |
| Artralgias | 4 (16,7) |
| Mialgias | 3 (12,5) |
| Artritis | 1 (4,2) |
| Endocrinos, n (%) | |
| Hipofisitis | 1 (4,2) |
| Hipertiroidismo | 1 (4,2) |
| Hipotiroidismo | 2 (8,3) |
| Gastrointestinales, n (%) | |
| Xerostomía | 3 (12,5) |
| Colitis | 1 (4,2) |
| Neurológicos, n (%) | |
| Neuropatía | 1 (4,2) |
| Reacción tipo sarcoide, n (%) | 1 (4,2) |
Los resultados del panel de autoanticuerpos se muestran en la tabla 3. Diecinueve de 22 pacientes (cuyo panel de autoanticuerpos se realizó con éxito) presentaron al menos un autoanticuerpo (86,4%), 5 presentaron un anticuerpo, 8 presentaron dos autoanticuerpos y 6 presentaron tres o más. Los autoanticuerpos más comúnmente encontrados fueron ANA: 17 pacientes dieron positivo (77,2%), 10 con títulos de 1/80 (58,8%) o más, y 11 de los 17 presentaron un patrón moteado (64,7%). Un paciente presentó anti-CCP positivos a títulos bajos (23,4 UI/mL). Ninguno de los pacientes dio positivo por anti-dsDNA, anti-Sm, anti-RNP o RF.
Autoanticuerpos
| Número de autoanticuerpos,n (%) | n=22 |
| Ningún autoanticuerpo | 3 (13,6) |
| Un autoanticuerpo | 5 (22,7) |
| Dos autoanticuerpos | 8 (36,3) |
| Tres autoanticuerpos | 3 (13,6) |
| Cuatro autoanticuerpos | 3 (13,6) |
| ANA, n (%) | 17 (77,2) |
| 1/80 | 10 (58,8) |
| ≥ 1/160 | 7 (41,1) |
| Patrón | |
| Moteado | 11 (64,7) |
| Homogéneo | 3 (17,6) |
| Otros | 3 (17,6) |
| Anti-Ro | 3 (13,6) |
| Anti-La | 1 (4,5) |
| Anti-CCP | 1 (4,5) |
| Anti-TPO | 4 (18,1) |
| Anti-GPC, n (%) | 5 (22,7) |
| 1/40 | 2 (40) |
| 1/80 | 3 (60) |
| Antimitocondrial | 1 (4,5) |
| Anti-SMA | 10 (45,4) |
| 1/40 | 3 (30) |
| 1/80 | 7 (70) |
ANA: anticuerpos antinucleares; Anti-CCP: anticuerpos contra péptidos cíclicos citrulinados; Anti-GPC: anticuerpos contra células gástricas parietales; Anti-SMA: anticuerpos contra músculo liso; Anti-TPO: anticuerpos contra peroxidasa tiroidea.
La evidencia de autoanticuerpos en pacientes tratados con ICC es limitada, principalmente debido a la baja frecuencia de su presentación después del tratamiento con tales moléculas9. Estudios previos de pacientes tratados con ICC informan una baja prevalencia de autoanticuerpos, como Calabrese et al.10, que evaluaron a 13 pacientes sin enfermedad autoinmune preexistente y solo un paciente que tenía artritis como irAE dio positivo por anti-dsDNA y ANA. Cappelli et al.6 informaron previamente 13 pacientes tratados con ICI que expresaron irEA reumáticas. Solo 3 de ellos desarrollaron autoanticuerpos bajo tratamiento con ICI. Estos informes contrastan con nuestro estudio: el 86,4% de nuestras muestras de suero (19 de 22) dio positivo para al menos un autoanticuerpo y 14 tenían al menos un irAE.
El 63% del total de los pacientes (15 de 24) tenía al menos un irAE, lo que es similar a la incidencia agrupada obtenida en un metaanálisis que incluyó a 36 ensayos clínicos y mostró un rango del 56-76%11. Observamos que uno de los más comunes eran los dermatológicos, en particular erupción cutánea y vitíligo. Estos resultados son similares a un estudio con 296 pacientes con melanoma en tratamiento con nivolumab12. Cuando se trata de vitíligo, ICIR-BIOGEAS informó que 353 de 368 pacientes (96%) con vitíligo tenían melanoma13. Este fenómeno también ocurrió en nuestros pacientes, donde 2 de los 3 que desarrollaron vitíligo también tenían melanoma, lo que respalda la hipótesis de reactividad cruzada entre los antígenos de melanoma y los melanocitos14. Otra irAE dermatológica que observamos fue la repigmentación del cabello y la piel, que se informó anteriormente15.
Hay algunas limitaciones en nuestro estudio. Primero, nuestro número de muestra fue pequeño y no aleatorizado, lo que podría haber llevado a un sesgo de selección. En segundo lugar, tuvimos una muestra muy heterogénea, sin un número igual en cada subgrupo. Tercero, la naturaleza transversal del estudio impidió observar alguna progresión de los irAE o de los niveles de autoanticuerpos a lo largo del tiempo. En cuarto lugar, el estudio no contó con un grupo control. En quinto lugar, se reclutaron pacientes sometidos a terapia con nivolumab y pembrolizumab; no se incluyeron pacientes con ningún otro inhibidor de punto control como atezolizumab, ipilimumab, avelumab, durvalumab o tremelimumab, entre otros. Finalmente, no podemos estar seguros de si nuestros pacientes ya tenían autoanticuerpos antes del tratamiento o si aparecieron como resultado de este.
La mayor seroprevalencia de AA encontrada en nuestro estudio sugiere que puede ser útil explorar la presencia de AA basal antes de comenzar el tratamiento; se podrían seguir los títulos positivos de AA y las manifestaciones clínicas, proporcionando pistas sobre cualquier asociación entre los 2. Además, es importante buscar AA cuando se desarrolla un irAE, porque dicho AA podría explicar la presencia del evento adverso. Aunque encontramos una asociación entre algunos AA e irAE, la utilidad de los autoanticuerpos necesita más investigación. Vale la pena señalar que los AA no fueron ampliamente evaluados en diferentes estudios con irAE; por lo tanto, podrían ser útiles como biomarcadores en la toma de decisiones de tratamiento y seguimiento de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Participación de autoresTomás Urrego Callejas y Juan Felipe Soto Restrepo contribuyeron de igual manera al presente manuscrito.
FinanciaciónLa entidad financiadora fue la Asociación Colombiana de Reumatología (ASOREUMA), Bogotá, Colombia. El ID de la beca fue: ASOREUMA - 2018-23516.
Agradecemos a Asoreuma la financiación del proyecto. A los programas Joven Investigador y Sostenibilidad de la Universidad de Antioquia, a la Unidad de Investigación del Instituto de Cancerología Clínica las Américas-Auna y a los pacientes por su apoyo a la investigación.