El lupus eritematoso sistémico (LES) es una enfermedad inflamatoria autoinmune que presenta una gran heterogeneidad clínica, por lo que hasta 60% de los pacientes pueden desarrollar nefropatía lúpica (NL).
ObjetivoIdentificar las características demográficas, clínicas y bioquímicas de los pacientes que presentan NL y los que no en el momento del diagnóstico de LES en una cohorte de pacientes mexicanos.
Materiales y métodosEstudio transversal, analítico y de un solo centro. Se realizaron pruebas de normalidad y se aplicó t de Student o U de Mann Withney dependiendo del tipo de variable. Para determinar la diferencia entre las variables se realizó prueba de X2 o f de Fisher.
ResultadosDe 160 pacientes, 79 (49,37%) presentaron NL, los cuales tuvieron una mayor prevalencia de serositis (14,3 vs. 8,1%, p=0,048) e hipertensión arterial (40,50 vs. 24,6%, p=0,033) y aquellos sin NL una mayor prevalencia de artritis reumatoide y afección articular (6 vs. 1%, p=0.052), alergias (43,2 vs. 20,25%, p=0,002), infecciones (23,45 vs. 10%, p=0,020) y niveles más bajos de C3 (52,25±28,7 vs. 74,6±32,2mg/dL, p <0,001).
ConclusionesLas características descritas en nuestra cohorte son similares a las presentadas en otras series latinas y asiáticas. Sin embargo, la presencia de infecciones concomitantes al momento del diagnóstico de LES no había sido descrita y debe ser considerada para el futuro de nuevas investigaciones.
Systemic lupus erythematosus (SLE) is an autoimmune inflammatory disease that presents great clinical heterogeneity, so that up to 60% of patients may develop lupus nephropathy (LN).
ObjectiveTo identify demographic, clinical, and biochemical characteristics of patients presenting with and without lupus nephritis at the time of SLE diagnosis in a cohort of Mexican patients.
Materials and methodsThis is a cross-sectional, analytical, and single-centre study. Frequencies and percentages were used for categorical variables and the comparison was made with Pearson's Chi2 statistical test or Fisher's exact test. For the quantitative variables, their distribution was calculated and according to this, Student's t was used in case of normal distribution and Mann-Whitney U for those with free distribution.
ResultsOf 160 patients, 79 (49.37%) had LN. These individuals had a higher prevalence of serositis (14.3 vs 8.1%, p=.048) and arterial hypertension (40.50% vs 24.6%, p=.033), while those without LN had a higher prevalence of rheumatoid arthritis and joint disease (6 vs 1%, p=.052), allergies (43.2 vs 20.25%, p=.002), infections (23.45 vs 10%, p=.020), and lower levels of C3 (52.25±28.7 vs 74.6±32.2mg/dl, p <.001).
ConclusionsThe characteristics described in our cohort are like those presented in other Latino and Asian series. However, the presence of concomitant infections at the time of SLE diagnosis has not been described and should be considered for future research.
El lupus eritematoso sistémico (LES) es una enfermedad inflamatoria autoinmune crónica y heterogénea que puede afectar cualquier parte del cuerpo. La mayor parte de su patología está relacionada con depósitos de complejos inmunes en diversos órganos, lo que activa el sistema de complemento y otros mediadores de la inflamación. Los síntomas varían de persona a persona, pueden aparecer y desaparecer, según la parte del cuerpo afectada, y se clasifican en leves, moderados o graves. Los estudios derivados de registros suelen tener un gran número de pacientes procedentes de entornos clínicos no experimentales y permiten un seguimiento más extenso que el que se puede lograr en los ensayos clínicos1.
La nefropatía lúpica (NL) es una de las complicaciones más graves del LES, que puede causar daño renal irreversible si no se identifica a tiempo o se trata adecuadamente. Es definida como una enfermedad inflamatoria del riñón secundaria a la actividad del LES, la cual se produce como resultado de una respuesta inmunológica anormal en la que los autoanticuerpos y complejos inmunes dañan directamente la estructura y la función glomerular2. Esta nosología tiene una presentación clínica variable y puede ir desde proteinuria subnefrótica o microhematuria hasta un cuadro franco de lesión renal aguda. La NL está presente al momento del diagnóstico de LES en 40-70%, con una incidencia exacta que depende de factores como raza, edad y género3. Hasta 60-80% de los pacientes con diagnóstico de LES desarrollarán alteraciones urinarias o de la función renal en algún momento de la evolución de la enfermedad4. En términos generales, afecta más a individuos de raza negra, asiáticos y latinos, con una relación mujer-hombre de 9:15,6.
Las guías Kidney Disease: Improving Global Outcomes (KDIGO) determinan como indispensables la presencia de manifestaciones bioquímicas específicas, o bien, hallazgos histopatológicos en pacientes con LES para la definición de NL, que se clasifican en diferentes categorías asociadas con un pronóstico y un enfoque terapéutico particular7. Cuando los resultados clínicos son hematuria y proteinuria leves, las lesiones renales suelen ser mesangiales (clases I o II); si se manifiesta como síndrome nefrítico o un comportamiento rápidamente progresivo, suele haber lesiones glomerulares activas (clases III y IV); cuando se presenta como un síndrome nefrótico puro, es frecuente encontrar daños glomerulares de tipo membranoso (clase V), y cuando hay enfermedad renal crónica se espera hallar alteraciones esclerosantes avanzadas (clase VI)8,9. Sin embargo, la presentación clínica e histopatológica es muy heterogénea y los hallazgos clínicos y de laboratorio impiden predecir con certeza el tipo y grado de lesiones.
A pesar de los avances en el diagnóstico y el tratamiento, la NL sigue siendo una patología compleja y heterogénea, cuyo pronóstico y evolución pueden variar ampliamente de un paciente a otro10, por lo que el objetivo de este estudio es comparar las características demográficas, clínicas y bioquímicas de aquellos que debutaron con NL, en contraste con los que no la presentaron al momento del diagnóstico, con el fin de proporcionar una comprensión integral de los perfiles asociados a esta complicación renal en el contexto de LES en la población mexicana.
Materiales y métodosSe trata de un estudio transversal analítico que incluyó a 160 pacientes con diagnóstico de LES, pertenecientes a la cohorte LUPUS-IMMex del Hospital de Especialidades del Centro Médico Nacional Siglo XXI. Se compararon las características demográficas, clínicas y bioquímicas de los sujetos que presentaron NL al momento del diagnóstico de LES con las de aquellos que no la presentaron. La cohorte incluyó a pacientes con diagnóstico de LES desde el 2009, por los que cumplieron criterios de clasificación ya fuera del Colegio Americano de Reumatología (ACR) 1997, Clínicas Colaboradoras Internacionales de Lupus Sistémico (SLICC) 2012 o Liga Europea contra el Reumatismo (EULAR)/ACR 2019. La NL se definió como la presencia de una proteinuria de 24 horas superior a 500mg/día o microhematuria o deterioro de la función renal, o aquellos que tuvieran biopsia renal compatible con NL al momento del diagnóstico de LES. Se emplearon frecuencias y porcentajes para variables categóricas y se realizó la comparación con la prueba estadística X2 de Pearson o f de Fisher. Para las variables cuantitativas se calculó su distribución y de acuerdo con esta se empleó t de Student en caso de distribución normal y U de Mann-Whitney para las de libre distribución. Se considera como significativo todo valor de p <0,05. Se utilizó el paquete estadístico Statistical Package for the Social Sciences (SPSS) versión 26.
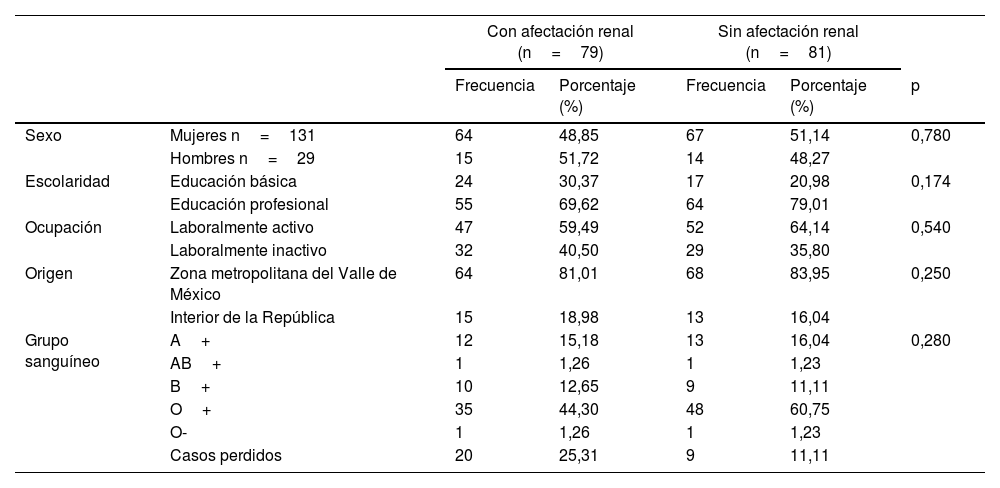
ResultadosDe los 160 pacientes con diagnóstico de LES, 79 (49,37%) presentaron NL al momento del diagnóstico. Entre los que debutaron con NL y los que no, no existió diferencia significativa en las variables sociodemográficas (tabla 1).
Características sociodemográficas
| Con afectación renal (n=79) | Sin afectación renal (n=81) | |||||
|---|---|---|---|---|---|---|
| Frecuencia | Porcentaje (%) | Frecuencia | Porcentaje (%) | p | ||
| Sexo | Mujeres n=131 | 64 | 48,85 | 67 | 51,14 | 0,780 |
| Hombres n=29 | 15 | 51,72 | 14 | 48,27 | ||
| Escolaridad | Educación básica | 24 | 30,37 | 17 | 20,98 | 0,174 |
| Educación profesional | 55 | 69,62 | 64 | 79,01 | ||
| Ocupación | Laboralmente activo | 47 | 59,49 | 52 | 64,14 | 0,540 |
| Laboralmente inactivo | 32 | 40,50 | 29 | 35,80 | ||
| Origen | Zona metropolitana del Valle de México | 64 | 81,01 | 68 | 83,95 | 0,250 |
| Interior de la República | 15 | 18,98 | 13 | 16,04 | ||
| Grupo sanguíneo | A+ | 12 | 15,18 | 13 | 16,04 | 0,280 |
| AB+ | 1 | 1,26 | 1 | 1,23 | ||
| B+ | 10 | 12,65 | 9 | 11,11 | ||
| O+ | 35 | 44,30 | 48 | 60,75 | ||
| O- | 1 | 1,26 | 1 | 1,23 | ||
| Casos perdidos | 20 | 25,31 | 9 | 11,11 | ||
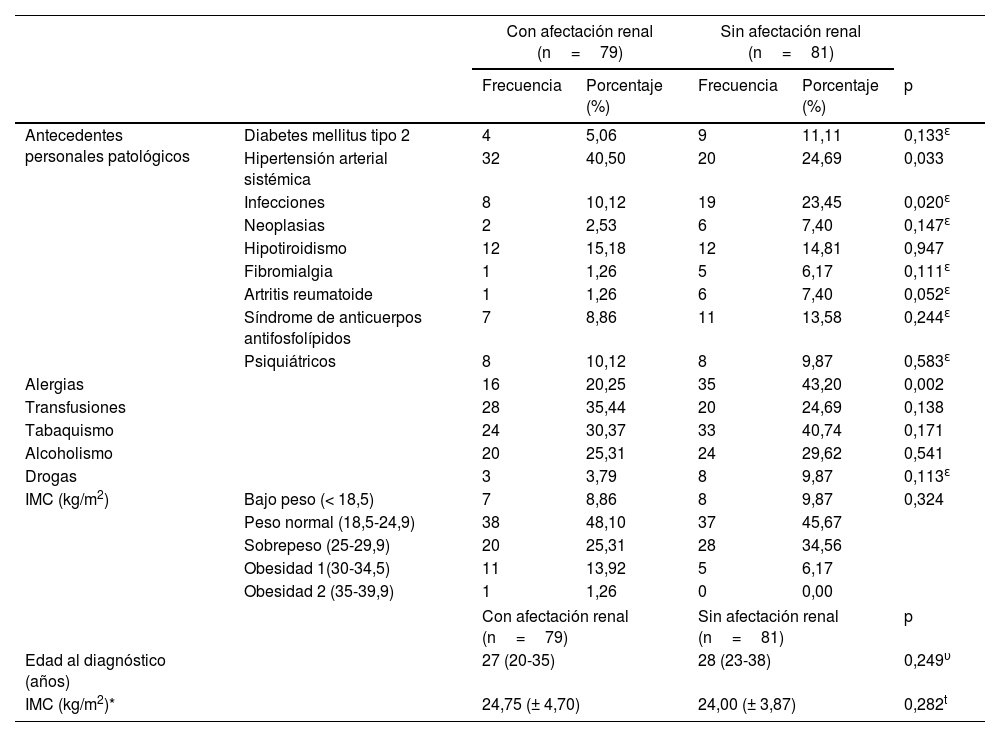
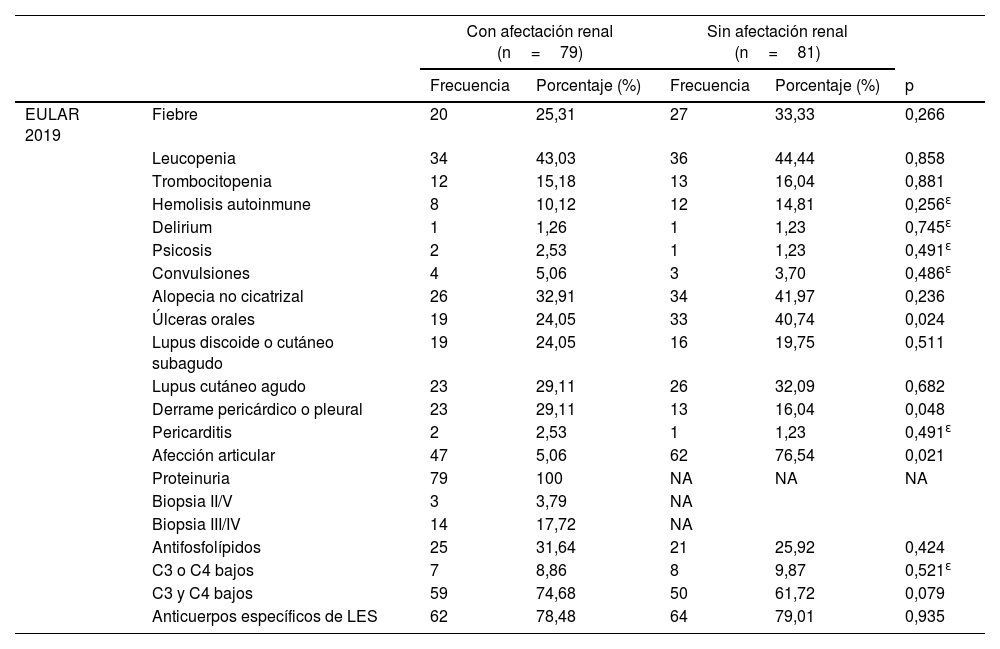
Como se puede apreciar en la tabla 2, la hipertensión arterial sistémica, definida como cifras de presión arterial mayores de 130/80mmHg, fue más frecuente en los pacientes con NL (40,50%, p=0,033). La presencia de procesos infecciosos (23,45%), alergias (43,20%), de artritis reumatoide (7,40%) (p=0,020, p=0,002 y p=0,052, respectivamente) y úlceras orales (p=0,024) es más frecuente en los pacientes sin NL (tabla 3). El derrame pericárdico o pleural (p=0,048) fue más común en pacientes con NL, así como el descenso de las fracciones 3 y 4 del complemento (p <0,079). Aquellos con NL, a diferencia de los pacientes sin NL, presentaron niveles más altos de colesterol total (199,00mg/dL [165,70-248,70mg/dL] vs. 142,00mg/dL [127,00-172,60mg/dL], p <0,001), colesterol de las lipoproteínas de baja densidad (LDL) (119,66± 63,26mg/dL vs. 82,38±39,65mg/dL, p=0,037) y triglicéridos (244,97±105,37mg/dL vs. 168,90±101,84mg/dL, p=0,009) (tabla 4).
Antecedentes y características clínicas
| Con afectación renal (n=79) | Sin afectación renal (n=81) | |||||
|---|---|---|---|---|---|---|
| Frecuencia | Porcentaje (%) | Frecuencia | Porcentaje (%) | p | ||
| Antecedentes personales patológicos | Diabetes mellitus tipo 2 | 4 | 5,06 | 9 | 11,11 | 0,133ɛ |
| Hipertensión arterial sistémica | 32 | 40,50 | 20 | 24,69 | 0,033 | |
| Infecciones | 8 | 10,12 | 19 | 23,45 | 0,020ɛ | |
| Neoplasias | 2 | 2,53 | 6 | 7,40 | 0,147ɛ | |
| Hipotiroidismo | 12 | 15,18 | 12 | 14,81 | 0,947 | |
| Fibromialgia | 1 | 1,26 | 5 | 6,17 | 0,111ɛ | |
| Artritis reumatoide | 1 | 1,26 | 6 | 7,40 | 0,052ɛ | |
| Síndrome de anticuerpos antifosfolípidos | 7 | 8,86 | 11 | 13,58 | 0,244ɛ | |
| Psiquiátricos | 8 | 10,12 | 8 | 9,87 | 0,583ɛ | |
| Alergias | 16 | 20,25 | 35 | 43,20 | 0,002 | |
| Transfusiones | 28 | 35,44 | 20 | 24,69 | 0,138 | |
| Tabaquismo | 24 | 30,37 | 33 | 40,74 | 0,171 | |
| Alcoholismo | 20 | 25,31 | 24 | 29,62 | 0,541 | |
| Drogas | 3 | 3,79 | 8 | 9,87 | 0,113ɛ | |
| IMC (kg/m2) | Bajo peso (< 18,5) | 7 | 8,86 | 8 | 9,87 | 0,324 |
| Peso normal (18,5-24,9) | 38 | 48,10 | 37 | 45,67 | ||
| Sobrepeso (25-29,9) | 20 | 25,31 | 28 | 34,56 | ||
| Obesidad 1(30-34,5) | 11 | 13,92 | 5 | 6,17 | ||
| Obesidad 2 (35-39,9) | 1 | 1,26 | 0 | 0,00 | ||
| Con afectación renal (n=79) | Sin afectación renal (n=81) | p | ||||
| Edad al diagnóstico (años) | 27 (20-35) | 28 (23-38) | 0,249υ | |||
| IMC (kg/m2)* | 24,75 (± 4,70) | 24,00 (± 3,87) | 0,282t | |||
IMC: índice de masa corporal; LES: lupus eritematoso sistémico; p: X2.
Criterios clasificatorios de LPS
| Con afectación renal (n=79) | Sin afectación renal (n=81) | |||||
|---|---|---|---|---|---|---|
| Frecuencia | Porcentaje (%) | Frecuencia | Porcentaje (%) | p | ||
| EULAR 2019 | Fiebre | 20 | 25,31 | 27 | 33,33 | 0,266 |
| Leucopenia | 34 | 43,03 | 36 | 44,44 | 0,858 | |
| Trombocitopenia | 12 | 15,18 | 13 | 16,04 | 0,881 | |
| Hemolisis autoinmune | 8 | 10,12 | 12 | 14,81 | 0,256ɛ | |
| Delirium | 1 | 1,26 | 1 | 1,23 | 0,745ɛ | |
| Psicosis | 2 | 2,53 | 1 | 1,23 | 0,491ɛ | |
| Convulsiones | 4 | 5,06 | 3 | 3,70 | 0,486ɛ | |
| Alopecia no cicatrizal | 26 | 32,91 | 34 | 41,97 | 0,236 | |
| Úlceras orales | 19 | 24,05 | 33 | 40,74 | 0,024 | |
| Lupus discoide o cutáneo subagudo | 19 | 24,05 | 16 | 19,75 | 0,511 | |
| Lupus cutáneo agudo | 23 | 29,11 | 26 | 32,09 | 0,682 | |
| Derrame pericárdico o pleural | 23 | 29,11 | 13 | 16,04 | 0,048 | |
| Pericarditis | 2 | 2,53 | 1 | 1,23 | 0,491ɛ | |
| Afección articular | 47 | 5,06 | 62 | 76,54 | 0,021 | |
| Proteinuria | 79 | 100 | NA | NA | NA | |
| Biopsia II/V | 3 | 3,79 | NA | |||
| Biopsia III/IV | 14 | 17,72 | NA | |||
| Antifosfolípidos | 25 | 31,64 | 21 | 25,92 | 0,424 | |
| C3 o C4 bajos | 7 | 8,86 | 8 | 9,87 | 0,521ɛ | |
| C3 y C4 bajos | 59 | 74,68 | 50 | 61,72 | 0,079 | |
| Anticuerpos específicos de LES | 62 | 78,48 | 64 | 79,01 | 0,935 | |
| Con afectación renal (n=79) | Sin afectación renal (n=81) | p | |
|---|---|---|---|
| Puntuación EULAR 2019 | 24,22 (± 7,22) | 19,42 (± 5,04) | 0,013t |
Anti-DNA: anticuerpos antidesoxirribonucleico; C3 y C4: proteínas de complemento 3 y 4; EULAR: Liga Europea contra el Reumatismo; LES: lupus eritematoso sistémico; p: X2.
Características bioquímicas
| Con afectación renal (n=79) | Sin afectación renal (n=81) | |||||
|---|---|---|---|---|---|---|
| Frecuencia | Porcentaje (%) | Frecuencia | Porcentaje (%) | p | ||
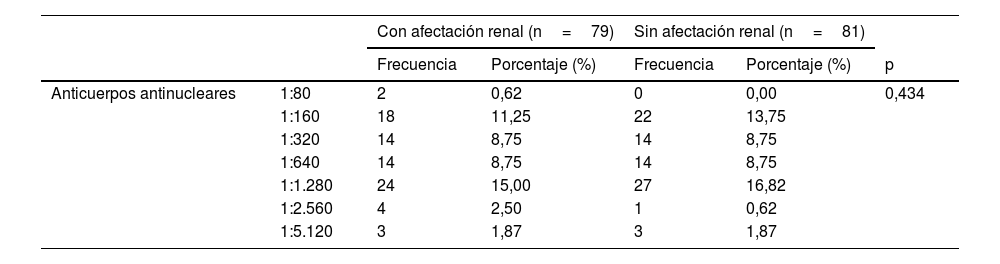
| Anticuerpos antinucleares | 1:80 | 2 | 0,62 | 0 | 0,00 | 0,434 |
| 1:160 | 18 | 11,25 | 22 | 13,75 | ||
| 1:320 | 14 | 8,75 | 14 | 8,75 | ||
| 1:640 | 14 | 8,75 | 14 | 8,75 | ||
| 1:1.280 | 24 | 15,00 | 27 | 16,82 | ||
| 1:2.560 | 4 | 2,50 | 1 | 0,62 | ||
| 1:5.120 | 3 | 1,87 | 3 | 1,87 | ||
| Con afectación renal (n=79) | Sin afectación renal (n=81) | p | |
|---|---|---|---|
| Anti-ADN (UI/mL) | 265,00 (46,60-664,00) | 258,50 (80,32-624,75) | 0,912υ |
| C3 (mg/dL)* | 52,25 (± 28,76) | 74,59 (±32,21) | 0,000t |
| C4 (mg/dL) | 6,30 (2,90-10,57) | 8,30 (3,83-13,10) | 0,087υ |
| Hemoglobina (g/dL)* | 10,60 (± 2,39) | 11,36 (±3,14) | 0,099t |
| Leucocitos (células/mm3)* | 5.768,99 (± 331,25) | 5.908,31 (±602,26) | 0,804t |
| Linfocitos (células/mm3)* | 1.214,80 (± 100,10) | 1.227,85 (±130,47) | 0,937t |
| Neutrófilos (células/mm3) | 3.600 (2.225-5.525) | 3.115 (2.080-5.225) | 0,748υ |
| Plaquetas (x103 células/mm3)* | 229,88 (± 109,68) | 221,92 (±111,08) | 0,066t |
| Glucosa(mg/dL) | 89,00 (87,75-100,00) | 91,00 (82,50-102,50) | 0,541υ |
| Creatinina (mg/dL) | 1,03 (0,71-1,93) | 0,71 (0,63-0,86) | 0,000υ |
| Proteínas totales(g/dL)* | 5,49 (± 1,14) | 6,84 (±1,13) | 0,000t |
| Albúmina(g/dL)* | 2,55 (± 0,78) | 3,58 (±0,71) | 0,000t |
| Colesterol total(mg/dL) | 199,00 (165,75-248,75) | 142,00 (127,00-172,50) | 0,000υ |
| Colesterol LDL (mg/dL)* | 119,66 (± 63,26) | 82,38 (±39,65) | 0,037t |
| Colesterol HDL (mg/dL)* | 41,99 (± 20,35) | 42,00 (±18,41) | 0,998t |
| Triglicéridos(mg/dL)* | 244,97 (± 105,37) | 168,90 (±101,84) | 0,009t |
| Deshidrogenasa láctica (UI/L) | 332,00 (215,25-447,75) | 321,00 (243,25-445,00) | 0,763υ |
| Bilirrubina total (mg/dL) | 0,30 (0,22-0,48) | 0,44 (0,30-0,88) | 0,003υ |
| Bilirrubina indirecta (mg/dL) | 0,18 (0,12-0,28) | 0,22 (0,14-0,32) | 0,067υ |
| Proteína C reactiva (g/dL) | 1,03 (0,29-9,44) | 1,33 (0,34-12,20) | 0,393υ |
| Velocidad de Sedimentación globular (mm/hora)* | 36,38 (± 3,32) | 29,86 (±2,68) | 0,127t |
| Proteinuria en examen general de orina (mg/dL) | 500 (150-791) | 0 (0-100) | 0,000υ |
| Depuración de creatinina en orina de 24 horas (ml/minuto/1,73m2 SC)* | 76,25 (± 6,44) | 107,69 (±10,85) | 0,030t |
| Proteínas en orina de 24 horas (mg/24 h) | 2.400 (900-5.250) | 193 (139-315) | 0,000υ |
| CKD-EPI (mL/min) | 84,20 (39,00-117,50) | 106,25 (86,55-122,48) | 0,001υ |
Anti-ADN: anticuerpos antidesoxirribonucleico; C3 y C4: proteínas de complemento 3 y 4; CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; UI: unidades internacionales; p: X2.
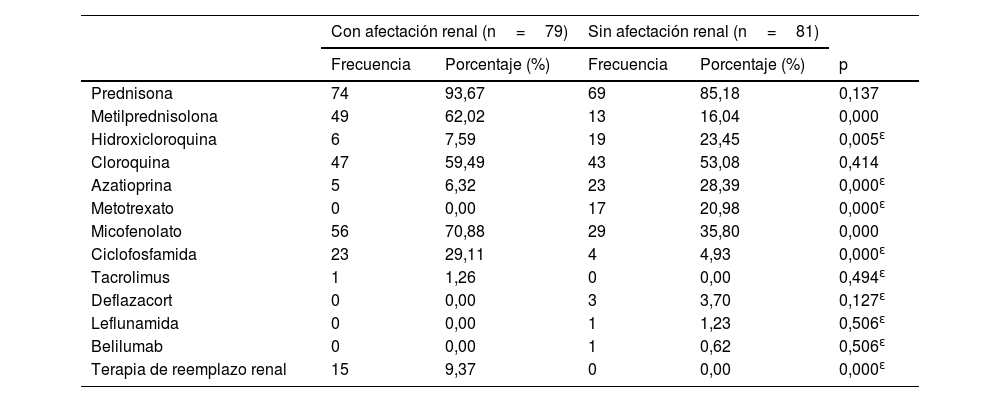
Los medicamentos más utilizados para el tratamiento de la NL fueron metilprednisolona (30,62%), micofenolato de mofetil (34,99%) y ciclofosfamida (14,37%) (p <0,001); los más empleados en pacientes sin NL fueron hidroxicloroquina (11,87%), azatioprina (14,27%) y metotrexato (10,62%) (p <0,05) (tabla 5).
Tratamiento
| Con afectación renal (n=79) | Sin afectación renal (n=81) | ||||
|---|---|---|---|---|---|
| Frecuencia | Porcentaje (%) | Frecuencia | Porcentaje (%) | p | |
| Prednisona | 74 | 93,67 | 69 | 85,18 | 0,137 |
| Metilprednisolona | 49 | 62,02 | 13 | 16,04 | 0,000 |
| Hidroxicloroquina | 6 | 7,59 | 19 | 23,45 | 0,005ɛ |
| Cloroquina | 47 | 59,49 | 43 | 53,08 | 0,414 |
| Azatioprina | 5 | 6,32 | 23 | 28,39 | 0,000ɛ |
| Metotrexato | 0 | 0,00 | 17 | 20,98 | 0,000ɛ |
| Micofenolato | 56 | 70,88 | 29 | 35,80 | 0,000 |
| Ciclofosfamida | 23 | 29,11 | 4 | 4,93 | 0,000ɛ |
| Tacrolimus | 1 | 1,26 | 0 | 0,00 | 0,494ɛ |
| Deflazacort | 0 | 0,00 | 3 | 3,70 | 0,127ɛ |
| Leflunamida | 0 | 0,00 | 1 | 1,23 | 0,506ɛ |
| Belilumab | 0 | 0,00 | 1 | 0,62 | 0,506ɛ |
| Terapia de reemplazo renal | 15 | 9,37 | 0 | 0,00 | 0,000ɛ |
p: X2.
La NL es una complicación frecuente de los pacientes con LES y su prevalencia varía dependiendo de la raza. En países asiáticos se ha reportado su presencia en 40-80%, en la población hispana en 40-60%, la africana en 50-60%, la europea en 20-45% y en caucásicos 14-23%11–14. En este estudio de pacientes pertenecientes a la cohorte de LUPUS-IMMex del Hospital de Especialidades de Centro Médico Nacional Siglo XXI, la prevalencia fue de 49,37%, similar a la ya reportada en la población hispana, asiática y africana. Gui et al., en una cohorte asiática de 8.713 pacientes con LES, encontraron que el sexo masculino desarrollaba NL con mayor frecuencia que el femenino (43,60 vs. 36,20%)15, al igual que lo reportado en una cohorte europea donde la NL afecta más a hombres que mujeres (61 vs. 32%)16. En nuestra investigación esta tendencia no cambia y, aunque el resultado no tuvo significancia estadística, la afección en hombres corresponde a 51,72% y en mujeres a 48,85%.
En el presente estudio, la hipertensión arterial fue más frecuente en mujeres con nefropatía lúpica (33 vs. 10%, p=0,001). Debido al papel del riñón sobre el control de la presión arterial, los pacientes que debutaron con NL tuvieron una mayor prevalencia de hipertensión arterial sistémica. Existe una compleja interacción entre genes, hormonas sexuales y el medio ambiente en el desarrollo de la hipertensión arterial en LES, mediadores locales (como las citoquinas y las especies reactivas de oxígeno) contribuyen a la inflamación local que, en última instancia, afecta negativamente a la función renal17. La variación de la hemodinámica renal, por el daño directo a nivel glomerular y tubular, altera la capacidad renal de excretar sodio y agua, con la subsecuente retención hidrosalina, lo que contribuye al desarrollo de hipertensión18. Por otro lado, la disfunción vascular, la cual se ha demostrado de manera indirecta (mediante mediciones del flujo de la arteria braquial) que existe en los pacientes con LES, se asocia con ateroesclerosis acelerada, lo que favorece el desarrollo de hipertensión19. El LES es un trastorno autoinmune crónico que afecta predominantemente a mujeres en edad fértil. Diversos estudios han demostrado que existen alteraciones en el metabolismo de los estrógenos endógenos que pueden afectar al sistema inmunológico e incrementar la producción de citocinas, lo que conlleva una disfunción endotelial y, por tanto, alteraciones de la presión arterial20.
En pacientes con LES, las infecciones se consideran en gran medida una complicación del tratamiento inmunosupresor. En el estudio de Wang et al.21 se reporta una prevalencia de 25,9% de infecciones graves en los primeros 12 meses después del diagnóstico de LES, aun en ausencia de terapia inmunosupresora, y se encuentra como factor de riesgo una cuenta de linfocitos <1,0 × 109/L. En nuestro estudio, la prevalencia de infecciones al momento del diagnóstico de LES fue mayor en la población sin NL, en tanto que las infecciones más frecuentes fueron las virales (infección por SARS-CoV-19, influenza, hepatitis A, virus del papiloma humano y dengue). La aparición concomitante de procesos infecciosos y alergias al momento del diagnóstico de LES pudiera estar relacionada con factores intrínsecos, los cuales incluyen disfunción del sistema inmunológico caracterizada por alteración en la quimiotaxis y la producción anormal de células T22. Wang et al.21 describieron como factores de riesgo para el desarrollo de infecciones en los primeros cuatro meses del inicio de LES, con independencia del tratamiento inmunosupresor, el índice de actividad de la enfermedad de LES >10 puntos, el recuento de linfocitos periféricos <0,8×109/L y la creatinina sérica> 9mg/dL. En nuestro estudio, la puntuación EULAR entre los pacientes con infecciones osciló entre 13-35 puntos y solo 33% tenía linfocitos menores de <0,8×109/L, además de que fueron más frecuentes los procesos infecciosos en pacientes sin daño renal.
En lo que concierne a los criterios de clasificación EULAR 2019 de LES, la presencia de artritis y úlceras orales se documentó con mayor recurrencia en el grupo de pacientes sin afectación renal; por otro lado, la presencia de hipocomplementemia y serositis (derrame pleural o pericárdico) fue más frecuente en el grupo con afectación renal. Nuestros hallazgos fueron similares a lo reportado por Zhao et al.23 en una cohorte china de 2.104 pacientes, en la cual la prevalencia de NL, leucocitopenia, trombocitopenia, hipocomplementemia y anticuerpos de ADN de cadena doble (anti-dsADN) fue significativamente mayor en pacientes con serositis (p <0,05). Esta suele reflejar la actividad del LES en general, por lo que su asociación en aquellos con NL no es rara.
A pesar de que la proporción de pacientes que debutan concomitantemente con afectación renal y manifestaciones articulares es menor, esta relación guarda un estatus pronóstico a la evolución y progresión de la enfermedad. Ginzler et al. consideran que la presencia de artritis al momento del diagnóstico es un predictor significativo de la progresión de la nefritis lúpica (hazard ratio [HR]=2,13; intervalo de confianza [IC] 95% 1,14-3,97; p=0,018)24. Por su parte, en el estudio de Kaplan et al. encontraron que los pacientes que presentan factor reumatoide positivo tienen menos probabilidad de desarrollar nefritis que aquellos con un factor reumatoide negativo y sin artralgia25,26. Li et al.27 establecen que existe mayor número de personas con artritis reumatoide concomitante al diagnóstico de LES en pacientes sin afección renal (5 vs. 26%, p <0,05).
La hipocomplementemia es una característica común en la población con diagnóstico de LES. En este sentido, logramos identificar una notable tendencia a la coexistencia de dicha característica a expensas de niveles séricos de C3 en el grupo de NL, lo que coincide con diversos estudios que reportan resultados similares a los nuestros y atribuyen esta asociación a la gravedad de la enfermedad28. Asimismo, los pacientes con hipocomplementemia también tienen una mayor prevalencia de proteinuria, hematuria, disminución de la función renal y actividad de la enfermedad en comparación con aquellos con niveles normales de complemento29. Chen et al. plantean la teoría de que este fenómeno se debe a una sobreexpresión de la vía alterna del complemento a nivel glomerular por una sobreexpresión del factor B, lo que demuestra que al utilizar LNP023, molécula capaz de inhibir la sobreexpresión del factor B, el debut de los pacientes con enfermedad renal es menor30.
Es de esperarse que en los sujetos con NL se encuentren alterados en mayor proporción los niveles séricos de proteínas y el perfil de lípidos que en aquellos con LES sin NL, dada la fisiopatología del síndrome nefrótico y nefrítico, manifestaciones renales características de los pacientes con NL. En los que predomina el síndrome nefrótico, se presenta a nivel hepático un aumento en la síntesis de colesteroles y triglicéridos, con alteración del perfil lipídico31.
El tratamiento de inducción a la remisión establecido por las guías internacionales hace mención del uso de pulsos de metilprednisolona seguidos de micofenolato o ciclofosfamida de acuerdo con el esquema elegido y, posteriormente, el tratamiento de mantenimiento con micofenolato o azatioprina32,33. En nuestro estudio, estos fármacos fueron los más utilizados en el grupo de pacientes que debutaron con actividad renal, en apego a las guías internacionales vigentes en la época.
ConclusionesLas características sociodemográficas, clínicas y bioquímicas de los pacientes que presentaron NL al momento del diagnóstico de LES en nuestra cohorte son similares a las descritas en series latinas y asiáticas, dado que son estos grupos en los cuales el LES se manifiesta de manera más agresiva. Hasta nuestro conocimiento, la presencia de infecciones concomitantes al momento del diagnóstico en pacientes con LES no ha sido descrita y debe ser considerada para el futuro de nuevas investigaciones.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Consideraciones éticasEl protocolo fue sometido y aprobado por el comité de investigación y ética del Hospital de Especialidades del Centro Médico Nacional Siglo XXI.
Conflictos de interesesNinguno.