Se conoce con amplitud la asociación entre algunos anticuerpos miositis específicos (AME) y el desarrollo de la enfermedad pulmonar intersticial (EPI), en el contexto de miopatías inflamatorias como el síndrome antisintetasa y anti-melanoma associated differentiation protein 5 (MDA5).. Sin embargo, la relación potencial con el anticuerpo anti transcription intermediary factor 1 (TIF1)-γ no es bien conocida, ya que los casos reportados hasta la fecha son pocos y no han permitido confirmar esta asociación de manera sólida, en tanto que la mayoría de la literatura se ha enfocado en el contexto de la asociación con neoplasias malignas. Buscamos que se incluyan dos nuevos casos dentro de los ya reportados en la literatura y que logren apoyar la afirmación del vínculo a pesar de su infrecuencia.
ObjetivoReportar dos casos de EPI en asociación con dermatomiositis (DM) anti-TIF1γ positivo.
Métodos y materialesDescripción de las características clínicas de dos casos de DM anti-TIF1γ positivo con EPI y compararlos con casos análogos.
ResultadosSe describen dos casos, el primero de un hombre de 47 años y el segundo de una mujer de 57 años, en quienes se diagnosticó DM anti-TIF1γ positivo con presencia de EPI. Se descartó neoplasia maligna subyacente por la presencia del AME en mención y se descartaron otras potenciales causas de EPI, por lo cual se inició un tratamiento inmunosupresor en ambos casos.
ConclusiónEs esencial continuar investigando más sobre la relación que existe entre las miopatías inflamatorias y como diversos AME, diferentes a los del sindrome antisintetasa y anti-MDA5 se asocian con EPI. El hecho de haber encontrado dos casos de EPI en relación con antiTIF1γ nos ayuda a sustentarlo.
The association of certain myositis-specific antibodies (MSA) with the development of interstitial lung disease (ILD) in relation to inflammatory myopathies, such as antisynthetase syndrome and anti-MDA5, is well known. However, the potential relationship with the anti-TIF1γ antibody is not well understood, as the reported cases to date are few and have not allowed for solid confirmation of this association. Most of the literature has focused primarily on the association with malignant neoplasms. We aim to include two new cases in the existing literature to support the assertion of the link despite its infrequency.
ObjectiveTo report two cases of ILD associated with anti-TIF1γ positive dermatomyositis (DM).
Materials and methodsA description of the clinical characteristics of two cases of anti-TIF1γ positive DM with ILD and a comparison with analogous cases.
ResultsTwo cases are described, the first of a 47-year-old man and the second of a 57-year-old woman, both diagnosed with anti-TIF1γ positive DM with the presence of ILD. Underlying malignancy was ruled out due to the presence of the MSA in question, and other potential causes of ILD were excluded, leading to the initiation of immunosuppressive treatment in both cases.
ConclusionIt is essential to further investigate the relationship between inflammatory myopathy and how different MSAs, other than antisynthetase and anti-MDA5 are also associated with ILD. Finding two cases related to anti-TIF1γ and knowing that there are analogous cases generates this hypothesis.
La prevalencia global de la enfermedad pulmonar intersticial (EPI) en miopatías inflamatorias puede llegar al 41%, según el metaanálisis de Sun et al., quienes analizaron 34 estudios con 10.130 pacientes1. Esta prevalencia ha aumentado exponencialmente en comparación con las cifras reportadas entre 1965 y 1971, que eran apenas del 5%2. Es probable que este incremento no se deba a una mayor incidencia de EPI, sino a un mayor reconocimiento y a mejores herramientas diagnósticas dentro del abordaje de los pacientes con miopatía inflamatoria, así como a una búsqueda activa de manifestaciones extramusculares. Se ha reconocido además que la EPI puede preceder al inicio de los síntomas musculocutáneos, o ser incluso la única manifestación, aunque generalmente se diagnostican de manera simultánea o durante el transcurso de la enfermedad3.
Existen asociaciones clínicas claras con respecto a ciertos anticuerpos miositis específicos (AME) y la EPI asociada a miopatía inflamatoria como lo son todos los anticuerpos del síndrome antisintetasa, los cuales incluyen el anti-Jo1, el anti-EJ, el anti-PL7 y el anti-PL12, que son los más frecuentemente identificados, y otros con menor frecuencia de detección como el anti-OJ, el anti-KS, el anti-Zo y el anti-Ha, pero que también acarrean la misma fuerza de asociación con EPI, con prevalencias que oscilan entre 83 y 100%. Por ende, se considera que el síndrome antisintetasa es la miopatía inflamatoria con mayor frecuencia de EPI.
En segundo lugar, se encuentra la dermatomiositis (DM) anti-MDA5 positivo, cuya frecuencia de EPI es de alrededor del 91%. En cuanto al resto de los anticuerpos, se afirma que su asociación es menor o incluso inexistente; sin embargo, algunas revisiones sistemáticas mencionan que otros anticuerpos como el anti-Mi2, el anti-SRP, el anti-NXP2, el anti-HMGCR, el anti-SAE y el anti-TIF1γ tienen una prevalencia de EPI asociada a miopatía inflamatoria de 29, 53, 23, 9, 40 y 18%, respectivamente4. Esto sugiere que la presencia de un AME no es por sí sola capaz de excluir la posibilidad de EPI, y se hará especial mención del anti-TIF1γ, cuyo papel en la EPI es cuestionado por algunos5. A continuación se presentan dos casos de EPI asociado con DM anti-TIF1γ.
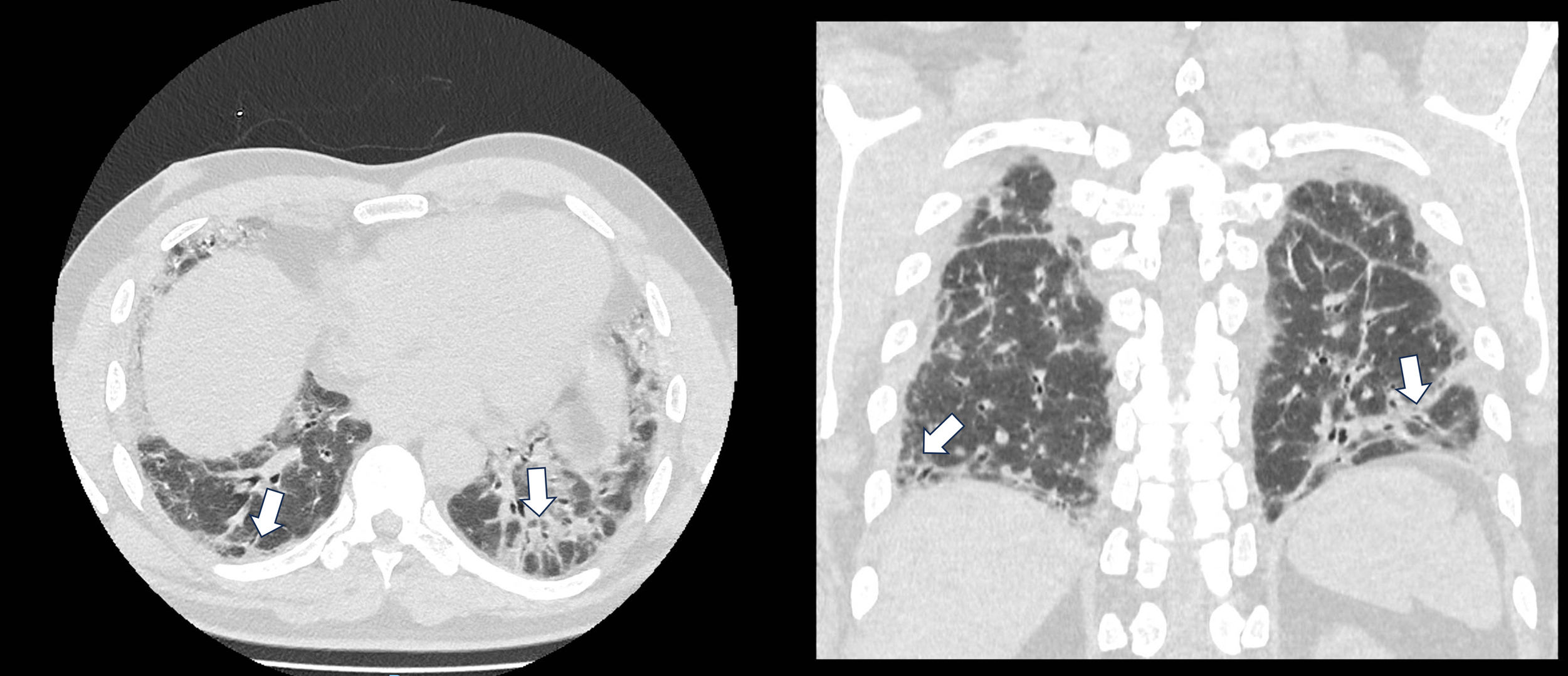
Presentación de casosCaso 1Hombre de 47 años, con antecedente de tabaquismo, con un índice paquete/año (IPA) de 10, que consulta debido a tres meses de disnea y tos. Negó cualquier otra sintomatología sistémica y aclaró que no había experimentado debilidad muscular ni brotes en la piel. Se le practicó una tomografía de tórax de alta resolución (TACAR), la cual evidenció una neumonía intersticial no específica (NINE) (fig. 1). Además, se realizaron pruebas de función pulmonar (PFP) que mostraron un patrón restrictivo moderado en la espirometría, acompañado de una disminución en los volúmenes pulmonares.
Dado que no presentaba síntomas que sugirieran alguna patología sistémica, se solicitó una serie de autoanticuerpos: anticuerpos antinucleares (ANA), anticuerpos nucleares extractables (ENAS), factor reumatoide (FR), anticuerpos citrulinados (ACPA), antitopoisomerasa I (AntiScl70) y anticuerpos anticitoplasma de neutrófilos (ANCA antimieloperoxidasa [MPO] y antiproteinasa 3 [PR3]), todos los cuales resultaron negativos, excepto unos ANA positivos a títulos de 1:320 con patrón citoplasmático. Sin embargo, se encontró un resultado positivo para anti-TIF1γ. A pesar de no mostrar compromiso muscular ni dermatológico, se decidió abordar el caso como una EPI asociada a miopatía inflamatoria idiopática. Además, debido al hallazgo anti-TIF1γ y su alta asociación con malignidad, se llevó a cabo una tomografía por emisión de positrones (PET-CT), la cual descartó la presencia de esta. Con base en los resultados, se optó por tratar al paciente con ciclofosfamida mensual a dosis de 750mg por vía endovenosa durante seis meses, de la cual ha recibido cinco dosis, y se inició prednisolona a dosis de 30mg día con desmonte. Se hizo seguimiento telefónico a los cinco meses del ingreso y no se ha documentado deterioro, por lo menos sintomático. Aún están pendientes las nuevas PFP y una nueva TACAR en aras de determinar la estabilización de estas o, por el contrario, su deterioro y se dieron ordenes de inmunización, además de seguimiento por neumología.
Caso 2Mujer de 57 años con antecedente de cirrosis Child B secundaria a colangitis biliar primaria, quien dos años atrás venía siendo estudiada por neumología y reumatología por una posible neumonía intersticial con características autoinmunes (IPAF), sustentada por la presencia de neumonía intersticial usual (NIU) y ANAS positivos a una dilución de 1:640, con un patrón citoplasmático, además de ausencia de síntomas sistémicos autoinmunes. Por lo anterior, y ante una espirometría con un patrón restrictivo moderado, se decidió el inicio de ciclofosfamida a dosis de 500mg por vía endovenosa mensual por seis dosis e inicio de prednisolona oral 20mg con desmonte. Adicionalmente, se observaron lesiones cutáneas sutiles compatibles con pápulas de Gottron, eritema heliotropo y signo del chal, por lo cual se optó por solicitar un panel de AME y, pasados dos meses, se obtuvo el resultado del panel de miopatías, en el que se identificó positividad para anti-TIF1γ. Por lo anterior, se replanteó el diagnóstico y se determinó que se trataba de una EPI asociada a miopatía inflamatoria idiopática anti-TIF1γ, debido a lo cual se continuó con el esquema de inmunosupresión propuesto, además de realizar PET-CT por la alta asociación con neoplasia de este anticuerpo.
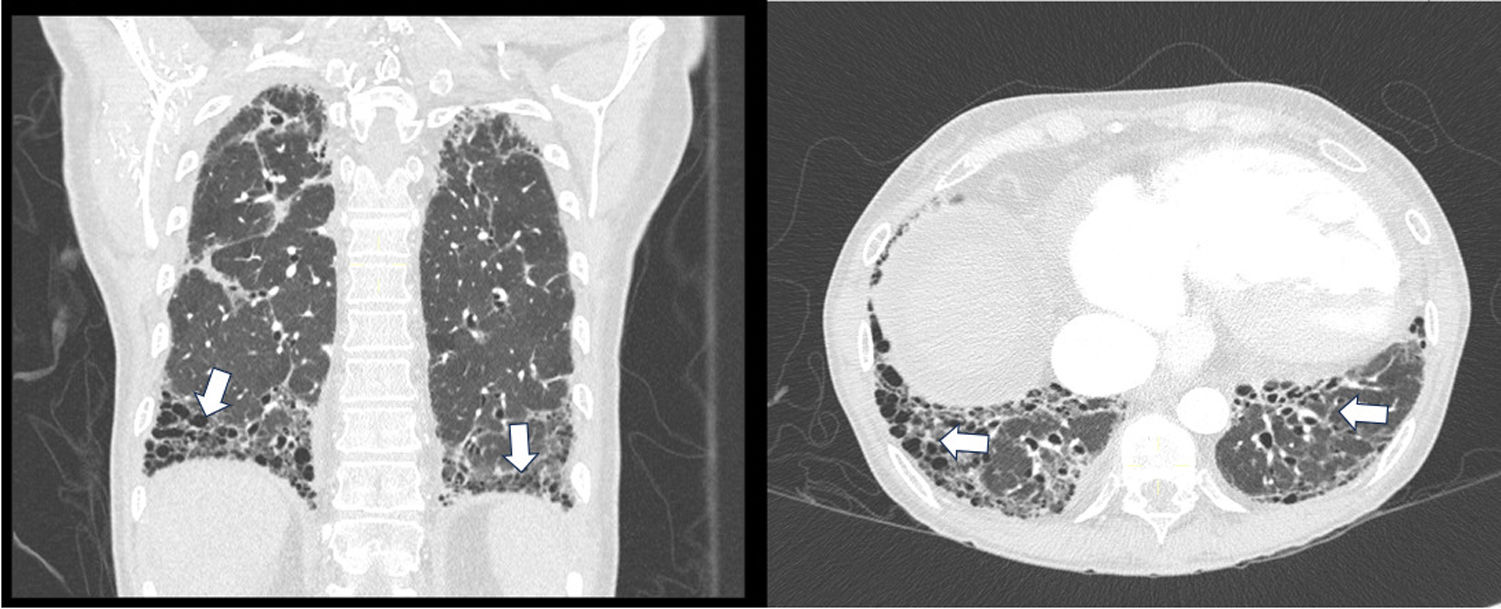
Después de ocho meses y luego de finalizar la ciclofosfamida, se repitieron la TACAR y las PFP que demostraron estabilidad y se optó por el mantenimiento con azatioprina a dosis de 100mg/día. Luego de cinco meses, la paciente presenta mayor disnea y síntomas respiratorios, por lo cual requiere ingreso hospitalario donde se le practica una nueva TACAR (fig. 2), la cual demostró mayor progresión en comparación con imágenes previas. Se consideró entonces que hubo un fallo a la ciclofosfamida y que ahora cumplía criterios para la enfermedad pulmonar fibrosante progresiva, debido al deterioro clínico e imagenológico, por lo que se decidió iniciar rituximab (RTX) previamente a haber descartado malignidad mediante PET-CT, y a pesar de la indicación de nintedanib se optó por no prescribirlo dado el antecedente de cirrosis Child B. A los tres meses del seguimiento por consulta externa, la paciente se encuentra con mejoría sintomática, con plan de inmunización y a la espera del control de PFP seis meses después de la aplicación del RTX. En la tabla 1 se presentan los paraclínicos al momento del diagnóstico correspondientes a cada caso.
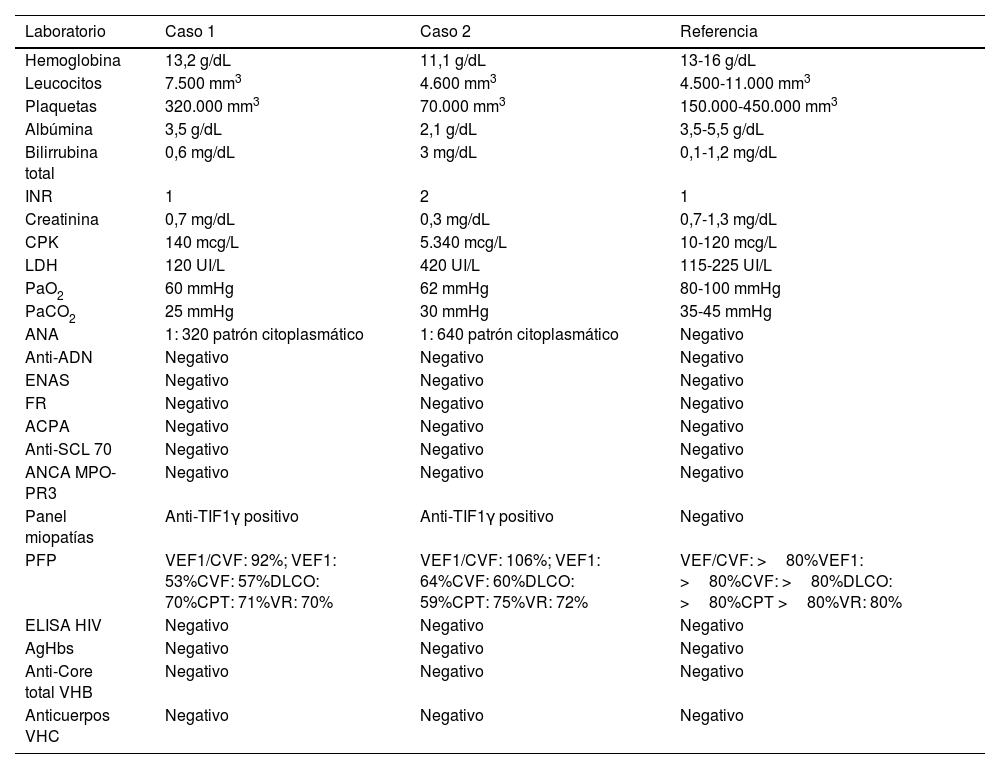
Paraclínicos de ambos casos clínicos al momento del diagnóstico
| Laboratorio | Caso 1 | Caso 2 | Referencia |
|---|---|---|---|
| Hemoglobina | 13,2 g/dL | 11,1 g/dL | 13-16 g/dL |
| Leucocitos | 7.500 mm3 | 4.600 mm3 | 4.500-11.000 mm3 |
| Plaquetas | 320.000 mm3 | 70.000 mm3 | 150.000-450.000 mm3 |
| Albúmina | 3,5 g/dL | 2,1 g/dL | 3,5-5,5 g/dL |
| Bilirrubina total | 0,6 mg/dL | 3 mg/dL | 0,1-1,2 mg/dL |
| INR | 1 | 2 | 1 |
| Creatinina | 0,7 mg/dL | 0,3 mg/dL | 0,7-1,3 mg/dL |
| CPK | 140 mcg/L | 5.340 mcg/L | 10-120 mcg/L |
| LDH | 120 UI/L | 420 UI/L | 115-225 UI/L |
| PaO2 | 60 mmHg | 62 mmHg | 80-100 mmHg |
| PaCO2 | 25 mmHg | 30 mmHg | 35-45 mmHg |
| ANA | 1: 320 patrón citoplasmático | 1: 640 patrón citoplasmático | Negativo |
| Anti-ADN | Negativo | Negativo | Negativo |
| ENAS | Negativo | Negativo | Negativo |
| FR | Negativo | Negativo | Negativo |
| ACPA | Negativo | Negativo | Negativo |
| Anti-SCL 70 | Negativo | Negativo | Negativo |
| ANCA MPO-PR3 | Negativo | Negativo | Negativo |
| Panel miopatías | Anti-TIF1γ positivo | Anti-TIF1γ positivo | Negativo |
| PFP | VEF1/CVF: 92%; VEF1: 53%CVF: 57%DLCO: 70%CPT: 71%VR: 70% | VEF1/CVF: 106%; VEF1: 64%CVF: 60%DLCO: 59%CPT: 75%VR: 72% | VEF/CVF: >80%VEF1: >80%CVF: >80%DLCO: >80%CPT >80%VR: 80% |
| ELISA HIV | Negativo | Negativo | Negativo |
| AgHbs | Negativo | Negativo | Negativo |
| Anti-Core total VHB | Negativo | Negativo | Negativo |
| Anticuerpos VHC | Negativo | Negativo | Negativo |
Anti-DNA: antiácido desoxirribonucleico; CVF: capacidad vital forzada; CPT: capacidad pulmonar total; DLCO: difusión monóxido de carbono; ELISA: ensayo por inmunoabsorción ligado a enzimas; INR: International Normalized Ratio; ANA: anticuerpos antinucleares; ENAS: anticuerpos extractables nucleares; FR: factor reumatoide; ACPA: anticuerpos anticitrulina; ANCA: anticuerpos anticitoplasma de neutrófilos; PFP: pruebas de función pulmonar; AgHbs: antígeno superficie virus hepatitis B; VHC: virus hepatitis C; HIV: virus inmunodeficiencia humana; CPK: creatinfosfocinasa; LDH: lactato deshidrogenasa; MPO-PR3: mieloperoxidasa-proteinasa 3; PaO2: presión arterial de oxígeno; PaCO2: presión arterial de dióxido de carbono; PFP: pruebas de función pulmonar; Scl70: antitopoisomerasa I; VEF1: volumen espirado forzado en el primer segundo; VHB: virus de la hepatitis B; VR: volumen residual.
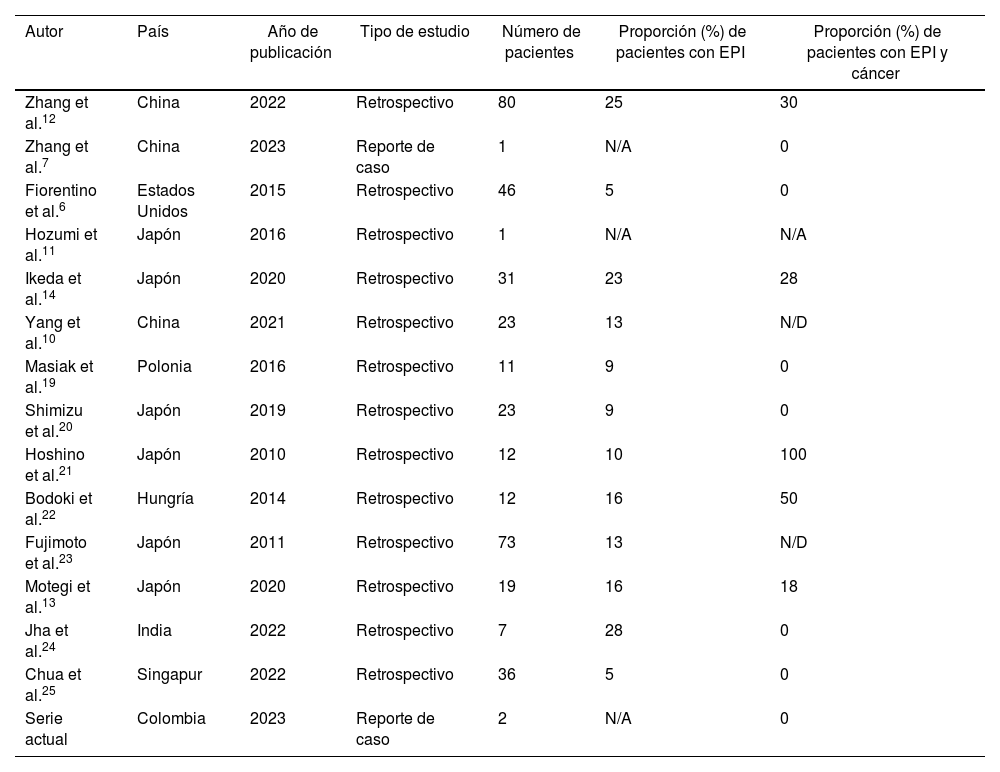
El fenómeno observado con el anticuerpo anti-TIF1γ, el cual se detecta en el 7-31% de los pacientes con DM, es particularmente interesante, ya que se ha descrito una asociación positiva con el desarrollo de malignidad, pero son pocas las series que sustentan una asociación clara con EPI, fenómeno de Raynaud y artritis/artralgia6. Sin embargo, se vienen reportando cada vez más casos de EPI asociada a este autoanticuerpo y en la tabla 2 se despliega de forma resumida una serie de estudios, incluyendo los casos descritos en este artículo, donde se especifica la proporción de diagnósticos de EPI del total de casos de DM anti-TIF1γ positivo, y adicionalmente la proporción de casos que además tienen malignidad concomitante.
Proporción de EPI en pacientes diagnosticados con DM anti-TIF1γ positivo y la proporción de casos con malignidad concomitante en las diferentes series
| Autor | País | Año de publicación | Tipo de estudio | Número de pacientes | Proporción (%) de pacientes con EPI | Proporción (%) de pacientes con EPI y cáncer |
|---|---|---|---|---|---|---|
| Zhang et al.12 | China | 2022 | Retrospectivo | 80 | 25 | 30 |
| Zhang et al.7 | China | 2023 | Reporte de caso | 1 | N/A | 0 |
| Fiorentino et al.6 | Estados Unidos | 2015 | Retrospectivo | 46 | 5 | 0 |
| Hozumi et al.11 | Japón | 2016 | Retrospectivo | 1 | N/A | N/A |
| Ikeda et al.14 | Japón | 2020 | Retrospectivo | 31 | 23 | 28 |
| Yang et al.10 | China | 2021 | Retrospectivo | 23 | 13 | N/D |
| Masiak et al.19 | Polonia | 2016 | Retrospectivo | 11 | 9 | 0 |
| Shimizu et al.20 | Japón | 2019 | Retrospectivo | 23 | 9 | 0 |
| Hoshino et al.21 | Japón | 2010 | Retrospectivo | 12 | 10 | 100 |
| Bodoki et al.22 | Hungría | 2014 | Retrospectivo | 12 | 16 | 50 |
| Fujimoto et al.23 | Japón | 2011 | Retrospectivo | 73 | 13 | N/D |
| Motegi et al.13 | Japón | 2020 | Retrospectivo | 19 | 16 | 18 |
| Jha et al.24 | India | 2022 | Retrospectivo | 7 | 28 | 0 |
| Chua et al.25 | Singapur | 2022 | Retrospectivo | 36 | 5 | 0 |
| Serie actual | Colombia | 2023 | Reporte de caso | 2 | N/A | 0 |
DM: dermatomiositis; EPI: enfermedad pulmonar intersticial; N/A: no aplica; N/D: no disponible.
Es importante entender los posibles mecanismos fisiopatológicos por los cuales el anticuerpo anti-TIF1γ podría contribuir al desarrollo de la EPI, como detallan Zhang et al.7, quienes describen que la proteína tripartita motif (TRIM) pertenece a una familia de ubiquitina ligasas que modifican otras proteínas. De las cuatro isoformas de TRIM, TRIM33, también conocida como TIF-1 γ, es particularmente relevante pues tiene un rol crucial en la inhibición del complejo Smad 2/3/4 y en la regulación negativa de la vía transforming Growth Factor-beta/SMAD signaling pathway (TGF-β/Smad)8. Diversos estudios han evidenciado que el TGF-β se encuentra altamente expresado en el tejido pulmonar afectado por la EPI, especialmente en células epiteliales alveolares y macrófagos pulmonares. El TGF-β y sus efectores subsiguientes inhiben la reparación proliferativa de las células epiteliales frente a lesiones inflamatorias y fomentan la hiperactivación de fibroblastos y miofibroblastos, lo que lleva a la fibrosis pulmonar. Por tanto, si existe una depleción de TRIM33, es decir, TIF-1 γ, o un bloqueo por anticuerpos, esto podría llevar a un déficit de TGF-β e inducir la fibrosis pulmonar y la inflamación intersticial9.
En un estudio realizado por Fiorentino et al.6 con una muestra de 122 pacientes, se buscó comparar las características clínicas de las DM en presencia de anticuerpos positivos y negativos para anti-TIF1γ. Los resultados mostraron que el 5% de los pacientes del grupo positivo presentaban EPI, en contraste con el 27% del grupo negativo. De manera similar, Yang et al.10, en un estudio con 141 pacientes con DM, encontraron que el 72% de los pacientes negativos para anti-TIF1γ presentaban EPI, en comparación con solo el 13% de los positivos.
Por otro lado, Hozumi et al.11 se propusieron identificar a todos los pacientes con miopatía inflamatoria idiopática y EPI. De un total de 60 pacientes, el 43,3% tenía anticuerpos anti-sintetasa (anti-Jo1), el 25% anti-MDA5, el 5% anti-SRP, el 1,7% anti-TIF1γ y el 25% restante no presentaba anticuerpos detectables. Esto destaca que, aun cuando en una proporción menor, los anti-TIF1γ están presentes en pacientes con miopatía inflamatoria idiopática y EPI.
Con todo lo anterior, aunque con pocos casos reportados, está comenzando a surgir la hipótesis de una posible asociación entre el anticuerpo anti-TIF1γ y la EPI. Las grandes revisiones sobre EPI y miopatías inflamatorias no incluyen este anticuerpo como asociado a esta condición. Por el contrario, se afirma que el desarrollo de neoplasia y la presencia de este anticuerpo tienen una relación inversamente proporcional con la EPI5. No obstante, hay datos que no soportan esta afirmación. Por ejemplo, Zhang et al.12 analizaron una cohorte de 80 pacientes con DM anti-TIF1γ positivos, quienes reportaron 14 casos de EPI sin neoplasia maligna y seis que sí tenían, y mostraron casi un 20% de concomitancia de neoplasia con EPI. De igual forma, en la serie de Motegi et al.13, de los tres casos de EPI, dos tenían neoplasia maligna asociada. También Ikeda et al.14 estudiaron a 31 pacientes con DM anti-TIF1γ positivos y encontraron cinco casos de EPI sin neoplasia maligna y dos casos con neoplasia maligna. A pesar de que hay una diferencia numérica, los casos en dichas series son pocos y probablemente no suficientes para sustentar de forma fehaciente la asociación inversamente proporcional de neoplasia y EPI.
Todos estos hallazgos sugieren la necesidad de una investigación más profunda para entender las complejas relaciones entre estos factores y determinar las verdaderas asociaciones, ya que incluso hay estudios como el de Kaneko et al.15 que afirman que las neoplasias malignas pueden ocurrir de forma concomitante en pacientes con miopatía inflamatoria idiopática asociada a EPI. No obstante, también hay que mencionar que si bien la presencia de anti-TIF1γ incrementa el riesgo de cáncer 9,37 veces más, ello no implica que siempre aparezca, ya que las diferentes series muestran una prevalencia variable de cáncer que va entre 19 y 100% de los casos, con un valor promedio de 41%. Esto implica que aun cuando no todos desarrollen cáncer, sí deben establecerse métodos de tamización tempranos en todos los pacientes16.
Por último, es importante enfatizar la relevancia que ha alcanzado el panel de miopatías en el estudio de la EPI, ya que permite establecer un diagnóstico etiológico que redirecciona las estrategias terapéuticas para los pacientes. Es difícil predecir en el contexto de las miopatías inflamatorias, y en general en cualquier enfermedad reumatológica, quiénes desarrollarán manifestaciones pulmonares y adicionalmente reconocer que muchas veces la EPI puede ser la primera manifestación de una enfermedad sistémica, e incluso ser la única. Es entonces cuando la entidad IPAF (EPI con características autoinmunes) se hace importante, ya que algunos autores la toman como una entidad independiente y otros logran reconocerla como una fase previa al desarrollo de otras manifestaciones sistémicas, pues algunas series demuestran cómo una proporción importante progresa a una enfermedad reumatológica sistémica claramente definida, por lo que el papel del reumatólogo es vital en el seguimiento, además de instaurar intervenciones terapéuticas tempranas que impacten en el pronóstico. El problema es que los criterios de IPAF de los que se dispone, no incluyen algunos anticuerpos que probablemente tengan relevancia en EPI, aunque sean infrecuentes, reconociendo así que aún falta mucho por conocer al respecto y teniendo siempre presente que la enfermedad pulmonar puede ser el anuncio de una enfermedad sistémica17,18.
ConclusiónLa descripción de dos casos de DM con EPI, en presencia del anticuerpo anti-TIF1γ, nos impulsó a investigar casos similares, con el objetivo de determinar la autenticidad y la relevancia de este hallazgo para la definición de un tratamiento adecuado. A partir de la información recopilada hasta ahora, es evidente que aún tenemos mucho por descubrir sobre la EPI y su relación con las miopatías inflamatorias idiopáticas. Es importante destacar que, aun cuando algunos anticuerpos se identifiquen con mayor frecuencia en casos de EPI, esto no significa que no puedan aparecer en contextos menos comunes, y no se puede negar la posible asociación con anti-TIF1γ, aunque los estudios actuales no hayan logrado establecer esta asociación de forma estadísticamente significativa por el reducido número de casos. Es posible que el anti-TIF1γ no sea el único anticuerpo con estas características, y que existan otros con comportamientos similares para dichas manifestaciones clínicas.
FinanciaciónEl trabajo no recibió financiación de fuentes públicas, comerciales o entidades sin ánimo de lucro.
Consideraciones éticasSe contó con el consentimiento verbal y escrito por parte de los pacientes, además de la aprobación por parte del comité de investigación y ética de la institución.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.