El síndrome seco o síndrome Sicca se caracteriza por la presencia de ojo seco (xeroftalmia - queratoconjuntivitis Sicca), boca seca (xerostomía) y piel seca (xerodermia). Esta tríada puede estar relacionada con el síndrome de Sjögren.
ObjetivoAsociar las características clínicas, gammagráficas e histopatológicas de pacientes con xerostomía y diagnóstico de síndrome Sicca con el diagnóstico presuntivo de síndrome de Sjögren, en Medellín (Colombia), en el periodo 2018-2020.
Materiales y métodosEstudio de enfoque cuantitativo, de tipo analítico transversal. Las participantes se agruparon en dos grupos diagnósticos: síndrome Sicca y diagnóstico presuntivo de síndrome de Sjögren. Se aplicó una encuesta de datos sociodemográficos. Para cada grupo se hicieron mediciones de flujo salival, test de Schirmer, estudio gammagráfico de glándulas salivales y evaluación histológica. Se realizó un análisis estadístico mediante medidas de tendencia central (mediana) y de dispersión (rango intercuartílico), prueba exacta de Fisher y prueba U de Mann-Whitney).
ResultadosLa muestra estuvo constituida por 24 mujeres. El signo clínico sistémico mas frecuente fue el dolor articular presente en el 90% de los casos en el síndrome Sicca y en el 92.9% de casos en el síndrome de Sjogren, mientras que el signos clinico de depapilación lingual estuvo presente en el 100% de los casos de síndrome Sicca y en un 92.9% de los casos en el síndrome de Sjogren. Las pruebas funcionales, tasa de flujo salival no estimulada y gammagrafía de glándulas salivales, presentaron un mayor compromiso en el grupo diagnóstico presuntivo de síndrome de Sjögren. En el análisis histopatológico se observaron cambios atróficos, fibrosis y cambios grasos en ambas categorías.
ConclusiónLos hallazgos sugieren que los pacientes con diagnóstico presuntivo de síndrome Sicca pueden encontrarse en una fase temprana de progresión de síndrome de Sjögren, por lo cual este estudio orienta a establecer una asociación de signos, síntomas y ayudas diagnósticas para hacer un diagnóstico y definir una terapéutica acertada.
Sicca syndrome is characterized by the presence of dry eye (xerophthalmia - keratoconjunctivitis sicca), dry mouth (xerostomia), and dry skin (xeroderma), this triad may be related to Sjögren's syndrome.
ObjectiveTo associate the clinical, scintigraphic, and histopathological characteristics of patients with xerostomia and diagnosis of SS and presumptive diagnosis of Sjögren's syndrome in Medellín-Colombia, 2018-2020.
Materials and methodsThe study was a quantitative approach, with cross-sectional analysis. The participants were grouped into two groups: diagnosis of Sicca syndrome and presumptive diagnosis of Sjögren's syndrome, and a survey of sociodemographic data was applied. For each group, salivary flow measurements, Schirmer's test, salivary gland scintigraphic study, and histological evaluation were performed. Statistical analysis was performed using measures of central tendency (median) and dispersion (interquartile range), Fisher's exact test, and the Mann-Whitney U test.
ResultsThe sample consisted of 24 women. The most frequent systemic clinical sign was joint pain which was present in 90% of cases of Sicca syndrome and in 92.9% of cases of diagnosis presumptive Sjogren's syndrome, while the clinical signs of tongue depapillation were present in 100% of cases of Sicca syndrome and in 92.9% of cases of Sjögren's syndrome. Functional tests, unstimulated salivary flow rate, and salivary gland scintigraphy showed greater involvement in the group of presumptive diagnosis of Sjögren's syndrome. Histopathological analysis showed atrophic changes, fibrosis, and fatty changes in both categories.
ConclusionThe findings suggest that patients with a presumptive diagnosis of Sicca syndrome may be in an early phase of Sjögren's syndrome progression, so this study aims to establish an association of signs, symptoms, and diagnostic aids to define an accurate diagnosis and therapy.
Henrik Sjögren usó el término síndrome Sicca (SS)1, caracterizado por un patrón fenotípico de sequedad en las mucosas ocular y oral que afecta con mayor frecuencia a mujeres posmenopáusicas. Dichos síntomas del SS están presentes en el síndrome de Sjögren (SSJ), lo cual puede generar confusión en el diagnóstico y en el tratamiento.
El SSJ es una enfermedad sistémica autoinmune que genera epitelitis y atrofia acinar, debido a infiltrados de células mononucleares en glándulas exocrinas y algunos tejidos extraglandulares2,3. Estos cambios morfológicos son generados por la migración progresiva de leucocitos y la persistencia de reacciones inmunes específicas contra los tejidos endógenos glandulares que desencadenan alteraciones funcionales, las cuales se expresan por medio de la disminución o ausencia de las secreciones (xerostomía y queratoconjuntivitis), que a su vez pueden estar acompañadas con dolores articulares, lo cual se corresponde con la tríada clínica de síntomas patognomónicos asociados a la enfermedad4,5. El SSJ puede ocurrir de forma primaria (SSJp) o puede ser parte de otras enfermedades inflamatorias crónicas, caso en el que se denomina síndrome de Sjögren secundario.
Se ha considerado que la etiopatogénesis del SSJ es multifactorial, al involucrar agentes ambientales, genéticos y moleculares, los cuales constituyen grandes desafíos para el diagnóstico y las terapias para mejorar los síntomas y prevenir complicaciones en las personas que lo padecen, dado que la calidad de vida puede verse afectada en diferentes grados6. Esto ha permitido que desde 1965 se hayan planteado diferentes criterios de clasificación o diagnóstico. Hoy se aceptan los elaborados por el consenso American College of Rheumatology/European League Agains Rheumatism Classification Criteria for Primary Sjogren's Syndrome (ACR/EULAR-2016), el cual incluye criterios subjetivos, como síntomas oculares y orales; evidencia objetiva de compromiso ocular y salival; infiltración linfocitaria en biopsia de glándula salival menor (gold standard), con una puntuación de foco ≥ 1, definida como un número de focos linfocíticos (que contienen ≥ 50 linfocitos) por 4mm2 de tejido glandular; y presencia de marcadores anticuerpos anti antígeno A relacionado con SS (anti-Ro o SSA) y anti-Sjogren tipo B (anti-La o SSB)7.
Nardi et al.8 sostienen que para el diagnóstico de SSJp pueden presentarse dificultades, debido a la presencia variable de autoanticuerpos contra antígenos nucleares y no nucleares, siendo más frecuentes los antimúsculo liso (62%) que los SSA y SSB. Por tanto, algunos autores recomiendan que para los casos en que los patrones de anticuerpos SSA y SSB no sean concluyentes para el SSJp, siempre que persista la sospecha clínica se sugiere realizar una biopsia de glándula salival menor9,10.
De otro lado, el SS, caracterizado por sequedad ocular, en la boca y mucosa vaginal, aumenta con la edad; compromete cerca del 30% de la población mayor de 65 años, con mayor prevalencia en mujeres11,12. La distinción entre el SS y el SSJ cobra relevancia, a fin de orientar el diagnóstico, la terapéutica y el compromiso de las glándulas exocrinas. Por consiguiente, algunos estudios imagenológicos han ido ganando importancia para el diagnóstico del SSJ, entre ellos la ecografía y el Doppler, que pueden proporcionar información para la identificación de pacientes en riesgo de desarrollar complicaciones de la enfermedad, así como documentar alteraciones estructurales y de vascularización de las glándulas13. Otra ayuda diagnóstica útil, pero poco utilizada, es la gammagrafía de glándulas salivales mayores, la cual se considera mínimamente invasiva, genera poca radiación, presenta un costo asequible y permite la evaluación morfofuncional de las glándulas salivales mayores (parótidas y submandibulares); características no estimadas en otras pruebas. Adicionalmente, provee información para establecer factores de riesgo, como las hipocaptaciones más severas del radiotrazador, que generalmente sugieren mayor posibilidad de compromiso sistémico y autoinmune, mayor incidencia de linfoma de células B y menor sobrevida14.
Aunque la fisiopatología del SS también es multifactorial, su diagnóstico es un reto, ya que las ayudas diagnósticas pueden diferir, de acuerdo con la severidad de los signos y los síntomas del paciente. Pijoan et al.9 proponen un algoritmo para el diagnóstico del SS y sospecha de SSJ con el análisis de las diferentes ayudas inmunológicas, funcionales e histopatológicas, que pueden ayudar en fases tempranas, quizá no diagnosticables del SSJ. Por ende, el objetivo del presente estudio fue asociar las características clínicas, gammagráficas e histopatológicas de pacientes con xerostomía y diagnóstico presuntivo de SS y SSJ en Medellín (Colombia), en el periodo 2018-2020.
Materiales y métodosEl diseño del estudio es de enfoque cuantitativo, de tipo analítico transversal, realizado en pacientes que consultaron a los servicios de estomatología de la Facultad de Odontología de la Universidad de Antioquia y a la consulta privada de las coinvestigadoras en Medellín (Colombia), entre abril de 2018 y enero de 2020. Fue aprobado por el Comité de Bioética de la Facultad de Odontología de la Universidad de Antioquia, con concepto n.o 14-2018, acta n.o 04 de 2018, Medellín, 21 de abril de 2018.
Criterios de inclusión y exclusiónPara el tamaño de la muestra se utilizó el criterio de muestreo por conveniencia; todos los pacientes fueron mayores de 18 años. Como criterios de inclusión se tuvieron en cuenta pacientes que presentaban síntomas de boca seca y sospecha de SSJ, con estudio histopatológico de glándulas salivales menores indicado por su médico tratante y test inmunológico negativo. Como criterios de exclusión, no se tuvieron en cuenta pacientes con antecedente de radioterapia en cabeza y cuello, quimioterapia o trauma directo sobre las glándulas salivales, así como la ingesta de medicamentos que generan xerostomía (antihipertensivos, antirresortivos y antidepresivos), hiper e hipotiroidismo, consumo de tabaco o sustancias psicoactivas, antecedentes de hepatitis C activa, virus de la inmunodeficiencia humana (VIH), sarcoidosis, amiloidosis, enfermedad de injerto contra huésped o síndrome relacionado con la inmunoglobulina G4 (IgG4).
Recolección de la informaciónUna vez que se identificó que cada participante cumpliera con los criterios de inclusión y si era elegible para el estudio, se le informó acerca del proyecto para determinar su disposición para participar. Con las mujeres que aceptaron participar se programó una cita para asistir a la evaluación clínica. Todas las participantes firmaron el consentimiento informado y, posteriormente, por medio de una entrevista cara a cara, se les aplicó una encuesta en la que se recolectaron datos sociodemográficos, y se les realizó el examen físico, por parte de dos residentes de la Especialización en Cirugía Oral y Maxilofacial de la Universidad de Antioquia. Estos datos se consignaron en una base de datos creada en Excel para su posterior análisis.
Características clínicasPara las mediciones de flujo salival se incluyeron pruebas de saliva no estimulada y estimulada, y para sequedad ocular el test de Schirmer, garantizando un ambiente clínico tranquilo para la realización de dichas pruebas.
- 1.
Recolección de saliva sin estimulación: cada uno de los pacientes depositó en un frasco (Falcon 50mL estéril) la saliva, que fluyó pasivamente dentro de su boca y que acumuló durante 5min, para su posterior cuantificación7.
- 2.
Recolección de saliva con estimulación: cada paciente recibió previamente la instrucción de masticar en forma alternada por ambos lados, un trozo de parafina de 5 g durante 60 segundos, al ritmo del metrónomo a 60 masticaciones por minuto (MPM). La saliva producida durante este tiempo fue descartada y seguidamente se solicitó acumular durante 5min la saliva en la boca, para recolectarla en un frasco (Falcon 50mL estéril) y posteriormente cuantificarla7.
- 3.
Test de Schirmer: para la realización de la prueba se utilizó papel filtro Whatman n.o 41, al cual se le hizo un pliegue de 5mm para suspenderlo en el párpado inferior de cada ojo, y se dejó por 5min para su posterior medición7.
Se hizo el estudio gammagráfico de glándulas salivales con ayuno de cuatro horas, previa explicación del procedimiento y la firma de consentimiento informado. Por vía intravenosa se administraron 10 mCi (37 Mbq) de 99mTc-pertecnectato, realizando una adquisición dinámica durante 30min (30 imágenes de 60 segundos) y estáticas en proyecciones anterior y lateral (700 kilocuentas/imagen) al finalizar la exploración. A los 20min se administró zumo de limón por vía oral como estímulo cítrico para valorar la función de la excreción. En el campo de detección se incluyeron las glándulas salivales y la tiroides.
Todos los estudios se realizaron en la gammacámara InfiniaTM Hawkeye 4 (General Electric, Medical Systems, Milwaukee, Estados Unidos), de doble detector, utilizando el colimador multipropósito de baja energía y alta resolución. Para el estudio dinámico se empleó una matriz de 64 × 64 y para las imágenes estáticas de 256 × 256, en ambos casos con una magnificación de 1,33. El procesamiento se llevó a cabo en la plataforma Xeleris 3 (General Electric, Medical Systems, Milwaukee, Estados Unidos). Se dibujó una región de interés (ROI) en las glándulas parótidas y submaxilares, se obtuvo el valor de las cuentas máximas (Cm) y totales (Ct) y se generó una curva de actividad/tiempo para cada una de las ROI.
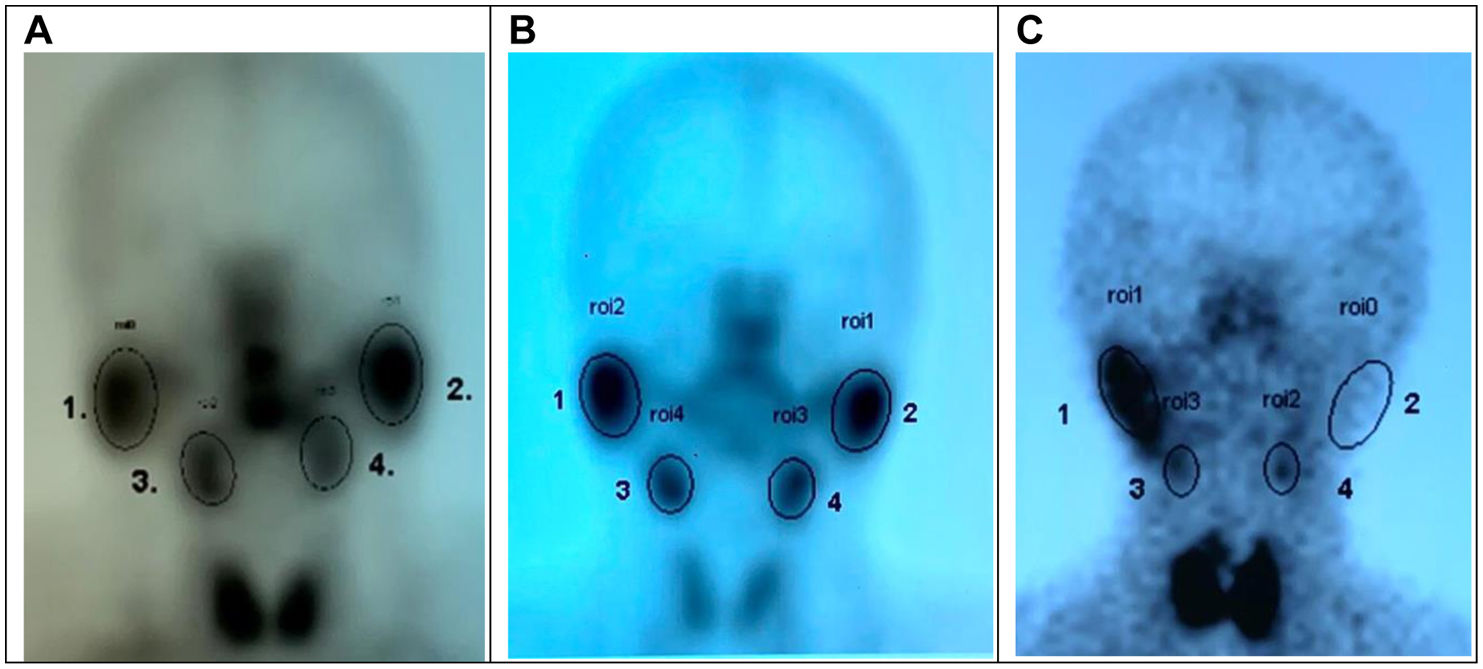
Los estudios fueron analizados e interpretados por dos médicos nucleares, de forma semicualitativa, teniendo en cuenta las imágenes y valorando el perfil de las curvas, determinando si se encontraba o no una adecuada incorporación por parte de las glándulas parótidas y submaxilares y valorando la excreción para descartar alteraciones funcionales tanto en el estudio dinámico como en las curvas de actividad/tiempo (fig. 1).
A) Glándulas parótidas y submaxilares de características gammagráficas normales. B) Signos gammagráficos de compromiso funcional en glándulas submandibulares caracterizado por disminución en la captación del radiofármaco. C) Signos gammagráficos de compromiso funcional severo de parótida unilateral sin captación del radiofármaco y glándulas submandibulares bilaterales, evidenciado por hipocaptación del radiofármaco.
El informe de cada paciente fue entregado por escrito y en CD, más gráficas en acetatos, con descripción de la función de cada una de las glándulas salivales mayores, porcentajes de captación y una conclusión. Posteriormente, estos datos también fueron registrados en la base de datos.
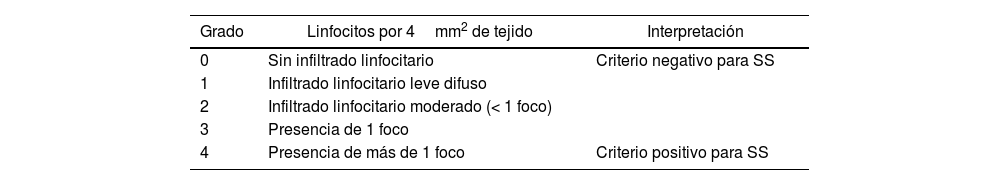
Análisis histopatológicoCon la previa autorización escrita de las pacientes para acceder a los bloques y las placas de patología, se hizo una nueva lectura por parte de una patóloga oral, quien desconocía la información clínica de los pacientes. Los hallazgos histológicos se expresaron de acuerdo con la escala de Chisholm y Mason (CH-M) para categorizar los pacientes en SS (CH-M 0-2) y diagnóstico presuntivo de SSJ (presuntivo SSJ) (CH-M 3-4), como se detalla en la tabla 1.
Escala de Chisholm y Mason15
| Grado | Linfocitos por 4mm2 de tejido | Interpretación |
|---|---|---|
| 0 | Sin infiltrado linfocitario | Criterio negativo para SS |
| 1 | Infiltrado linfocitario leve difuso | |
| 2 | Infiltrado linfocitario moderado (< 1 foco) | |
| 3 | Presencia de 1 foco | |
| 4 | Presencia de más de 1 foco | Criterio positivo para SS |
SS: síndrome Sicca.
Foco: agregado de 50 células/4mm2 (linfocitos).
Las características de los pacientes se describieron mediante medidas de tendencia central (mediana) y de dispersión (rango intercuartílico [IQR]). Para las comparaciones entre los grupos SS y diagnóstico presuntivo de SSJ, se utilizó la prueba exacta de Fisher para las variables categóricas y la prueba U de Mann Whitney para las variables cuantitativas. Se hizo un análisis de correlación de Pearson para medir el grado de asociación entre la cantidad de flujo salival estimulada y no estimulada, producida por cada glándula y los grupos SS y diagnóstico presuntivo de SSJ. Las pruebas estadísticas fueron a dos colas y se consideró como significancia estadística un valor de p <0,05. Los análisis se hicieron utilizando STATA V.12 (Stata Corporation, College Station, Texas, USA).
Consideraciones éticasEste estudio fue revisado y aprobado por el Comité de Bioética de la Facultad de Odontología de la Universidad de Antioquia, con concepto n.o 14-2018, acta n.o 04 de 2018, en la ciudad Medellín, el 21 de abril de 2018. La realización de este proyecto de investigación se ajusta a lo determinado en la Declaración Universal sobre Bioética y Derechos Humanos de la Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura (UNESCO) del año 2005 y a las Normas Científico-Técnicas y Administrativas para la Investigación en Salud, resolución n.° 008430 de 1993 del Ministerio de Salud de Colombia, en su título II, capítulo VI, sobre la manipulación de tejidos, artículos 47-48; y en su título IV, capítulo I, alusivo a la bioseguridad de las investigaciones y a las recomendaciones para investigación biomédica de la Declaración de Helsinki de 1964 (actualizada en 2008). Se obtuvo consentimiento informado por escrito, el cual autorizaba la participación en el proyecto, así como el uso de sus datos y los resultados para divulgación académica.
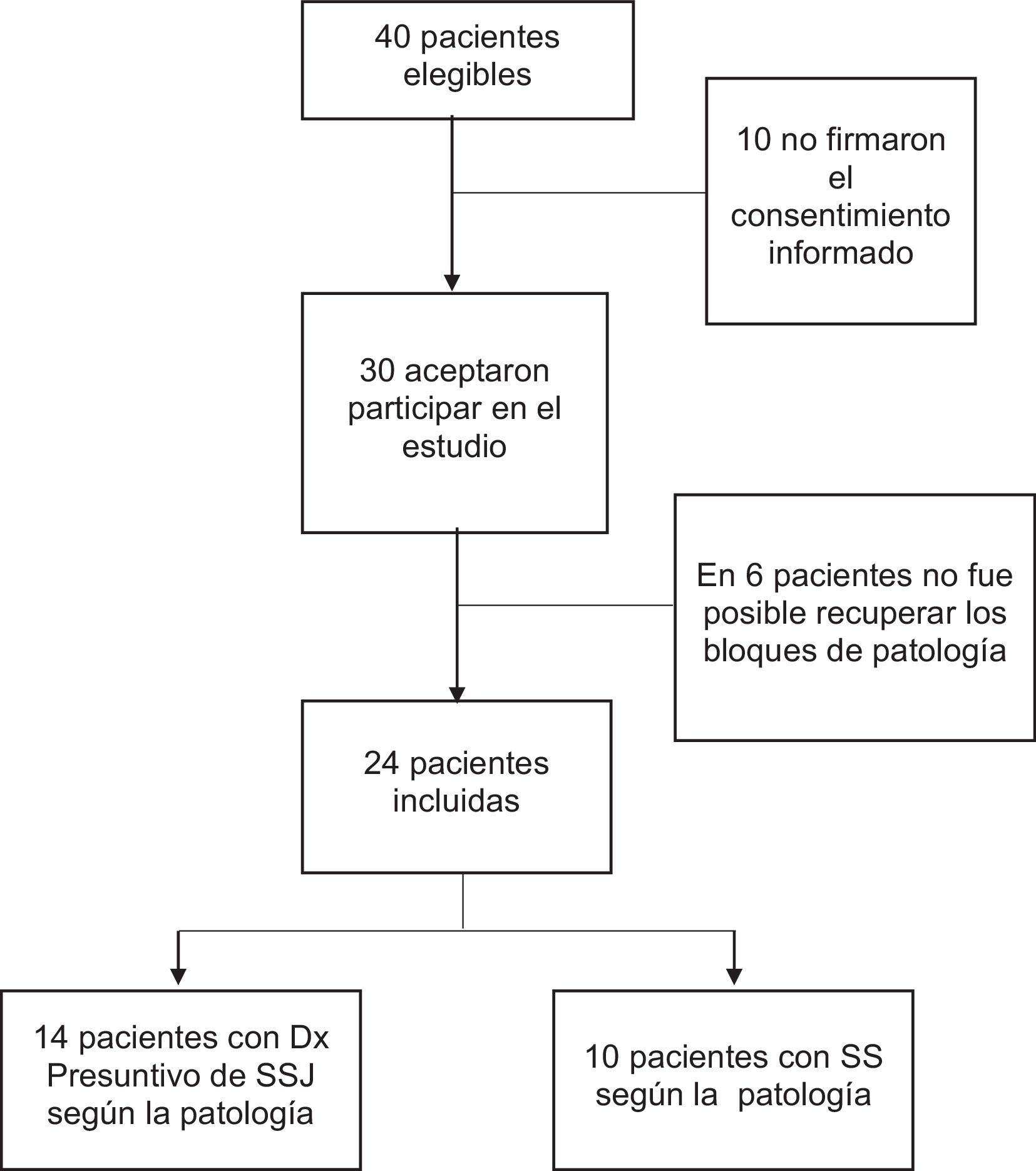
ResultadosParticipantesDe 40 pacientes elegibles, se incluyeron 24 tras excluir 10 pacientes que no aceptaron participar en el estudio y seis de quienes no fue posible obtener los bloques ni placas de patología en los laboratorios (fig. 2).
La totalidad de la muestra estudiada estuvo constituida por 24 mujeres. El grupo de SS (CH-M 0-2), conformado por 10 pacientes, tuvo una mediana de edad de 52,5 (IQR 41-57) años y para el grupo de diagnóstico presuntivo SSJ de 63,5 (IQR 51-69) años, y no se presentaron diferencias significativas entre los grupos.
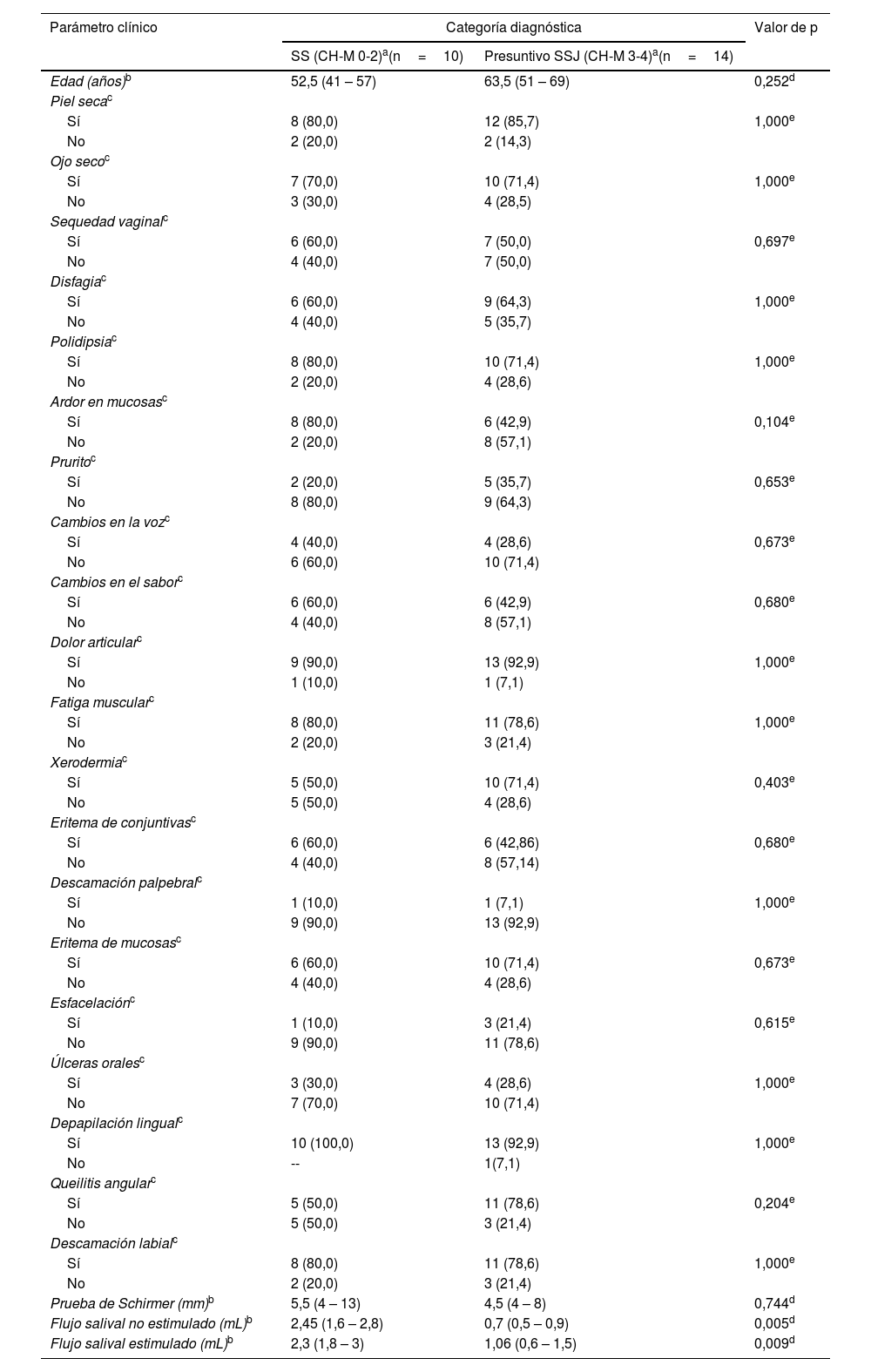
En la evaluación de los signos y los síntomas clínicos no hubo diferencias entre los grupos. Sin embargo, entre los grupos se observó una mayor frecuencia en los síntomas de dolor articular en SS (90%) y diagnóstico presuntivo SSJ (92,9%), piel seca en SS (80%) y diagnóstico presuntivo SSJ (85,7%), polidipsia en SS (80%) y en diagnóstico presuntivo SSJ (71,4%), fatiga muscular en SS (80%) y en diagnóstico presuntivo SSJ (78,6), y sequedad ocular en SS (70%) y en diagnóstico presuntivo SSJ (71,4%).
Los signos clínicos más frecuentes en ambos grupos fueron la depapilación lingual en SS (100%) y en diagnóstico presuntivo SSJ (92,9%), seguida de la descamación labial en SS (80%) y en diagnóstico presuntivo SSJ (78,6%), y el eritema de mucosas en SS (60%) y en diagnóstico presuntivo SSJ (71,4%).
Entre otros síntomas, en el grupo SS se presentó ardor en mucosas (80%), fatiga muscular (80%), cambio del sabor, disfagia y sequedad vaginal (60%) y el signo de eritema de conjuntivas (60%).
En relación con la comparación de la tasa de flujo salival entre los grupos SS y diagnóstico presuntivo SSJ, hubo diferencia significativa con valores de p=0,005 y p=0,009 para flujo salival no estimulado y estimulado, respectivamente (tabla 2).
Resumen de hallazgos clínicos obtenidos de los participantes de acuerdo con las categorías diagnósticas
| Parámetro clínico | Categoría diagnóstica | Valor de p | |
|---|---|---|---|
| SS (CH-M 0-2)a(n=10) | Presuntivo SSJ (CH-M 3-4)a(n=14) | ||
| Edad (años)b | 52,5 (41 – 57) | 63,5 (51 – 69) | 0,252d |
| Piel secac | |||
| Sí | 8 (80,0) | 12 (85,7) | 1,000e |
| No | 2 (20,0) | 2 (14,3) | |
| Ojo secoc | |||
| Sí | 7 (70,0) | 10 (71,4) | 1,000e |
| No | 3 (30,0) | 4 (28,5) | |
| Sequedad vaginalc | |||
| Sí | 6 (60,0) | 7 (50,0) | 0,697e |
| No | 4 (40,0) | 7 (50,0) | |
| Disfagiac | |||
| Sí | 6 (60,0) | 9 (64,3) | 1,000e |
| No | 4 (40,0) | 5 (35,7) | |
| Polidipsiac | |||
| Sí | 8 (80,0) | 10 (71,4) | 1,000e |
| No | 2 (20,0) | 4 (28,6) | |
| Ardor en mucosasc | |||
| Sí | 8 (80,0) | 6 (42,9) | 0,104e |
| No | 2 (20,0) | 8 (57,1) | |
| Pruritoc | |||
| Sí | 2 (20,0) | 5 (35,7) | 0,653e |
| No | 8 (80,0) | 9 (64,3) | |
| Cambios en la vozc | |||
| Sí | 4 (40,0) | 4 (28,6) | 0,673e |
| No | 6 (60,0) | 10 (71,4) | |
| Cambios en el saborc | |||
| Sí | 6 (60,0) | 6 (42,9) | 0,680e |
| No | 4 (40,0) | 8 (57,1) | |
| Dolor articularc | |||
| Sí | 9 (90,0) | 13 (92,9) | 1,000e |
| No | 1 (10,0) | 1 (7,1) | |
| Fatiga muscularc | |||
| Sí | 8 (80,0) | 11 (78,6) | 1,000e |
| No | 2 (20,0) | 3 (21,4) | |
| Xerodermiac | |||
| Sí | 5 (50,0) | 10 (71,4) | 0,403e |
| No | 5 (50,0) | 4 (28,6) | |
| Eritema de conjuntivasc | |||
| Sí | 6 (60,0) | 6 (42,86) | 0,680e |
| No | 4 (40,0) | 8 (57,14) | |
| Descamación palpebralc | |||
| Sí | 1 (10,0) | 1 (7,1) | 1,000e |
| No | 9 (90,0) | 13 (92,9) | |
| Eritema de mucosasc | |||
| Sí | 6 (60,0) | 10 (71,4) | 0,673e |
| No | 4 (40,0) | 4 (28,6) | |
| Esfacelaciónc | |||
| Sí | 1 (10,0) | 3 (21,4) | 0,615e |
| No | 9 (90,0) | 11 (78,6) | |
| Úlceras oralesc | |||
| Sí | 3 (30,0) | 4 (28,6) | 1,000e |
| No | 7 (70,0) | 10 (71,4) | |
| Depapilación lingualc | |||
| Sí | 10 (100,0) | 13 (92,9) | 1,000e |
| No | -- | 1(7,1) | |
| Queilitis angularc | |||
| Sí | 5 (50,0) | 11 (78,6) | 0,204e |
| No | 5 (50,0) | 3 (21,4) | |
| Descamación labialc | |||
| Sí | 8 (80,0) | 11 (78,6) | 1,000e |
| No | 2 (20,0) | 3 (21,4) | |
| Prueba de Schirmer (mm)b | 5,5 (4 – 13) | 4,5 (4 – 8) | 0,744d |
| Flujo salival no estimulado (mL)b | 2,45 (1,6 – 2,8) | 0,7 (0,5 – 0,9) | 0,005d |
| Flujo salival estimulado (mL)b | 2,3 (1,8 – 3) | 1,06 (0,6 – 1,5) | 0,009d |
SS: síndrome Sicca; SSJ: síndrome de Sjögren.
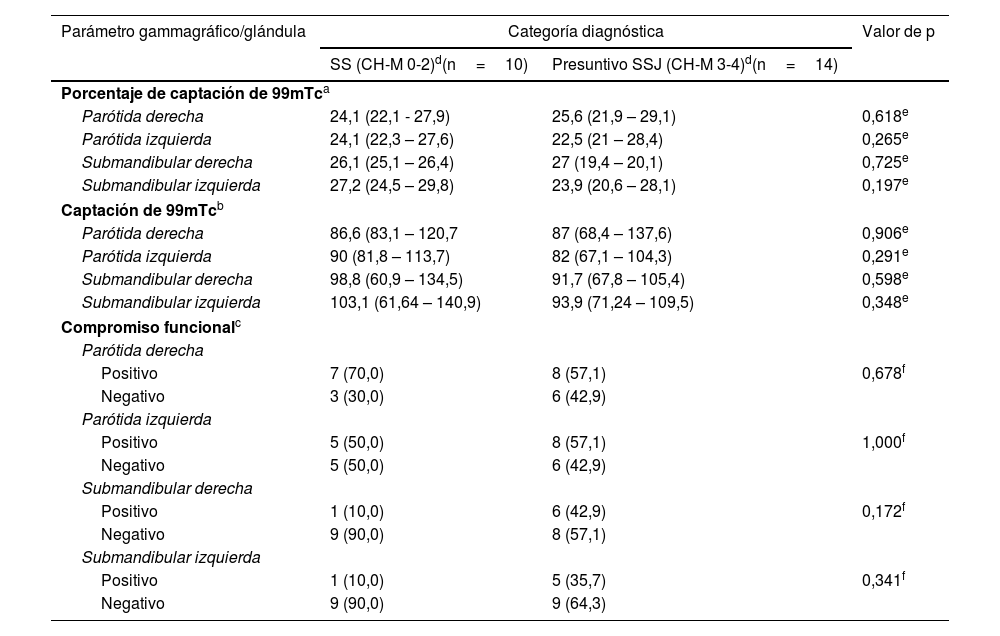
Al evaluar los hallazgos gammagráficos, se evidenció una tendencia a la menor captación de 99mTc, menor porcentaje de captación y mayor compromiso funcional en las glándulas submandibulares en los pacientes con diagnóstico presuntivo SSJ, al comparar ambos grupos, sin diferencias estadísticamente significativas (tabla 3). La captación de 99mTc tuvo correlación positiva con la prueba de flujo salival para las glándulas submandibulares, al evaluar los coeficientes de correlación de Pearson, con valores de p cercanos a 0,05 (tabla 4).
Resumen de hallazgos gammagráficos por glándula salival mayor con referencia a las categorías diagnósticas
| Parámetro gammagráfico/glándula | Categoría diagnóstica | Valor de p | |
|---|---|---|---|
| SS (CH-M 0-2)d(n=10) | Presuntivo SSJ (CH-M 3-4)d(n=14) | ||
| Porcentaje de captación de 99mTca | |||
| Parótida derecha | 24,1 (22,1 - 27,9) | 25,6 (21,9 – 29,1) | 0,618e |
| Parótida izquierda | 24,1 (22,3 – 27,6) | 22,5 (21 – 28,4) | 0,265e |
| Submandibular derecha | 26,1 (25,1 – 26,4) | 27 (19,4 – 20,1) | 0,725e |
| Submandibular izquierda | 27,2 (24,5 – 29,8) | 23,9 (20,6 – 28,1) | 0,197e |
| Captación de 99mTcb | |||
| Parótida derecha | 86,6 (83,1 – 120,7 | 87 (68,4 – 137,6) | 0,906e |
| Parótida izquierda | 90 (81,8 – 113,7) | 82 (67,1 – 104,3) | 0,291e |
| Submandibular derecha | 98,8 (60,9 – 134,5) | 91,7 (67,8 – 105,4) | 0,598e |
| Submandibular izquierda | 103,1 (61,64 – 140,9) | 93,9 (71,24 – 109,5) | 0,348e |
| Compromiso funcionalc | |||
| Parótida derecha | |||
| Positivo | 7 (70,0) | 8 (57,1) | 0,678f |
| Negativo | 3 (30,0) | 6 (42,9) | |
| Parótida izquierda | |||
| Positivo | 5 (50,0) | 8 (57,1) | 1,000f |
| Negativo | 5 (50,0) | 6 (42,9) | |
| Submandibular derecha | |||
| Positivo | 1 (10,0) | 6 (42,9) | 0,172f |
| Negativo | 9 (90,0) | 8 (57,1) | |
| Submandibular izquierda | |||
| Positivo | 1 (10,0) | 5 (35,7) | 0,341f |
| Negativo | 9 (90,0) | 9 (64,3) | |
SS: síndrome Sicca; SSJ: síndrome de Sjögren.
Análisis de correlación estadística entre los parámetros clínicos cuantitativos significativos y los resultados gammagráficos
| Parámetros clínicos | Hallazgos gammagráficos | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Porcentaje de captación de 99mTc | Captación de 99mTc | |||||||||||||||
| Parótida derecha | Parótida izquierda | Submandibular derecha | Submandibular izquierda | Parótida derecha | Parótida izquierda | Submandibular derecha | Submandibular izquierda | |||||||||
| ra | Valor de p | ra | Valor de p | ra | Valor de p | ra | Valor de p | ra | Valor de p | ra | Valor de p | ra | Valor de p | ra | Valor de p | |
| Flujo salival no estimulado (mL) | 0,122 | 0,572 | 0,311 | 0,139 | 0,104 | 0,630 | 0,233 | 0,274 | 0,083 | 0,700 | 0,223 | 0,294 | 0,152 | 0,480 | 0,199 | 0,351 |
| Flujo salival estimulado (mL) | -0,069 | 0,748 | 0,100 | 0,643 | 0,060 | 0,781 | 0,025 | 0,908 | 0,185 | 0,388 | 0,317 | 0,131 | 0,337 | 0,108 | 0,328 | 0,118 |
Según el análisis histomorfológico, 14 de las 24 pacientes con xerostomía tuvieron hallazgos compatibles con diagnóstico presuntivo de SSJ (CH 3-4), y con respecto a otros parámetros evaluados, se observaron más cambios atróficos en las pacientes con diagnóstico de SS y mayor porcentaje de fibrosis y cambios grasos en aquellas con diagnóstico presuntivo SSJ, con diferencia estadísticamente significativa para este último parámetro (p=0,047) (tabla 5).
Otros hallazgos histológicos
| Parámetro histológico | Categoría diagnóstica, n (%) | Valor de pa | |
|---|---|---|---|
| SS (n=10) | Presuntivo SSJ (n=14) | ||
| Atrofia | 8 (80) | 8 (57,1) | 0,387 |
| Dilatación | 8 (80) | 12(85,7) | 1,000 |
| Fibrosis | 7 (70) | 13 (92,8) | 0,272 |
| Cambios grasos | 2 (20) | 9 (64,3) | 0,047 |
SS: síndrome Sicca; SSJ: síndrome de Sjögren.
El SS puede cursar con signos y síntomas transitorios o persistentes que comprometen las mucosas orales, las oculares y la dermis, con impacto en la salud y la calidad de vida del paciente. Los síntomas subjetivos del SS, en especial la xerostomía, pueden tener relación con la hiposalivación, donde la tasa de flujo salival se ve alterada por la función anormal de las glándulas salivales16. Dichos cambios en la cantidad y la calidad de la saliva conducen a la aparición de síntomas y signos en las mucosas orales, como depapilación lingual, descamación labial, eritema, ardor, disgeusia, cambios en la voz y disfagia, entre otros concordantes con lo hallado en este estudio (tabla 4), los cuales se contrastan con lo reportado en la literatura17. Sin embargo, todos estos signos y síntomas pueden tener relación con una atrofia progresiva de las glándulas salivales, lo que sugiere evaluar diagnósticos diferenciales como el SSJ18.
El SSJ es la segunda enfermedad reumatológica crónica más común, después de la artritis reumatoidea, con una prevalencia que oscila entre 0,4 y 3,1 millones de individuos3. Se caracteriza por la infiltración linfocitaria de glándulas exocrinas y otros órganos, en conjunto con la producción de diversos autoanticuerpos. Se asocia con una alta morbilidad, no solo por la xerostomía y la queratoconjuntivitis seca, sino por las manifestaciones extraglandulares, incluido el desarrollo de linfomas no Hodgkin de células B4,16. La etiología del SSJ es multifactorial, puede estar determinado por la susceptibilidad epigenética, y secundariamente por la enfermedad reumatológica autoinmune19.
Los síntomas más comunes del SSJ son la fatiga, el ojo y la boca secos, los cuales se relacionan con el SS, por ende, el diagnóstico adecuado de sospecha de SSJ debe incluir los síntomas subjetivos orales y oculares, los signos objetivos positivos de test de Schirmer, gammagrafía de glándulas salivales, sialoadenitis focal y parámetros inmunológicos5. Según el consenso ACR/EULAR-2016, para el diagnóstico de SSJp los criterios incluyen la biopsia de glándula salival menor, la presencia de anticuerpos anti SSA/anti-RO, el test de Schirmer, la puntuación de tinción ocular y el flujo salival no estimulado7. En este estudio se evaluaron pacientes con diagnóstico de SS y diagnóstico presuntivo SSJ con estudio histológico que orientaba a la presencia positiva de SSJ, se obtuvieron resultados positivos en los hallazgos clínicos en la categoría de diagnóstico presuntivo SSJ, test de Schirmer (4,5 [IQR 4-8]), flujo salival no estimulado (0,7 [IQR 0,5-0,9]) y alteraciones histológicas glandulares (atrofia, dilatación, fibrosis y cambios grasos) que sugieren hacer seguimientos a largo plazo para definir un diagnóstico definitivo. Pijoan et al.9 proponen un algoritmo para el diagnóstico de SS con test de Schirmer ≤ 5mm y un análisis de autoinmunidad negativo (SSA[-] o SSB [-]). Sugieren hacer la biopsia de glándula salival menor para confirmar o descartar el SSJ. En contraste, si se obtiene un test de Schirmer> 5mm, con una evaluación gammagráfica de glándulas salivales y un análisis de autoinmunidad donde solo una de las dos es positiva, sugieren hacer el estudio histológico para confirmar o descartar el diagnóstico de SSJ. En este estudio no se contó con los test inmunológicos, debido a que las pacientes remitidas no presentaban positividad para estos. Los resultados obtenidos orientan entonces a analizar el desarrollo del SSJ por estadios de progresión y una evaluación individual fenotípica y genotípica de cada paciente para definir terapéuticas.
En la evaluación de las pruebas funcionales de las glándulas salivares, los estudios de gammagrafía de glándulas salivales y las pruebas de flujo salival mostraron diferencia significativa, con valores de p=0,002 y p=0,019 para la tasa de flujo salival no estimulado y estimulado en los pacientes con la categoría de diagnóstico presuntivo SSJ. Esto sugiere una alteración funcional de las glándulas salivales mayores, lo que concuerda con el estudio de Kalk et al.20, en el que los pacientes con SSJ mostraron tasas de flujo submandibular/sublingual (SM/SL) más bajas y una modificación en la composición de la saliva de las glándulas salivales mayores.
Los estudios de medicina nuclear suelen ser utilizados para evaluar el compromiso de las glándulas salivares en pacientes con síntomas de xerostomía. La gammagrafía con 99mTc es lo suficientemente sensible como para detectar la destrucción del 25% del parénquima glandular y se ha correlacionado con los hallazgos histopatológicos y las pruebas de función salivar, sin embargo, la captación disminuida o ausente del radiofármaco por las glándulas salivales es un fenómeno inespecífico, por lo que su hallazgo anormal no debe considerarse patognomónico de SSJ21,22.
La anomalía gammagráfica más frecuente de manera temprana en los pacientes con SSJ es el deterioro de la excreción, seguido de una disminución en la captación del radiofármaco, lo que refleja el daño en el parénquima glandular23. Wu et al.24 describieron recientemente una disminución tanto en la excreción como en la captación del 99mTc por las glándulas salivares en 10 pacientes con SSJ. Diferentes estudios25–27 reportan compromiso multiglandular, con predominio en las glándulas submandibulares, lo cual se relaciona con el grado de xerostomía subjetiva, resultados comparables con los obtenidos en la actividad gammagráfica de las glándulas salivales mayores. Los resultados presentan un compromiso funcional mayor en los pacientes con diagnóstico presuntivo SSJ en las submandibulares con respecto al grupo con diagnóstico de SS, el cual se correlaciona con la tasa de flujo salival no estimulado (tabla 4). Sin embargo, se observó para ambas categorías un compromiso funcional de las glándulas parótidas en menor grado, que puede ser contrastado con la xerostomía, dado que el tipo de saliva serosa genera la biopelícula en las mucosas orales. Estos hallazgos pueden sugerir un compromiso en etapas tempranas del SSJ, como lo reportan Güne et al.28, quienes proponen un patrón de actividad asimétrica en las glándulas parótidas en etapas tempranas de la enfermedad y que puede ser un predictor de progresión.
Se ha considerado que la biopsia de glándulas salivares menores que incluya más de cinco glándulas, así como la evaluación histopatológica de la sialoadenitis linfocítica focal con una puntuación ≥ 1 foco en 4mm2 de área de superficie de tejido, pueden proporcionar información sobre el alcance y la naturaleza del proceso de la enfermedad29. En nuestro estudio, 14 de 24 pacientes tuvieron hallazgos histológicos compatibles con SSJ (CH-M 3-4), con mayor porcentaje de fibrosis y cambios grasos al comparar los grupos de estudio. Este hallazgo coincide con el de Leehan et al.30, quienes evidenciaron que la fibrosis cuantificada es una característica de la patología del SSJ, y no únicamente una característica de la edad. Por tanto, los casos clasificados como diagnóstico presuntivo SSJ tuvieron un porcentaje de área de fibrosis más alto que aquellos que no cumplían con los criterios de clasificación para SSJ. De igual manera, los estudios de Skarstein et al.31 encontraron que el tejido adiposo es prominente en las glándulas salivales de los pacientes con síndrome de Sjögren y parece influir en el microambiente de estos órganos, además de ser detectado en regiones ricas en interleucina 6 (IL-6), lo que sugiere su posible participación en las reacciones inmunes. En consecuencia, se plantea la necesidad de estudios con cohortes más grandes y diversas para verificar este concepto, dado que Leehan et al.32 concluyeron en su estudio que la infiltración grasa es un fenómeno asociado con la edad y no una característica del SSJ, porque pacientes con síntomas secos que no cumplían con los criterios de SSJ tenían similares tasas de infiltración grasa de las glándulas salivales menores.
Entre las limitaciones del estudio se destaca una muestra reducida de pacientes, lo cual pudo haber afectado la magnitud del efecto de las variables contempladas, y, por consiguiente, la ausencia de diferencia estadísticamente significativa para algunos parámetros. También resulta pertinente mencionar la posibilidad de sesgo de medición al realizar una única lectura del estudio de gammagrafía y de histopatología, sin embargo, este escenario se asemeja a las condiciones habituales de diagnóstico clínico.
ConclusiónEl SS y el SSJ son patologías que comparten características clínicas (ojo seco, boca seca), lo que sugiere analizar las diferentes ayudas diagnósticas para establecer un diagnóstico acertado. El examen físico, las pruebas funcionales y los test inmunológicos e histológicos pueden ser discrepantes para definir el diagnóstico definitivo de SSJ, por lo cual deben evaluarse de forma objetiva, a efectos de establecer posibles etapas tempranas de progresión del SSJ. Los resultados orientan a establecer una medicina y odontología de precisión para el SSJ, aplicada de forma individual en cada paciente.
AutoríaEste proyecto estuvo inscrito dentro del proceso académico de investigación de las Dras. Vanessa Flórez y Mónica Posso durante su residencia. Funciones dentro del proyecto: las coinvestigadoras, estudiantes del Posgrado de Especialización Clínica en Cirugía Oral y Maxilofacial, quienes realizaron la recolección y procesamiento de muestras, el análisis histológico y de inmunotinciones, tabulación de información, análisis de resultados, presentación de avances y preparación de artículos requeridos y publicables.
La Dra. Leonor Victoria González, profesora de la facultad de Odontología de Universidad de Antioquia, se desempeñó como patóloga oral en el momento de la confirmación de diagnósticos de las placas/bloques de biopsias derivadas de la glándula salival menor.
FinanciaciónLa financiación fue el apoyo económico por parte de Euroetika para la realización de las gammagrafías de glándulas mayores.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.
A Euroetika por su aporte en la financiación de gammagrafías.