El uso de glucocorticoides es la causa más frecuente de osteoporosis y fracturas osteoporóticas. Puesto que la osteoporosis inducida por glucocorticoides (OIG) es un problema subestimado y generalmente no tratado, el Grupo de Estudio de Metabolismo Óseo de la Asociación Colombiana de Reumatología decidió elaborar esta guía de práctica clínica (GPC), con el fin de apoyar a los reumatólogos y a otros especialistas del país que usan este tipo de medicamentos para el manejo de condiciones inflamatorias y autoinmunes, con recomendaciones sobre prevención, diagnóstico y tratamiento de la OIG. Las recomendaciones aquí planteadas se construyeron siguiendo la metodología GRADE-ADOLOPMENT. Se seleccionó la guía del Colegio Americano de Reumatología, Guideline for the Prevention and Treatment of Glucocorticoid-Induced Osteoporosis, como fuente para la actualización de las búsquedas de la literatura. El desarrollo de esta GPC contó además con la participación de expertos clínicos de diferentes especialidades, pacientes y el equipo técnico metodológico de EpiThink Health Consulting.
The use of glucocorticoids is the most frequent cause of osteoporosis and osteoporotic fractures. Considering that glucocorticoid-induced osteoporosis (GIOP) is an underestimated and generally untreated problem, the Bone Metabolism study group of the Colombian Association of Rheumatology decided to create this Clinical Practice Guideline (CPG) in order to support rheumatologists and other specialists in the country who use this type of medication to manage inflammatory and autoimmune conditions, with recommendations on prevention, diagnosis, and treatment of GIOP. The recommendations presented here were constructed following the GRADE-ADOLOPMENT methodology. The American College of Rheumatology guideline, Guideline for the Prevention and Treatment of Glucocorticoid-Induced Osteoporosis, was selected as the source for updating the literature searches. The development of this CPG also included the participation of clinical experts from different specialties, patients, and the EpiThink Health Consulting technical-methodological team.
En la actualidad, los glucocorticoides son administrados en 0,5 a 1% de la población general y en 3% de los mayores de 50 años a escala mundial1,2. Estos medicamentos son potentes agentes osteopénicos que ejercen su acción en muchos sitios y afectan la homeostasis ósea por la reducción en la densidad ósea que producen, la cual oscila entre 10 y 40%3, con independencia de su estado en el sujeto que inicia el uso de estos fármacos4. La velocidad de la pérdida ósea depende de la dosis y de la duración de la corticoterapia; se estima que entre 30 y 50% de quienes reciben este tipo de tratamiento a largo plazo sufren fracturas3. Estas fracturas inducidas por glucocorticoides se presentan más a menudo por ciertos factores de riesgo identificados, tales como una edad mayor de 55 años, el sexo femenino, la raza blanca y el uso prolongado de prednisolona en una dosis mayor a 7,5 mg/día5. La incidencia anual de fracturas vertebrales y no vertebrales en estudios de osteoporosis inducida por glucocorticoides (OIG) fue de 5,1% entre los pacientes que usaban glucocorticoides de forma crónica y de 2,5% en aquellos que recién iniciaban el tratamiento con estos fármacos5–7.
El uso de glucocorticoides es la causa más frecuente de osteoporosis y fracturas osteoporóticas6,8, sin embargo, se registra que alrededor de 14% (rangos reportados de 6 a 42%) de los pacientes que usan estos medicamentos recibe algún tipo de tratamiento para evitar la pérdida de masa ósea causada por su consumo9–11. Estos datos sugieren que la OIG es un problema subestimado y generalmente no tratado12. Esta enfermedad se presenta principalmente en adultos de 20 a 45 años13,14, aunque todas las edades se ven afectadas por las complicaciones clínicas asociadas con la fractura por fragilidad, las cuales aumentan la morbilidad (dolor, discapacidad física y disminución de la calidad de vida), la mortalidad y el riesgo de presentar nuevas fracturas. Todas estas implicaciones tienen un impacto importante a nivel clínico, social y económico, por lo que el reconocimiento de este problema y la actuación inmediata son fundamentales.
En Colombia, con base en los registros nacionales de los años 2012-2018, la prevalencia estimada de osteoporosis es de 2.440 casos por cada 100.000 habitantes mayores de 50 años15. En un estudio realizado en Bogotá en pacientes mayores de 50 años, la osteoporosis en la columna vertebral y en la cadera tuvo una prevalencia de 15,7 y de 11,4%, respectivamente1,2,6,8. Con esta información y el uso ampliado de glucocorticoides en la práctica médica habitual, la OIG supone un problema de salud relativamente inadvertido en el país. Esta GPC ofrece un compendio actualizado de la evidencia disponible con respecto a la prevención, el diagnóstico y el tratamiento de la OIG. Está dirigida a médicos generales, médicos especialistas y otros profesionales de la salud involucrados en la atención de los pacientes en riesgo o con OIG, en los diferentes niveles de atención.
Las recomendaciones incluidas están orientadas a minimizar los riesgos asociados con la OIG, impactar positivamente en la salud de la población en riesgo o con esta enfermedad, promover el uso racional y pertinente de los recursos mediante la prevención de la OIG y los eventos óseos relacionados, además de constituir un instrumento de apoyo para los tomadores de decisiones en el sistema de salud en Colombia.
MetodologíaEl desarrollo de esta GPC contó con la participación de expertos clínicos de diferentes especialidades, pacientes y el equipo técnico metodológico de EpiThink Health Consulting (véanse participantes y declaración de intereses en el material suplementario 1). Las recomendaciones aquí planteadas se construyeron siguiendo la metodología GRADE-ADOLOPMENT (véanse los detalles metodológicos en el material suplementario 2)16. La población incluida en esta guía son los adultos de 18 años o más, en riesgo o con OIG, con independencia de la patología de indicación (se excluyó a los pacientes expuestos a glucocorticoides inhalados y a aquellos con tasa de filtración glomerular [TFG] menor de 30 mL/min).
El grupo desarrollador formuló las preguntas clínicas y los desenlaces de interés para el abordaje de la GPC, hizo una búsqueda sistemática de las guías y llevó a cabo una evaluación de la calidad con el instrumento AGREE II17. Por su alta calidad, adaptabilidad y conveniencia, se seleccionó la guía del Colegio Americano de Reumatología, Guideline for the Prevention and Treatment of Glucocorticoid-Induced Osteoporosis18, como fuente para la actualización de las búsquedas de la literatura.
Una vez se identificaron las recomendaciones coincidentes para cada pregunta planteada, se reprodujeron las estrategias originales en las bases de datos Medline (vía PubMed), Embase (Elsevier) y Cochrane. Además, se utilizó la base LILACS para incluir evidencia latinoamericana. Para la búsqueda de literatura de las preguntas no planteadas en la guía fuente, se crearon estrategias que combinaron términos de lenguaje libre y controlado según el tesauro correspondiente a cada base de datos (véanse las estrategias y los resultados de la búsqueda en el material suplementario 3). La selección de las referencias identificadas fue llevada a cabo por dos revisores de manera independiente, quienes evaluaron los documentos bajo los criterios de elegibilidad, tamizando inicialmente las referencias por título y resumen, y luego con la revisión del texto completo de los artículos potencialmente relevantes (véase Prisma en el material suplementario 4). A los artículos seleccionados se les realizó una evaluación de calidad, y la evidencia se resumió en tablas, de acuerdo con la metodología GRADE (véase el resumen de la evidencia en el material suplementario 5).
Cada experto del grupo desarrollador, conformado por 10 especialistas en reumatología, revisó las recomendaciones originales de la guía fuente junto con la nueva evidencia resultante de la actualización, y definió, a su criterio, si la recomendación original debía adoptarse o adaptarse. Posteriormente, en múltiples sesiones de discusión, se llevó a cabo la construcción de las recomendaciones. Finalmente, un grupo multidisciplinario de 19 médicos especialistas (reumatología, endocrinología, ginecología y ortopedia) y un representante de los pacientes revisaron en sesión las preguntas planteadas, la evidencia de soporte de cada tema y las recomendaciones formuladas para cada cuestión clínica. Los participantes del panel votaron cada una de las recomendaciones, discutieron con respecto al balance riesgo-beneficio, la factibilidad de la implementación y el posible impacto en el uso de los recursos (véanse los resultados de la votación en el material suplementario 6). Una versión preliminar del manuscrito de la guía fue revisada y ajustada por todos los miembros del grupo desarrollador y posteriormente enviada a revisión por pares externos.
Todos los aspectos contemplados en esta guía están sujetos a revisión periódica, según lo justifique la evolución del conocimiento, la tecnología y la práctica médica (véase el proceso de actualización en el material suplementario 2).
RecomendacionesLos principios generales y las definiciones clave aplicables a esta guía se describen a continuación (tablas 1 y 2).
Principios generales en el manejo de los pacientes con osteoporosis inducida por glucocorticoides
| Las recomendaciones hechas en esta guía son orientadoras, aunque no constituyen un lineamiento rígido de atención de pacientes con OIG. Los médicos deben tomar decisiones individualizadas, idealmente por medio de un proceso compartido que considere los valores y las preferencias del paciente.Esta guía expone orientaciones de manejo basadas en circunstancias clínicas frecuentes; los casos excepcionales deberán revisarse de manera individualizada.Una recomendación de tratamiento que favorece un medicamento sobre otro significa que el fármaco preferido sería la primera opción; sin embargo, esto no implica que el medicamento no favorecido esté contraindicado para su uso en dicha situación, por lo que todavía puede ser una opción potencial bajo ciertas condiciones.Todos los pacientes evaluados para OIG deben recibir la educación y las intervenciones necesarias para modificar los estilos de vida hacia hábitos saludables (nutrición y actividad física), útiles para reducir los riesgos asociados con la enfermedad.Las decisiones terapéuticas deben considerar siempre las condiciones generales del paciente, sus factores de riesgo y comorbilidades. Se deben diagnosticar, evaluar y tratar específicamente otras causas diferentes de osteoporosis y optimizar el tratamiento de la enfermedad subyacente.En todos los escenarios de atención médica debe promoverse el manejo multidisciplinario que permita las medidas de prevención, el control adecuado de la OIG y el manejo de las condiciones asociadas.Esta GPC brinda recomendaciones farmacológicas de acuerdo con la evidencia, a pesar de la no disponibilidad de algunos medicamentos en el país, pero que podrán ser incluidos por las regulaciones nacionales en un futuro.En esta GPC no se hicieron análisis económicos explícitos; sin embargo, las decisiones de manejo de los pacientes en riesgo o con OIG deben considerar los costos médicos y sociales asociados. |
GPC: guía de práctica clínica; OIG: osteoporosis inducida por glucocorticoides.
Definiciones y categorías de riesgo de fractura en OIG
| Medicamentos y conceptos | Descripción |
|---|---|
| Uso prolongado de glucocorticoides | Administración de glucocorticoides durante 3 meses o más |
| Dosis muy altas de glucocorticoides | Dosis inicial ≥ 30 mg de prednisolona, o equivalente, dosis acumulada > 5 g durante un año |
| Bifosfonatos orales | Alendronato, risedronato, ácido ibandrónico |
| Bifosfonatos intravenosos | Ácido zoledrónico, ácido ibandrónico |
| Falla terapéutica | Adultos ≥ 40 años que continúan en tratamiento con glucocorticoides y presentan fractura 18 meses o más después de iniciar el tratamiento con bifosfonato oral, o un descenso de la DMO ≥ 10%/año, después de un año de tratamiento |
| Categorías de riesgo de fractura en pacientes tratados con glucocorticoides | |
| Alto riesgo de fractura18,19 | En adultos ≥ 40 añosFractura previa por fragilidadPuntaje T en DMO < -2,5 en cadera o columna, o evaluación de riesgo por FRAX* ≥ 20% para fractura mayor, ≥ 3% para fractura de caderaEn adultos < 40 añosFractura previa por fragilidad |
| Moderado riesgo de fractura18,19 | En adultos ≥ 40 añosEvaluación de riesgo por FRAX* 10-19% para fractura mayor, > 1% y < 3% para fractura de caderaEn adultos < 40 añosPuntaje Z en DMO < -3 en cadera o columna o pérdida ósea rápida (10% en cadera o columna vertebral en un año) y continuación del tratamiento con glucocorticoides en 7,5 mg/día durante 6 meses |
| Bajo riesgo de fractura18,19 | En adultos ≥ 40 añosEvaluación de riesgo por FRAX* < 10% para fractura mayor, ≤ 1% para fractura de caderaEn adultos < 40 añosNinguno de los factores de riesgo referidos, salvo el tratamiento con glucocorticoides |
Riesgo a 10 años ajustado por glucocorticoides.
DMO: densidad mineral ósea; FRAX: instrumento para el cálculo del riesgo de fracturas por fragilidad ósea20. La fractura osteoporótica mayor incluye las fracturas de columna (clínica), cadera, muñeca o húmero; OIG: osteoporosis inducida por glucocorticoides.
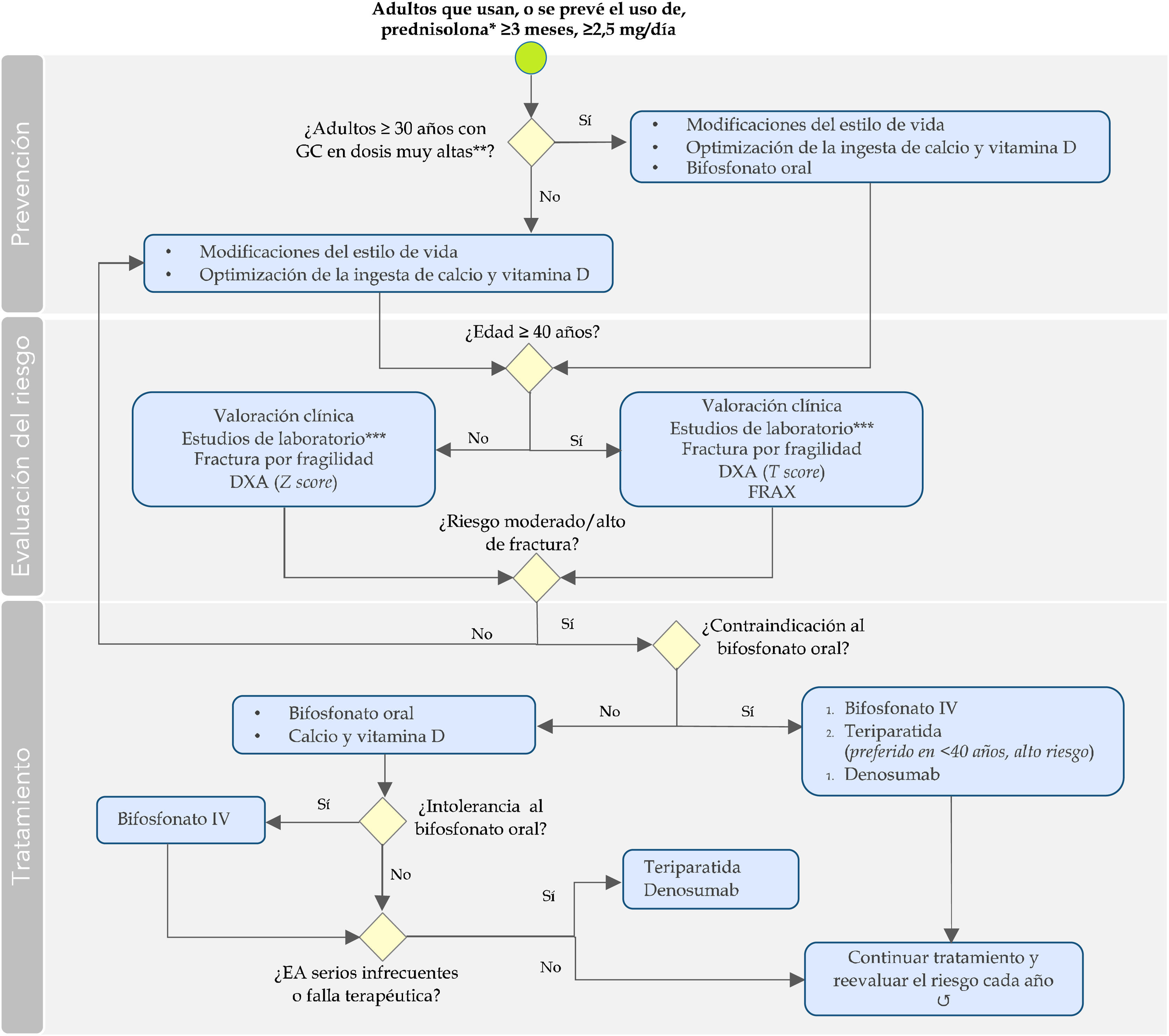
Las recomendaciones formuladas para la prevención, la evaluación y el manejo de los pacientes con OIG se resumen y esquematizan en la tabla 3 y en la figura 1.
Recomendaciones para la prevención, el diagnóstico y el tratamiento de la osteoporosis inducida por glucocorticoides en Colombia
| Recomendación | PICO |
|---|---|
| Prevención de la OIG | |
| Recomendación 1En adultos que tomen prednisolona durante más de 3 meses, en dosis ≥ 2,5 mg/día, o su equivalente, se recomienda optimizar la ingesta de calcio y vitamina D junto con modificaciones del estilo de vida. Recomendación condicional a favor, calidad de la evidencia baja.Punto de buena práctica: las dosificaciones deben ajustarse hasta lograr unas concentraciones séricas de 30-50 ng/mL de vitamina D (mínimo 800 UI/día) y 1.200-1.500 mg/día de ingesta de calcio elemental, teniendo en cuenta la ingesta dietaria y la tolerancia del paciente a la suplementación. | 1-6 |
| Recomendación 2En adultos de 30 años o más que reciban tratamiento con glucocorticoides en dosis muy altas (dosis inicial ≥ 30 mg de prednisolona por más de 3 meses o dosis acumulada > 5 g en un año, o su equivalente), se recomienda administrar bifosfonato oral (alendronato o risedronato), junto con calcio y vitamina D.Recomendación condicional a favor, calidad de la evidencia baja.Punto de buena práctica: la decisión terapéutica en OIG debe considerar los factores de riesgo y las comorbilidades. En mujeres en edad reproductiva que van a recibir bifosfonatos, debe garantizarse un método de anticoncepción seguro. | 1-6 |
| Diagnóstico y evaluación del riesgo | |
| Recomendación 3En adultos que tomen prednisolona durante más de 3 meses, en dosis ≥ 2,5 mg/día, o su equivalente, se recomienda realizar densitometría ósea (por DXA) y evaluar la presencia de fractura vertebral.Recomendación fuerte a favor, calidad de la evidencia baja.Punto de buena práctica: profundizar en el diagnóstico y el estado de salud general del paciente mediante paraclínicos antes del inicio de la terapia, que incluyan glucosa, función renal y función tiroidea | 7 |
| Recomendación 4En adultos menores de 40 años se recomienda clasificar el riesgo de acuerdo con la presencia de fractura por fragilidad o la evaluación de la densidad mineral ósea (puntaje Z). Se recomienda seguimiento anual. Recomendación fuerte a favor, calidad de la evidencia baja. | 7 |
| Recomendación 5En adultos de 40 años o más se recomienda la evaluación del riesgo de acuerdo con la presencia de fractura por fragilidad o la evaluación de la densidad mineral ósea (puntaje T) y del riesgo de fractura por FRAX. En caso de estar disponible, realizar también TBS. Se recomienda seguimiento densitométrico anual. Recomendación fuerte a favor, calidad de la evidencia baja.Punto de buena práctica: realizar la evaluación del riesgo de caídas y factores asociados (relacionados con el paciente y ambientales) e implementar las medidas para su prevención. | 7 |
| Tratamiento de la OIG | |
| Recomendación 6En adultos con OIG y bajo riesgo de fractura, se recomienda tratar con calcio y vitamina D, además de las modificaciones en el estilo de vida. Recomendación fuerte a favor, calidad de la evidencia baja. | 8-11 |
| Recomendación 7En los adultos menores de 40 años con OIG y riesgo moderado a alto de fractura, se recomienda tratar con bifosfonatos orales (alendronato o risedronato), calcio y vitamina D. En caso de contraindicación a los bifosfonatos orales, otras terapias, en orden de preferencia, son:Riesgo moderado: bifosfonato intravenoso (ácido zoledrónico), teriparatida y denosumab.Alto riesgo: teriparatida.Recomendación condicional a favor, calidad de la evidencia baja. | 12-14 |
| Recomendación 8En adultos de 40 años o más, con OIG y riesgo moderado a alto de fractura, se recomienda tratar con bifosfonatos orales (alendronato o risedronato). En caso de contraindicación a los bifosfonatos orales, otras terapias, en orden de preferencia, son: bifosfonato intravenoso (ácido zoledrónico), teriparatida y denosumab.Recomendación fuerte a favor de los bifosfonatos orales, condicional para otras terapias, calidad de la evidencia baja. | 12-14 |
| Tratamiento de la OIG en situaciones especiales | |
| Recomendación 9En las mujeres con OIG que desean quedar embarazadas, están gestando o en lactancia y tienen alto riesgo de fractura, se recomienda el uso de calcio y vitamina D. Reevaluar el riesgo una vez terminada la gestación y el periodo de lactancia, para determinar el tratamiento que debe seguirse. Recomendación condicional a favor, calidad de la evidencia muy baja.Punto de buena práctica: en caso de fractura durante el periodo de lactancia, deberá establecerse si se prioriza el tratamiento farmacológico. | 15 |
| Recomendación 10En adultos con OIG, con trasplante de órganos, tasa de filtración glomerular ≥ 30 mL/min* y sin evidencia de enfermedad adinámica del hueso, que continúan el tratamiento con glucocorticoides, se recomienda tratar igual que los adultos sin trasplante. Recomendación condicional a favor, calidad de la evidencia baja.Punto de buena práctica: todos los pacientes con trasplante renal deben ser evaluados por un especialista en enfermedades metabólicas óseas. | 16 |
| Falta de respuesta terapéutica en OIG | |
| Recomendación 11En caso de falta de respuesta a los bifosfonatos orales, se recomienda evaluar las causas, como la suplencia inadecuada de calcio y vitamina D, los problemas de adherencia o intolerancia, entre otras, antes de definir un cambio en la conducta terapéutica. Recomendación condicional a favor, consenso de expertos. | 17 |
| Recomendación 12En caso de intolerancia gastrointestinal a los bifosfonatos orales, se recomienda cambiar a un bifosfonato intravenoso (ácido zoledrónico). En caso de eventos adversos serios infrecuentes como uveítis, osteonecrosis de mandíbula y fractura atípica, se recomienda cambiar a otro grupo terapéutico. Recomendación condicional a favor, calidad de la evidencia baja. | 17 |
| Recomendación 13En caso de falla terapéutica a los bifosfonatos, se recomienda cambiar la terapia a denosumab o a teriparatida. Recomendación condicional a favor, calidad de la evidencia baja. | 17 |
| Tratamiento de la OIG a largo plazo | |
| Recomendación 14En adultos con OIG que han recibido bifosfonatos (3 a 5 años), que siguen en riesgo moderado-alto de fractura y continúan con glucocorticoides, puede extenderse el tratamiento con bifosfonatos hasta el tiempo máximo indicado, o cambiarse a denosumab o teriparatida, según el criterio médico y las características del paciente. Recomendación condicional a favor, calidad de la evidencia muy baja.Punto de buena práctica: el tratamiento con alendronato o risedronato no debe prolongarse por más de 10 años; el tratamiento con ácido zoledrónico no debe administrarse por más de 6 años. | 18 |
| Recomendación 15En adultos de 40 años o más, con OIG en tratamiento, que suspenden definitivamente la terapia con glucocorticoides y se evalúan con riesgo bajo de fractura, se recomienda suspender el medicamento para la osteoporosis, pero continuar con el calcio y la vitamina D. Recomendación condicional a favor, calidad de la evidencia muy baja. | 19 |
| Recomendación 16En adultos de 40 años o más, con OIG en tratamiento, que suspenden definitivamente la terapia con glucocorticoides y se evalúan con riesgo moderado a alto de fractura, se recomienda continuar el medicamento para la osteoporosis, además del calcio y la vitamina D. Recomendación condicional a favor, consenso de expertos. | 20 |
≥ 35 mL/min para ácido zoledrónico.
DMO: densidad mineral ósea; DXA: absorciometría con rayos X de doble energía; FRAX: instrumento para el cálculo del riesgo de fracturas por fragilidad ósea20; OIG: osteoporosis inducida por glucocorticoides; PICO: PICO: pregunta de investigación en formato P: población I: intervención C: comparador O: desenlaces (del inglés outcome); TBS: trabecular bone score.
Algoritmo para la prevención, la evaluación y el manejo de la osteoporosis inducida por glucocorticoides en adultos.
*O dosis equivalentes.
**Dosis inicial ≥ 30 mg de prednisolona por más de 3 meses o dosis acumulada > 5 g en un año, o su equivalente.
****Paraclínicos previamente al inicio de la terapia: glucosa, función renal y tiroidea y otros, según las comorbilidades y el estado general.
Bifosfonato IV: ácido zoledrónico; Bifosfonato oral: alendronato, risedronato; DXA: absorciometría con rayos X de doble energía; EA: eventos adversos; FRAX: instrumento para el cálculo del riesgo de fracturas por fragilidad ósea; GC: glucocorticoides; IV: intravenoso.
Recomendación 1
En adultos que tomen prednisolona durante más de 3 meses en dosis ≥ 2,5 mg/día, o su equivalente, se recomienda optimizar la ingesta de calcio y vitamina D junto con modificaciones del estilo de vida.
Recomendación condicional a favor, calidad de la evidencia baja.
Punto de buena práctica: la dosificación de vitamina D (mínimo 800 UI/día) debe ajustarse hasta lograr unas concentraciones séricas de 30-50 ng/mL, y la dosificación de calcio debe ajustarse hasta lograr los 1.200-1.500 mg/día de ingesta de calcio elemental, teniendo en cuenta la ingesta dietaria y la tolerancia del paciente a la suplementación.
Recomendación 2
En adultos de 30 años o más que reciban tratamiento con glucocorticoides en dosis muy altas (dosis inicial ≥ 30 mg de prednisolona por más de 3 meses o dosis acumulada > 5 g en un año, o su equivalente), se recomienda administrar bifosfonato oral (alendronato o risedronato), junto con calcio y vitamina D.
Recomendación condicional a favor, calidad de la evidencia baja.
Punto de buena práctica: la decisión terapéutica debe considerar los factores de riesgo y las comorbilidades. En mujeres en edad reproductiva que van a recibir bifosfonatos, debe garantizarse un método de anticoncepción seguro.
Un estudio de cohorte19, que incluyó a 244.235 usuarios de corticosteroides orales y 244.235 de control, demostró el aumento del riesgo de fracturas, principalmente vertebral y de cadera, durante la terapia con glucocorticoides en relación con la dosis (tasa de incidencia de fracturas [RR]: 1,44; intervalo de confianza [IC] 95%: 1,34-1,54). En adultos que reciben dosis muy altas de glucocorticoides, los ensayos clínicos con seguimiento a 6 y 36 meses mostraron que la suplementación con calcio y vitamina D no presentó diferencias significativas en términos de fractura vertebral o no vertebral, en comparación con la no suplementación21,22.
Un metaanálisis en red23 (16 ensayos clínicos aleatorizados [ECA]) investigó el efecto de la vitamina D o del calcio en el aumento de la densidad mineral ósea (DMO) en 1.073 adultos sometidos a terapia con glucocorticoides. Se encontró que el alfacalcidol más calcio y el calcitriol más calcio produjeron el mayor aumento porcentual en la DMO de la columna lumbar y del cuello femoral, respectivamente, en comparación con ningún tratamiento. Las medidas de efecto no fueron estadísticamente significativas, al igual que los datos limitados disponibles para desenlaces de fractura vertebral21,22.
Por otra parte, la evidencia de adicionar bifosfonato a calcio y vitamina D en adultos que reciben terapia con glucocorticoides en muy altas dosis se resumió en 2 metaanálisis24,25, que reportaron una reducción del riesgo a 24 meses en fractura vertebral en población con OIG. El alendronato mostró mantenimiento de la DMO y disminución del riesgo de fractura hasta por 24 meses26–30. En un estudio de cohorte, basado en registros de más de tres millones de pacientes, el alendronato redujo significativamente el riesgo de fractura de cadera y fractura no vertebral31. En población que recibió altas dosis de esteroides, dos ECA con risedronato mostraron reducción del riesgo de fracturas vertebrales en comparación con calcio y vitamina D solos32,33. La certeza de la evidencia de los bifosfonatos en la prevención de la OIG es de calidad baja a moderada, y en algunas de las medidas de efecto reportadas las diferencias numéricas no resultaron estadísticamente significativas. Los seguimientos hasta 36 meses no reportaron diferencias en los eventos adversos por bifosfonatos en comparación con el calcio y la vitamina D solos24,25.
La evidencia disponible para los bifosfonatos intravenosos en la población general con osteoporosis34–36 muestra una reducción significativa del riesgo de fracturas vertebrales y no vertebrales. En pacientes que reciben glucocorticoides, un ECA37 mostró que el ácido zoledrónico no fue inferior al risedronato oral en el aumento de la DMO de columna lumbar a los 12 meses, aunque se presentaron mayores eventos adversos en el grupo que recibió bifosfonato intravenoso.
La administración de teriparatida fue abordada por 2 metaanálisis24,25 en una población que recibió altas dosis de esteroides y seguimientos hasta 36 meses, los cuales mostraron una reducción en el riesgo de fracturas vertebrales y no vertebrales, en comparación con el calcio y la vitamina D. Del mismo modo, los seguimientos hasta 36 meses mostraron una reducción en el riesgo de fracturas vertebrales en comparación con el bifosfonato oral (baja calidad de la evidencia)38,39.
Por su parte, un metaanálisis25 que analizó la asociación de denosumab al calcio y a la vitamina D mostró una reducción significativa del riesgo de fractura no vertebral en una población que recibió altas dosis de esteroides. Ningún estudio abordó la comparación de denosumab con bifosfonatos o teriparatida en esta población de pacientes.
Discusión del panelAunque se ha demostrado que hay afectación ósea y aumento del riesgo de fractura con las diferentes dosis de prednisolona, particularmente con las dosis mayores de 7,5 mg/día, los pacientes que reciben glucocorticoides sistémicos también tienen diferentes factores de riesgo de osteoporosis y predisponentes de fracturas osteoporóticas, por lo que se requiere una evaluación individualizada de los riesgos, con independencia de las dosis administradas de glucocorticoides.
La evidencia expone la necesidad de administrar tratamientos preventivos contra la pérdida ósea en pacientes de alto riesgo, y el panel hace precisiones con respecto a los ajustes de la dosis de vitamina D para asegurar la ingesta adecuada de calcio, teniendo en cuenta la ingesta dietaria y la tolerancia del paciente a la suplementación.
Diagnóstico y evaluación del riesgoRecomendación 3
En adultos que tomen prednisolona durante más de 3 meses, en dosis ≥ 2,5 mg/día, o su equivalente, se recomienda realizar densitometría ósea (DXA) y evaluar la presencia de fractura vertebral.
Recomendación fuerte a favor, calidad de la evidencia baja.
Punto de buena práctica: profundizar en el diagnóstico y el estado de salud general del paciente mediante paraclínicos antes del inicio de terapia, que incluyan glucosa, función renal y función tiroidea.
Recomendación 4
En adultos menores de 40 años se recomienda clasificar el riesgo de acuerdo con la presencia de fractura por fragilidad o la evaluación de la densidad mineral ósea (puntaje Z). Se recomienda seguimiento anual.
Recomendación fuerte a favor, calidad de la evidencia baja.
Recomendación 5
En adultos de 40 años o más se recomienda la evaluación del riesgo de acuerdo con la presencia de fractura por fragilidad o la evaluación de la densidad mineral ósea (puntaje T) y del riesgo de fractura mediante el instrumento para el cálculo del riesgo de fracturas por fragilidad ósea (FRAX). En caso de estar disponible, realizar también Trabecular Bone Score (TBS). Se recomienda seguimiento densitométrico anual. Recomendación fuerte a favor, calidad de la evidencia baja.
Punto de buena práctica: realizar la evaluación del riesgo de caídas y factores asociados (relacionados con el paciente y ambientales) e implementar medidas para su prevención.
En un estudio observacional40, que incluyó a 127 pacientes en tratamiento con glucocorticoides (tiempo promedio de uso de 47,7 meses; dosis diaria promedio de 14,5 mg/día), 17% presentaba fractura vertebral, 28% cualquier tipo de fractura por fragilidad (vertebral y no vertebral), 29% osteoporosis y 52% microarquitectura degradada. Para la fractura por fragilidad, el TBS fue más sensible y menos específico que la densitometría ósea, con valores predictivos mínimamente mejores. De igual manera, el TBS tuvo una mejor capacidad que la evaluación de la DMO para discriminar entre los pacientes con fractura, especialmente fractura vertebral. La especificidad para fractura vertebral y para cualquier fractura por fragilidad mejoró al combinar la DMO con el TBS. Similares resultados se reportaron en otro estudio observacional41 en 416 hombres y mujeres de 40 años o más, donde el TBS fue más sensible que la evaluación de la DMO para detectar fracturas asociadas al uso de glucocorticoides.
Otros estudios observacionales42–44 han reportado un aumento del riesgo de alteraciones óseas y fractura en usuarios de glucocorticoides, así como el valor de la evaluación del riesgo de fractura mediante el instrumento para el cálculo del riesgo de fracturas por fragilidad ósea, FRAX, y de la densidad ósea mediante absorciometría con rayos X de doble energía (DXA) en la evaluación de esta población de pacientes.
Discusión del panelEl panel destaca la necesidad de una valoración clínica adecuada y completa en todos los pacientes que reciban, o vayan a recibir, tratamiento con glucocorticoides de forma prolongada (3 meses o más). Deberán indagarse las características de la corticoterapia, los antecedentes y las comorbilidades y realizarse la valoración clínica de otros riesgos de osteoporosis y de fracturas. Del mismo modo, en estos pacientes deben evaluarse los riesgos de caídas, por ejemplo, la historia de más de 2 caídas al año, los factores físicos (como la sarcopenia) y los factores ambientales (barreras, mala iluminación), e implementarse las acciones indicadas que mitiguen estos riesgos, según el caso específico.
Los estudios de laboratorio deben contemplar el riesgo metabólico aumentado en estos pacientes y las mediciones del perfil fosfocálcico, además de los estudios requeridos, que deben quedar a criterio del médico tratante, de acuerdo con las condiciones clínicas de cada paciente. La evaluación de la DMO por DXA y el FRAX han sido validados en estudios en vida real y se recomiendan actualmente desde el inicio del tratamiento45. El TBS puede ser útil como apoyo en la evaluación de los pacientes con sospecha de OIG, aunque está sujeto a la disponibilidad en el país.
Tratamiento de OIGRecomendación 6
En adultos con OIG y bajo riesgo de fractura, se recomienda tratar con calcio y vitamina D, además de las modificaciones en el estilo de vida.
Recomendación fuerte a favor, calidad de la evidencia baja.
Recomendación 7
En los adultos menores de 40 años con OIG y riesgo moderado a alto de fractura, se recomienda tratar con bifosfonatos orales (alendronato o risedronato), calcio y vitamina D. En caso de contraindicación a los bifosfonatos orales, otras terapias, en orden de preferencia, son:
Riesgo moderado: bifosfonato intravenoso (ácido zoledrónico), teriparatida y denosumab.
Alto riesgo: teriparatida.
Recomendación condicional a favor, calidad de la evidencia baja.
Recomendación 8
En adultos de 40 años o más, con OIG y riesgo moderado a alto de fractura, se recomienda tratar con bifosfonatos orales (alendronato o risedronato). En caso de contraindicación a bifosfonatos orales, otras terapias, en orden de preferencia, son: bifosfonato intravenoso (ácido zoledrónico), teriparatida y denosumab.
Recomendación fuerte a favor de los bifosfonatos orales, condicional para otras terapias, calidad de la evidencia baja.
En pacientes con OIG que continúan tratamiento crónico con glucocorticoides orales y no tienen factores de alto riesgo, los ECA disponibles no reportan diferencias significativas en la incidencia de fracturas por fragilidad en aquellos tratados con bifosfonato oral en comparación con quienes recibieron vitamina D y calcio solos26–30,32,33,46–48.
No se identificaron estudios que evaluaran directamente intervenciones, tales como el bifosfonato intravenoso, la teriparatida o el denosumab en pacientes con OIG y bajo riesgo. En población general con osteoporosis, los bifosfonatos intravenosos han reportado mínimas diferencias en la reducción de fractura vertebral y no vertebral en comparación con el calcio y la vitamina D solos34–36. Para la teriparatida asociada al calcio y la vitamina D, la evidencia indirecta, que incluye un metaanálisis con más de 4.000 pacientes, mostró una reducción significativa del riesgo de fractura vertebral y no vertebral34–36,49–51. Por su parte, el denosumab mostró, en evidencia indirecta, reducciones en la incidencia de fractura de cadera y fractura vertebral34,35,52,53. Todas estas comparaciones constituyen evidencia indirecta proveniente de poblaciones de pacientes diferentes y deben interpretarse a la luz de las consideraciones de seguridad de las intervenciones para hacer un adecuado balance riesgo-beneficio.
Resumen de la evidencia en OIG y alto riesgoEl cuerpo global de la evidencia de la comparación de bifosfonatos orales con vitamina D y calcio es de baja calidad. En general, los bifosfonatos aumentan la densidad ósea en pacientes que reciben tratamiento con glucocorticoides, con hallazgos de reducción del riesgo de fracturas de cadera, vertebrales y no vertebrales en comparación con el calcio y la vitamina D solos, a 12 y 24 meses de seguimiento, y sin diferencias en cuanto a los eventos adversos entre las comparaciones24,27–30,32,33,46,47. La administración de bifosfonato intravenoso fue evaluada en un metaanálisis24 de múltiples tratamientos, en el que se evidenció una reducción del riesgo de fractura vertebral en comparación con la administración de calcio y vitamina D solos. Dos ensayos clínicos adicionales reportaron efectos adversos comparables con los bifosfonatos orales24,37,48.
Dos metaanálisis recientes, que evaluaron las intervenciones farmacológicas en OIG23,24, mostraron una reducción de las fracturas vertebrales y no vertebrales con el tratamiento con teriparatida a los 12 y 36 meses, en comparación con el tratamiento con calcio y vitamina D solos. Tres ECA de comparación con alendronato reportaron un mayor aumento de la DMO con la teriparatida, con menor riesgo de fracturas vertebrales hasta por 36 meses38,39,54.
En los metaanálisis referidos23,24, denosumab mostró una reducción de las fracturas vertebrales a los 12 y a los 36 meses, en comparación con el calcio y la vitamina D solos. La comparación con bifosfonatos mostró superioridad del denosumab en términos de aumento de la DMO de la columna y la cadera a los 24 meses, con un perfil de seguridad similar entre los grupos de tratamiento55,56. En pacientes que recibieron glucocorticoides por más de 12 meses, un estudio abierto mostró un aumento estadísticamente significativo de la DMO de la columna lumbar en el grupo de tratamiento con denosumab en comparación con el grupo que recibió bifosfonato oral más calcio y vitamina D, sin diferencias en cuanto a las fracturas de cadera o del cuello del fémur57.
Un estudio observacional de cohorte, que incluyó a 66 pacientes, reportó un aumento significativo de la DMO a los seis y a los 12 meses, incluso en pacientes con tratamiento previo con bifosfonatos o teriparatida, sin eventos adversos serios58. Con base en la evidencia, en la actualidad se recomienda el denosumab como una alternativa de tratamiento en pacientes de alto riesgo con uso crónico de esteroides o en quienes presentan intolerancia o contraindicación a los bifosfonatos orales.
Discusión del panelLos bifosfonatos orales tienen la mejor evidencia disponible y experiencia de uso en pacientes con OIG, y se consideran efectivos tanto en la prevención como en el tratamiento de la OIG, con capacidad de aumentar la DMO en la columna y en la cadera, y administrados en asociación con la suplementación adecuada de calcio y vitamina D. Estas y otras intervenciones con evidencia, como el ácido zoledrónico, la teriparatida y el denosumab deben considerar, en todos los casos, la seguridad según el perfil de cada paciente, para hacer un adecuado balance riesgo-beneficio. En mujeres premenopáusicas, la indicación de bifosfonatos debe acompañarse con el uso de medidas anticonceptivas u optar por otros tratamientos si se desea la concepción, debido al riesgo potencial para el feto durante o después de su administración59.
Adicionalmente, las preferencias del paciente son importantes en la selección terapéutica, donde debe favorecerse la mayor adherencia al tratamiento, junto con una adecuada información acerca de la administración y los efectos secundarios de las terapias.
Tratamiento de la OIG en situaciones especialesRecomendación 9
En las mujeres con OIG que desean quedar en embarazo, están embarazadas o en lactancia y tienen alto riesgo de fractura, se recomienda el uso de calcio y vitamina D. Se debe reevaluar el riesgo una vez terminada la gestación y el período de lactancia, para determinar el tratamiento que debe seguirse.
Recomendación condicional a favor, calidad de la evidencia muy baja.
Punto de buena práctica: en caso de fractura durante el periodo de lactancia, deberá establecerse si se prioriza el tratamiento farmacológico.
Los datos publicados con respecto a la administración de los bifosfonatos en mujeres en edad fértil y sus efectos sobre el resultado del embarazo son limitados. No se identificó ningún estudio prospectivo que evaluara esta exposición en el embarazo. Un resumen de la evidencia60 incluyó reportes de caso y series de casos con 40 mujeres que recibieron bifosfonatos previamente o durante el embarazo, en todas indicados para condiciones graves del metabolismo óseo. No se informaron efectos adversos graves en las mujeres que completaron el embarazo, y en los neonatos se identificó hipocalcemia transitoria. Las tasas de complicaciones neonatales y abortos espontáneos fueron mayores en las pacientes con enfermedades sistémicas y enfermedades óseas, en probable relación con la gravedad de estas y los medicamentos concomitantes. Si se produce un embarazo mientras una mujer recibe bifosfonatos, en la actualidad no hay indicios para interrumpir la gestación61.
Discusión del panelLa evidencia de la administración de bifosfonatos durante el embarazo o la lactancia es de muy baja calidad y el seguimiento en estos estudios es limitado, lo cual debe considerarse en su interpretación. Con la información disponible, el panel considera razonable tener especial precaución con la administración de bifosfonatos en mujeres en edad reproductiva y optar por otros medios de protección ósea. Se destaca la importancia de reevaluar el riesgo de luxofractura de cóccix en esta población y determinar el inicio del tratamiento antiosteoporótico en caso de fractura.
Recomendación 10
En adultos con OIG, con trasplante de órganos, tasa de filtración glomerular ≥ 30 mL/min* y sin evidencia de enfermedad adinámica del hueso, que continúan el tratamiento con glucocorticoides, se recomienda tratar igual que los adultos sin trasplantes.
Recomendación condicional a favor, calidad de la evidencia baja.
* ≥ 35 mL/min para el ácido zoledrónico.
Punto de buena práctica: todos los pacientes con trasplante renal deben ser evaluados por un especialista en enfermedades metabólicas óseas.
Un ensayo clínico aleatorizado62, prospectivo, en un solo centro, comparó la eficacia y la seguridad del denosumab y del alendronato en 32 pacientes con OIG, enfermedad glomerular y uso crónico de glucocorticoides. Todos los pacientes disminuyeron notablemente las concentraciones séricas de los marcadores de remodelado óseo a los 12 meses, en comparación con los valores iniciales, pero sin diferencias significativas entre los grupos que recibieron cada tratamiento evaluado. El tratamiento con denosumab produjo un aumento significativamente mayor en la DMO de la columna lumbar en comparación con el tratamiento con alendronato (p < 0,05).
Discusión del panelEl panel discute acerca de los límites de la tasa de filtración glomerular (30-35 mL/min) para la administración de medicamentos en OIG. En este sentido, deberán tenerse en cuenta las especificaciones farmacéuticas de los productos al momento de la prescripción (inserto de los productos). Los pacientes con trasplante de órgano y corticoterapia constituyen un reto clínico en el manejo; en este escenario, el apoyo de un especialista en enfermedades metabólicas óseas podrá orientar de mejor manera el abordaje de estos pacientes.
Falta de respuesta terapéutica en OIGRecomendación 11
En caso de falta de respuesta a los bifosfonatos orales, se recomienda evaluar las causas, como la suplencia inadecuada de calcio y vitamina D, los problemas de adherencia o intolerancia, entre otros, antes de definir un cambio en la conducta terapéutica.
Recomendación condicional a favor, consenso de expertos.
Recomendación 12
En caso de intolerancia gastrointestinal a los bifosfonatos orales, se recomienda cambiar a un bifosfonato intravenoso (ácido zoledrónico). Si se presentan eventos adversos serios infrecuentes, como uveítis, osteonecrosis de mandíbula y fractura atípica, se recomienda cambiar a otro grupo terapéutico.
Recomendación condicional a favor, calidad de la evidencia baja.
Recomendación 13
En caso de falla terapéutica a los bifosfonatos, se recomienda cambiar la terapia a denosumab o teriparatida.
Recomendación condicional a favor, calidad de la evidencia baja.
Un ECA63 evaluó el efecto del cambio de bifosfonatos orales a denosumab en usuarios de glucocorticoides a largo plazo. En el mes 12, la DMO de la columna vertebral y de la cadera aumentó en el grupo que cambió a denosumab, mientras que no se observó un cambio significativo en el grupo que continuó con bifosfonatos orales. El denosumab mostró una mayor reducción en los marcadores de recambio óseo, con mayor frecuencia de infecciones menores.
Como evidencia de vida real, en el estudio de Iwamoto et al.58, denosumab fue efectivo y seguro para el tratamiento de los pacientes con OIG, con independencia del tratamiento farmacológico antiosteoporótico previo. Por su parte, un estudio prospectivo64 del tratamiento con denosumab y teriparatida en pacientes con OIG y previa administración de bifosfonatos mostró un aumento significativo de la DMO de la columna lumbar en los dos grupos a los 24 meses con respecto a sus valores iniciales. No se produjeron cambios significativos en la DMO de la cadera en ninguno de los grupos y la DMO del cuello femoral aumentó significativamente solo en el grupo tratado con teriparatida.
Un metaanálisis en red24 comparó varias intervenciones en una población previamente tratada o no con bifosfonatos orales. Se observó una reducción significativa en el riesgo de fractura vertebral con la teriparatida y el denosumab en comparación con placebo, y con la teriparatida en comparación con el alendronato.
Discusión del panelEl panel reitera la importancia de las intervenciones no farmacológicas hacia estilos de vida saludables y la suplencia adecuada de calcio y vitamina D en pacientes con OIG, con independencia de los tratamientos complementarios necesarios. Las decisiones de modificación de la terapia deben estar siempre precedidas de una evaluación de las causas y una verificación de la adherencia. Del mismo modo, es importante un exhaustivo conocimiento de los posibles efectos adversos del uso de los tratamientos, por ejemplo, intolerancia gástrica, osteonecrosis de la mandíbula, uveítis, entre otros, para identificarlos tempranamente e intervenirlos de forma adecuada cuando sea necesario (por ejemplo, en casos de hipocalcemia no se requiere cambio de medicamento).
Tratamiento de la OIG a largo plazoRecomendación 14
En adultos con OIG que han recibido bifosfonatos (3 a 5 años), que siguen en riesgo moderado-alto de fractura y continúan con glucocorticoides, puede extenderse el tratamiento con bifosfonatos hasta el tiempo máximo indicado o cambiarse a denosumab o teriparatida, según el criterio médico y las características del paciente.
Recomendación condicional a favor, calidad de la evidencia muy baja.
Punto de buena práctica: el tratamiento con alendronato o risedronato no debe prolongarse por más de 10 años; el tratamiento con ácido zoledrónico no se debe extender por más de 6 años.
Recomendación 15
En adultos de 40 años o más, con OIG en tratamiento, que suspenden definitivamente la terapia con glucocorticoides y se evalúan con riesgo bajo de fractura, se recomienda suspender el medicamento para osteoporosis, pero continuar con el calcio y la vitamina D.
Recomendación condicional a favor, calidad de la evidencia muy baja.
Recomendación 16
En adultos de 40 años o más, con OIG en tratamiento, que suspenden definitivamente la terapia con glucocorticoides y se evalúan con riesgo moderado a alto de fractura, se recomienda continuar el medicamento para osteoporosis además del calcio y la vitamina D.
Recomendación condicional a favor, consenso de expertos.
Múltiples estudios basados en población han demostrado la rápida disminución del riesgo después de suspender la exposición a los glucocorticoides65–68. Un estudio estadounidense, que incluyó a cerca de 289.000 pacientes con afecciones crónicas y que recibían glucocorticoides, demostró una disminución del riesgo de fractura de 27% a los 60 días sin tratamiento, hasta 35% después de un año33. En pacientes que recibían glucocorticoides en una dosis diaria mayor de 15 mg se observó una rápida disminución en el riesgo de fracturas a los 3 meses después de la interrupción. Aquellos que recibían una dosis diaria menor de 15 mg no tenían exceso de riesgo más allá de los 9 meses después de su última dosis.
Discusión del panelLa evidencia con respecto al tratamiento de la OIG a largo plazo es escasa. Teniendo en cuenta la evidencia de la reversibilidad de los efectos de los glucocorticoides en el hueso, todas las guías de práctica clínica sugieren que el medicamento para la osteoporosis puede interrumpirse después de que se suspendan los glucocorticoides. Las recomendaciones que se construyeron y aprobaron en este tema constituyen consenso de expertos con base en el conocimiento de los medicamentos, la experiencia práctica y la opinión documentada de grupos de expertos internacionales.
Aplicabilidad, difusión e implementaciónEsta guía, realizada por la Asociación Colombiana de Reumatología (ASOREUMA), proporciona una orientación para la toma de decisiones de los profesionales de la salud encargados del cuidado de los pacientes con OIG en Colombia. Las recomendaciones se construyeron teniendo en cuenta el contexto socioeconómico y el sistema de salud, a partir de la evidencia más reciente con respecto a la prevención, el diagnóstico y el tratamiento de la OIG. La participación de un grupo multidisciplinario de expertos clínicos con experiencia en la atención y el manejo de la patología permitió generar recomendaciones aplicables a la práctica de la atención en salud en el país.
El abordaje desde la prevención de la osteoporosis en usuarios de glucocorticoides espera aumentar la visibilidad de este riesgo potencial en la atención médica de las diferentes enfermedades y en todos los ámbitos de la atención en salud. Se promueve el uso racional de la terapia con glucocorticoides, con la prescripción de la menor dosis efectiva para el control de la enfermedad durante el menor tiempo posible, y la consideración de vías alternas de administración, según el caso (por ejemplo, inhalados en el asma, glucocorticoides intraarticulares en ciertas enfermedades con compromiso inflamatorio articular, entre otros)69.
Las recomendaciones sobre la evaluación de la densidad ósea se basan en el supuesto de la disponibilidad en la región; sin embargo, se insiste en la necesidad de superar las barreras de acceso y oportunidad para facilitar el uso de las imágenes de apoyo para la toma de decisiones clínicas. Se incluyen igualmente orientaciones para la evaluación del riesgo de fracturas durante la corticoterapia, donde es importante considerar las limitaciones de instrumentos como el FRAX70,71 para su adecuado uso en la evaluación del riesgo de fractura en los pacientes.
Las preferencias con respecto a la recomendación de los tratamientos en los diferentes escenarios se basaron en la evaluación de la eficacia antifractura, los potenciales efectos adversos y el análisis de disponibilidad y costo realizado por los expertos del grupo desarrollador. De este modo, los bifosfonatos orales están recomendados en la mayoría de las situaciones clínicas en las cuales el riesgo de fractura es considerable, de acuerdo con las recomendaciones internacionales vigentes72. En caso de contraindicación, intolerancia o problemas de adherencia al tratamiento, se recomiendan otras opciones, de acuerdo con el balance riesgo-beneficio y con las características individuales de los pacientes. La adherencia a las terapias en OIG puede constituir una barrera de implementación de las recomendaciones, que puede ser intervenida con adecuados programas de educación al paciente, los cuales aborden sus creencias y preferencias73,74.
Existen algunas limitaciones en estas recomendaciones. La mayoría de la evidencia sobre las intervenciones de la OIG es de baja certeza (baja calidad de los estudios o evidencia disponible indirecta), y en otros casos no existe evidencia específica en OIG, por lo que la mayoría de las recomendaciones de esta guía son condicionales. En este contexto, además del conocimiento clínico amplio acerca de los riesgos y los beneficios de los tratamientos, tienen especial interés las perspectivas de los pacientes.
Con respecto al impacto potencial de esta guía sobre el uso de los recursos, aunque no se hicieron estudios económicos para determinar la relación costo-efectividad de las intervenciones en el contexto del país, en general, se considera que estas no exigen un uso de recursos adicionales a los ya dispuestos por los planes y beneficios en salud. Estas recomendaciones constituyen una orientación sobre la generalidad de los casos de los pacientes en riesgo o con OIG, y se insiste en la necesidad de una evaluación individualizada que tenga en cuenta los diferentes factores que alimentan el juicio clínico para la toma de decisiones compartida.
Optimizar la salud ósea en estos pacientes puede ser un desafío para cualquier médico asistencial, por lo que se promueve fuertemente el apoyo multidisciplinario y la atención integral. Los glucocorticoides son ampliamente formulados por médicos generales y diferentes especialidades, por lo que esta guía debe ser socializada al personal sanitario en todos los niveles de atención y junto con los entes gubernamentales correspondientes y las administradoras en salud, para garantizar los elementos necesarios que permitan llevar a la práctica las intervenciones indicadas para los pacientes en riesgo o con OIG establecida.
La diseminación de esta guía se hará por medio de la publicación en la Revista Colombiana de Reumatología, órgano oficial de ASOREUMA, mediante acceso libre, y la socialización en los eventos académicos respaldados por la asociación.
ConclusiónLos problemas asociados al uso prolongado de los glucocorticoides deben ser considerados en todos los pacientes que reciben estas terapias, para abordar adecuada y oportunamente el alto riesgo de osteoporosis y fractura osteoporótica. La evaluación del riesgo de fractura debe realizarse desde el inicio en pacientes en quienes se estima probable el uso de corticoterapia por 3 meses o más, mediante valoración clínica y de laboratorio, densitometría ósea y puntaje FRAX. Las intervenciones primarias incluyen estilos de vida saludables y suplementación adecuada de calcio y vitamina D. Otros fármacos, recomendados en el contexto de moderado y alto riesgo de fractura, deben considerarse a la luz de las circunstancias clínicas individuales y las perspectivas/preferencias de los pacientes.
Financiación e independencia editorialEsta GPC fue desarrollada en su totalidad por la Asociación Colombiana de Reumatología (ASOREUMA), que recibió apoyo financiero por parte de Eli Lilly y Farma de Colombia. Sin embargo, ASOREUMA desarrolló esta GPC de manera independiente y los financiadores no participaron de forma alguna en el desarrollo y el contenido de la guía, ni en las recomendaciones finales.
Conflicto de interesesTodos los participantes de esta GPC declararon sus intereses relacionados con el desarrollo y ninguno de ellos presentó un conflicto de interés (véase material suplementario 1).
Expertos temáticos: Miguel Ángel González, Adriana Medina Ojeda, Christian Colón, Carlos Pérez Niño, Juan José Jaller, Diana Rocío Gil Calderón, Tomás Caicedo, Lina María Saldarriaga, Yimy Medina.
Representante de los pacientes: María Mercedes Rueda (QEPD), Fundación Colombiana de Apoyo al Reumático (Fundare).