La biopsia de glándulas salivales es el estándar por excelencia para el diagnóstico del síndrome de Sjögren. Existen varias aproximaciones para su realización, siendo utilizado de forma general un abordaje por la mucosa con empleo de diversos instrumentos e incisiones que varían en su longitud, pasando por biopsia por trucut hasta raspado con aguja.
ObjetivoEvaluar el rendimiento, complicaciones y sistemas de reporte histològico de de la biopsia de glandula salival menor realizada con una tènica minimamente invasiva.
Materiales y métodosSe llevó a cabo un estudio descriptivo que incluyó a pacientes adultos sometidos a biopsia de glándulas salivales entre 2017 y 2022. Se utilizaron historias clínicas e informes de biopsia de glándula salival para recopilar información y se registraron en la plataforma Magpi. Se catalogaron variables sociodemográficas, clínicas e histopatológicas. Las cualitativas se expresaron en frecuencias absolutas y relativas; las cuantitativas por mediana y rango intercuartílico. Se incluyeron 72 biopsias.
ResultadosEn cuanto a las características demográficas, 87,5% de los pacientes eran mujeres, con una edad media de 52. Las características de las biopsias mostraron que 70 (97,2%) de estas correspondían a una muestra representativa. Un total de 27 biopsias (38,5%) mostraron infiltración linfocítica y reportaron un sistema de clasificación, de los cuales el más utilizado fue el de Chisholm-Mason, empleado en 18 de estas (66,6%). Hubo complicaciones en cuatro pacientes (5,7%).
ConclusionesA pesar de la recomendación de utilizar el Focus Score (FS) como criterio de clasificación, el sistema de Chisholm-Mason sigue siendo el de más uso. La presente técnica es segura y eficaz para la realización de biopsias de glándulas salivales menores.
Salivary gland biopsy is the gold standard for the diagnosis of Sjogren's syndrome. There are several approaches for the realization of the biopsy, being generally used an approach to the mucosa with the use of various instruments and incisions that vary in its length, passing through trucut biopsy to scraping with needle.
ObjectiveEvaluate the performance, complications and histological report systems of the minor salivary gland biopsy with a minimally invasive technique.
Materials and methodsWe conducted a descriptive study that included adult patients undergoing salivary gland biopsy between 2017-2022. Medical records and salivary gland biopsy reports were used to collect information and registered in the Magpi platform. Sociodemographic, clinical, and histopathological variables were recorded. The qualitative variables were expressed in absolute and relative frequencies; the quantitative ones were by median and interquartile range. Seventy-two biopsies were included.
ResultsRegarding demographic characteristics, 87,5% were women with a median age of 52 years. The biopsy characteristics showed that 70 (97,2%) corresponded to a representative sample. Twenty-seven (38,5%) biopsies showed lymphocytic infiltration and reported a classification system, of which the most used one was the Chisholm Mason used in 18 (66,6%) of such biopsies. Complications were present in four (5,7%) patients.
ConclusionsDespite the recommendation of using Focus Score for classification criteria, the Chisholm Mason system is still the most widely used. The present technique is a safe and effective for the realization of minor salivary gland biopsy.
La biopsia de glándula salival menor (BGSMM) es uno de los pilares fundamentales para el diagnóstico de síndrome de Sjögren, ya que aporta evidencia histológica del proceso autoinmune. Por este motivo, es uno de los principales exámenes que, junto con la evidencia de anticuerpos anti-Ro, pertenecen a los criterios clasificatorios del Colegio Americano de Reumatología y la Liga Europea contra el Reumatismo (ACR/EULAR)1.
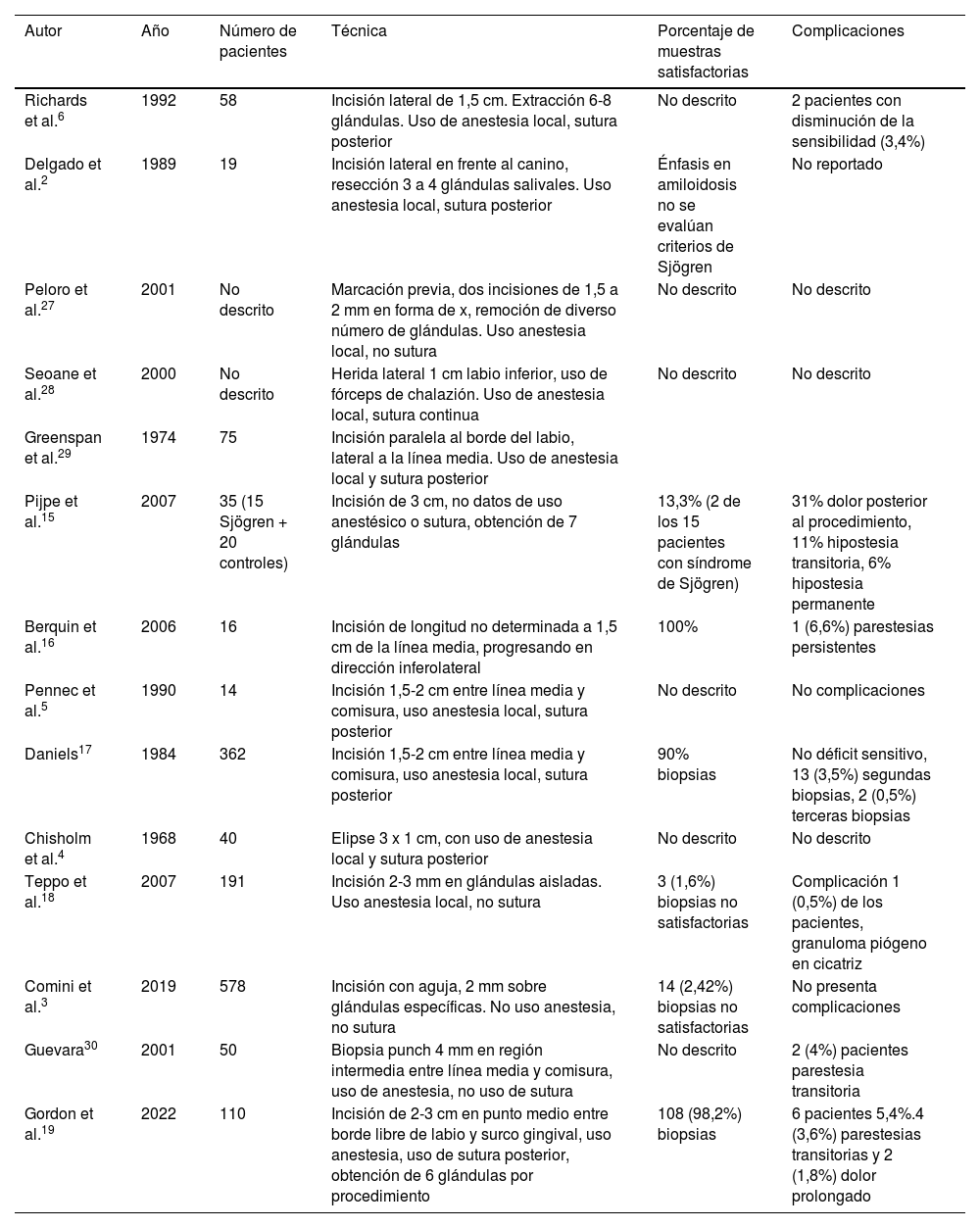
Desde el punto de vista técnico, existen varias aproximaciones para la realización de la biopsia. Normalmente, se utiliza un abordaje por la mucosa con empleo de diversos instrumentos e incisiones que varían en su longitud, pasando por biopsia por trucut hasta raspado con aguja (tabla 1)2–5. En términos generales, los reportes de las técnicas presentan una sensibilidad y especificidad mayor a 80%, aunque suelen carecer de estudios de validación externa. Desde el punto de vista de las complicaciones, estas varían según el tipo de técnica, pero se pueden resumir en infección, trastornos de la cicatrización y alteración de la sensibilidad tanto transitoria como permanente2,6.
Resumen de los principales estudios de técnica de biopsia de glándula salival
| Autor | Año | Número de pacientes | Técnica | Porcentaje de muestras satisfactorias | Complicaciones |
|---|---|---|---|---|---|
| Richards et al.6 | 1992 | 58 | Incisión lateral de 1,5 cm. Extracción 6-8 glándulas. Uso de anestesia local, sutura posterior | No descrito | 2 pacientes con disminución de la sensibilidad (3,4%) |
| Delgado et al.2 | 1989 | 19 | Incisión lateral en frente al canino, resección 3 a 4 glándulas salivales. Uso anestesia local, sutura posterior | Énfasis en amiloidosis no se evalúan criterios de Sjögren | No reportado |
| Peloro et al.27 | 2001 | No descrito | Marcación previa, dos incisiones de 1,5 a 2 mm en forma de x, remoción de diverso número de glándulas. Uso anestesia local, no sutura | No descrito | No descrito |
| Seoane et al.28 | 2000 | No descrito | Herida lateral 1 cm labio inferior, uso de fórceps de chalazión. Uso de anestesia local, sutura continua | No descrito | No descrito |
| Greenspan et al.29 | 1974 | 75 | Incisión paralela al borde del labio, lateral a la línea media. Uso de anestesia local y sutura posterior | ||
| Pijpe et al.15 | 2007 | 35 (15 Sjögren + 20 controles) | Incisión de 3 cm, no datos de uso anestésico o sutura, obtención de 7 glándulas | 13,3% (2 de los 15 pacientes con síndrome de Sjögren) | 31% dolor posterior al procedimiento, 11% hipostesia transitoria, 6% hipostesia permanente |
| Berquin et al.16 | 2006 | 16 | Incisión de longitud no determinada a 1,5 cm de la línea media, progresando en dirección inferolateral | 100% | 1 (6,6%) parestesias persistentes |
| Pennec et al.5 | 1990 | 14 | Incisión 1,5-2 cm entre línea media y comisura, uso anestesia local, sutura posterior | No descrito | No complicaciones |
| Daniels17 | 1984 | 362 | Incisión 1,5-2 cm entre línea media y comisura, uso anestesia local, sutura posterior | 90% biopsias | No déficit sensitivo, 13 (3,5%) segundas biopsias, 2 (0,5%) terceras biopsias |
| Chisholm et al.4 | 1968 | 40 | Elipse 3 x 1 cm, con uso de anestesia local y sutura posterior | No descrito | No descrito |
| Teppo et al.18 | 2007 | 191 | Incisión 2-3 mm en glándulas aisladas. Uso anestesia local, no sutura | 3 (1,6%) biopsias no satisfactorias | Complicación 1 (0,5%) de los pacientes, granuloma piógeno en cicatriz |
| Comini et al.3 | 2019 | 578 | Incisión con aguja, 2 mm sobre glándulas específicas. No uso anestesia, no sutura | 14 (2,42%) biopsias no satisfactorias | No presenta complicaciones |
| Guevara30 | 2001 | 50 | Biopsia punch 4 mm en región intermedia entre línea media y comisura, uso de anestesia, no uso de sutura | No descrito | 2 (4%) pacientes parestesia transitoria |
| Gordon et al.19 | 2022 | 110 | Incisión de 2-3 cm en punto medio entre borde libre de labio y surco gingival, uso anestesia, uso de sutura posterior, obtención de 6 glándulas por procedimiento | 108 (98,2%) biopsias | 6 pacientes 5,4%.4 (3,6%) parestesias transitorias y 2 (1,8%) dolor prolongado |
La interpretación de la biopsia fue descrita por primera vez por Chisholm et al.4, pero con el paso del tiempo se fueron implementando otros sistemas como el Focus Score (FS) y el Chisholm-Mason modificado, lo que ha llevado a una falta de uniformidad en los reportes de patología y diversidad en las clasificaciones utilizadas7. Ante esta situación, sociedades como EULAR han emitido guías en las cuales recomiendan el FS como la metodología de referencia al momento de evaluar la glándula salival para determinar la presencia de sialoadenitis linfocítica8. Brevemente, el reporte histológico puede clasificarse en histología normal, sialoadenitis crónica no específica, sialoadenitis linfocítica focal (SLF), sialoadenitis crónica esclerosante e inflamación granulomatosa; la SLF constituye el hallazgo característico del síndrome de Sjögren7.
La biopsia de glándula salival, además de ser un elemento diagnóstico en el síndrome de Sjögren, también se ha asociado con algunas manifestaciones de la enfermedad, como enfermedad pulmonar intersticial, compromiso hematológico e hipergammaglobulinemia9. La presencia de FS ≥ 1 ha sido útil para predecir los resultados adversos, tales como manifestaciones extraglandulares y el desarrollo de linfoma. Risselada et al. observaron que el FS ≥ 3 tiene un valor predictivo para el desarrollo de linfomas no Hodgkin10,11.
En el presente estudio, los integrantes del servicio de reumatología realizan el procedimiento de biopsia de glándula salival con un proceso mínimamente invasivo modificado de la técnica descrita por Delgado et al.12. Por este motivo, se quiso responder a tres preguntas: ¿qué tan efectiva es esta técnica para obtener material satisfactorio para análisis?, ¿qué tan frecuentes son sus complicaciones? y ¿cuáles son los principales sistemas de reporte histológicos utilizados en el medio?
MetodologíaSe llevó a cabo un estudio transversal descriptivo, en el cual se incluyeron pacientes mayores de 18 años, a quienes se les realizó una BGSM en el servicio de reumatología de dos instituciones en Medellín, Antioquia, que consultaron entre los años 2017 y 2020. Se excluyeron aquellos en quienes el reporte de la biopsia de glándula salival no estuvo disponible. Por motivos pragmáticos no se estimó tamaño muestral, sino que se incluyó la totalidad de quienes cumplieron los criterios del estudio durante el periodo establecido.
La información, que se obtuvo a partir de la revisión de historias clínicas y de resultados histopatológicos, se registró en un formato diseñado para tal fin en la herramienta Magpi versión 6.2.6. Las variables recolectadas fueron sociodemográficas (edad, sexo y lugar de residencia), clínicas (complicaciones del paciente: sangrado, segunda incisión, dolor local, síncope, infección en el sitio de la herida, edema, granulomas o hematomas), calidad de la muestra (si el patólogo la definió como satisfactoria o si fue representativa) y los hallazgos histológicos de la biopsia.
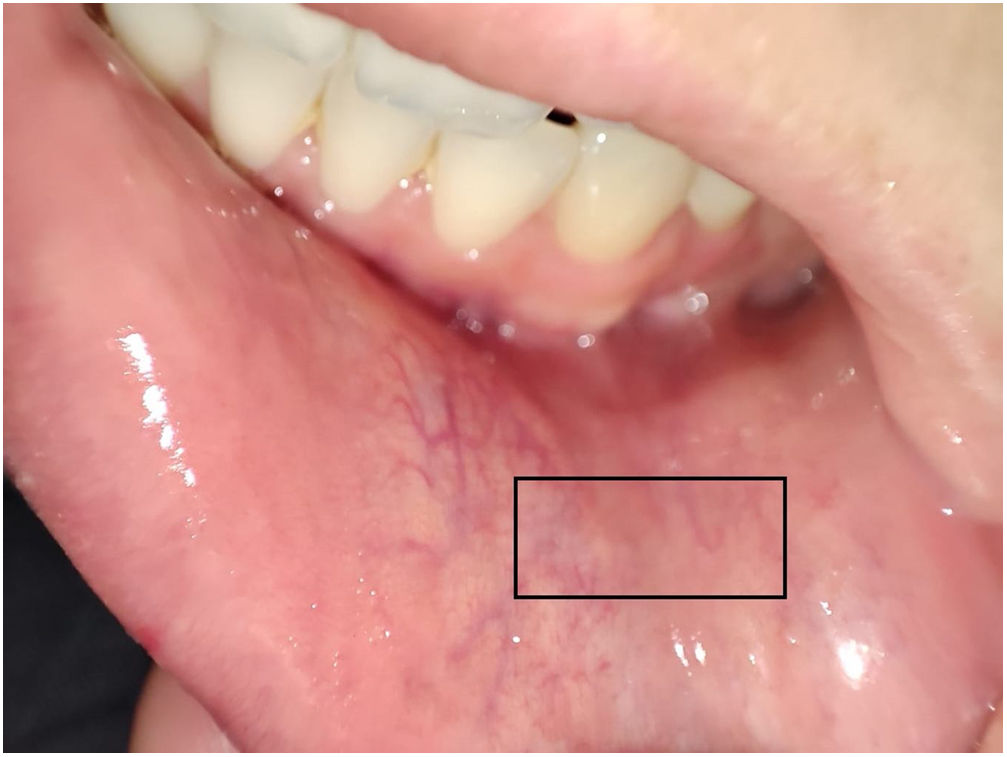
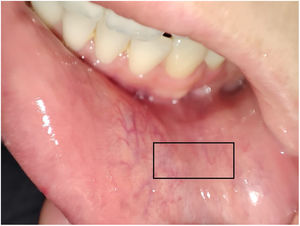
Las BGSM se realizaron por Miguel Antonio Mesa y por Marcela Posada y la técnica utilizada en ambas instituciones fue la siguiente (fig. 1): en la mucosa yugal adyacente al canino anterior, en una región intermedia entre la línea media y el borde de la boca y entre la base de esta y el borde del bermellón, se localizaban por medio de palpación las glándulas salivares. Una vez localizadas, se procedía a infiltrar con una aguja de número 30 (aguja de insulina), utilizando 1 cm de lidocaína a 2% sin epinefrina. La infiltración se iniciaba en un ángulo de 30° y se reubicaba la aguja en ángulos más agudos hasta completar la infiltración, con el fin de separar la capa mucosa de la submucosa para minimizar el sangrado. Posteriormente, utilizando un bisturí número 11, se realizaba una incisión de medial a lateral con poca presión, tratando de incidir solo en la capa mucosa, con una longitud de 1 cm, y con ayuda de una gaza se realizaba presión en la cara opuesta de la incisión. Las glándulas eran denudadas empleando una aguja número 30 y, una vez localizadas, eran seccionadas en su base con ayuda del bisturí y depositadas en un frasco con formol preparado con anterioridad a tal efecto. La zona anatómica seleccionada para la toma de la muestra se escogió por la abundancia de glándulas salivares y la relativa seguridad en lo referente a las variaciones de las ramas del nervio mentoniano, lo que minimiza el riesgo de parestesias posterior al procedimiento13. Al terminar se hacía presión en el área de la herida por 5 min o hasta lograr control del sangrado y se afrontaba la herida sin uso de sutura. En caso de que en un corte no se obtuviesen suficientes glándulas o se considerara técnicamente inviable continuar la exploración, se llevaba a cabo una segunda incisión en el lado contralateral siguiendo el mismo método. El número mínimo de glándulas requeridas para considerar el proceso como satisfactorio fue de cuatro.
Desde el punto de vista histopatológico, la muestra se consideró representativa cuando cumplía una de las tres condiciones ante la dificultad de obtener un reporte histológico uniforme:
- 1.
Presencia de al menos cuatro glándulas salivares8.
- 2.
Descripción de área de análisis de 8 mm2,8.
- 3.
Descripción por parte del patólogo de una muestra satisfactoria.
Para el seguimiento de las complicaciones, los pacientes fueron observados por un periodo de 30 min después de la biopsia y, al momento del egreso, se les daba información de contacto y se les instruía y alentaba a reportar cualquier inconveniente.
Análisis estadísticoLas variables cualitativas fueron expresadas en frecuencias absolutas y relativas, mientras que las cuantitativas se describieron utilizando media y desviación estándar (DE), debido al cumplimiento del supuesto de normalidad evaluado con la prueba de Kolgomorov-Smirnov. Los análisis se llevaron a cabo en el paquete estadístico IBM SPSS 25.0.
ResultadosDurante el periodo de estudio se atendieron 72 pacientes que tuvieron indicación de biopsia, la mayoría de ellos de una institución de mayor complejidad y 10 en una de manejo ambulatorio.
En cuanto a las características de la población estudiada, 63 pacientes (87,5%) eran de sexo femenino y el promedio de edad fue de 52 (DE: 13,1). Con respecto a las características de las biopsias, 70 (97,2%) se consideraron representativas; en dos casos solo se obtuvo tejido sebáceo. A partir de este punto los resultados se reportan con base en estas 70, de las cuales se obtuvo una muestra significativa (n = 70).
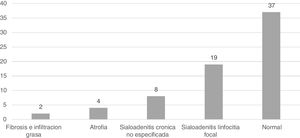
En 27 biopsias (38,5%) se documentó sialoadenitis (fig. 2), con reporte del sistema de clasificación utilizado, de los cuales el más común fue el de Chisholm-Mason, en 18 de estas (66,6%); los demás datos se reportan en la tabla 2.
Sistema de clasificación de las biopsias con sialoadenitis n = 27
| Sistema de clasificación | n (%) |
|---|---|
| Chisholm-Mason | 18 (66,6) |
| Grado 1 | 6 (22,2) |
| Grado 2 | 2 (7,4) |
| Grado 3 | 4 (14,8) |
| Grado 4 | 7 (25,9) |
| Chisholm-Mason modificado* | 8 (29,62) |
| Grado 2 | 1 (3,7) |
| Grado 3 | 1 (3,7) |
| Grado 4.1 | 5 (18,5) |
| Grado 4.2 | 1 (3,7) |
| FS | 1 (3,7) |
FS: Focus Score.
El único paciente que usó FS tuvo un puntaje de 1 en este.
Score para los focos, según Daniels y Whitcher31. Utilizar este esquema en caso de no poder medir tamaño de los lobulillos glandulares.
4.1= 2 a 3 focos.
4.2= 4 a 6 focos.
4.3= 7 a 12 focos.
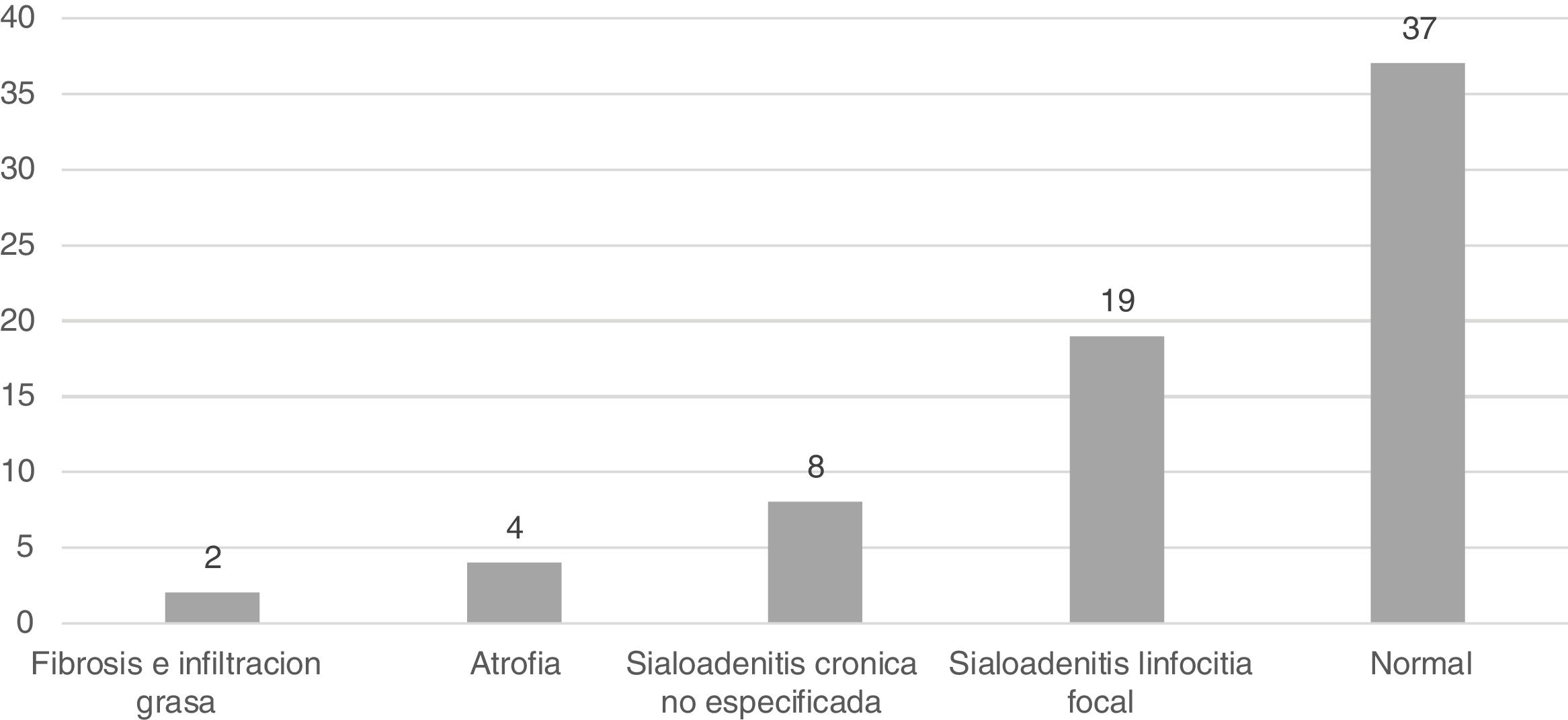
El hallazgo más frecuente fue la glándula salival normal, que correspondió a 37 casos (52,8%), seguida por la sialoadenitis focal, en 19 ocasiones (27,1%) y la sialoadenitis inespecífica, de la cual se hallaron ocho (11,4%); la totalidad de los hallazgos se describe en la figura 1.
Las complicaciones se presentaron en cuatro de los casos (5,7%), siendo estas: episodio cercano al síncope, en una oportunidad que se presentó en el periodo de recuperación inmediata al pasar el paciente del decúbito prono a la posición sedente. Este episodio mejoró al retomar el decúbito por un periodo de 5 min. Dos casos requirieron una segunda incisión pues no se obtuvo material suficiente en el primer intento. Finalmente, se presentó uno de dolor intenso en el posoperatorio, el cual mejoró con la administración de acetaminofén 1.000 mg y uso de hielo por 20 min en la región de la incisión; en el seguimiento posterior la paciente no presentó reaparición de este. Es importante recalcar que no se reportaron dificultades en la cicatrización, requerimiento de uso de sutura, sangrado persistente o parestesias transitorias o permanentes.
DiscusiónEl presente artículo muestra la experiencia con una técnica de BGSM y el tipo de reporte histológico utilizado. Se encontró un predominio en el sexo femenino, hallazgo esperado por la mayor prevalencia del síndrome de Sjögren en dicho grupo, y una edad esperable para una población con sospecha de síndrome de Sjögren14.
El primer hallazgo para mencionar es la efectividad del procedimiento para obtener material satisfactorio para análisis histológico; este es similar a las series descritas por otros autores con distintas técnicas, donde se alcanzan valores superiores a 90%3,15–19. Es importante tener presente que EULAR recomienda obtener cuatro glándulas y seis en caso de ser pequeñas y que debe utilizarse este estándar para lograr el mayor porcentaje de biopsias representativas posible8. Uno de los hallazgos llamativos de nuestro estudio fue encontrar en dos ocasiones glándulas sebáceas en las biopsias. Estas en cavidad oral históricamente se han descrito como manchas de Fordyce y se localizan típicamente en el borde del bermellón, lo que podría generar dudas con respecto a la correcta localización de la zona de la biopsia; no obstante, en todos los casos los autores siguieron estrictamente el protocolo de selección del área de incisión para minimizar el riesgo de parestesias. Adicionalmente, estudios de patología en cavidad oral han descrito la presencia esporádica de glándulas sebáceas como un hallazgo normal en individuos sanos, presente incluso hasta en 80% de los casos20.
El sistema de reporte en los pacientes en los que se encontró infiltración linfocítica fue el de Chisholm-Mason, contrariamente a lo señalado por las recomendaciones internacionales de usar el de FS1,8. A pesar de los cambios a lo largo del tiempo en los sistemas de clasificación, todavía se usa ampliamente el de Chisholm-Mason, el cual tiene un menor desempeño, en especial al momento de clasificar los focos de inflamación confluentes y al sufrir de un efecto techo en casos de mayor inflamación8,19,21. En un estudio realizado en el Hospital San José en Bogotá, se encontró que había poca concordancia entre los dos y que el de Chisholm Manson sobreestima el conteo de focos, ya que todos estos se tienen en cuenta con independencia del estado del parénquima glandular, lo que determina un probable sesgo sistemático19.
Estos hallazgos no pueden ser generalizados, pues al evaluar solo las biopsias de dos centros, esto pudiera no representar la totalidad de la realidad local; no obstante, sí genera un llamado de atención para evaluar y actualizar dicho sistema, además de constituir el principal hallazgo de nuestro estudio y aquel que puede impactar de forma más inmediata la práctica reumatológica, mediante una comunicación entre los reumatólogos y los servicios de patología.
Con referencia a las complicaciones encontradas, estas se mostraron en una baja proporción, siendo menores y sin presencia de parestesias que son una de las más temidas por el deterioro de la calidad de vida que producen. Este estudio demuestra que la presente técnica es segura y al no requerir sutura evita un segundo tiempo para el retiro de esta.
Dentro de las fortalezas de esta investigación puede resaltarse el tamaño muestral, que está en el rango medio de los distintos estudios similares (tabla 2). Adicionalmente, la técnica quirúrgica fue unificada, lo que permite aseverar que existió homogeneidad en el procedimiento.
Al momento de interpretar nuestro estudio, es importante aclarar que su intención no es la de hacer una comparación con otras técnicas, sino describir la experiencia local y, por lo tanto, no puede concluirse en relación con otras técnicas descritas en la literatura.
Adicionalmente, es un trabajo de carácter retrospectivo, lo que limita la información disponible como, por ejemplo, el número de glándulas obtenidas para definir si se cumplieron los lineamientos internacionales para la biopsia. Otra debilidad es la dificultad en el seguimiento de las complicaciones mediatas, pues los pacientes no tuvieron visita de seguimiento. A pesar de esto, a todos se les instruyó sobre las posibles complicaciones y se les dio un teléfono de contacto para reportar la presencia de cualquier inconveniente.
Otra complicación, más propia de la literatura que del estudio, es la heterogeneidad en el momento del reporte de la técnica, la representatividad de la muestra obtenida y los problemas asociados, lo cual se describe más ampliamente en la tabla 1 y demuestra la dificultad para hacer comparaciones con otros artículos.
Finalmente, un aspecto que vale la pena abordar es si en la actualidad, con la aparición de nuevas tecnologías como la ecografía de glándula salival, es todavía pertinente la realización de estudios histológicos, más aún cuando existe una concordancia superior a 78% entre la ecografía y la presencia de un foco inflamatorio22. En nuestro criterio, el estudio histológico sigue siendo necesario por las siguientes razones:
- 1.
Los criterios ecográficos para síndrome de Sjögren ya han sido homogeneizados a través de las guías Omeract. Es necesario que dichas definiciones sean adoptadas por la totalidad del personal que realiza este procedimiento para que sea realmente efectivo23.
- 2.
El síndrome de Sjögren seronegativo, al menos para anticuerpos anti-Ro, corresponde a cerca de 30% de los casos. Estos tienen un comportamiento y unas historias naturales diferentes de su contraparte positiva. Dada la gran variedad de cuadros simuladores de síntomas secos, la biopsia se hace necesaria para confirmar el diagnóstico24.
- 3.
La biopsia de glándula salival aporta información sobre el curso de la enfermedad, el riesgo de progresión a linfoma y manifestaciones extraglandulares24,25.
- 4.
Reemplazar la biopsia por ecografía de glándula salival mayor genera una disminución leve de sensibilidad (85 vs. 85,6%) y especificidad (79,8 vs. 82,2%) que, si bien por sí sola no implica un cambio importante, sí lo es si consideramos la pérdida de la información descrita en el numeral tres26.
El presente artículo muestra la experiencia de una técnica de biopsia de glándula salival con incisión de 10 mm sin sutura posterior, un procedimiento que provee en más del 90% muestras representativas con baja tasa de complicaciones. En el ámbito local, el sistema de reporte histológico preferido es el de Chisholm-Mason, en contravía de las recomendaciones internacionales, y refleja la necesidad de actualizar dichos reportes.
AgradecimientosAl doctor Rubén Mantilla, quien instruyo a Miguel Antonio Mesa Navas, uno de los autores de este artículo, en el procedimiento de realización de la biopsia.
FinanciaciónEste estudio no conto con financiación.
Conflictos de interesesLos autores declaran no tener ningún conflicto de intereses.