Describir las características clínicas y de laboratorio en pacientes mayores de 15años con diagnóstico de lupus eritematoso sistémico (LES) hospitalizados por fiebre, cuyo diagnóstico final fue infección, actividad lúpica o ambas (actividad e infección).
MétodosSe realizó un estudio descriptivo retrospectivo en el que se incluyeron pacientes con diagnóstico de LES admitidos por fiebre en el servicio de urgencias del Hospital Universitario Clínica San Rafael; se estudiaron variables clínicas y paraclínicas, dividiéndose en 3grupos de interés: pacientes con actividad de la enfermedad, de la infección o de ambas, de acuerdo con el diagnóstico definitivo una vez se daba el alta hospitalaria. Se estudiaron variables clínicas y de laboratorio, realizándose una descripción de la población en los 3estados.
ResultadosSe evaluaron en total 115 pacientes, incluyéndose en el análisis final 108 pacientes. La mediana de edad fue de 36años y el 86% fueron mujeres. La mediana del puntaje del Systemic Lupus Erythematosus Disease Activity Index (SLEDAI) en toda la población fue de 6 (R 1-15), en los pacientes con infección y actividad el puntaje mostró una mediana de 9,5 (R 6-15). No hubo diferencias significativas entre los síntomas clínicos y los hallazgos de laboratorio en los diferentes grupos. El uso de prednisolona en los últimos 3meses fue mayor en el grupo de infección (p=0,001), pero sin diferencias significativas entre las otras terapias de inmunosupresión.
ConclusiónEl uso de esteroides en los últimos 3meses, el puntaje de la escala SLEDAI y el tiempo transcurrido desde el diagnóstico de LES podrían ser variables que pueden ayudar a discriminar entre infección y actividad en pacientes con historia de LES y fiebre. Los hallazgos clínicos y paraclínicos no discriminan entre estas condiciones de enfermedad.
To describe clinical characteristics and laboratory findings of patients older than 15years of age diagnosed with Systemic Lupus Erythematosus (SLE) that were admitted to hospital with fever and with a final diagnosis of infection, disease flare-up, or both.
MethodsA retrospective chart review of medical charts was performed to identify patients with a diagnosis of SLE with a fever, admitted to the Emergency Department of Hospital Universitario Clinica San Rafael. The data collected included demographics, SLEDAI (Systemic Lupus Erythematosus Disease Activity Index) scores, clinical symptoms, laboratory findings, and steroid use. Results analysis was based on three groups (according to final diagnosis at discharge): patients diagnosed with SLE and infection, SLE and disease flare-up, and SLE with both infection and disease flare-up.
ResultsThis study included 108 patients with a mean age of 36, of whom 86% were female. The mean SLEDAI score of all patients analysed was 6 (R 1-15), and for patients with SLE with both infection and disease flare-up was 9.5 (R 6-15). No significant differences were found with clinical symptoms and laboratory findings for any group analysed. SLE patients diagnosed with infections took significantly more prednisolone in the last three months before admission (P=.001). No differences were found with other immunosuppressants.
ConclusionThe use of steroids in the last three months, the SLEDAI score, and time since a SLE diagnosis may be variables used to distinguish between infection and disease flare-up in SLE patients presenting with fever. Clinical symptoms and laboratory results are not useful markers to make this distinction.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune crónica que compromete múltiples sistemas con una amplia variedad de manifestaciones clínicas1,2. Esta condición tiene una mayor susceptibilidad al desarrollo de infecciones por la alteración del sistema inmune innato y adaptativo, así como el uso de fármacos inmunosupresores3. Las infecciones son una de las principales causas de hospitalización en pacientes con LES después de la actividad de la enfermedad y representan una alta mortalidad4,5. Dentro de las infecciones se ha mencionado la etiología bacteriana como la más usual, seguida de la viral y de la fúngica6. Predominan las infecciones respiratorias, urinarias y de tejidos blandos. Sin embargo, uno de los retos diagnósticos es diferenciar entre la actividad de la enfermedad e infección en pacientes con LES que consultan por fiebre, ya que ambas condiciones pueden manifestarse de manera similar. La fiebre puede ocurrir entre el 36 y el 96% de pacientes tanto infectados como no infectados, además de compartir otras manifestaciones similares secundarias al propio proceso inflamatorio común entre la infección y la inflamación, por lo cual la búsqueda de características diferenciadoras entre estas condiciones es una actividad permanente para tratar de objetivar esta distinción de forma oportuna7.
Ante la falta de un marcador específico se han planteado diferentes variables en aras de mejorar la precisión diagnóstica, dentro de las que se mencionan una mayor actividad de la enfermedad, complemento consumido, leucopenia, anticuerpos anti-DNA y el uso de fármacos inmunosupresores como los esteroides o la ciclofosfamida8,9. Se debe elegir uno o varios marcadores predictores que sean específicos y sensibles, apoyando el diagnóstico y determinando la causa del episodio febril. Por medio de este estudio descriptivo se pretende determinar el comportamiento tanto de las manifestaciones clínicas y pruebas de laboratorio, como el uso de diferentes fármacos inmunosupresores previos en las dos situaciones (actividad lúpica e infección), con el objetivo de establecer posibles marcadores diagnósticos por separado o en combinación útiles para determinar si se trata de actividad, de infección o de ambas.
MétodosSe realizó un estudio descriptivo retrospectivo mediante la revisión de los registros médicos de pacientes adultos con LES admitidos por fiebre en el servicio de urgencias del Hospital Universitario Clínica San Rafael entre enero de 2005 y diciembre de 2014. Los datos fueron recolectados entre enero y marzo de 2017. Se incluyeron pacientes con diagnóstico confirmado de lupus según los criterios de clasificación SLICC y valoración por un reumatólogo, mayores de 15años, con fiebre (definida como temperatura axilar mayor a 37,5°C). Se consideró como evento la primera hospitalización con fiebre en un paciente, y no se incluyeron eventos recurrentes de un mismo paciente. Se excluyeron pacientes con otra enfermedad autoinmune concomitante (excepto síndrome antifosfolípido) y con diagnóstico de lupus inducido por medicamentos. Este estudio fue aprobado por el comité de ética del hospital y se llevó a cabo de conformidad con el protocolo de buenas prácticas clínicas y los principios de la Declaración de Helsinki. Las variables se recogieron de acuerdo con un protocolo estandarizado en un registro electrónico. Se registraron datos de la afectación previa de órganos además del tipo de fármacos inmunosupresores recibidos previo al ingreso y durante la admisión. La actividad de la enfermedad se midió con el Systemic Lupus Erythematosus Disease Activity Index (SLEDAI). Así mismo, se obtuvieron datos de laboratorios generales y específicos, como pruebas inmunológicas, cultivos en sangre, orina u otros, según el caso. Se obtuvieron los niveles de los siguientes resultados de laboratorio en los 3primeros días de admisión: velocidad de eritrosedimentación (VSG) (valor normal: <20mm/h; proteína C reactiva (PCR) (valor normal: <1mg/dl); procalcitonina (<0,5ng/ml); anticuerpos anti ácido desoxirribonucleico de doble cadena (anti dsDNA), valor absoluto positivo o negativo; hemoglobina (valor normal 12-17g/dl); ferritina (valor normal: 18-160mg/ml); LDH (valor normal 250-450UI/l); complemento C3 (valor normal: 76-181mg/dl); complemento C4 (valor normal: 12-52mg/dl); leucocitos (valor normal: 4.600-10.200/μl); neutrófilos (valor normal: 3.700-8.000/μl); linfocitos (valor normal: 1.000-5.000/μl). Cultivos positivos: en orina, sangre, esputo: ninguno. Las definiciones de actividad lúpica, infección general y específica, y recaída utilizadas se encuentran en el apéndice A.
Los datos después de ser registrados en hoja electrónica se analizaron en el programa SPSS20 licenciado por la Universidad de La Sabana. Las variables continuas se resumieron en promedio y desviación estándar si su distribución fue normal, y en mediana y rango intercuartílico si su distribución no fue normal. Las variables cualitativas se resumieron en frecuencias y porcentajes. La descripción general se realizó en la población general y luego en 3grupos: actividad, infección y actividad e infección. Se realizaron posteriormente cruces exploratorios entre las variables clínicas y paraclínicas completas con los estados de la enfermedad; las variables cualitativas se analizaron con chi-cuadrado y test de Fisher, y las variables cuantitativas, si su distribución fue normal, con t de Student, y si su distribución fue no normal, con U de Mann Whitney. Para más de 2grupos se utilizó Kruskal Wallis, considerándose una p significativa menor de 0,05. Se siguieron todas las consideraciones éticas y de protección de datos.
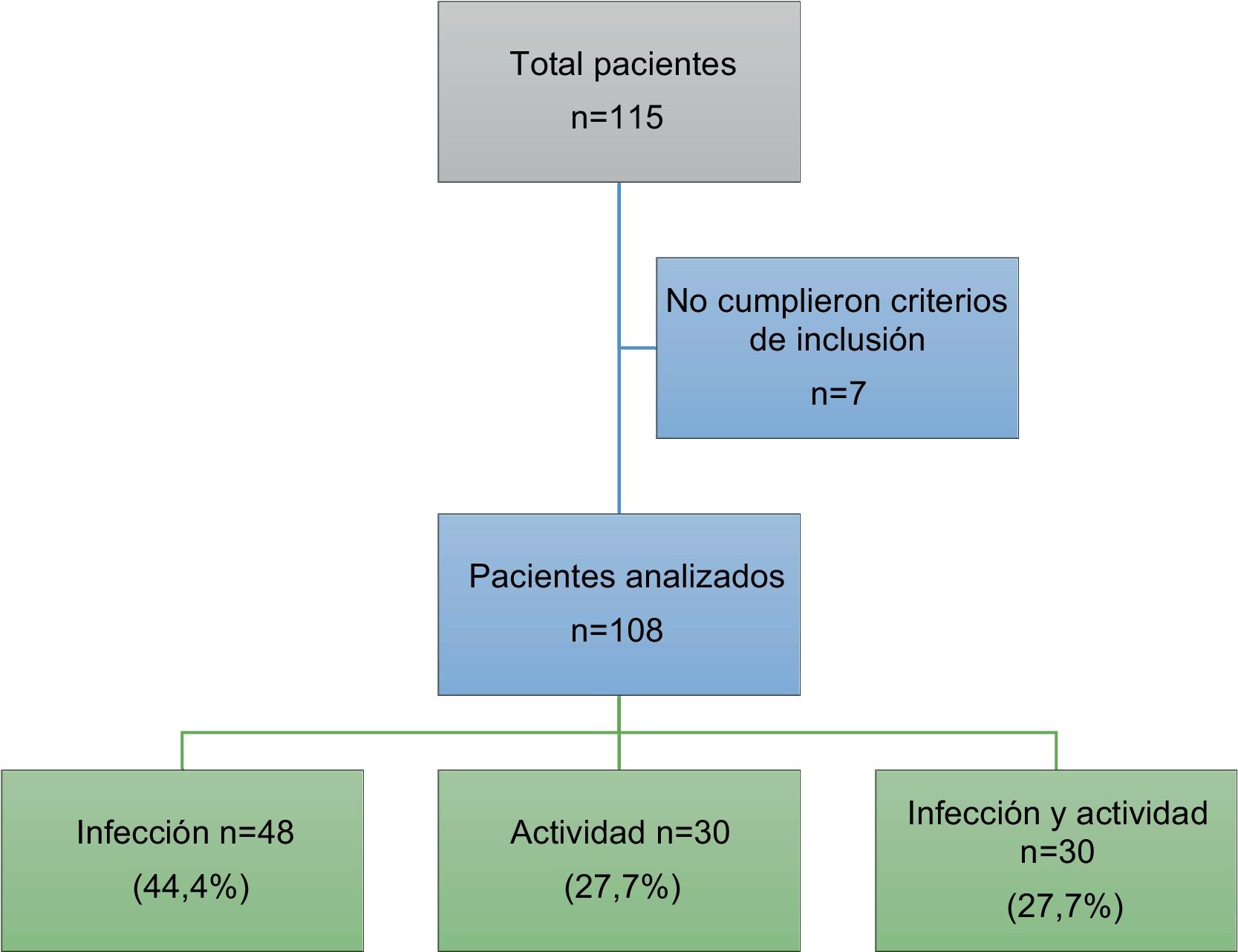
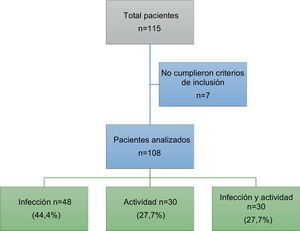
ResultadosIngresaron un total de 115 pacientes. Siete de ellos fueron excluidos dado que el diagnóstico final no correspondía a infección ni actividad, ingresando finalmente al análisis 108 pacientes. En la figura 1 se observa el diagrama de pacientes excluidos.
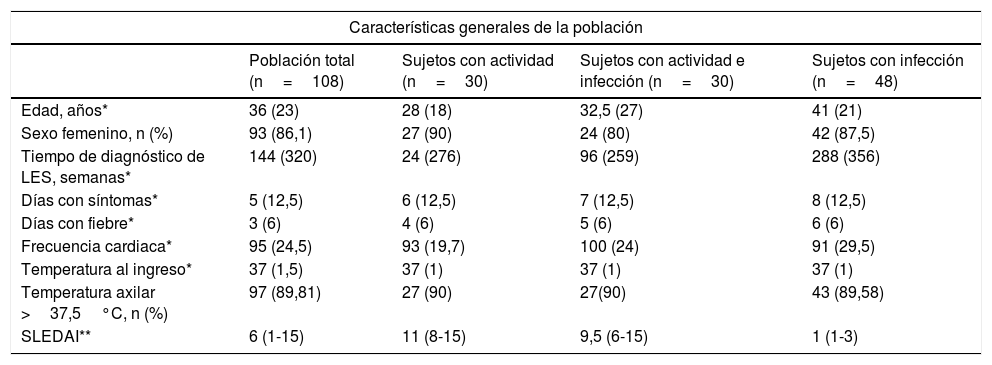
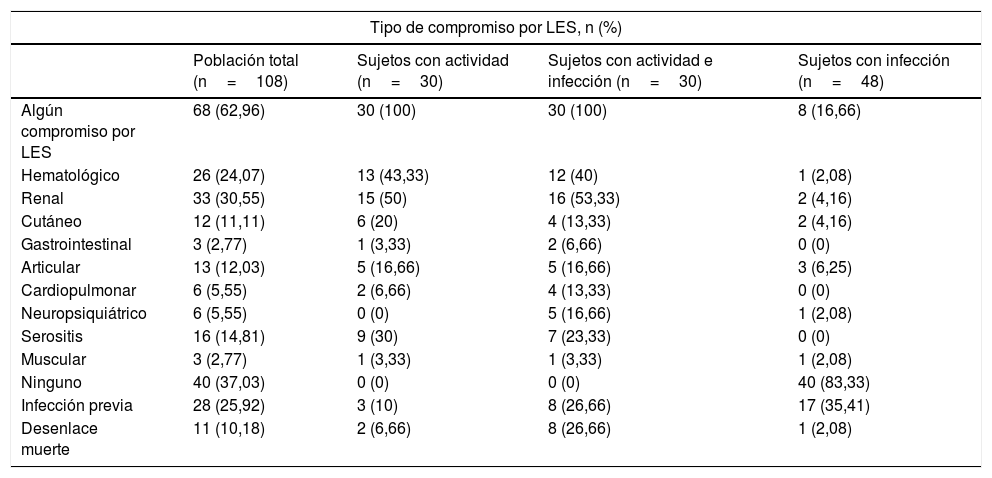
La mediana de edad de los pacientes analizados fue de 36años, y el 86% (93/108) fueron mujeres. La edad media del grupo de pacientes con infección fue de 42,3±14,6años, siendo este grupo con promedio de edad mayor al grupo de actividad (31,5±12,9años) o ambas (37,4±18,2años) (p=0,017). En la tabla 1 se observan las características generales de la población, incluyendo las manifestaciones clínicas por LES. En la tabla 2 se diferencian los tipos de compromiso por LES presentes al momento del ingreso a urgencias, para el total y para cada uno de los subgrupos del estudio.
Características generales de la población y hallazgos clínicos
| Características generales de la población | ||||
|---|---|---|---|---|
| Población total (n=108) | Sujetos con actividad (n=30) | Sujetos con actividad e infección (n=30) | Sujetos con infección (n=48) | |
| Edad, años* | 36 (23) | 28 (18) | 32,5 (27) | 41 (21) |
| Sexo femenino, n (%) | 93 (86,1) | 27 (90) | 24 (80) | 42 (87,5) |
| Tiempo de diagnóstico de LES, semanas* | 144 (320) | 24 (276) | 96 (259) | 288 (356) |
| Días con síntomas* | 5 (12,5) | 6 (12,5) | 7 (12,5) | 8 (12,5) |
| Días con fiebre* | 3 (6) | 4 (6) | 5 (6) | 6 (6) |
| Frecuencia cardiaca* | 95 (24,5) | 93 (19,7) | 100 (24) | 91 (29,5) |
| Temperatura al ingreso* | 37 (1,5) | 37 (1) | 37 (1) | 37 (1) |
| Temperatura axilar >37,5°C, n (%) | 97 (89,81) | 27 (90) | 27(90) | 43 (89,58) |
| SLEDAI** | 6 (1-15) | 11 (8-15) | 9,5 (6-15) | 1 (1-3) |
| Hallazgos clínicos, n (%) | ||||
|---|---|---|---|---|
| Nefritis lúpica | 47 (43,51) | 11 (36,6) | 14 (46,66) | 22 (45,83) |
| Antecedente de actividad lúpica | 97 (89,81) | 26 (86,66) | 28 (93,33) | 43 (89,58) |
| Antecedente de actividad lúpica últimos 3 meses | 78 (72,22) | 24 (80) | 25 (83,33) | 29 (60,41) |
| Antecedente de actividad lúpica últimos 6 meses | 71 (65,74) | 18 (60) | 24 (80) | 29 (60,41) |
| Artritis | 31 (28,7) | 13 (43,33) | 9 (30) | 9 (18,75) |
| Mialgias | 25 (23,14) | 12 (40) | 7 (23,33) | 6 (12,5) |
| Rash cutáneo | 10 (9,25) | 6 (20) | 2 (6,66) | 2 (4,16) |
| Tos | 41 (37,96) | 7 (23,33) | 13 (43,33) | 21 (43,75) |
| Producción de esputo | 23 (21,29) | 2 (6,66) | 10 (33,33) | 11 (22,91) |
| Vómito | 24 (22,22) | 6 (20) | 8 (26,66) | 10 (20,83) |
| Diarrea | 17 (15,74) | 4 (13,33) | 6 (20) | 7 (14,58) |
| Dolor abdominal | 34 (31,48) | 8 (26,66) | 10 (33,33) | 16 (33,33) |
Tipo de compromiso por lupus eritematoso sistémico (LES) al ingreso a urgencias
| Tipo de compromiso por LES, n (%) | ||||
|---|---|---|---|---|
| Población total (n=108) | Sujetos con actividad (n=30) | Sujetos con actividad e infección (n=30) | Sujetos con infección (n=48) | |
| Algún compromiso por LES | 68 (62,96) | 30 (100) | 30 (100) | 8 (16,66) |
| Hematológico | 26 (24,07) | 13 (43,33) | 12 (40) | 1 (2,08) |
| Renal | 33 (30,55) | 15 (50) | 16 (53,33) | 2 (4,16) |
| Cutáneo | 12 (11,11) | 6 (20) | 4 (13,33) | 2 (4,16) |
| Gastrointestinal | 3 (2,77) | 1 (3,33) | 2 (6,66) | 0 (0) |
| Articular | 13 (12,03) | 5 (16,66) | 5 (16,66) | 3 (6,25) |
| Cardiopulmonar | 6 (5,55) | 2 (6,66) | 4 (13,33) | 0 (0) |
| Neuropsiquiátrico | 6 (5,55) | 0 (0) | 5 (16,66) | 1 (2,08) |
| Serositis | 16 (14,81) | 9 (30) | 7 (23,33) | 0 (0) |
| Muscular | 3 (2,77) | 1 (3,33) | 1 (3,33) | 1 (2,08) |
| Ninguno | 40 (37,03) | 0 (0) | 0 (0) | 40 (83,33) |
| Infección previa | 28 (25,92) | 3 (10) | 8 (26,66) | 17 (35,41) |
| Desenlace muerte | 11 (10,18) | 2 (6,66) | 8 (26,66) | 1 (2,08) |
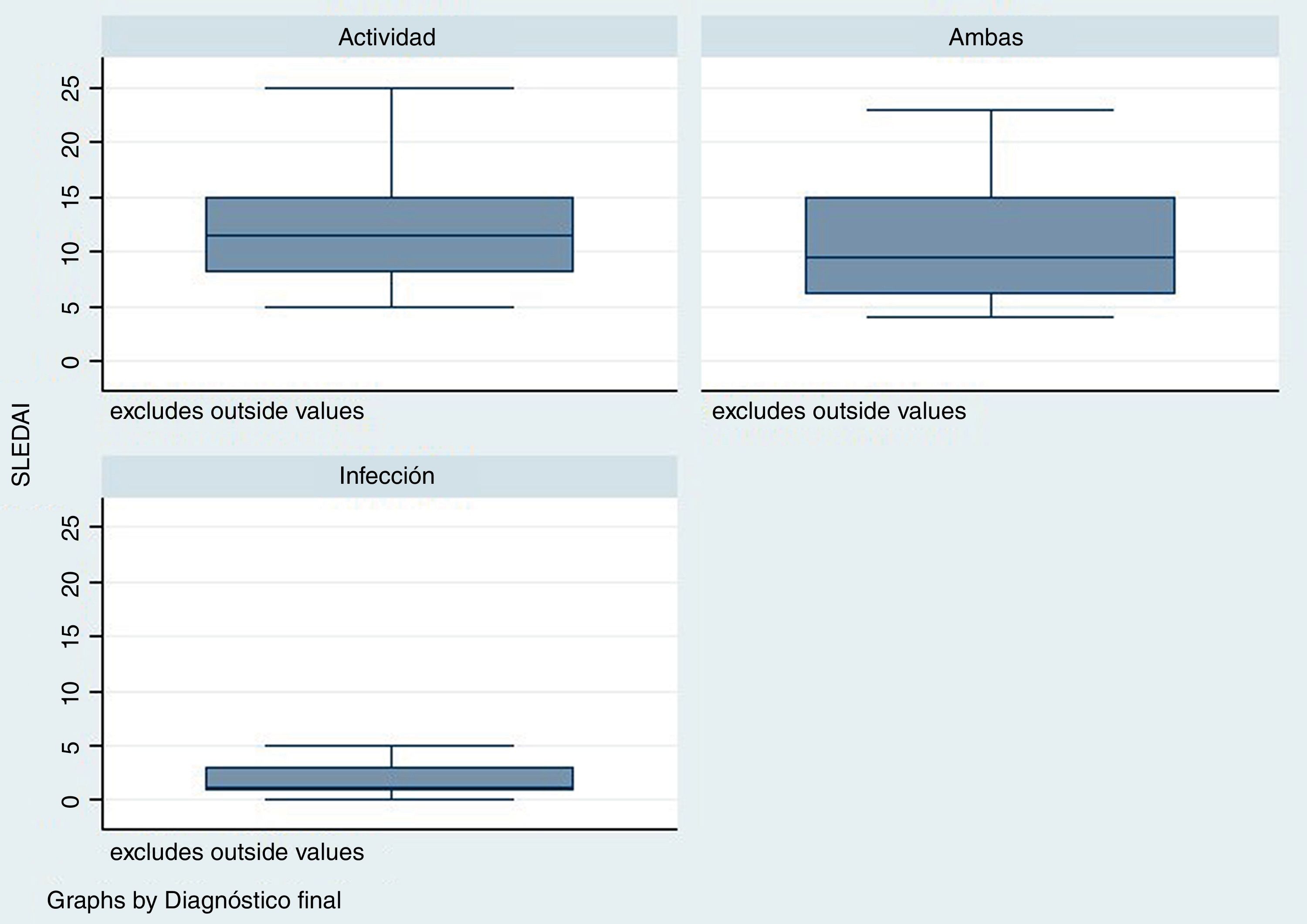
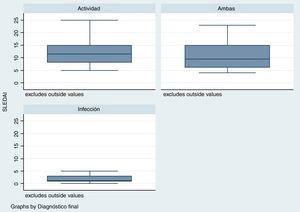
El tiempo transcurrido desde el diagnóstico de LES fue mayor para el grupo de infección, con una mediana en semanas de 288 (rango: 124-480) en comparación con el grupo de actividad /24semanas; R: 0-276) y el grupo de infección y actividad (96semanas; R: 17-276) (p=0,001). El puntaje de la escala SLEDAI fue menor en el grupo de infección, mediana1 (R: 1-3), comparado con los otros 2grupos: actividad11 (R: 8-15), infección y actividad9,5 (R: 6-15), como se observa en la figura 2 (p=0,004).
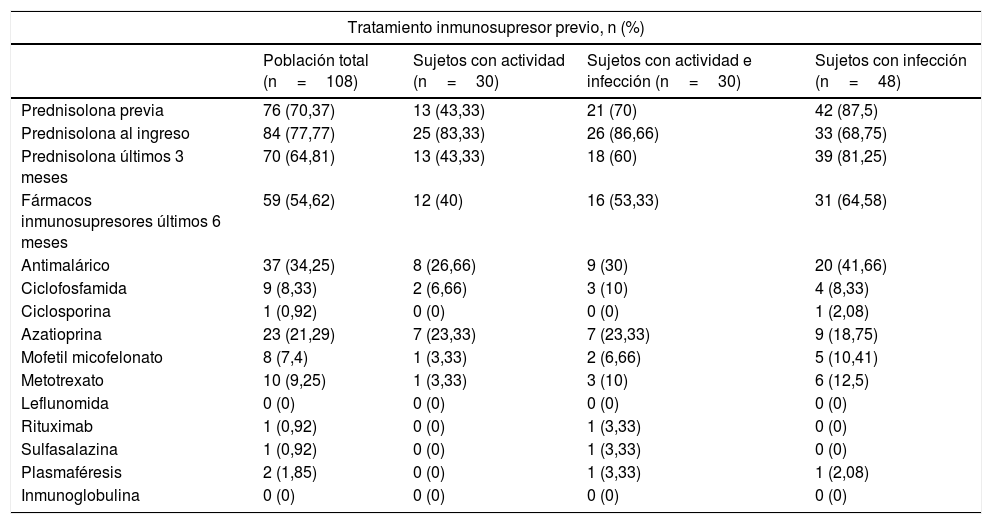
En la tabla 3 se observan los tratamientos recibidos por los pacientes. El tratamiento previo con prednisolona, en especial en los últimos 3meses, fue más frecuente en el grupo de pacientes infectados (p=0,001). Sin embargo, no hubo diferencias con el uso de antimaláricos y otros medicamentos inmunosupresores entre los grupos.
Tratamientos recibidos
| Tratamiento inmunosupresor previo, n (%) | ||||
|---|---|---|---|---|
| Población total (n=108) | Sujetos con actividad (n=30) | Sujetos con actividad e infección (n=30) | Sujetos con infección (n=48) | |
| Prednisolona previa | 76 (70,37) | 13 (43,33) | 21 (70) | 42 (87,5) |
| Prednisolona al ingreso | 84 (77,77) | 25 (83,33) | 26 (86,66) | 33 (68,75) |
| Prednisolona últimos 3 meses | 70 (64,81) | 13 (43,33) | 18 (60) | 39 (81,25) |
| Fármacos inmunosupresores últimos 6 meses | 59 (54,62) | 12 (40) | 16 (53,33) | 31 (64,58) |
| Antimalárico | 37 (34,25) | 8 (26,66) | 9 (30) | 20 (41,66) |
| Ciclofosfamida | 9 (8,33) | 2 (6,66) | 3 (10) | 4 (8,33) |
| Ciclosporina | 1 (0,92) | 0 (0) | 0 (0) | 1 (2,08) |
| Azatioprina | 23 (21,29) | 7 (23,33) | 7 (23,33) | 9 (18,75) |
| Mofetil micofelonato | 8 (7,4) | 1 (3,33) | 2 (6,66) | 5 (10,41) |
| Metotrexato | 10 (9,25) | 1 (3,33) | 3 (10) | 6 (12,5) |
| Leflunomida | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Rituximab | 1 (0,92) | 0 (0) | 1 (3,33) | 0 (0) |
| Sulfasalazina | 1 (0,92) | 0 (0) | 1 (3,33) | 0 (0) |
| Plasmaféresis | 2 (1,85) | 0 (0) | 1 (3,33) | 1 (2,08) |
| Inmunoglobulina | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
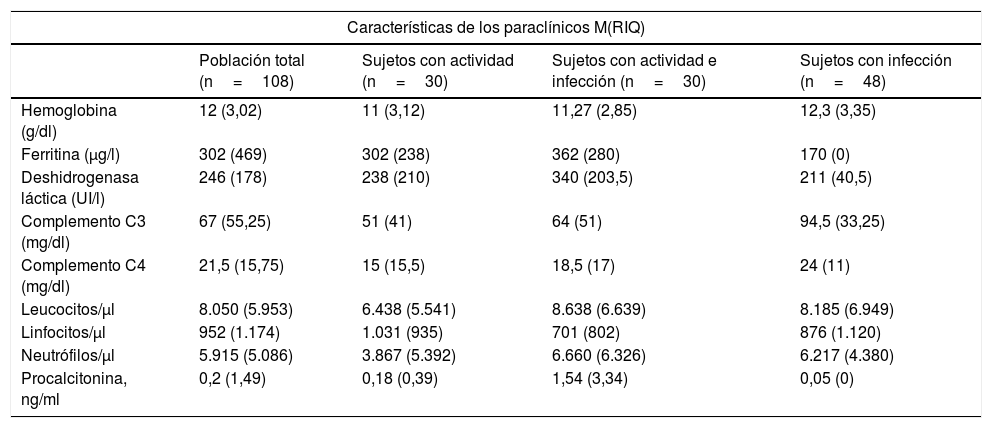
En la tabla 4 se observan los resultados de las pruebas diagnósticas realizadas a los pacientes. La mediana de medición de C3 y C4 fue mayor en el grupo de infecciones que en los demás grupos (p=0,002), y no hubo diferencias en ninguno de los otros laboratorios entre los grupos. Solo 12pacientes reportaron los valores de VSG y 86 pacientes los valores de PCR, 24 en el grupo de actividad, 27 en el grupo de infección y actividad y 35 en el grupo de infección, sin evidenciarse diferencias significativas entre los grupos. Dada la ausencia de datos completos, se consideró no ingresar en la tabla de resultados los reportes de VSG y PCR.
Características de los paraclínicos realizados
| Características de los paraclínicos M(RIQ) | ||||
|---|---|---|---|---|
| Población total (n=108) | Sujetos con actividad (n=30) | Sujetos con actividad e infección (n=30) | Sujetos con infección (n=48) | |
| Hemoglobina (g/dl) | 12 (3,02) | 11 (3,12) | 11,27 (2,85) | 12,3 (3,35) |
| Ferritina (μg/l) | 302 (469) | 302 (238) | 362 (280) | 170 (0) |
| Deshidrogenasa láctica (UI/l) | 246 (178) | 238 (210) | 340 (203,5) | 211 (40,5) |
| Complemento C3 (mg/dl) | 67 (55,25) | 51 (41) | 64 (51) | 94,5 (33,25) |
| Complemento C4 (mg/dl) | 21,5 (15,75) | 15 (15,5) | 18,5 (17) | 24 (11) |
| Leucocitos/μl | 8.050 (5.953) | 6.438 (5.541) | 8.638 (6.639) | 8.185 (6.949) |
| Linfocitos/μl | 952 (1.174) | 1.031 (935) | 701 (802) | 876 (1.120) |
| Neutrófilos/μl | 5.915 (5.086) | 3.867 (5.392) | 6.660 (6.326) | 6.217 (4.380) |
| Procalcitonina, ng/ml | 0,2 (1,49) | 0,18 (0,39) | 1,54 (3,34) | 0,05 (0) |
| Cultivos positivos, n (%) | ||||
|---|---|---|---|---|
| Orina | 19 (17,59) | 1 (3,33) | 5 (16,66) | 13 (27,08) |
| Sangre | 11 (10,18) | 0 (0) | 8 (26,66) | 3 (6,25) |
| Microorganismos, n (%) | ||||
|---|---|---|---|---|
| Escherichia coli | 14 (12,96) | 1 (3,33) | 3 (10) | 10 (20,83) |
| Enterococcus faecium | 1 (0,92) | 0 (0) | 0 (0) | 1 (2,08) |
| Klebsiella oxytoca | 1 (0,92) | 0 (0) | 0 (0) | 1 (2,08) |
| Klebsiella pneumoniae | 2 (1,85) | 0 (0) | 2 (6,66) | 0 (0) |
| Neisseria meningitidis | 1 (0,92) | 0 (0) | 1 (3,33) | 0 (0) |
| Salmonella typhi | 1 (0,92) | 0 (0) | 0 (0) | 1 (2,08) |
| Staphylococcus aureus | 10 (9,25) | 0 (0) | 7 (23,33) | 3 (6,25) |
| Ninguno | 78 (72,22) | 29 (96,66) | 17 (56,66) | 32 (66,66) |
Por último, solo el 27,77% de todos los pacientes tuvieron algún tipo de aislamiento microbiológico, de los cuales el mayor fue de orina (17,59%); predominó el aislamiento de Escherichia coli (12,96%), siendo este último superior en el grupo de infección.
El número de días con síntomas fue menor para el grupo infección y actividad (p=0,002) pero no hubo diferencias estadísticamente significativas en el número de días con fiebre, en la temperatura y en la frecuencia cardiaca al ingreso. En los grupos actividad e infección y actividad todos los pacientes tuvieron algún tipo de compromiso por lupus en comparación con el 17% (8/48) del grupo de infección (p=0,0001). En relación con la presencia de mialgias, estas fueron más frecuentes en el grupo con actividad (p=0,02), al igual que el compromiso hematológico (p=0,001). La producción de esputo fue menos frecuente en el grupo de actividad (p=0,03). No hubo diferencias en los otros hallazgos clínicos, como compromiso renal, vómito, diarrea, serositis, articular, muscular o neuropsiquiátrico.
La potencia con 108 sujetos para los análisis exploratorios alcanza el 55,36%.
DiscusiónEste es uno de los primeros estudios a escala regional donde se describen las características clínicas y paraclínicas de pacientes con diagnóstico de LES que consultaron por fiebre, y donde se relacionan las poblaciones de pacientes solo con actividad, con proceso infeccioso activo o con ambos. Nuestra población es similar a la reportada en el estudio de Torres-Ruiz et al.10, publicado en 2017, así como de otros autores latinoamericanos, donde el promedio de edad en estos pacientes fue de 33años y el porcentaje de sexo femenino entre el 87 y el 89%11, siendo además concordante con estudios poblacionales mayores donde las personas con mayor afectación por esta enfermedad y sus recaídas son mujeres jóvenes.
El tiempo transcurrido desde el diagnóstico de LES es de corta evolución en la mayoría. Sin embargo, los sujetos con mayor tiempo desde el diagnóstico presentaron mayor frecuencia de infección en comparación con los otros grupos, lo cual es acorde con lo descrito en la literatura, donde una mayor duración de la enfermedad es un factor de riesgo independiente para el desarrollo de infecciones. Jeong et al.12 realizaron un estudio retrospectivo de casos y controles con 110 pacientes con el objetivo de identificar factores de riesgo para infección en pacientes con LES, siendo mayor el riesgo con una duración de la enfermedad mayor de 8años, especialmente para infecciones adquiridas en la comunidad de origen pulmonar y de tejidos blandos. Lo anterior se relaciona con una mayor exposición a terapia inmunosupresora, así como mayor compromiso del sistema inmune innato y adaptativo de forma crónica3.
Así mismo, el puntaje en la escala SLEDAI fue menor en el grupo de infección al compararlo con los otros dos grupos. Esta escala puntúa la actividad de la enfermedad y permite discriminar su severidad13. Cabe resaltar que el grupo con mayor puntuación en esta escala fue el de actividad. Diferentes estudios epidemiológicos han reportado una relación entre mayor actividad de la enfermedad, especialmente con actividad severa (SLEDAI >12), y mayor tasa de complicaciones infecciosas. Lo anterior es mencionado por Rúa-Figueroa et al.14 en un estudio de cohorte multicéntrico publicado en 2019 donde se analizaron 114 episodios de bacteriemia con el objetivo de describir su incidencia en pacientes con LES, la cual fue más frecuente en aquellos con actividad (de los cuales el 66% tenían actividad severa por SLEDAI).
Respecto a las características de los síntomas al ingreso, no se encontraron diferencias significativas entre la temperatura, la frecuencia cardiaca o las demás variables clínicas. Se han realizado múltiples estudios en aras de determinar si la presencia de fiebre u otras características clínicas podría ayudar a diferenciar una reactivación de la enfermedad de un proceso infeccioso7,15. Incluso desde la década de los setenta se han realizado estudios en pacientes con LES y fiebre, encontrando que el 60% correspondían a actividad de la enfermedad, el 23% a infecciones y el 12% a misceláneo16. Beça et al.17 publicaron en 2015 una cohorte retrospectiva para el desarrollo y la validación de un algoritmo de riesgo predictivo en este escenario. Encontraron que la fiebre se asocia en el 48% a infección y en el 45% a actividad, considerando que el uso de tres variables adicionales —días de fiebre, anti-dsDNA y PCR— podría ser útil en combinación para diferenciar actividad de infección en pacientes con LES.
El grupo de infección presentó solo un 17% de algún tipo de compromiso por LES en comparación con el grupo de actividad y en el de ambas, en donde llamativamente el compromiso fue del 100%. Lo anterior se relaciona con una fuerte coexistencia entre la severidad de la actividad y mayor riesgo de complicaciones infecciosas, evidenciado el 100% del compromiso en el grupo de ambas14. Además, aquellos con actividad presentaron más síntomas, como mialgias, y mayor compromiso hematológico que los que cursaron con infección. Sin embargo, no hubo diferencias significativas en los demás tipos de compromiso por LES. La literatura sugiere que no existe un único o múltiples hallazgos clínicos que puedan predecir con certeza si se trata de infección o actividad, e incluso en combinación con parámetros paraclínicos su diferenciación es difícil18,19.
Adicionalmente, otro gran interrogante que ha surgido a la hora de analizar los factores de riesgo asociados a las infecciones en pacientes con lupus es la afectación del sistema inmune secundaria a los diferentes esquemas de tratamiento. Dentro de los resultados de este estudio se encontró que el tratamiento previo con prednisolona, en especial en los últimos 3meses, fue más frecuente en el grupo de pacientes infectados que en los otros grupos. Sin embargo, no se encontraron diferencias significativas con el uso de los otros fármacos inmunosupresores.
La mayoría de los estudios han concluido que sí existe una relación entre el uso de ciertos inmunosupresores y el mayor desarrollo de infecciones, especialmente con dosis de prednisolona superiores a 20mg/día18-20. Un estudio prospectivo con 92 pacientes con LES reportó que en los que recibían dosis de mantenimiento o mayores (>20mg/día) la fiebre usualmente se asociaba a infección e incluso con el desarrollo de sepsis21. Se ha evaluado además su relación con el riesgo de infección por gérmenes oportunistas, encontrando que el uso de prednisolona a dosis medias (definidas como 15-30mg/día) y altas (30-60mg/día) en los primeros 3meses del diagnóstico vs. bajas dosis reportó un hazard ratio (HR) de 1,72 (IC95%: 1,02-2,91) y de 1,96 (IC95%: 1,17-3,28), respectivamente, representando un mayor riesgo; sin embargo, estos pacientes no tenían adecuado control de la enfermedad como limitación del estudio22. Algunos estudios son controversiales con respecto al riesgo de infección y el uso de otros fármacos inmunosupresores, como la ciclofosfamida14.
Dentro de las pruebas de laboratorio realizadas se encontraron niveles de complemento mayores en el grupo de infección frente a los demás grupos, pero no hubo diferencias significativas entre los demás. Varios autores han realizado estudios estableciendo comparaciones entre algunos reactantes de fase aguda, como la PCR, la VSG, la procalcitonina, así como otros marcadores y su utilidad a la hora de establecer si se trata de infección o de actividad23. La mayoría de ellos han propuesto la PCR como un marcador útil en esta diferenciación; sin embargo, se debe tener en cuenta un punto de corte más elevado (usualmente >10mg/dl), dado que valores más bajos se han observado en pacientes con actividad de la enfermedad18,24. Otros reactantes de fase aguda, como la ferritina o la VSG, parecen no contribuir a establecer la diferencia25,26.
La medición de procalcitonina ha arrojado resultados controversiales en este escenario27,28. Algunos estudios, incluyendo un metaanálisis publicado por Liu et al.29 en 2017, incluyeron 8 estudios con 205 pacientes con LES activo y 198 pacientes con LES e infección, sin encontrar diferencias significativas (diferencia estandarizada de medias de −0,45 (IC95%: −0,96 a 0,06). En contraparte, Serio et al.30 realizaron una revisión sistemática que incluía 12 artículos hasta 2013, observando valores superiores de procalcitonina en pacientes con infecciones bacterianas (valores >0,5μg/l). Algunos otros reportan una sensibilidad del 75% y una especificidad del 90% con el uso de procalcitonina en pacientes con enfermedades autoinmunes4,31. La verdadera utilidad de la procalcitonina es aún objeto de debate y la mayoría de los autores recomiendan, ante estos hallazgos, la combinación de múltiples parámetros de laboratorio junto a los hallazgos clínicos con el fin de obtener una diferenciación más objetiva. En la actualidad se están desarrollando estudios con nuevos marcadores en aras de optimizar esta diferenciación. Se han mencionado las proteínas de unión al calcio (S100A8/A9), el índice delta de neutrófilos, el índice neutrófilo/linfocito y el índice plaqueta/linfocito, los cuales se han asociado con la actividad de LES y probablemente con una mayor predicción de enfermedades bacterianas en estos pacientes32; sin embargo, hacen falta estudios con mayor población para confirmar esta premisa.
Entre las debilidades de este estudio se incluye sesgo de selección e información, teniendo en cuenta el análisis de sujetos en un hospital de tercer nivel de atención, el carácter retrospectivo del mismo, la limitación a un único centro de atención y el no poder discriminar el tipo de infección por órgano. Adicionalmente, es un estudio descriptivo, por lo cual los cruces realizados son únicamente exploratorios. Las comparaciones de variables donde se encontraron diferencias significativas deben ser corroboradas en otro tipo de estudios.
ConclusiónLa diferenciación entre infección o actividad en los pacientes con LES y fiebre representa en la actualidad un reto diagnóstico. A pesar de que se han realizado múltiples estudios para determinar diferentes escalas o marcadores clínicos y paraclínicos que generen predicción diagnóstica, aún no hay una recomendación clara sobre su utilidad y aplicación.
De acuerdo con la exploración hecha en este estudio, deben estudiarse el poder discriminatorio entre infección y actividad en pacientes con LES, de las variables, del uso de esteroides en los últimos 3meses, del puntaje de la escala SLEDAI y del tiempo transcurrido desde el diagnóstico de LES.
FinanciaciónLos autores no recibieron ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.