La depresión es una importante comorbilidad en pacientes con artritis reumatoide; diversos factores como la actividad de la enfermedad, el dolor y la discapacidad contribuyen a su desarrollo.
Materiales y métodosSe realizó un estudio transversal en pacientes con artritis reumatoide para determinar la prevalencia de depresión, utilizando el cuestionario Patient health questionnaire (PHQ-9) y su relación con la actividad de la enfermedad mediante DAS-28 y la discapacidad funcional mediante HAQ-DI.
ResultadosEl 42,9% de los pacientes presentaron depresión. Se encontró una asociación entre depresión con DAS-28 y HAQ-DI, ya que el 70% de los pacientes con alta actividad de la enfermedad y el 38% de los pacientes con discapacidad funcional presentaron depresión de moderada a grave. El número de articulaciones dolorosas y tumefactas fue mayor en los pacientes con depresión grave que en aquellos con depresión leve. Los pacientes con mayor depresión referían un dolor más intenso según la escala visual del dolor.
Depression is significant comorbidity in patients with rheumatoid arthritis (RA), with many factors, such as disease activity, pain, and disability determining its development.
Materials and methodA cross-sectional study including patients with rheumatoid arthritis was conducted to determine prevalence of depression using the Patient Health Questionnaire (PHQ-9), and its relationship with disease activity using DAS-28. The HAQ-DI was used to determine functional disability and the number of painful and swollen joints.
ResultsDepression was observed in 42.9% of the patients. An association was found between depression, DAS-28 and HAQ-DI. It was also found that 70% of the patients with high activity disease and 38% of the patients with functional disability had moderate-severe depression. The number of painful and swollen joints was greater in patients with severe depression than in patients with mild depression. Patients with greater depression referred to more intense pain according to the visual analogue pain scale.
La artritis reumatoide (AR) es una enfermedad inflamatoria, crónica, de etiología desconocida, que afecta, en su mayoría, a personas en edad productiva y caracterizada por poliartritis bilateral y simétrica de pequeñas y grandes articulaciones1. La depresión es una importante comorbilidad en pacientes con AR y se puede presentar de forma crónica o intermitente. Su incidencia es variable (10-25%) y es más frecuente en mujeres2. La incidencia de depresión en la población general es del 10% en mujeres y del 6% en varones3; las personas con enfermedades crónicas tienen de 5 a 10 veces más riesgo de depresión4.
Los factores que contribuyen a la depresión en pacientes reumáticos son diversos. Entre ellos se encuentran el dolor, sufrimiento por síntomas somáticos, las limitaciones funcionales, la liberación de citocinas proinflamatorias, la progresión de la enfermedad y la discapacidad5. Wolfe et al. determinaron que la actividad de la enfermedad, los cambios en el dolor y el Health assessment questionnaire disability index (HAQ-DI) predicen mayor depresión6,7.
La inflamación es la vía fisiopatológica común entre la depresión y enfermedades crónicas como la AR. En pacientes con depresión se ha observado un aumento de citocinas proinflamatorias, proteínas de fase aguda y moléculas de adhesión. Los estudios de Lanquillon et al., junto con los realizados por Alesci et al., encontraron concentraciones altas de interleucina 6 (IL-6) y proteína C reactiva (PCR) en pacientes con depresión8,9. Otros estudios describieron elevaciones de interleucina 1 beta (IL-1-β) y del factor de necrosis tumoral alfa (TNF-α)10,11. Frommberger et al. encontraron que la IL-6 estaba elevada en pacientes durante la fase aguda de la depresión y que esta disminuía luego de alcanzar la remisión12.
El diagnóstico de depresión se hace mediante una entrevista psiquiátrica y los criterios clínicos del Manual diagnóstico y estadístico de los trastornos mentales (DSM-IV) que incluyen: estado de ánimo depresivo, disminución del interés o capacidad de placer, pérdida o ganancia considerable de peso, insomnio o hipersomnia, agitación o enlentecimiento psicomotor, fatiga, sentimiento de inutilidad o culpa, disminución de la capacidad de concentrarse o pensar, y pensamientos o intentos suicidas13. Cinco o más de los síntomas mencionados deben estar presentes durante al menos 2 semanas para el diagnóstico de depresión mayor.
En reumatología existen cuestionarios de tamización para ayudar a identificar pacientes con depresión, como: Patient health questionnaire 9 (PHQ-9), Hospital anxiety and depression scale (HADS), Hamilton rating scale for depression (HAM-D), Mental health inventory (MHI-5), Center for epidemiologic studies depression scale (CES-D) y Beck depression inventory (BDI-II). Estos cuestionarios tienen la ventaja de ser fáciles de responder y rápidos de interpretar14.
El PHQ-9 se basa en los criterios de diagnóstico del DSM-IV y permite medir el estado de ánimo del paciente en las semanas previas a la consulta. Estudios realizados sobre depresión en AR han utilizado este cuestionario debido a su reproducibilidad, validez, confiabilidad y sensibilidad al cambio15. Milette et al. compararon el PHQ-9 con la escala de depresión del CES-D y encontraron que ambos son similares en cuanto a validez y confiabilidad; sin embargo, el PHQ-9 tiene la ventaja de ser más corto y fácil de aplicar16.
Debido a la ausencia de datos similares en nuestro país, el objetivo de este estudio es evaluar la presencia de depresión en pacientes con diagnóstico establecido de AR, por medio del cuestionario de PHQ-9 y evaluar su relación con la actividad de la enfermedad.
Materiales y métodosSe realizó un estudio prospectivo de tipo descriptivo, en una población de pacientes con diagnóstico de AR, proveniente de la consulta externa del Hospital Luis Vernaza y de un centro de reumatología privado (CERER) de la ciudad de Guayaquil. El tiempo del estudio fue de un año.
Se incluyó a hombres y mujeres mayores de 18 años que tenían un diagnóstico establecido de AR, según los criterios del Colegio Americano de Reumatología 198717, excluyendo a pacientes con otras enfermedades del tejido conectivo y trastornos psiquiátricos conocidos. Se creó la base de datos que incluyó: manifestaciones clínicas, datos demográficos, etnia (autodefinida por cada paciente), comorbilidades (hipertensión arterial, diabetes mellitus, enfermedades tiroideas, gástricas, alérgicas y neoplasias), hábitos (alcohol, tabaco y fármacos), tratamiento habitual, escala visual análoga del dolor (EVA) hecha por el paciente y el médico, índice de actividad de la enfermedad DAS-28 —utilizando como marcador inflamatorio la PCR18—, índice de discapacidad HAQ-DI validado al español en 199319 y el cuestionario de depresión PHQ-9 validado al español en el año 200120.
Los datos fueron recolectados mediante cuestionarios que los pacientes llenaron individualmente luego de haber sido evaluados por el reumatólogo. Se consideraron valores estándares de remisión y actividad de la enfermedad mediante la escala DAS-28.
Los cuestionarios HAQ-DI y PHQ-9 fueron llenados exclusivamente por el paciente en su idioma nativo. El primero consta de 8 categorías y tiene una puntuación que va del 0 al 3, según el grado de dificultad que el paciente presenta en cada actividad. Una puntuación de HAQ-DI mayor a 1,25 indica discapacidad y 3, discapacidad grave. El PHQ-9 tiene 9 preguntas y una puntuación de 0 a 27. Puntajes de 0 a 4 indican ausencia de depresión; de 5 a 9, depresión leve; de 10 a 14, depresión moderada; de 15 a 19, depresión moderadamente grave y de 20 a 27, depresión grave.
Los datos fueron cargados y analizados en el programa estadístico SPSS v. 22. Las variables cualitativas fueron estudiadas utilizando estadística descriptiva con frecuencias y porcentajes, mientras que para las variables cuantitativas se utilizaron medidas de tendencia central, máximo y mínimo. Para los datos ordinales se calculó el coeficiente de correlación de Spearman y ANOVA para la comparación de las medias. La significación estadística empleada fue de 0,01, con una confiabilidad del 99%.
ResultadosSe incluyó a 184 pacientes con una edad promedio de 51 años (20-90 años), con una edad media de comienzo de la enfermedad de 40 años (18-49 años) y un seguimiento medio de 56 meses.
De acuerdo con los datos demográficos, el 94,6% eran mestizos; el 3,8%, blancos y el 1,6%, afroecuatorianos. De estos, el 10,3% provenían de atención pública; el 29,3% de atención privada y el 60,3% mixta (público-privada). El 86,4% de los pacientes provenían de zonas urbanas y el 13,6%, de zona rural; además, el 5,4% fumaba tabaco y el 4,9% ingería alcohol.
Las comorbilidades más frecuentes en los pacientes fueron la hipertensión arterial y la diabetes mellitus, con 28,3% cada una, como se evidencia en la tabla 1.
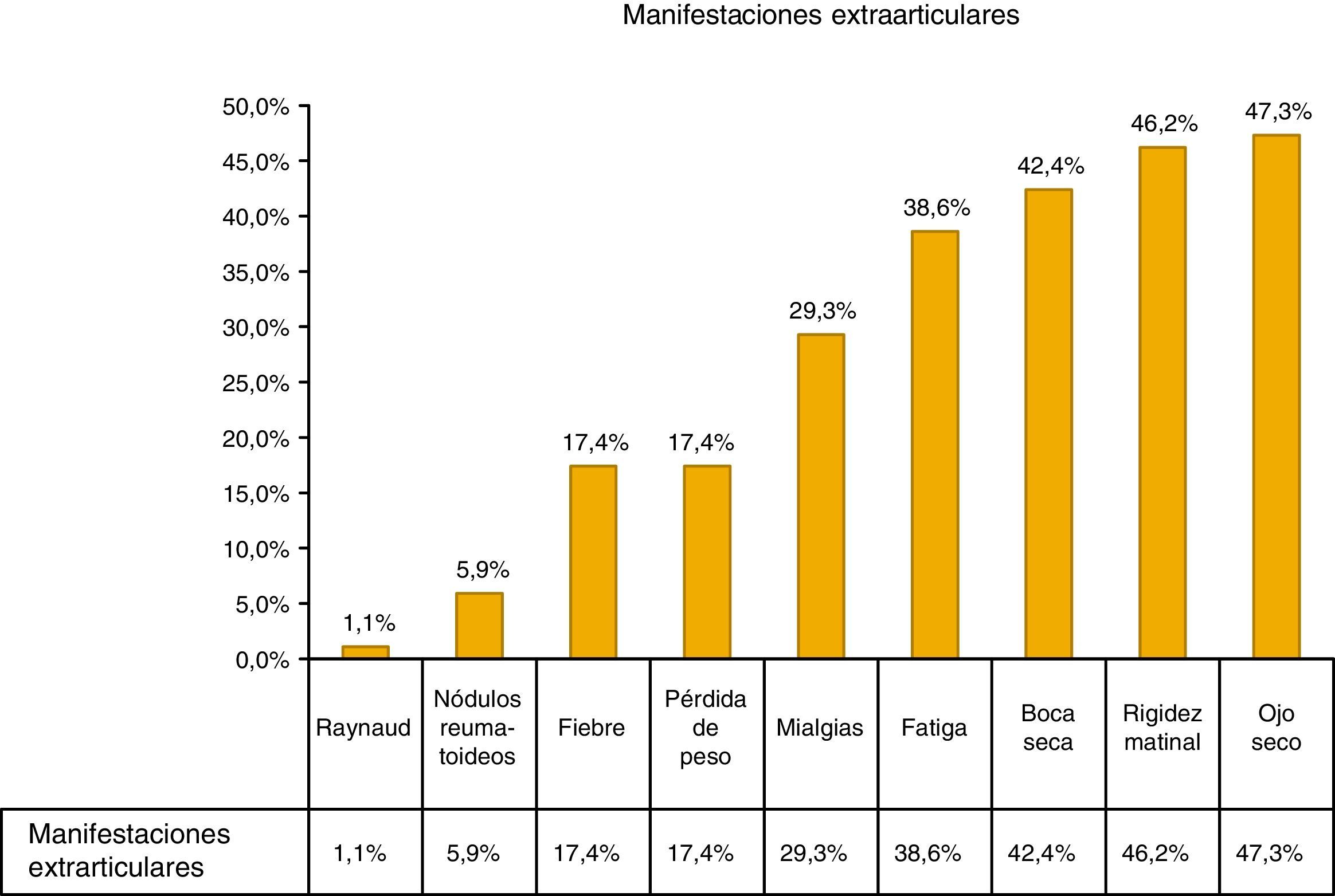
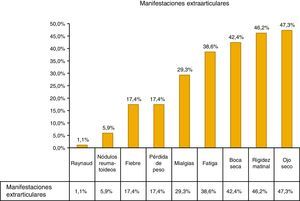
La manifestación extraarticular más común fue el ojo seco (47,3%), otras manifestaciones incluyeron: fiebre, pérdida de peso y mialgias, como se muestra en la figura 1.
La media del DAS-28 fue de 3,11 (0,7-7,6), con el 44% en remisión, el 16,8% de actividad baja, el 32,1% de actividad moderada y el 7,1% de actividad alta.
La media del cuestionario HAQ-DI fue de 0,8 (0-3), el 27,0% de la población estudiada presentó discapacidad funcional y el 1,6% presentó discapacidad grave.
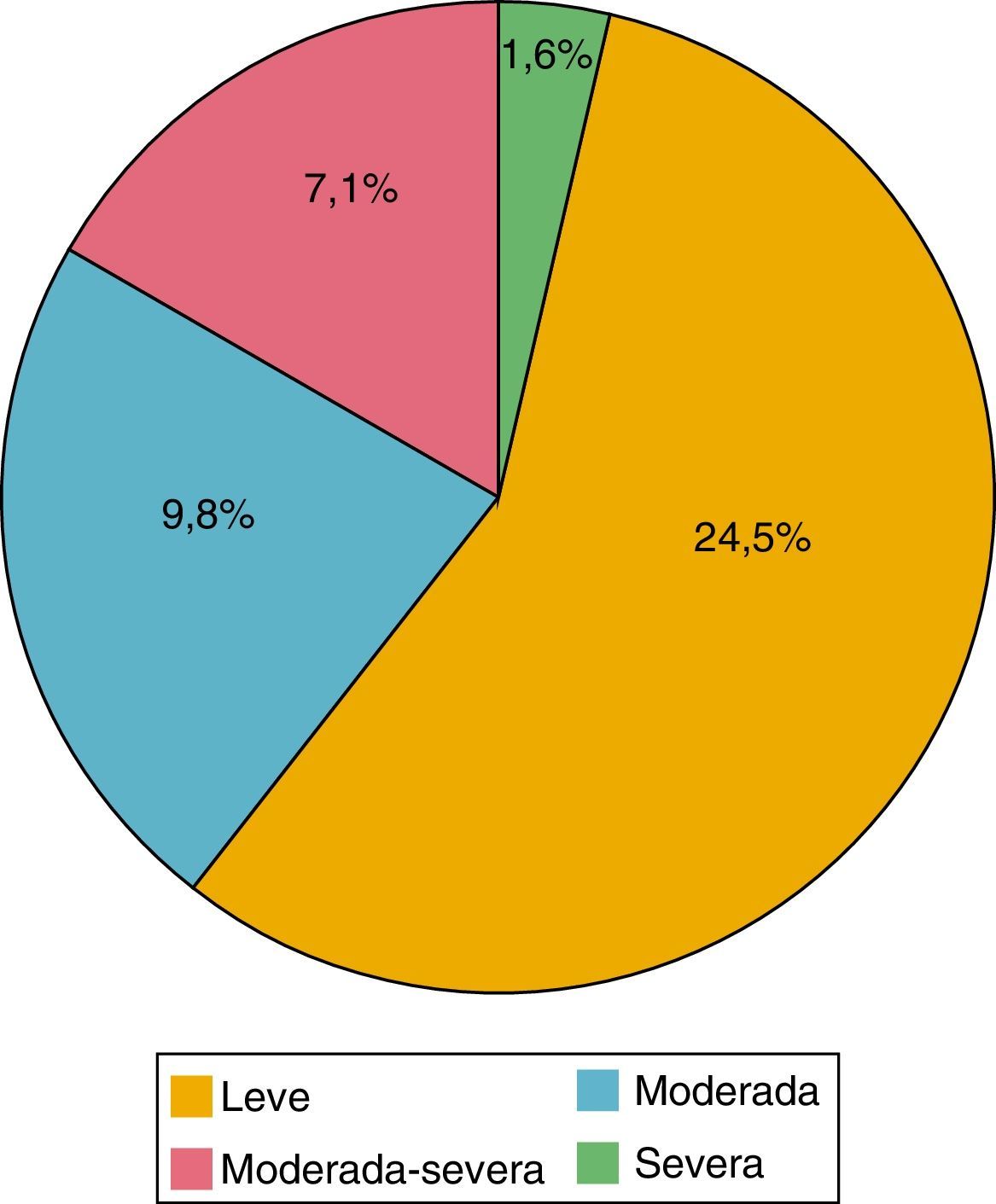
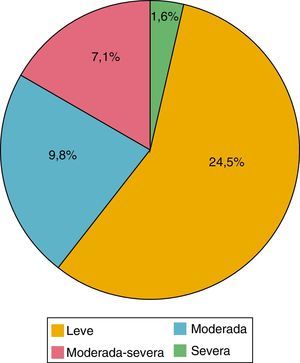
De los 184 pacientes estudiados, la media del cuestionario PHQ-9 fue de 5,39 puntos (0-24). De acuerdo con la evaluación de este cuestionario se encontró depresión en el 42,9%; de estos pacientes, el 24,5% tenía depresión leve; el 9,8% moderada, el 7,1% moderada grave y el 1,6% grave (fig. 2). El 89,9% eran mujeres y el 10,1% hombres; el 44,3% tenían un HAQ-DI>1,25 y el 46,8%, DAS-28>3,2.
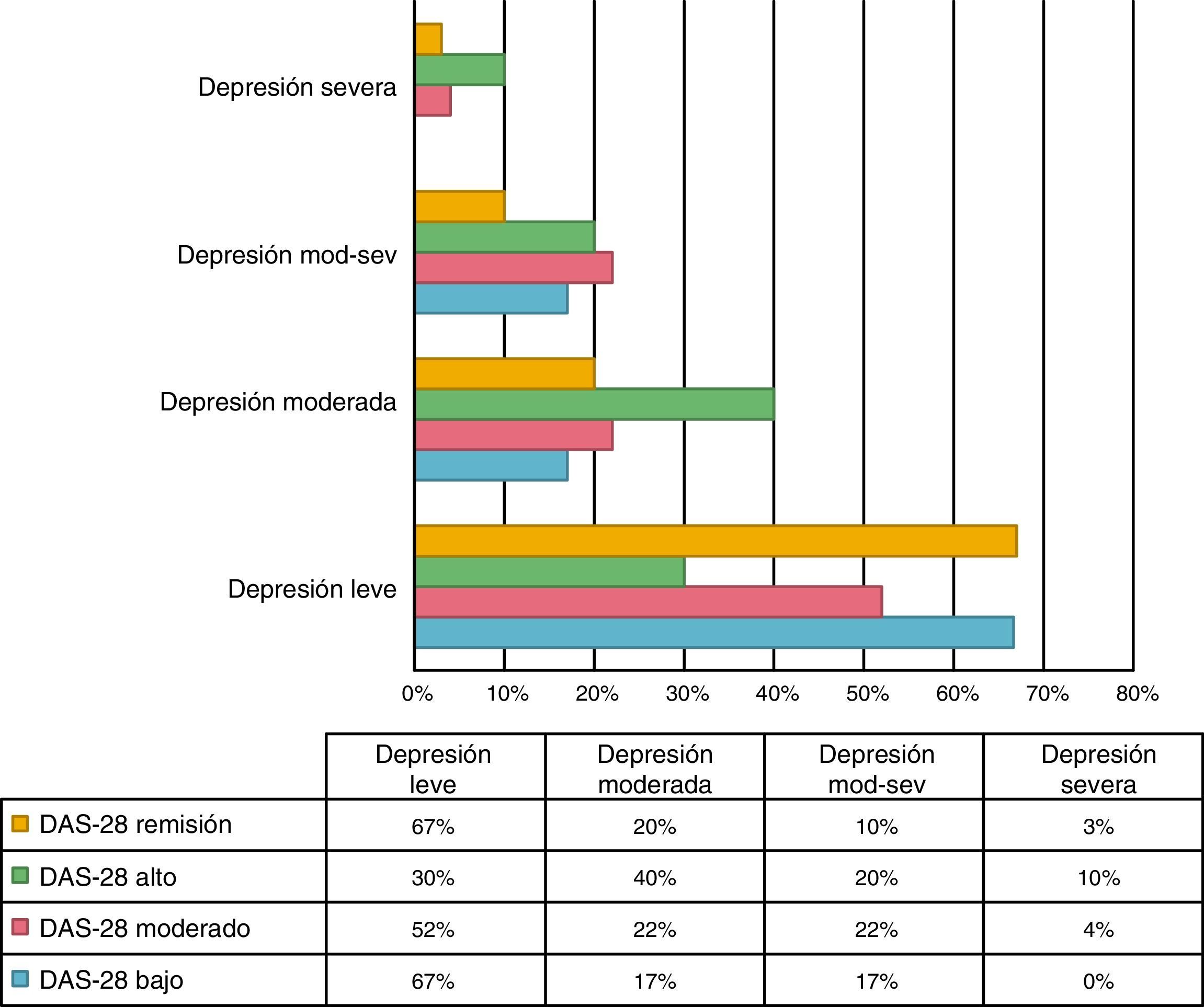
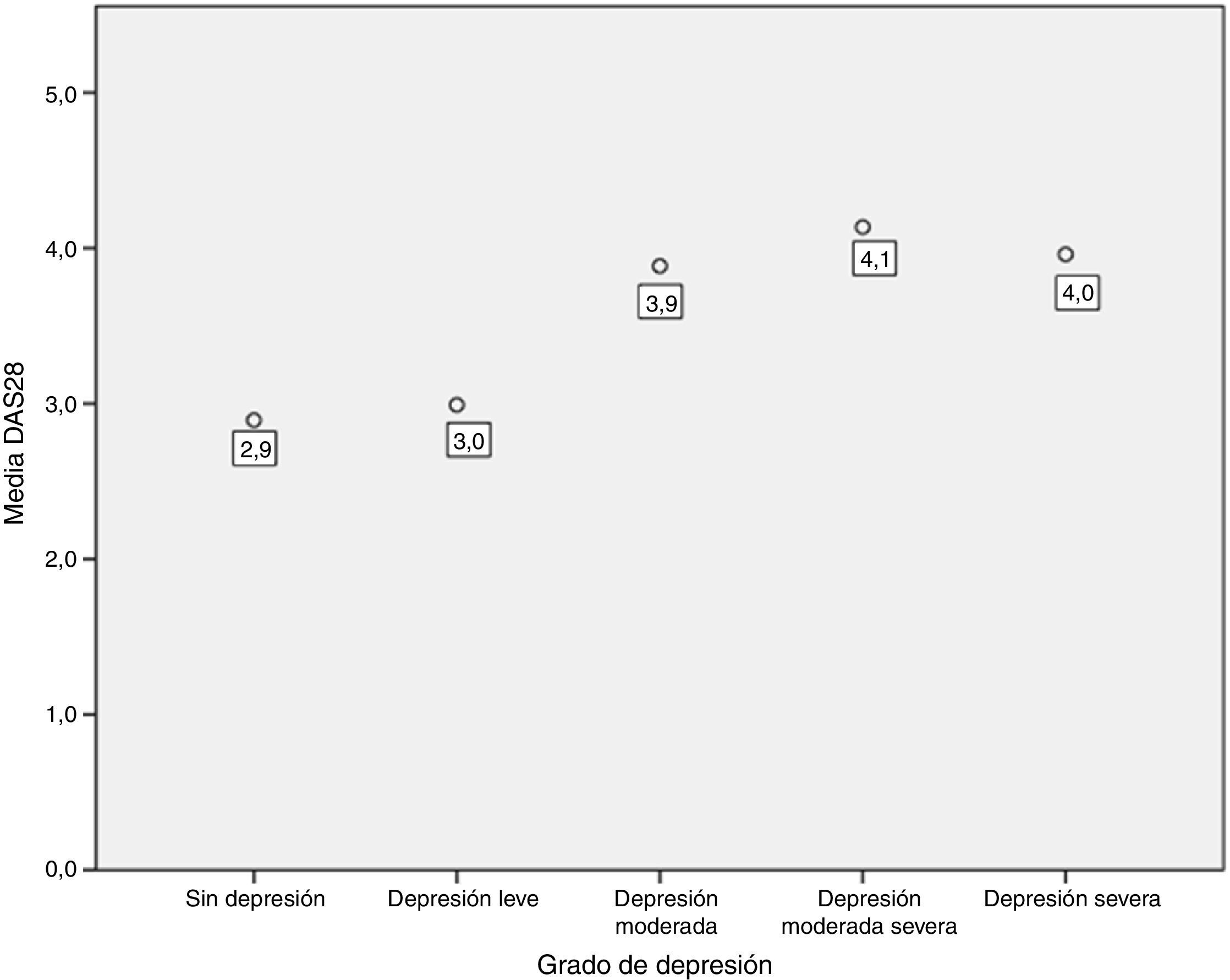
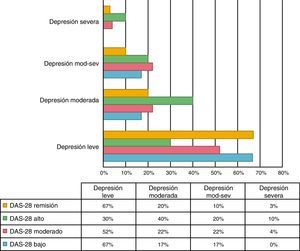
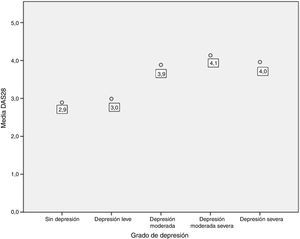
Se encontró una asociación entre los niveles de depresión y la actividad de la enfermedad por DAS-28 de PCR. El 66,7% de los pacientes en remisión tuvieron depresión leve, mientras que el 70% de los pacientes con actividad alta presentaron depresión de moderada a grave (p=0,009) (fig. 3). El promedio de DAS-28 para los pacientes con depresión moderada a grave fue mayor que en aquellos con depresión leve (4,0 vs. 2,9; p=0,004) (fig. 4).
La discapacidad también se relacionó con los niveles de depresión, ya que el 38,0% de los pacientes con discapacidad funcional (HAQ-DI>1,25) presentaron niveles de depresión moderada a severa, en comparación con el 11,19% de los pacientes sin discapacidad (p=0,000).
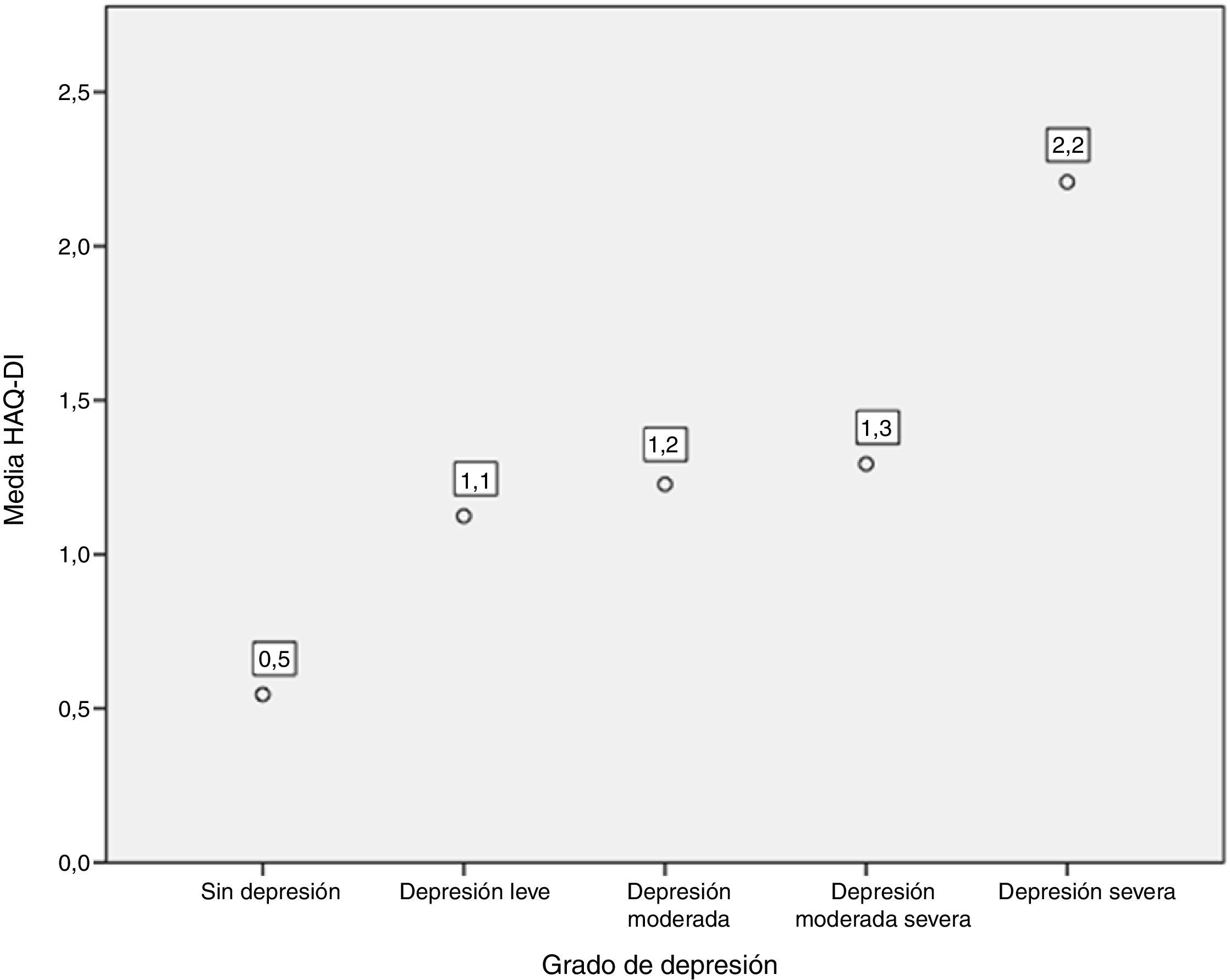
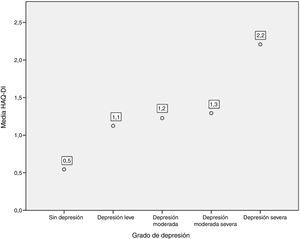
Así mismo, al comparar el HAQ-DI en los pacientes con depresión, se encontró que los pacientes con depresión grave tuvieron el valor medio más alto de HAQ-DI (con 2,2; p=0,000). Los 3 pacientes que presentaron discapacidad grave con HAQ-DI tuvieron niveles elevados de depresión medidos por PHQ-9 (fig. 5).
En cuanto a la EVA del paciente, se encontró que el valor medio en personas con depresión leve fue de 3,7, mientras que en depresión moderada a grave fue de 5,4 (p=0,000). En la del médico, el valor medio en personas con depresión leve fue de 3,1, mientras que en depresión de moderada a grave fue de 4,6 (p=0,000).
El número de articulaciones dolorosas fue mayor en los pacientes con depresión grave que en aquellos con depresión leve (7 vs. 1; p=0,000), al igual que las articulaciones tumefactas (8 vs. 1; p=0,000).
DiscusiónLa AR es una enfermedad inflamatoria, discapacitante e invalidante, que tiene un gran impacto en la vida emocional y física del paciente; los pacientes afectados por AR se enfrentan a estrés psicológico constante, por lo cual la depresión constituye una comorbilidad frecuente en ellos. En el metaanálisis realizado por Matcham y et al., se encontró que la prevalencia de depresión en pacientes con AR fue del 38,8%21. Esto es ligeramente inferior a lo encontrado en el presente estudio, que fue del 42,9%. Dickens et al. publicaron que había mayor depresión en pacientes con AR que en osteoartritis; sin embargo, esta era menor que en las personas con fibromialgia22. La prevalencia de depresión en pacientes con AR es incluso mayor que la observada en pacientes diabéticos (12%)23, con enfermedad de Parkinson (17%)24 y cáncer (24%)25.
La media de PHQ-9 en este estudio fue de 5,39, cifra que, al igual que en el estudio de Margaretten en el que la media fue de 7,0, corresponde a depresión leve26. El cuestionario PHQ-9ha demostrado ser útil, confiable y reproducible para evaluar la depresión. Englebrecht et al. demostraron que el PHQ-9 tiene una fiabilidad de r=0,68 (p<0,001), validez convergente r=0,61 (p<0,001) y validez discriminante r=−0,13 (p=0,074) vs. otros cuestionarios que evalúan depresión, como el inventario de depresión Beck II, el índice de bienestar general WHO-5 y la escala de depresión de Montgomery-Asberg14.
Wolfe demostró que la depresión se asocia a discapacidad de la enfermedad, edad, dolor y tiempo entre las visitas7. Rathbun coincidió con esto, ya que, en su estudio, las medidas de actividad de la enfermedad se asociaron con síntomas depresivos previos, habiendo mayor correlación con la EVA del paciente, dolor y HAQ-DI2. En el presente estudio se demostró una relación entre los niveles de depresión, EVA del paciente, EVA del médico, HAQ-DI, DAS-28 y número de articulaciones tumefactas y dolorosas.
Kekow demostró que los pacientes que alcanzaban remisión clínica con DAS-28 tenían menos síntomas de depresión27. La relación fue similar en este estudio, ya que solo el 33,3% de los pacientes en remisión presentaron depresión de moderada a grave, en comparación con el 70% de los pacientes con actividad alta.
Diversos autores han demostrado que la relación entre depresión y actividad de la enfermedad es bidireccional; es decir, la actividad de la AR favorece la aparición de depresión y, a su vez, la depresión influye en la actividad de la AR28. En el trabajo de Hider et al., se vio que los pacientes con depresión tuvieron puntajes DAS-28 más altos y aquellos que estaban persistentemente deprimidos tuvieron menor reducción en dicho puntaje a lo largo del tiempo, a pesar de ser tratados con terapia anti-TNF29.
Esta relación entre depresión y actividad de la enfermedad se basa en el estado proinflamatorio en el que se encuentran las personas con enfermedades crónicas. Las citocinas liberadas en la periferia llegan al cerebro mediante diversas vías. Maier y Watkins establecieron que la comunicación entre el sistema inmune y el cerebro se da por la entrada de citocinas a través de órganos circunventriculares, unión a moléculas transportadoras expresadas en el endotelio cerebral y activación de fibras vagales aferentes que transmiten señales a núcleos cerebrales específicos como el tracto solitario30. Una vez ahí, ejercen efectos en los neurotransmisores, lo cual produce alteraciones en el comportamiento31. Dunn et al. estudiaron los efectos de las citocinas en la neurotransmisión y encontraron que la IL-1, IL-6 y TNF-α alteran el metabolismo de la serotonina, norepinefrina y dopamina en regiones reguladoras de la emoción como el sistema límbico32.
Magni et al. encontraron que el dolor aumenta la depresión y que la depresión contribuye a la persistencia y aumento del dolor33; en los estudios de Conner et al., junto con los de Zautra et al., los pacientes que tenían depresión recurrente reportaron mayores niveles de dolor que los que no tenían depresión34,35. Esto se puede atribuir a que los pensamientos negativos en la depresión afectan la forma en que los pacientes perciben sus síntomas somáticos.
Así mismo, las limitaciones funcionales conllevan depresión, lo cual aumenta la discapacidad. Según Katz y Yelin, una reducción del 10% en la capacidad de llevar a cabo actividades de la vida diaria ocasiona un aumento de 7 veces el riesgo de depresión en los años siguientes36.
Diversos autores han demostrado que la depresión es más común en las mujeres, solteras, de raza blanca y jóvenes2,37,38. Wolfe demostró que los cambios en el grado de depresión se relacionan, aunque en menor medida, con el nivel de educación, rigidez matutina y la duración de la enfermedad7. En este estudio, la depresión fue más común en mujeres; sin embargo, no se encontró ninguna relación con las demás variables demográficas.
Además de la actividad de la enfermedad y la discapacidad, Covic estableció que la baja autoestima, la tensión emocional, la fatiga y el dolor constituyen predictores fuertes de depresión39. Otros predictores encontrados fueron la presencia de mialgias y sentirse deprimido. En el estudio de Kojima et al., los puntajes de depresión se correlacionaron con los niveles de PCR y ambos, a su vez, con los niveles de dolor40. En otro estudio, la PCR también se asoció a actividad de la enfermedad, depresión y discapacidad, en mayor medida que la VSG41.
Las consecuencias de la depresión en pacientes con AR son diversas y ocasionan gran deterioro de la calidad de vida. Las alteraciones del sueño son más comunes en los pacientes que presentan depresión recurrente, como se evidenció en el estudio de Jindal et al.; el suicidio y las ideas suicidas también son mayores42. Treharne et al. demostraron que el 11% de los pacientes con AR habían tenido ideas suicidas, que son más comunes en mujeres43. Así mismo, en otro estudio, se demostró que la odds ratio para ideas suicidas en las personas con artritis es 2 veces mayor que en aquellas sin artritis39.
Timonen et al. analizaron los registros de suicidios en el norte de Finlandia desde 1988 hasta el 2000 y encontraron 19 casos de suicidio en pacientes con AR. De estos, el 52,6% eran de mujeres, el 90% había presentado depresión previa al suicidio y el 50% había tenido un intento de suicidio previo44.
Rathbun et al. encontraron que la depresión disminuía la eficacia del tratamiento farmacológico y no farmacológico de la AR45. DiMatteo et al. encontraron que la depresión se asociaba a una falta de adherencia al tratamiento46. Además, se relaciona con un aumento en la tasa de interrupción, como se vio en el estudio de Mattey47.
La mayoría de los pacientes con AR y depresión no han consultado a un profesional de la salud mental. Fuller y Shaked determinaron que solo el 45% de las personas con ambas comorbilidades había asistido a consulta por depresión, el 29% había tenido más de 4 visitas, un tercio usaba antidepresivos y el 25% había discutido sus problemas mentales con su médico de familia37.
Con el tratamiento correcto de la depresión se puede mejorar el estado de salud del paciente y la calidad de vida. Lin et al. demostraron que los pacientes con artritis y depresión que recibieron terapia presentaron en 12 meses una reducción de los síntomas depresivos, reducción de los scores de dolor y mejoría funcional por menor interferencia con las actividades diarias48.
El reconocimiento y el tratamiento de la depresión en pacientes con AR es importante, ya que esta entidad afecta al estado de salud del paciente y a la capacidad de manejar su enfermedad. Ang et al. determinaron que la depresión incrementa el riesgo de mortalidad en pacientes con AR con una hazard ratio de 2,228. En cuanto al factor económico, los costos en salud de los pacientes con AR y depresión aumentan significativamente. Joyce et al. encontraron que los costos anuales de la enfermedad en pacientes con AR y depresión (12,225 $) fueron mayores que los que tenían solo AR (11,404 $)49. Otras repercusiones que se dan por la depresión son: la ausencia laboral, ideas suicidas y poca adherencia al tratamiento médico.
La presencia de depresión en pacientes ecuatorianos con AR fue alta, similar a la de otras poblaciones, las mujeres fueron las más afectadas, la depresión se asoció a mayor discapacidad y actividad de la enfermedad.
La principal limitación de este estudio es el uso del cuestionario PHQ-9 que, a pesar de tener excelente fiabilidad para detectar depresión, no constituye el diagnóstico de elección con criterios del DSM-IV; además no se recolectó información acerca de ideas suicidas, ni de uso de antidepresivos.
Hasta donde se sabe, este es el primer estudio de depresión en AR del país; la enfermedad está estrechamente relacionada con la depresión, por lo que sería recomendable que los pacientes recibieran evaluación psicológica en caso de presentar manifestaciones clínicas que indiquen depresión. Adicionalmente se debe recordar que la depresión y la AR presentan síntomas en común como fatiga, insomnio y pérdida del apetito, que dificultan su diagnóstico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNo existe conflicto de intereses.