La artritis reactiva describe la interrelación entre el hospedero y el medio ambiente. Aparece después de infecciones urogenitales o digestivas. Clínicamente presenta dolor lumbosacro inflamatorio, oligoartritis asimétrica y entesitis del tendón de Aquiles y la fascia plantar. Entre las manifestaciones extraarticulares, se encuentran la uveítis anterior aguda, lesiones en piel, lesiones genitales y úlceras orales. Las más infrecuentes son las cardiovasculares. Describimos el caso de un paciente con infección urogenital y manifestaciones cardiovasculares interpretadas y manejadas como síndrome coronario agudo, pero que a la luz de estudios posteriores se consideró finalmente una miopericarditis aguda como manifestación primaria de una artritis reactiva.
Reactive arthritis describes the relationship between the host and the environment. This leads to urogenital or gastrointestinal infections. It clinically presents with inflammatory lumbosacral pain, asymmetric oligoarthritis and enthesitis of the Achilles tendon and plantar fascia. Among the extra-articular manifestations are acute anterior uveitis, skin lesions, genital lesions, and oral ulcers, with the rarest being cardiovascular. A case is presented of a patient with a urogenital infection and cardiovascular manifestations, interpreted and managed as acute coronary syndrome. After further studies an acute myopericarditis was considered as a primary manifestation of reactive arthritis.
La artritis reactiva es uno de los tipos de artritis inflamatoria que describe claramente la interrelación entre los factores del hospedero y los ambientales. Aparece después de cuadros infecciosos urogenitales o digestivos en personas predispuestas1. Se han implicado diferentes agentes infecciosos, dependiendo del origen de la infección, sin embargo se considera que existe un amplio subregistro de los agentes, por la falta de documentación de la enfermedad, así como la dificultad en el diagnóstico microbiológico o serológico, dada la temporalidad del cuadro y el curso asintomático de algunos casos, como los desencadenados por Chlamydia2. Clínicamente, los síntomas de la artritis reactiva se desarrollan entre una a 4 semanas después de la infección desencadenante y se caracteriza por dolor lumbosacro inflamatorio, oligoartritis asimétrica, entesitis y síntomas extraarticulares, que en orden de frecuencia son: uveítis anterior aguda (50-75%), lesiones en piel, lesiones genitales (20-40%) y úlceras orales1,2. Las manifestaciones cardiovasculares son infrecuentes, aunque algunas series las han reportado hasta en el 10% de los pacientes2. A continuación presentamos el caso de un paciente con orquiepididimitis quien desarrolla una miopericarditis aguda secundaria.
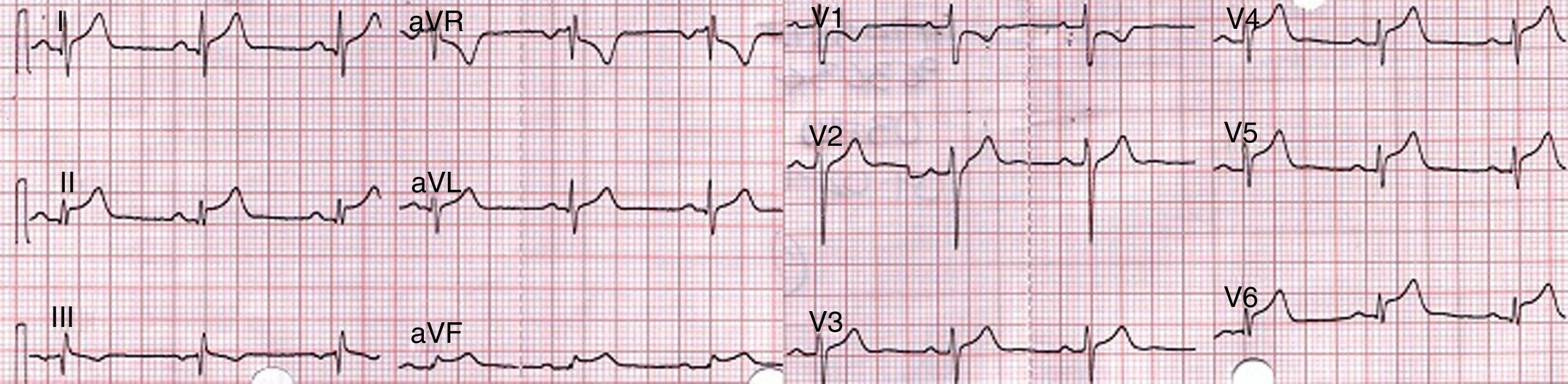
Presentación del casoPaciente de 44 años, con cuadro de una semana de dolor y edema en región testicular izquierda, asociado a síntomas constitucionales. Consultó a nuestro centro donde se diagnosticó orquiepididimitis aguda e iniciaron manejo antibiótico con ceftriaxona y doxiciclina. Transcurridas 48 h de observación, el paciente refirió inicio súbito de dolor precordial, con disnea y disautonomía franca. Toman EKG que muestra supradesnivel cóncavo del ST en cara inferior y lateral con supradesnivel del PR en aVR (fig. 1).
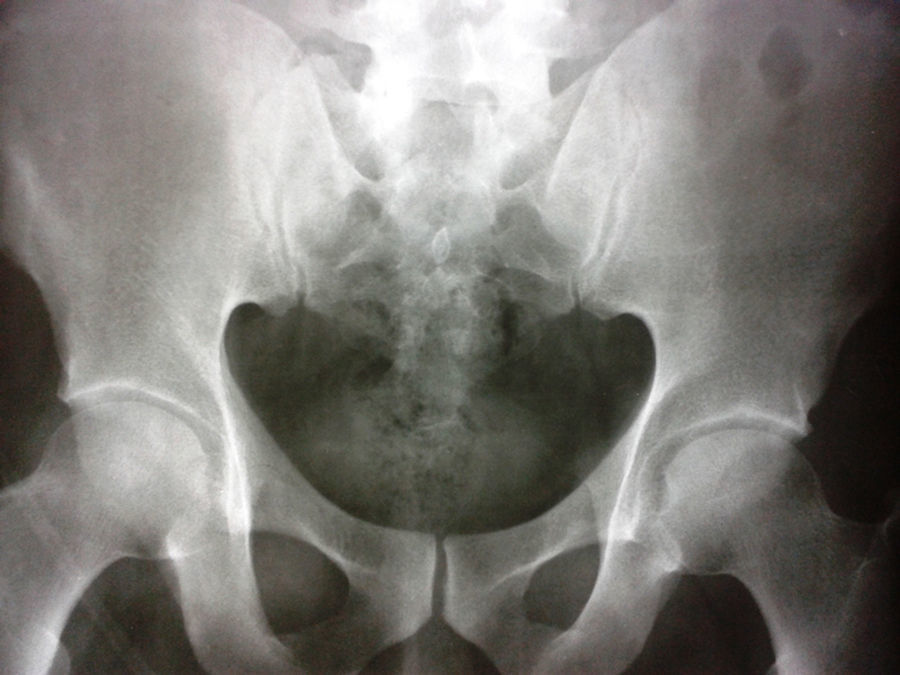
Los observadores iniciales consideraron un infarto agudo de miocardio con elevación del ST, razón por la cual decidieron trombolizar con alteplase, con mejoría del dolor precordial y disminución del segmento ST en el EKG de control postrombólisis. Los paraclínicos mostraron: troponina inicial de 2,88 ng/mL (positiva>0,5); segunda troponina de control de 6,53 ng/mL y tercera troponina de 14,7 ng/mL. El ecocardiograma TT mostró una cardiopatía hipertrófica concéntrica y miocardio hiperdinámico. FEVI: 70%. Hipoquinesia leve inferior. PSP: 33mmHg. Aurículas normales. Leve dilatación de la aorta ascendente. Fue llevado a angiografía coronaria, donde reportaron arterias coronarias sin lesiones. Durante su evolución el paciente refirió dolor lumbosacro por lo cual solicitaron una radiografía de pelvis, la cual tuvo hallazgos sugestivos de sacroileítis grado 2 (fig. 2).
Los paraclínicos adicionales mostraron, uroanálisis: nitritos negativos, estearasa de leucocitos: 70 leu/ul, sedimento con leucocitos: 8 - 10 x C, hematíes: 6 - 8 x C eumorfos, bacterias:+. Urocultivo: negativo. PCR: 16,2mg/dl, VSG: 52mm3/hora. Dado el resultado negativo del urocultivo asociado a leucocituria y la aparición de los síntomas cardiovasculares, a pesar del manejo empírico inicial se decidió solicitar cultivo de semen buscando un posible microorganismo aún no cubierto. El cultivo de semen reportó más de 100.000 unidades formadoras de colonias de Staphylococcus haemolyticus (S. haemolyticus) resistente a meticilina, que requirió manejo con vancomicina con adecuada evolución. Se consideró, entonces, que el paciente cursó con una artritis reactiva de origen urogenital, con compromiso cardiaco (miopericarditis), dados los cambios electrocardiográficos, sugestivos de pericarditis asociada a la elevación de biomarcadores de injuria miocárdica. Se inició manejo antiinflamatorio con Naproxen con rápida resolución del dolor precordial y lumbosacro. Se dio egreso al paciente después de 2 semanas de manejo intrahospitalario.
DiscusiónLa artritis reactiva, considerada dentro del grupo de las espondiloartropatías seronegativas, se presenta con mayor frecuencia entre los 20 a 40 años, y tiende a ser más frecuente en el sexo masculino, cuando su origen es urogenital y de igual distribución en los casos de origen gastrointestinal. En Colombia no existen datos acerca de la prevalencia o incidencia de esta enfermedad, sin embargo, algunos datos de países desarrollados refieren una incidencia de uno a 30 casos por 100.000 personas/año2. Los agentes principalmente implicados en la etiopatogenia de la enfermedad, varían según el origen de la infección. En el tracto gastrointestinal se encuentran: Yersinia, Salmonella, Shigella, Campylobacter jejuni. En el tracto urogenital: Chlamydia trachomatis (C. trachomatis), Neisseria gonorrhoea, Mycoplasma genitalium, Ureaplasma urealyticum (U. urealyticum)1,2. Otros diferentes agentes infecciosos han sido reportados como desencadenantes de la enfermedad, pero su prevalencia es realmente baja, por lo que a la fecha solo existen unos pocos reportes de casos en la literatura, ninguno que incluya infección por S. haemolyticus.
El compromiso cardiovascular de las enfermedades reumatológicas ha sido ampliamente descrito, principalmente la correlación con enfermedad coronaria temprana y artritis reumatoidea (OR 1,59, IC 95%: 1,46-1,73) o lupus eritematoso sistémico (OR 52,43; IC 95%: 21,6-98,5), con respecto a la población general de la misma edad y sexo3. Respecto a las espondiloartropatías seronegativas, la espondilitis anquilosante fue la mejor documentada en estudios ecocardiográficos y de autopsia, refiriendo aortitis proximal con daño valvular secundario (prevalencia del 18%), trastornos de la conducción AV (7 al 15%), miocarditis y falla cardiaca con FE disminuida (18% en el estudio de Brewerton, muy similar a lo reportado por Pizepiera-Bedzak en pacientes con artritis psoriásica), pericarditis sintomática (1%) y derrame pericárdico asintomático, no explicado por otras causas (4 a 42%)4–6. Todas las manifestaciones anteriores se asocian a la presencia de HLA-B277.
En artritis reactiva, los datos son escasos, confinados a reportes de casos desde los años 40 y solo una serie de 344 pacientes descrita por Paronen en 1948, de los cuales el 69,8% cumplía con los criterios de clasificación del síndrome de Reiter y el 6,7% (23 pacientes) presentó compromiso cardiovascular. Para la época el diagnóstico de miocarditis, pericarditis y daño valvular se basó en hallazgos clínicos y electrocardiográficos8. En referencia a los primeros se destacó el frote pericárdico generalmente asociado a dolor por pericarditis aguda, ritmo de galope y soplo sistólico apical. Las principales alteraciones eléctricas referidas fueron: prolongación del intervalo PR, bloqueos auriculoventriculares, prolongación del QRS, alteraciones del ST u onda T, como las más frecuentes. Otros 6 casos fueron reportados entre 1960 y 1993, con datos disponibles solo en 3 de ellos, entre los que describen eventos similares a lo reportado por Paronen, alteraciones electrocardiográficas y anormalidades al examen físico cardiovascular, sin embargo para 1992 Gran et al., aporta las mediciones ecocardiográficas encontrando dilatación de cámaras cardiacas y disminución en la FEVI, en su paciente con miocarditis y artritis reactiva secundaria a Chlamydia pneumoniae8–13. Debe tenerse en cuenta que en pacientes con enfermedad activa persistente, finalmente se desarrolla un síndrome similar al de la espondilitis anquilosante, llevando a la insuficiencia valvular aórtica y los trastornos de la conducción en un periodo que puede variar entre 4 y 31 años, después de la primoinfección7,8.
En el caso de nuestro paciente, se encontraron varios aspectos interesantes, como fue el compromiso miocárdico y pericárdico, evidenciado por la elevación de biomarcadores de injuria y los cambios electrocardiográficos sugestivos de pericarditis, asociado a la confirmación angiográfica de coronarias sanas, en el escenario de una orquiepididimitis aguda. Desde el punto de vista microbiológico, al ingreso, se pudo establecer un proceso inflamatorio del tracto urinario, por el recuento de leucocitos, eritrocitos y la estearasa leucocitaria positiva pero con urocultivo negativo, motivo por el que se procedió a la toma de cultivo de semen, con el fin de determinar un microorganismo diferente a bacterias gram negativas, C. trachomatis, U. urealyticum y Mycoplasma hominis, ya cubiertos empíricamente con el tratamiento inicial. El cultivo de semen reportó S. haemolyticus, con un recuento de colonias mayor a 100.000UFC. Si bien algunos estudios como el publicado por Strebel et al., establece que los principales microorganismos comensales de la uretra son el Streptococcus alfa-hemolítico y Staphylococcus coagulasa-negativo, también lograron determinar que la presencia de estos microorganismos debe evaluarse en función del recuento de colonias en el cultivo de semen y la historia personal del paciente, ya que hasta el 33% de los pacientes con recuento de colonias significativo (recuento mayor a 105), ya había presentado un episodio previo de epididimitis o prostatitis en menor proporción. Otro hallazgo llamativo en dicho estudio es que más del 50% de los aislamientos en cultivo o por PCR se obtuvieron solo en muestras de semen14. Por lo anterior, aunque las recomendaciones en guías de manejo establecen que el urocultivo es la piedra angular del diagnóstico, no debe olvidarse la utilidad que ofrece también el cultivo de semen, con las salvedades previamente referidas15. Fisiopatológicamente es de vital importancia conocer la virulencia de este microorganismo, ya que como todos los Staphylococcus coagulasa-negativos, tiene la capacidad de formar biofilms sobre dispositivos protésicos, así como macrocolonias que limitan el efecto bactericida de los antibióticos. Por otro lado S. haemolyticus tiene la capacidad de producir hemolisina, citolisina y enterotoxina, lo cual acarrea compromiso tisular, mayor virulencia y lleva a la colonización ascendente retrograda de las vías urinarias causando procesos infecciosos locales (epididimitis, cistitis) o sistémicos (bacteriemia), principalmente en pacientes inmunosuprimidos16. Con lo anterior se considera finalmente que se trata de un caso de artritis reactiva secundario a infección por S. haemolyticus resistente a metilcilina, aislado en el cultivo de semen que tiene como manifestación primaria una miopericarditis aguda.
Queda por aclarar qué mecanismo llevó a la mejoría de los cambios electrocardiográficos después de la trombólisis, lo cual fue interpretado como reperfusión exitosa. A este respecto no existe suficiente soporte bibliográfico que lleve a una explicación fisiopatológica, dado el bajo número de casos reportados en este contexto clínico específico. Sin embargo, Millaire et al., en 1995, publicó una serie de 9 casos de miopericarditis diagnosticados erróneamente como infarto agudo de miocardio con elevación del ST y que recibieron terapia trombolítica. En estos pacientes se reportó una baja tasa de complicaciones (solo uno de los 9 pacientes presentó derrame pericárdico no crítico) y una mejoría de los cambios electrocardiográficos después de la trombólisis17. Es poco probable que tal regresión de los cambios electrocardiográficos se deba a algún efecto secundario del trombolítico (ya que no se han descrito propiedades antiinflamatorias), y muy posiblemente se debió al uso concomitante de estatinas (suministradas por la consideración diagnóstica inicial), dados sus efectos antiinflamatorios e inmunomoduladores, que ya han sido claramente documentados tanto en miocarditis de origen viral como en miocarditis autoimune experimental en modelos murinos, desde los puntos de vista ecocardiográfico e histopatológico18,19. Por otro lado, pudiera tratarse simplemente del curso evolutivo natural de los cambios electrocardiográficos en este tipo de procesos.
Otro aspecto a discutir y que puede llevar a mútiples opiniones, está dado por el manejo ideal en este grupo de patologías, ya que no existen evidencias fuertes al respecto.
En primera instancia se debe tener claridad en los conceptos y tipos de síndromes miopericárdicos que muchas veces en la literatura se utilizan de forma indistinta para referirse a la misma enfermedad. El espectro de este síndrome puede variar desde una pericarditis pura, hacia grados variables de compromiso miocárdico (miopericarditis cuando existió compromiso pericárdico primario o perimiocarditis cuando existió un compromiso miocárdico primario), hasta una miocarditis pura20, lo cual va a direccionar el tratamiento adecuado para el paciente. Al día de hoy se considera que la primera línea de manejo, en este tipo de manifestaciones cardiovasculares asociadas a las enfermedades del colágeno, continúan siendo los antiinflamatorios no esteroideos (AINE) y la colchicina como terapia antiinflamatoria no específica, principalmente en el contexto de pericarditis aguda pura y en las miopericarditis/perimiocarditis con fracción de eyección ventricular izquierda (FEVI) preservada21. Imazio et al., en el 2013, publicaron un estudio de cohorte prospectivo de pacientes con pericarditis y compromiso miocárdico (n=486 pacientes) con una media de seguimiento a 36 meses, en el cual describieron que en el 10% de la población estudiada existía asociación con una enfermedad del colágeno. Hubo una clara tendencia al manejo con AINE o aspirina en los pacientes con pericarditis o miopericarditis (94 y 88% respectivamente), pero en los pacientes con perimiocarditis el uso de AINE fue solo del 17% y su tratamiento se basó fundamentalmente en inhibidores de la enzima convertidora de angiotensina y beta bloqueadores. Como dato adicional, describen que durante el seguimiento no se reportó un aumento en la mortalidad en aquellos pacientes con niveles de troponina elevados y que la mayor tasa de recurrencia se observó en pacientes con pericarditis pura, lo cual llevó a la deducción de que la historia natural de la enfermedad con los tratamientos descritos suele tener un buen pronóstico20.
Cuando existe compromiso miocárdico primario, evidenciado por la presencia de trastornos segmentarios y especialmente disminución de la FEVI, el grado de recomendación de los AINE disminuye, dada la evidencia existente y extrapolada, en la que se involucran con un aumento de la mortalidad en la miocarditis viral en modelos murinos22. Se considera en estos casos que el manejo ideal es la terapia inmunosupresora sistémica, donde tiene un rol la terapia con glucocorticoides3,4,23,24 y probablemente los bloqueadores del factor de necrosis tumoral alfa3.
En el contexto de una miocarditis como manifestación extraarticular de una enfermedad reumática, no existen estudios con diseños metodológicos de alto poder estadístico para el uso de corticoides, dada la baja prevalencia de la enfermedad, por lo que su recomendación parte de reportes de casos. Sin embargo, no se debe confundir la evidencia existente y creciente de este grupo de medicamentos en estudios como el Myocarditis Treatment Trial, ESETCID y TIMIC, en los cuales se incluyeron pacientes con miocarditis viral, cardiomiopatía viral (demostrada y clasificada por PCR para virus cardiotrópicos en biopsia endomiocárdica y recuento de linfocitos) o miocarditis virus negativos, clasificados histopatológicamente como miocarditis linfocitaria aguda o miocarditis autorreactiva23, cuya causa principal siguen siendo las infecciones virales y no el compromiso inflamatorio por las colagenopatías. A pesar de lo anterior es muy llamativo el hallazgo del estudio ESETSID en el cual se encontró una resolución espontánea de la miocarditis en el 45% de los pacientes en el grupo placebo, así como de la FEVI y la clase funcional25. Por último debe hacerse mención a que el uso de los corticoides en el contexto de pericarditis o perimiocarditis/miopericarditis, sin compromiso de la FEVI, tienen un efecto deletéreo, especialmente cuando se usan a dosis altas, con respecto a los AINE o la colchicina26. Más recientemente se ha introducido dentro del armamentario terapéutico el uso de los biológicos bloqueadores del factor de necrosis tumoral, los cuales claramente han cambiado la visión terapéutica en las espondiloatropatías y pueden generar una notable eficacia clínica en las manifestaciones extraarticulares. Sin embargo, algunos autores llaman la atención en los efectos adversos y precauciones (por ejemplo: trastornos del ritmo, hipertensión y trombosis) con el uso de estos medicamentos, principalmente en pacientes con falla cardiaca temprana y probablemente no en todos aquellos con falla cardiaca avanzada3,27.
Se consideró finalmente que la importancia en la descripción de este caso está en recordar y tener siempre en mente las manifestaciones cardiovasculares de las enfermedades reumatológicas, diferentes a la enfermedad coronaria, para tener un adecuado enfoque clínico en este grupo de pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.