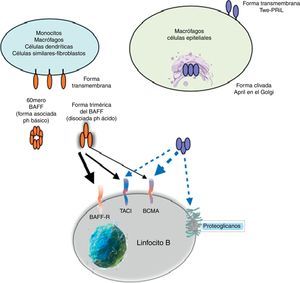
El complejo BAFF (factor activador de células B) compuesto por la citocina BAFF, APRIL y sus receptores —BAFF-R (BR3), TACI y BCMA— influyen en la sobrevida periférica, en la maduración de los linfocitos B y en el cambio de clase de las inmunoglobulinas, con múltiples implicaciones clínicas potenciales. Las funciones biológicas de BAFF y su relevancia en varios desórdenes clínicos —autoinmunes, neoplásicos, infecciosos, incluyendo las terapias BAFF dirigidas— son revisadas y discutidas en el presente artículo. Los niveles séricos de BAFF/APRIL se encuentran incrementados en las enfermedades autoinmunes en las que sus concentraciones se relacionan con los títulos de anticuerpos, actividad, progresión de la enfermedad e incluso compromiso orgánico, haciendo de su inhibición un blanco terapéutico atractivo.
The BAFF complex (B cell activator factor) composed by the BAFF cytokine, APRIL and their receptors —BAFF-R (BR3), TACI, BCMA— influences B-lymphocyte maturation, peripheral survival and immunoglobulins class isotype switching, with multiple potential clinical implications. In this review we discuss BAFF biologic functions and it relevance in several clinical disorders —autoimmune, neoplastic, infectious and BAFF therapies—. BAFF/APRIL serum levels are increased in autoimmune diseases where their concentrations are related with disease antibodies titles, activity, progression and inclusive organic compromise, making its inhibition an important therapeutic target.
Las citocinas son un grupo de proteínas de bajo peso molecular (por lo general menos de 30kDa) producidas y secretadas durante respuestas inmunes innatas y adquiridas, que actúan como un sistema de señales, que permiten interacciones complejas entre células linfoides, inflamatorias y hematopoyéticas1. Mediante su unión a receptores específicos de la membrana presentes en las células blanco, inician una cascada de señalización intracelular que altera el patrón de expresión génica, regulando de esta manera importantes funciones biológicas, tales como el crecimiento celular, la activación, la supervivencia, la diferenciación e incluso la muerte celular1,2.
La citocina B-cell activating factor (BAFF), o factor de activación de linfocitos B, ha sido reconocida durante los últimos años como una citocina homeostática vital para la maduración, sobrevida de los linfocitos B periféricos, y desarrollo y activación de órganos linfoides. Esta citocina ejerce importantes funciones reguladoras induciendo respuestas pleiotrópicas a través de su interacción con 3 receptores: factor de necrosis tumoral (TNF), receptor homologue transmembrane activator and calcium modulator and cyclophilin ligand interactor (TACI), B-cell maturation antigen (BCMA) y BAFF-receptor (BAFF-R) cuya expresión está restringida a linfocitos B (LB) y T (LT)3,4.
La importancia de BAFF ha sido demostrada previamente en modelos murinos, en los cuales la deficiencia de esta proteína resulta en una disminución en el número de células B periféricas y en una baja capacidad para la respuesta humoral, mientras que una sobreexpresión de BAFF ha sido vinculada con el desarrollo de fenómenos autoinmunes y neoplasias hematológicas4,5. Altos niveles de BAFF han sido asociados con la presencia de autoanticuerpos, tales como anticuerpos antidoble cadena de ADN (anti-ADNdc) en el lupus eritematoso sistémico (LES), anticuerpos anti-SSA en el síndrome de Sjögren primario (SSp) y en el factor reumatoide (FR) en la artritis reumatoide (AR)3.
A través de esta revisión narrativa, se mostrará la información existente acerca de la función de BAFF, la regulación de su expresión, sus receptores celulares, su implicación en enfermedades inmunológicas y el uso de una terapia biológica dirigida contra BAFF en el tratamiento de las enfermedades autoinmunes sistémicas.
MetodologíaSe realizó una revisión de la literatura, basados en artículos de relevancia de la citocina BAFF. Para la búsqueda bibliográfica se utilizaron bases de datos como PUBMED y EMBASE. La búsqueda no tuvo límites de fecha y se introdujeron palabras clave y términos MESH como: BAFF, Blys, APRIL, BCMA, TACI, enfermedades autoinmunes sistémicas.
Para la búsqueda de las terapias actuales se utilizaron los siguientes términos: belimumab, atacicept, tabalumab, blisibimod, rituximab, en enfermedades autoinmunes.
Como criterios de selección de la literatura encontrada se establecieron los siguientes: que fueran revisiones sistemáticas de la literatura y ensayos clínicos que fueran de interés de los autores. Se incluyeron artículos en inglés, español y francés.
Después de revisar los artículos se extrajeron las ideas clave para poder exponer de manera sencilla y completa el papel de la citocina BAFF en las enfermedades autoinmunes y simplificar las alternativas de tratamiento.
DefiniciónEl BAFF, también conocido como BlyS, TALL-1, zTNF4 y THANK, TNFSF13B, fue identificado independientemente por varios grupos de investigación en 1999, de allí sus múltiples nombres6,7. Es un miembro de la superfamilia de ligandos del TNF, producido y secretado, principalmente, por células mieloides (macrófagos, monocitos, neutrófilos, células dendríticas), células T activadas, células no linfoides (astrocitos, células epiteliales de glándula salival, sinoviocitos similares a fibroblastos, células bronquiales, nasales) y células estromales (nichos locales que modulan la supervivencia y función de las células B y de las células plasmáticas en salud y enfermedad)8,9. Su síntesis se produce en respuesta a múltiples estímulos, entre ellos: el interferón (IFN)-α o IFN-γ, la interleucina-10 (IL-10), los lipopolisacáridos10,11 y la activación de receptores Toll-like (TLR) TLR-4, TLR-9 y el CD40 ligando (CD40L)12, producidos durante la inflamación o las infecciones crónicas. Normalmente la citocina BAFF no se expresa en células B, sin embargo, se ha detectado en procesos infecciosos y linfoproliferativos como la infección por el virus de Epstein-Barr y la leucemia linfoide crónica13–16.
Modelos animales de BAFFEn 1999, a partir de modelos murinos, se empezó a dilucidar el potente papel regulatorio de BAFF en múltiples funciones de células B murinas (deficientes de BAFF y del BAFF-R), en los cuales se alteraba la maduración más allá del estadio transicional de tipo 1 (T1)17. Estos modelos iniciales se trasladaron posteriormente a modelos in vitro humanos, y se encontró que, en contraste con las células B murinas, los efectos de BAFF en la sobrevida de células B transicionales en reposo y maduras humanas, al menos in vitro, eran menos pronunciados que los efectos del BAFF en las células B murinas17,18 (tabla 1). En estas últimas, BAFF soporta además la sobrevida de células plasmáticas, mas no las de humanos o monos, lo que evidencia diferencias de especie en cuanto a la respuesta a BAFF. Con la excepción de estas pocas diferencias específicas de especie, se puede concluir que esta citocina es esencial para la sobrevida de células B humanas y murinas en diferentes estadios de desarrollo y diferenciación14–16.
Expresión de BAFF y receptores BAFF durante el desarrollo y diferenciación de las células B humanas y murinas
| Médula ósea | Médula ósea, sangre, bazo | Tejido linfoide | Médula ósea, bazo, amígdala, intestino | ||||
|---|---|---|---|---|---|---|---|
| Célula B | Inmadura | Transicional | Virgen | Centro germinal | Zona marginal | Plasmablasto | Célula plasmática longeva |
| BAFF-R | + | + | ++ | ++ | ++ | ✓± | - |
| BCMA | - h/m + | - | - | + | - | ++ | - h/m + |
| TACI | - | - h/m + | - | ± | + | + | - |
| Respuesta a BAFF | |||||||
| Ratón | - | +++ | ++ | + | + | ++ | ++ |
| Humano | ? | - | ✓± | ? | ± | ++ | - |
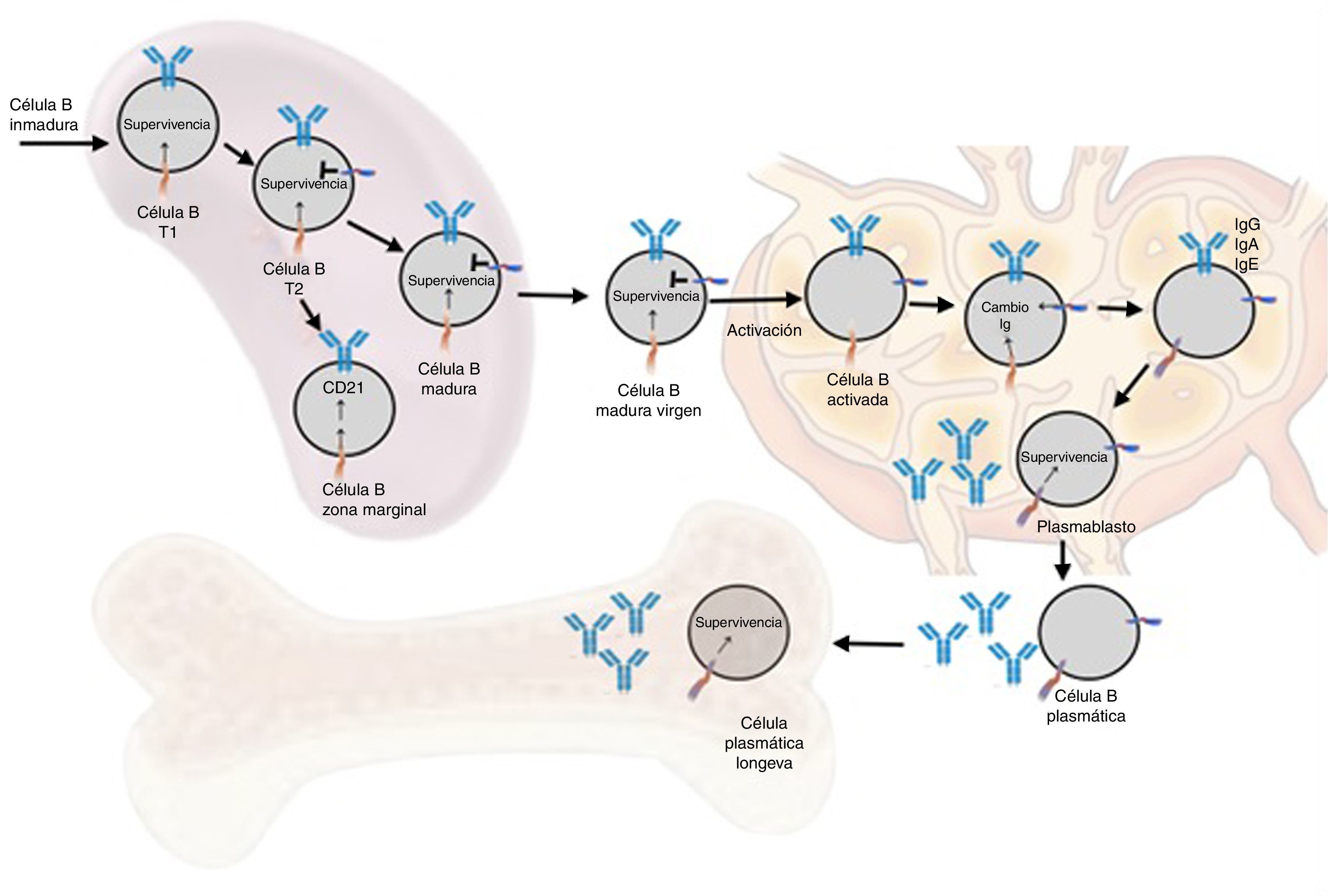
Los modelos transgénicos o deficientes de BAFF, a proliferation-inducing ligand (APRIL) y de los diferentes receptores (BAFF-R, TACI y BCMA)15 permitieron sustanciar una serie de fenotipos murinos (tabla 2) y en resumen han mostrado que tanto BAFF como su principal receptor (BAFF-R) controlan el desarrollo y sobrevida de células B transicionales de tipo 2 (T2) y de la zona marginal. APRIL regula aspectos del cambio de clase de inmunoglobulinas (Ig) independientemente del CD-40 y promueve la sobrevida de células plasmáticas. TACI ayuda a la respuesta inmune humoral de células B innatas a antígenos repetitivos y, de alguna manera, regula la expansión de la reserva de células B. Y el BCMA contribuye al mantenimiento de las células plasmáticas y de memoria15.
Fenotipo de los ratones genéticamente modificados para BAFF, APRIL y sus receptores
| Modelo murino | Fenotipo |
|---|---|
| Ratón BAFF -/- | -Alteración de maduración de célula B más allá de T1 -Disminución de niveles de Ig -Disminución en respuesta inmune dependiente/independiente de célula T -Modesto incremento de la sobrevida del injerto, mejorada con dosis bajas no efectivas de ciclosporina |
| Ratón APRIL -/- | -Alteración de cambio de isotipo IgA -Alteración de sobrevida en médula ósea de células plasmáticas toxoide tetánico específicas-sobrevida normal en médula ósea células plasmáticas de larga vida nitrofenol-específicas - Aumento del porcentaje de células T efectoras de memoria CD44hiCD62Llow |
| Ratón transgénico BAFF | -Desarrollo de hiperplasia de células B a partir de estadio -Desarrollo de autoinmunidad independiente de células T pero dependiente de MyD88, involucrando la producción de autoanticuerpos, glomerulonefritis, inflamación y destrucción de glándulas salivares -Disminución en producción de saliva; células B, B1 presentes en glándula salival Expansión de los compartimentos de células T reguladores y efectores |
| Ratones transgénicos APRIL | -Desarrollo de neoplasia de células B, B1 -Incremento en sobrevida de células T CD4+ y CD8+ e incremento de la producción de IL-2 por las células T CD8+ -Incremento de sobrevida de células T superantígeno reactivas ligadas a expresión aumentada de BCL-2 -Incremento en proliferación de células T -Disminución del porcentaje de células T en ganglios linfáticos periféricos |
| Ratones BAFFR -/- | -Igual a BAFF -/- -Disminución de la longevidad en centros germinales -Alteración del cambio de clase de Ig |
| A/WySnJ ratón mutante BAFFR | -Igual a BAFF -/- pero menos severo -Autoinmunidad se desarrolla conforme el ratón envejece -Alteración en respuestas de células T dependientes de anticuerpos |
| Ratón TACI -/- | -Desarrollo de hiperplasia de célula B en estadio B1 -Incremento tasa de proliferación célula B -Respuesta defectuosa de anticuerpos independiente de células T tipo II -Desarrollo de linfomas de células B -Alteración del cambio de clase a IgA -Aumento del número de células T CD4+ en las placas de Peyer -Falla en inducir la proliferación de células T citotóxicas después de transferirse a ratones deficientes de células B |
| BCMA -/- | Sobrevida alterada de células plasmáticas de larga vida en médula ósea |
APRIL: a roliferation-inducing ligand; BAFF: B-cell activating factor; BAFF-R: BAFF receptor; BCMA: B-cell maduration antigen; BCL-2: B-cell lymphoma 2; IL-2: interleuquina-2; MYD88: myeloid differentiation primary response protein 88; T1: transitional type 1; TACI: transmembrane activator and calcium-modulator and cytophilin ligand interactor.
Los ratones BAFF Tg presentan un modelo de enfermedad similar al lupus inducida por BAFF, pues desarrollan características fenotípicas reminiscentes de manifestaciones similares a LES y a otras condiciones autoinmunes: aumento de compartimentos de células B, células T efectoras y de órganos linfoides, títulos elevados de múltiples anticuerpos incluyendo anti-ADNdc, FR e hipergammaglobulinemia, complejos inmunes circulantes y glomerulonefritis con depósitos de Ig. Conforme envejecen, desarrollan infiltración celular linfoide de glándulas salivares con disminución del flujo salivar, de manera muy similar a lo que ocurre en el SSp18.
Otros modelos murinos de LES en los cuales se han encontrado niveles elevados de BAFF son los New-Zealand Black×New-Zealand White (NZB×NZW) F1 y los ratones MRL-lpr/lpr. Estos ratones susceptibles al LES han mostrado disminución de la actividad de la enfermedad en respuesta a antagonistas de la citocina BAFF19.
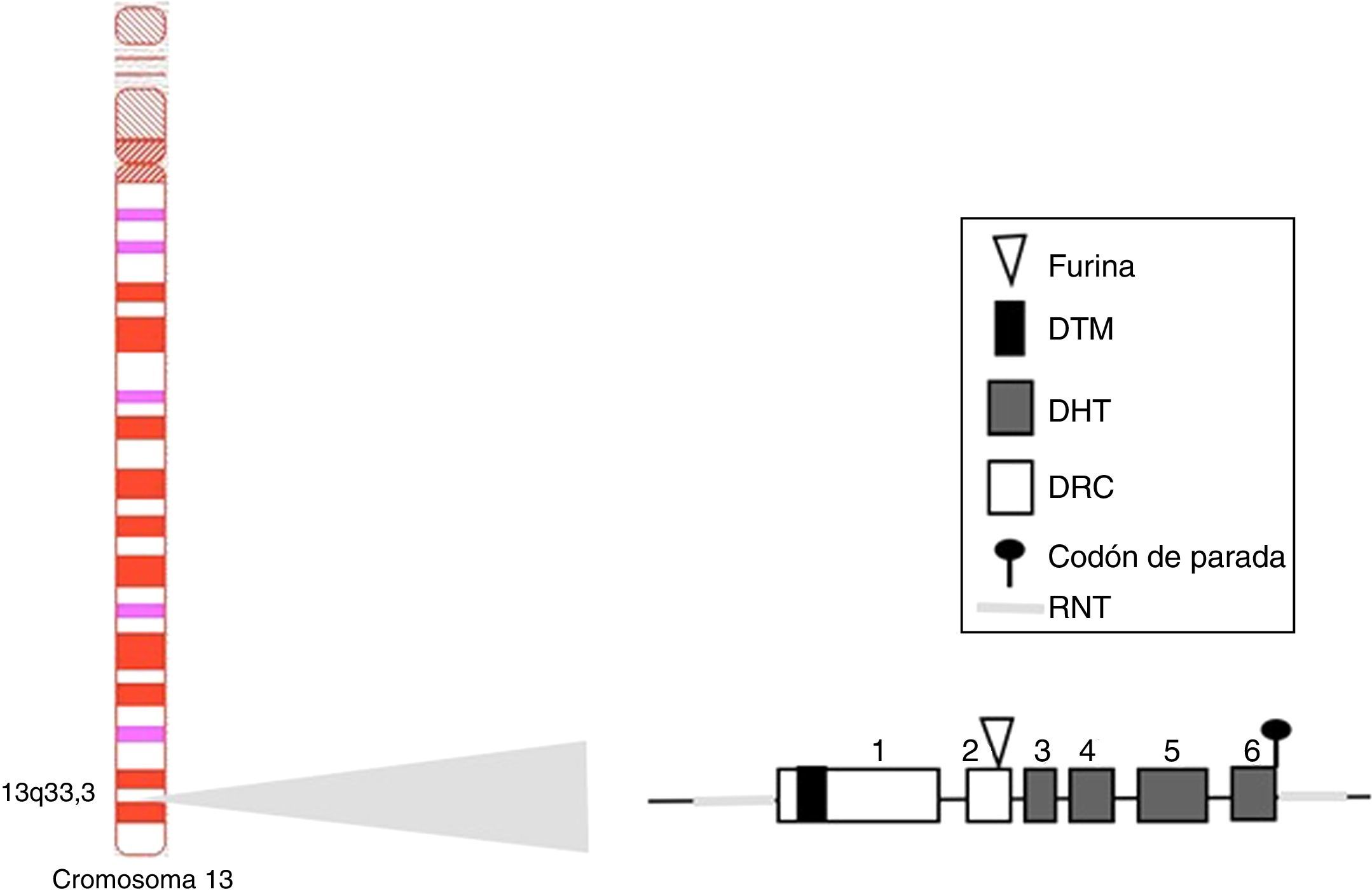
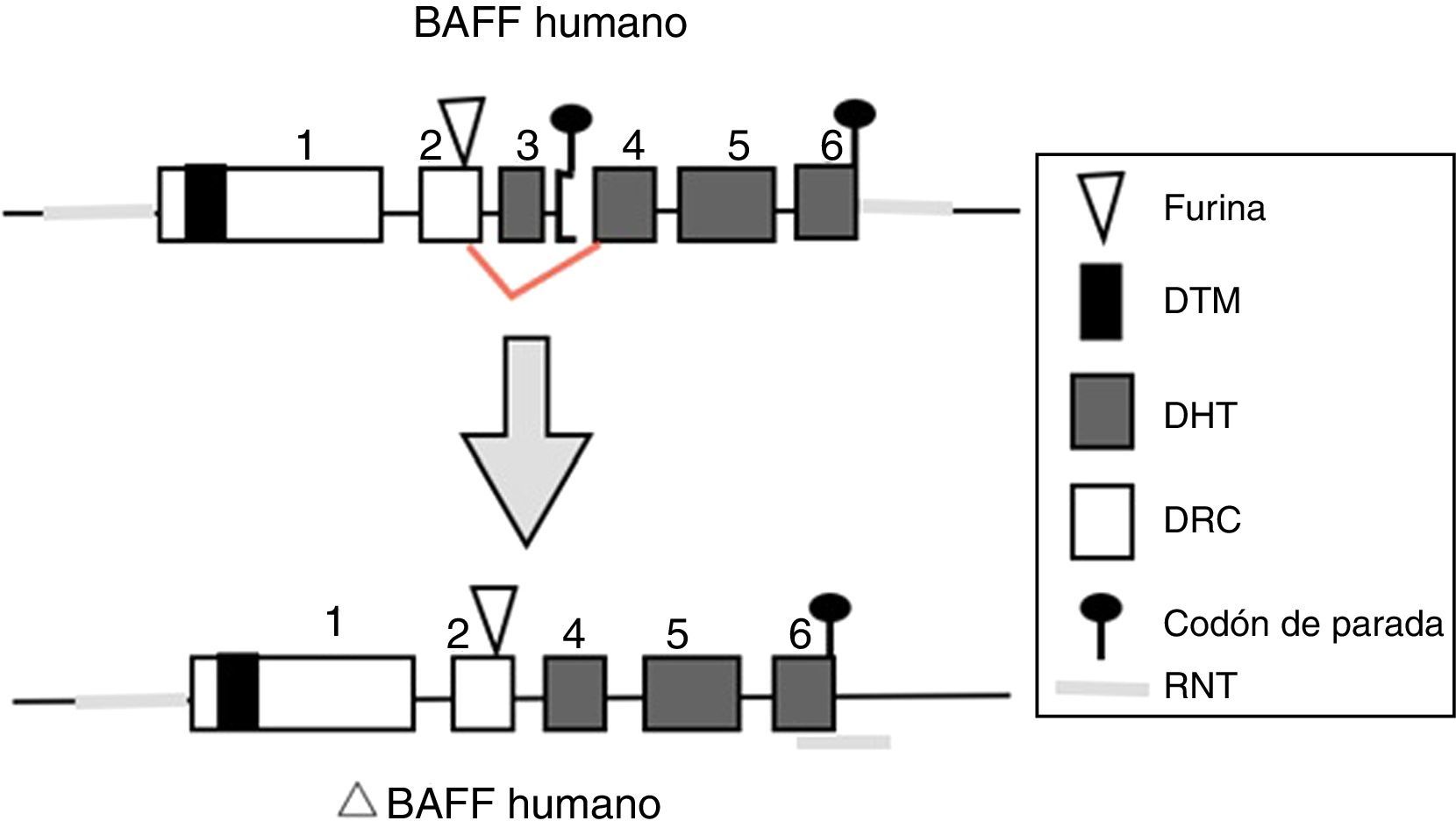
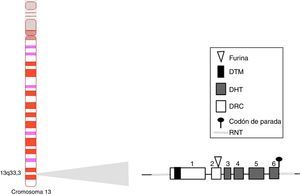
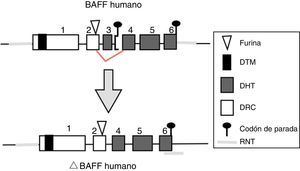
BAFF: del gen a la proteína BAFF en los humanosEl gen BAFF en los humanos (fig. 1) está localizado en el cromosoma 13q33.3 y está compuesto por 6 exones y 5 intrones, correspondientes a 39kb. El exón 1 codifica para el dominio transmembrana y las regiones flanqueantes, el exón 2 para el sitio de procesamiento de furina, y los exones 3 al 6 codifican para el dominio de homología al TNF (DHT), el cual se une a los receptores14.
Gen del BAFF humano y su localización cromosómica.
Los exones están representados en cajas; los intrones, en líneas gruesas grises.
DHT: dominio homología TNF; DRC: dominio rico en cisteína; DTM: dominio transmembrana; RNT: regiones 5’ y 3’ no traducidas.
Fuente: Diseño y concepción Betancur et al. (2015).
El promotor BAFF de 1.020 pares de bases puede activarse por múltiples factores de transcripción, incluyendo miembros de la familia NFAT y del factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas (NF-kB) (p50, p52, c-Rel y p65)20. Dos factores de transcripción adicionales pertenecientes a la familia del receptor del TNF han sido descritos: CD40 y BR38,9. Estos últimos, interactúan con c-Rel de la vía del NF-kB para activar la transcripción de BAFF. Este transcripto de BAFF codificado por el gen incluye 1.204 pares de bases, con un código de lectura de 858 pares de bases9,21.
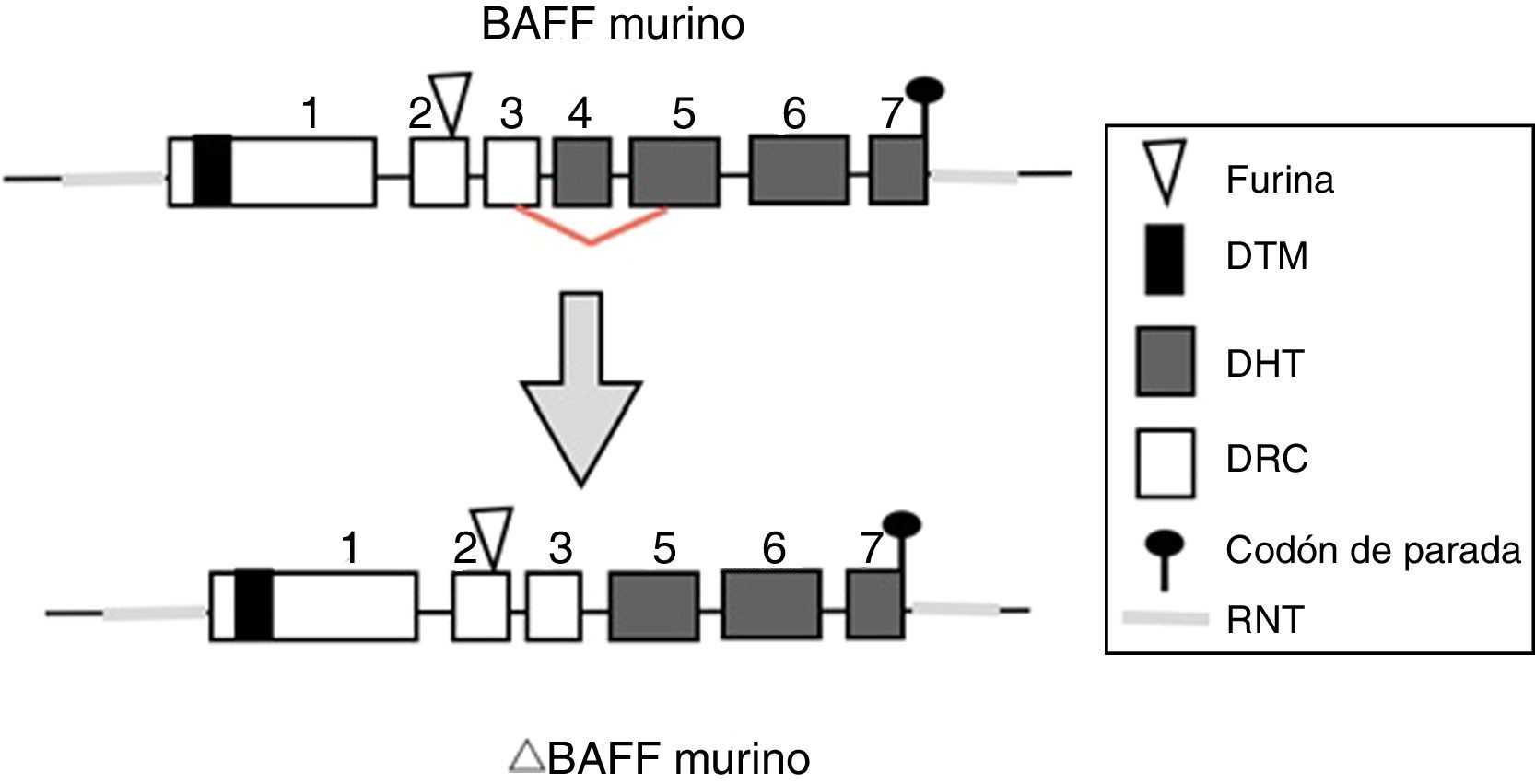
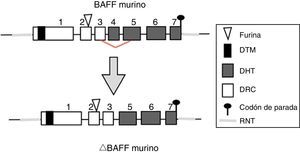
Gen de BAFF en ratonesEn ratones, el gen BAFF (fig. 2) se encuentra en el cromosoma 8 A1.1 y está compuesto de 7 exones y 6 intrones correspondientes a 31kb. A diferencia del humano, codifica un exón adicional con un tramo de 30 aminoácidos localizados entre el sitio de furina y el dominio homólogo del TNF (DHT)14. Su activación depende de varios factores de transcripción. El primer factor de transcripción descrito fue p65 (de la vía NF-kB) que puede actuar en colaboración con la proteína coactivadora p30022. La expresión de BAFF puede estar inducida por Smad3 y Smad4 e inhibida por Smad7. Las proteínas Smad son homólogas tanto de la proteína de la mosca Drosophila, la proteína mothers against decantaplegic (MAD), (donde «decan-tapléjico» se refiere a una proteína de la mosca homóloga a la proteína morfogénica ósea humana) y la proteína de la especie de nemátodos Caenorhabditis elegans SMA (del gen «sma» de la palabra «small», cuerpo pequeño en vista de su capacidad de alterar el tamaño corporal). La proteína Smad3 se une en el promotor a 3 sitios potenciales llamados smad binding elements, lo cual es indispensable para la activación de BAFF en murinos23.
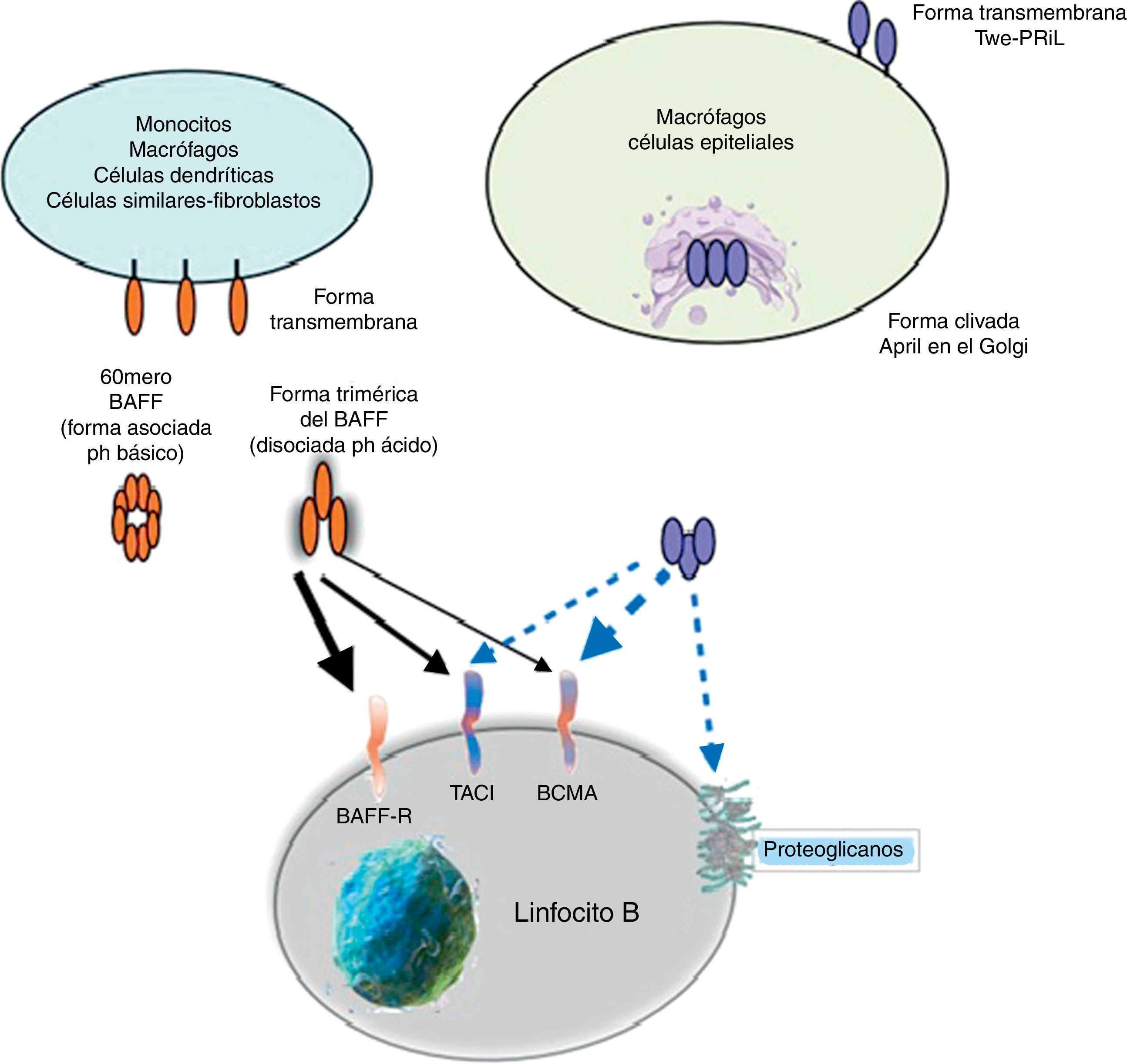
La citocina BAFF como proteínaBAFF es una proteína transmembrana tipo ii de 285 aminoácidos, con un dominio citoplasmático de 46 aminoácidos, caracterizado por ser rico en cisteína en su región de unión al ligando, una región hidrofóbica transmembrana y un dominio de 218 aminoácidos que contienen 2 sitios potenciales de N-glicosilación. La secuencia del dominio extracelular de BAFF muestra gran homología con APRIL (33% aa idénticos, 48% homólogos). El BAFF puede ser secretado como un ligando soluble trimérico por procesamiento proteolítico en el sitio de consenso de furina. A pH neutro o básico, 20 trímeros de BAFF humano soluble recombinante se asocian en 60-meros con estructura similar a un virus. Esta asociación es dependiente de un asa única en la familia TNF. La importancia fisiológica del 60-mero se desconoce, pero puede ligarse a receptores y es moderadamente más activo que los trímeros en ensayos in vitro. En un pH ácido o cuando se fusiona a la extensión N-terminal como una etiqueta myc (técnica recombinante con el gen c-myc), el 60-mero se disocia en trímeros6,14.
Isoformas de BAFFMientras el ARNm de longitud completa codifica la forma biológicamente activa de la proteína, existen diferentes isoformas, descritas en ambas especies, que se forman por splicing o empalme alternativo (fig. 3). Dentro de las isoformas de BAFF, se encuentra el delta-BAFF (ΔBAFF) identificado en 200324, que no incluye el exón 3 en los humanos ni el 4 en ratones, donde conserva el marco de lectura, a pesar de la pérdida de 57 pares de bases. En ratones este empalme alternativo resulta en la codificación de un residuo amino en la posición 155, lo que conlleva una glicosilación sobre el nuevo sitio, resultando en un mayor peso para la isoforma de BAFF. El ΔBAFF expresado en ratones tiene una falencia del asa A-A1 que imposibilita la capacidad de unión a los receptores BAFF, TACI y BAFF-R. También tiene la capacidad de unirse por medio de enlaces di-sulfuro con el BAFF y formar heteromultímeros intracelulares, los cuales se unen pobremente a los receptores de BAFF, limitando la homotrimerización del BAFF y cumpliendo un papel supresor por su coasociación competitiva, al modular la liberación de BAFF24. De esta manera, la expresión de la isoforma ΔBAFF tiene un efecto contrario en la sobrevida y el número de LB en la zona marginal25. En humanos el transcripto se ha visto expresado en tejido linfático, astrocitos y en células mieloides24,25.
Variante delta BAFF en el humano.
Los exones están representados en cajas; los intrones, en líneas gruesas grises.
DHT: dominio homología TNF; DRC: dominio rico en cisteína; DTM: dominio transmembrana; RNT: regiones 5’ y 3’ no traducidas.
Fuente: Diseño y concepción Betancur et al. (2015).
También existe otra isoforma en humanos llamada Δ4BAFF (Δ5BAFF en murinos), la cual, a diferencia del ΔBAFF, tiene una escisión del exón 4 que se da por la formación de un nuevo codón de parada dentro del exón 5 en el empalme, causando que no se traduzcan los exones 5 y 6, con conservación del sitio de glicosilación N124 y el sitio de clivaje de furina, lo cual hace que probablemente no formen trímeros o se una a los receptores del BAFF26. Sin embargo, esta variante podría actuar como un factor de transcripción para el mismo gen en asociación con la proteína p50 en la vía NF-κB. Esto ha sido observado en enfermedades linfoproliferativas y autoinmunes de predominio de células B26. La presencia de Δ4BAFF es fundamental para la liberación de BAFF soluble por los monocitos estimulados por IFN-γ y la sobrevida de linfocitos B en leucemia linfocítica crónica26. En consenso, tanto ΔBAFF como Δ4BAFF juegan un papel en la regulación de la respuesta inmune, tanto en estadios fisiológicos como en algunas enfermedades, como las enfermedades autoinmunes27.
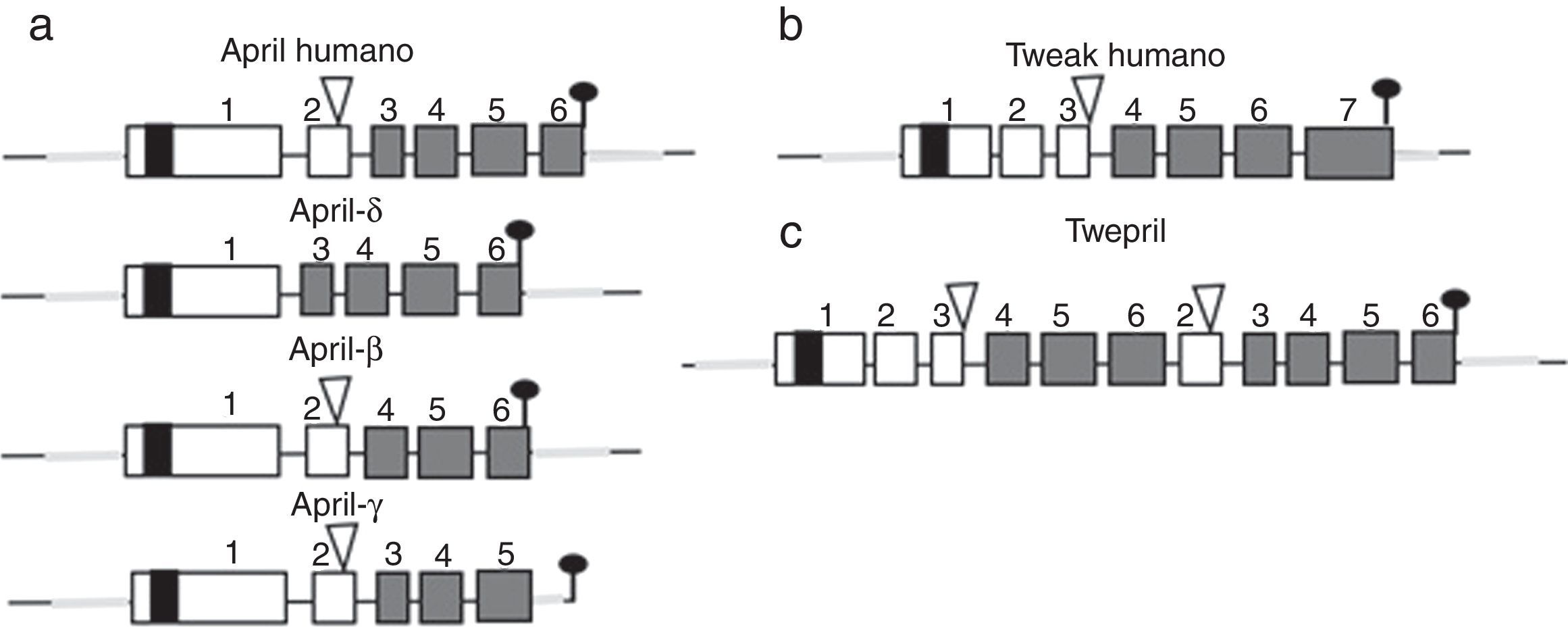
Otros miembros de la familia: APRIL y TWEAKDentro de esta familia de citocinas, existe otro miembro de la familia del TNF, el cual comparte muchas de las vías de señalización y se denomina APRIL, localizado en el cromosoma 17 p13 (fig. 4a), el cual genera 7 variantes transcritas. A diferencia de BAFF, APRIL es clivado en el aparato de Golgi por la enzima furina convertasa antes de ser liberado, y solo se encuentra en su forma secretora27. Al igual que BAFF, se expresa en las mismas células y comparte algunos de sus receptores: el TACI y BCMA28,29. De esta forma, el BAFF-R es prácticamente exclusivo para ligar BAFF, aunque se ha descrito por algunos autores una pobre unión incluso del APRIL14.
Variantes de APRIL (a proliferation-inducing ligand) y TWEAK (tumor necrosis factor [TNF]-like weak inducer of apoptosis) humanos.
Los exones están representados en cajas; los intrones, en líneas gruesas grises.
DHT: dominio homología TNF; DRC: dominio rico en cisteína; DTM: dominio transmembrana; RNT: regiones 5’ y 3’ no traducidas.
Fuente: Diseño y concepción Betancur et al. (2015).
APRIL posee además la capacidad de unirse a los glicosaminoglicanos sulfatados, como los presentes en el sindecan-1 (CD138) o a otros proteoglicanos expresados tanto en las células linfoides como no linfoides. La relevancia de esta unión es incierta, pero puede servir para acumular o multimerizar APRIL en la matriz extracelular o en la superficie de las células sindecan positivas, lo cual facilita el acceso al receptor TACI o BCMA (fig. 5)30.
Al encontrarse en forma soluble y ser muy similar estructuralmente a BAFF, puede formar heterotrímeros con este de la siguiente manera: 3 APRIL o 2 APRIL+1 BAFF, que pueden ser formas activas. Estos se forman en la membrana de la célula o en el aparato de Golgi, y son detectados más frecuentemente en enfermedades autoinmunes31.
Adicionalmente, se han identificado algunos polimorfismos de APRIL, 2 de los cuales se asocian a enfermedades autoinmunes como LES, localizados en la región del dominio extracelular32. APRIL, al igual que BAFF, tiene importancia también en el cáncer y otras enfermedades autoinmunes como la esclerosis sistémica y la esclerosis múltiple33. En el LES activo las concentraciones de APRIL séricas aumentan de forma paralela a los anticuerpos anti-ADNdc34. En AR las células dendríticas parecen ser las principales responsables del aumento de los niveles séricos de APRIL35 y en la esclerosis múltiple se ha encontrado un aumento de ARNm de APRIL en especial monocitos, LT y sangre periférica36.
APRIL también posee isoformas que se forman por eventos poco comunes de empalme como el APRIL-δ (fig. 4a) en el cual se combina el exón 1 del APRIL humano con un sitio aceptor alternativo en el sitio del exón 3, generando una isoforma ligada a membrana, no clivable, sin unión a glicosaminoglicanos14. El APRIL-β se forma por omisión del exón 3. Esta isoforma es homóloga al ΔBAFF que por analogía regula la actividad de APRIL de manera negativa14. El APRIL-γ se forma por empalme de un intrón críptico en el exón 6 en el cual se da un truncamiento de 4 aminoácidos en la región C-terminal, reemplazándose por un residuo único (esta isoforma no ha sido estudiada)14.
En ambas especies (humanos y ratones) el gen APRIL está localizado en contigüidad con el extremo 3′ del TNF-like weak inducer of apoptosis (TWEAK), el cual se encuentra corriente arriba del gen APRIL en el cromosoma 17 p13 (fig. 4b)7.
De la proteína TWEAK se han descrito 2 transcritos proteicos funcionales: el TWEAK-ligando (TWEAK-L) y el TWEAK. El TWEAK-L se une a su receptor TWEAK (TWEAK-R o FN14) y genera funciones de proliferación, migración, sobrevida y muerte celular37. Es una proteína transmembrana de tipo ii sintetizada en el retículo endoplasmático con un sitio C-terminal extracelular con un residuo de N-glicosilación y un N-terminal intracelular asociado a la fosforilación de protein cinasa C38. Se ha encontrado expresado de manera intracelular en macrófagos, células dendríticas, natural killer, LT e incluso en células endoteliales, astrocitos y plaquetas39.
Por otro lado, el TWEAK es una proteína transmembrana de 102 aminoácidos de tipo i y su actividad está mediada por la interacción con el dominio rico en cisteína del receptor FN1437 al inducir trimerización del receptor, esto supone una preferencia por la vía TNF receptor associated factor (TRAF) donde TRAF2 y TRAF5 activan el NF-κB40. En autoinmunidad, TWEAK se ha asociado a AR, y se ha encontrado en altas concentraciones en el tejido sinovial: los LB son una de las mayores fuentes de TWEAK41. En LES, la proteína TWEAK promueve la producción de mediadores inflamatorios como interferon-γ-inducible protein-10, regulated on activation, normal T expressed and secreted y monocyte chemotactic protein-1 en las células renales, aumenta el infiltrado celular y la inflamación tisular, y muestra un papel en la iniciación o exacerbación de la autoinmunidad42. En esclerosis múltiple hay un aumento de la expresión no solo de TWEAK, sino también de su receptor el FN14, donde la microglía lo secreta y causa una pérdida de la mielina y daño neuronal14.
Existe, además, una isoforma formada por empalme intergénico entre el exón 6 de TWEAK y el exón 2 de APRIL: el TWE-PRIL (fig. 4c), que contiene el TDH (dominio de homología al TNF) completo de APRIL, lo que le confiere la misma especificidad de receptor que APRIL, aunque su función aún no ha sido dilucidada14,43.
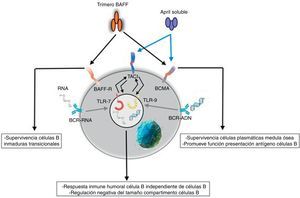
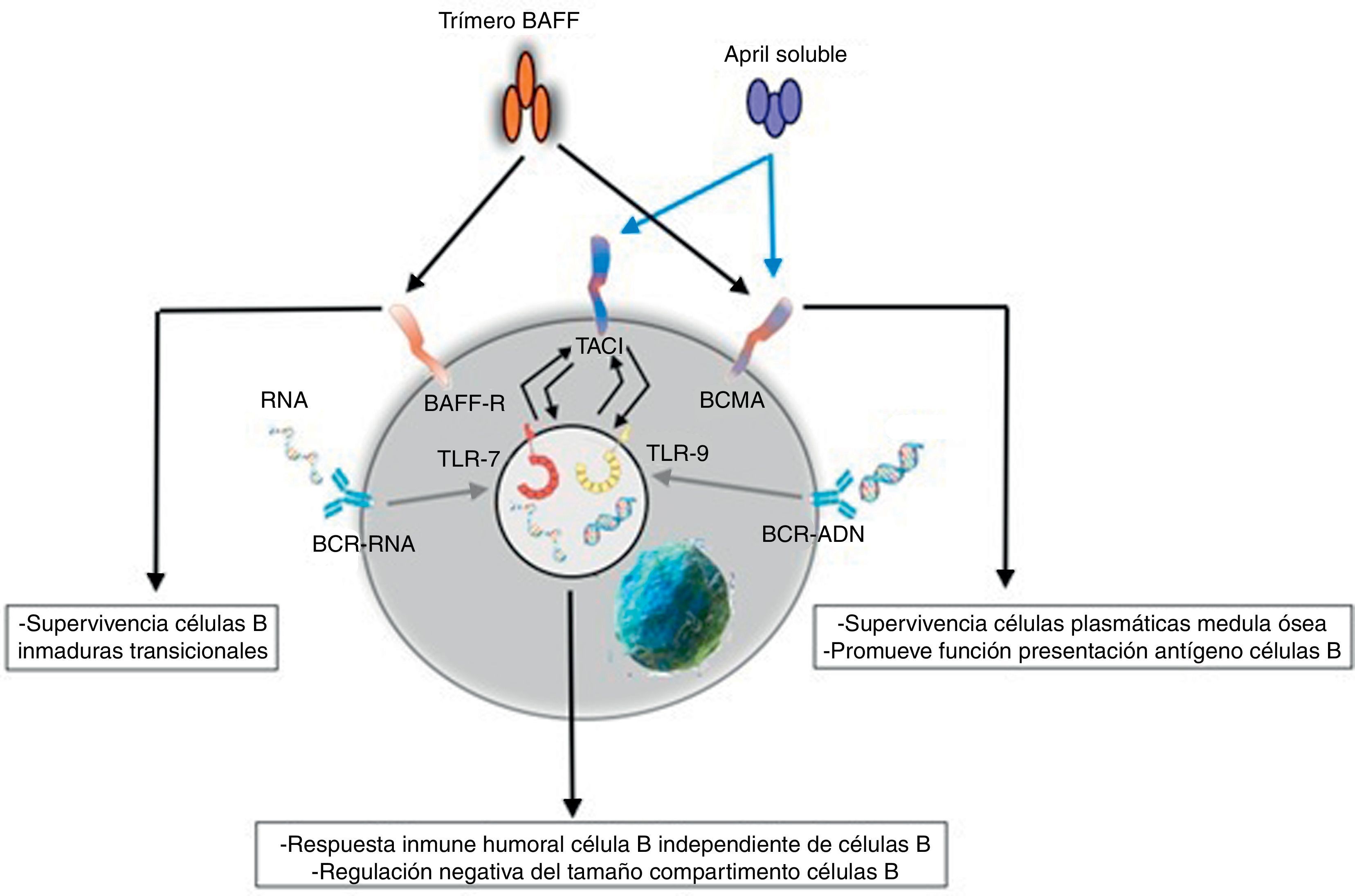
ReceptoresEl BAFF es ligando de receptores inusuales, ya que son proteínas transmembrana de tipo iii que carecen de una secuencia de señal. Son 3 receptores descritos: BAFF-R, TACI y BCMA (tabla 3), cuya expresión es bastante restringida y se expresan en diferentes momentos durante el desarrollo de las células B (fig. 5)14. BCMA, TACI y BAFF-R son expresados por LB, mientras que TACI y BAFF-R son, además, expresados por LT activados. Por otra parte, BAFF-R es el único que tiene solo como ligando al BAFF mientras que BCMA y TACI se unen a APRIL14. Estos 3 receptores carecen de dominios asociados a muerte, comunes en algunas moléculas de la superfamilia de ligandos del TNF, y en lugar de esto interactúan con miembros de la familia de proteínas TRAF, lo que indica su participación en vías de sobrevida y diferenciación más que en muerte celular14,15.
Funciones específicas de BAFF-R, TACI y BCMA en células B humanas y murinas
| Receptor BAFF | Función |
|---|---|
| BAFF-R/BR3 | Sobrevida de células transicionales murinas, células B maduras murinas y humanas Mantiene la longevidad de la reacción del centro germinal Cambio de clase para producir IgG, IgA e IgE en respuesta a BAFF Coestimula la proliferación y secreción de citocinas por células T humanas y murinas |
| TACI | Regulador negativo de células B murinas Soporta respuestas a anticuerpos de células Cambio de clase para producir IgG, IgA e IgE en respuesta a APRIL Cambio a IgA en respuesta a BAFF y APRIL |
| BCMA | Mantiene supervivencia de plasmablastos Aumenta la presentación antigénica por células B |
APRIL: a roliferation-inducing ligand; BAFF: B-cell activating factor; BAFF-R: BAFF receptor; BCMA: B-cell maduration antigen; BR3: BAFF receptor 3; Ig: inmunoglobulina; TACI: transmembrane activator and calcium-modulator and cytophilin ligand interactor.
Muchas de las moléculas de BAFF expresadas son separadas de la superficie celular y circulan como homotrímeros activos solubles que van a unirse con el BAFF-R. Una pequeña proporción de BAFF libre circulante se asocia en multímeros de 20 trímeros que se unen y activan a TACI, o bien puede ser activado unido a la membrana15. BCMA es un receptor de alta afinidad para APRIL, mientras que en humanos este se une a BAFF con baja afinidad15.
Diversos estudios han mostrado que solo BAFF-R juega un rol claro en la maduración celular. Esto se demostró en una cepa de ratón A/WySnJ, la cual presentaba un gen mutante natural para BAFF-R que daba como resultado un fenotipo similar a los ratones deficientes de BAFF, reflejado como una significativa reducción de los LB maduros periféricos y una pobre respuesta inmune44,45. Así mismo, se ha descrito que la expresión de BAFF-R es determinante en la formación de los centros germinales28.
BCMA y TACI parecen tener relación con la fase efectora de la respuesta inmune humoral, mediando la diferenciación de células plasmáticas. BCMA es, además, esencial para la sobrevida de células plasmáticas de larga vida de la médula ósea14.
BAFF-R, TACI y BCMA son expresados en el bazo, timo, linfocitos de sangre periférica y células B; BAFF-R y BCMA se expresan además en los ganglios linfáticos; BAFF-R y TACI se expresan también en las células T activadas. Por otra parte, TACI es el único expresado en el intestino delgado, mientras que BCMA se puede expresar también en el hígado y en las glándulas adrenales33.
BAFF-R, TACI y BCMA muestran patrones de expresión específicos pero sobrepuestos, y el análisis funcional ha revelado papeles distintos para estos 3receptores en la mediación de las señales de BAFF y de APRIL14. Con relación a los LB, la expresión de BAFF, TACI y BCMA no es evidente hasta que dicha célula alcanza un estado de maduración transicional14. TACI es el receptor predominante en células plasmáticas de vida corta mientras que BCMA predomina en las células plasmáticas de larga vida14. Cada receptor activa su propia vía de señalización; BAFF-R es el único receptor que activa la vía alternativa del NF-kB15.
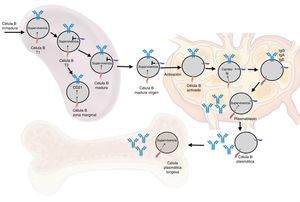
Funciones en respuesta inmune normalOntogénesis del linfocito B: el rol del BAFF y sus receptoresLa generación de la reserva de LB maduros involucra un desarrollo secuencial de células hematopoyéticas madre en células pro-B, que se transforman en células pre-B y luego en células inmaduras (fig. 6). Estas últimas son exportadas a la periferia donde van a una selección posterior que involucra una serie de eventos: primero entran al bazo en un estadio inmaduro T1, luego van a un estadio T2, para pasar, posteriormente, a un estadio de célula B madura o de la zona marginal; durante la diferenciación requieren un receptor de células B funcional. En adición a la señal del receptor de células B funcional, se requiere una señal de sobrevida dada por BAFF durante su diferenciación (la deleción del BAFF resulta en una pérdida de más del 90% de células maduras). En esta etapa, el receptor BAFF-R es crucial para mediar la sobrevida de las células B de la zona marginal y la regulación positiva del CD21, mientras TACI actúa como regulador negativo15. Cuando las células B maduras se encuentran con un antígeno T-dependiente se diferencian en células efectoras de alta afinidad llamadas células B de memoria y células secretoras de Ig o células plasmáticas de larga vida. Este proceso ocurre en estructuras especializadas llamadas centros germinales, localizadas en tejidos linfoides secundarios. Es en este estadio de diferenciación tardía donde la expresión del BCMA parece ser relevante en la sobrevida de estas células plasmáticas de larga vida14,16.
Respuesta innataEl sistema BAFF/APRIL ligando y receptor interactúa con la inmunidad innata a través de sus receptores de señalización. Después de su internalización por el receptor Fc-gamma IIa (FcγRIIa) en células dendríticas plasmocitoides, los complejos inmunes constituidos por autoanticuerpos y autoantígenos que contienen ARN o ADN son capaces de unir y activar receptores intracelulares TLR-7 y TLR-9 (fig. 7), aumentar la activación de estos últimos y llevar a la secreción de IFN-α, promoviendo la inflamación. Como la expresión del BAFF/APRIL es inducida por el IFN, especialmente el IFN-α, este último induce su secreción por células del sistema de inmunidad innata como los neutrófilos, monocitos, macrófagos, células dendríticas y células dendríticas foliculares19.
También se ha descrito una estrecha interrelación positiva entre los TLR-7 y TLR-9 y el TACI, pues ambos pueden regular al alza su expresión a través de la estimulación de ambos receptores19.
Son estos acontecimientos los que llevan a algunos autores a suponer que BAFF podría ser el vínculo entre la activación de la inmunidad innata y la modificación de la respuesta inmune adaptativa en condiciones fisiológicas, al igual que en enfermedades autoinmunes mediadas por LB19.
Activación de células TSi bien la mayoría de los estudios se han enfocado en la función estimuladora de BAFF sobre las células B14,15, se ha documentado además una función coestimuladora sobre los LT que influyen la activación, supervivencia y diferenciación de células T efectoras30.
Sin embargo, el BAFF también incrementa el número de células T reguladoras, lo que indica que cualquier efecto activador del BAFF en las células T puede ser anulado por la expansión de células T reguladoras19. Esto muestra que hay mecanismos del BAFF independientes de células T, corroborado por modelos transgénicos de LES en los cuales los ratones Tg BAFF sin células T desarrollan un LES indistinguible de los que tienen células T suficientes, donde probablemente tenga papel la expresión del TACI inducida por los TLR19.
Papel de BAFF en la autoinmunidadLupus eritematoso sistémicoEl papel del sistema BAFF en LES se da gracias a la importancia de esta citocina en la maduración y sobrevida de los LB18. Los ratones que sobreexpresan BAFF presentan un alto número de células B y autoanticuerpos que llegan a desarrollar enfermedades autoinmunes similares al lupus18. Esto se ha comprobado gracias a estudios en ratones deficientes en BAFF, los cuales desarrollan una inmadurez de las células B e inmunodeficiencia. Adicionalmente, se han encontrado polimorfismos de nucleótido simple en las regiones promotoras, codificantes y reguladoras de la región TNFSF13B (el gen humano de BAFF)46,47, pero tan solo en un estudio se ha visto una relación de susceptibilidad al LES en las posiciones 871C>T y 2701T>A27.
En LES tanto los niveles séricos de BAFF como de APRIL se encuentran elevados en individuos con la enfermedad, en comparación con individuos controles sin la enfermedad, por lo cual podrían ser usados como marcadores de enfermedad activa48. Incluso tienen correlación positiva (particularmente el BAFF) con puntajes clinimétricos de valoración de la actividad de la enfermedad como el SLEDAI. Pero se debe tener en cuenta que los niveles de BAFF varían de acuerdo con una serie de factores, dentro de los cuales podemos incluir: la raza, los polimorfismos poblacionales, la unión a glicoproteínas (proteoglicanos) en el caso de APRIL, o la depuración renal donde la excreción renal de BAFF puede aumentarse en casos de glomerulonefritis, lo que resulta en una disminución de los niveles séricos48–50. También existe una regulación de los niveles séricos de BAFF respecto a la concentración de ARNm: se encuentra este en concentraciones elevadas, pero con niveles de BAFF disminuidos, por lo que se podría deber a un mecanismo compensador o a pérdida de BAFF en orina51. Es por esto por lo que dentro de los múltiples factores que pueden asociarse a la inducción y actividad de la enfermedad, se encuentra BAFF, que se contempla como uno de los blancos terapéuticos para la modulación de la enfermedad48–51.
En la actualidad solo hay un estudio que muestra la expresión del ARNm en pacientes con nefritis lúpica y en sujetos pretrasplantados por otra causa diferente a la nefropatía lúpica, donde se encontró que los niveles del ARNm de BAFF y APRIL eran significativamente mayores en pacientes con nefropatía lúpica en los glomérulos y en sus receptores en la zona túbulo-intersticial52. Sin embargo, no existen reportes en la literatura de hallazgos similares o que evalúen la expresión proteica por inmunohistoquímica y su correlación con variables de severidad o actividad de la nefritis lúpica. La tabla 4 muestra los principales estudios que expresan el efecto de BAFF en LES48–51.
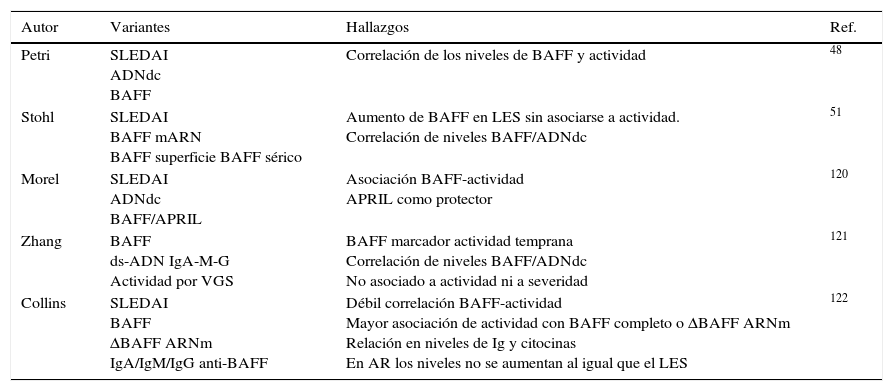
Resumen de estudios que muestran alteración de la citocina BAFF en el LES
| Autor | Variantes | Hallazgos | Ref. |
|---|---|---|---|
| Petri | SLEDAI ADNdc BAFF | Correlación de los niveles de BAFF y actividad | 48 |
| Stohl | SLEDAI BAFF mARN BAFF superficie BAFF sérico | Aumento de BAFF en LES sin asociarse a actividad. Correlación de niveles BAFF/ADNdc | 51 |
| Morel | SLEDAI ADNdc BAFF/APRIL | Asociación BAFF-actividad APRIL como protector | 120 |
| Zhang | BAFF ds-ADN IgA-M-G Actividad por VGS | BAFF marcador actividad temprana Correlación de niveles BAFF/ADNdc No asociado a actividad ni a severidad | 121 |
| Collins | SLEDAI BAFF ΔBAFF ARNm IgA/IgM/IgG anti-BAFF | Débil correlación BAFF-actividad Mayor asociación de actividad con BAFF completo o ΔBAFF ARNm Relación en niveles de Ig y citocinas En AR los niveles no se aumentan al igual que el LES | 122 |
ΔBAFF: delta BAFF; ADNdc: ADN de doble cadena; AR: artritis reumatoidea; BAFF: B-cell activating factor; LES: lupus eritematoso sistémico; SLEDAI: systemic lupus erythematosus activity index; VSG: velocidad de sedimentación globular.
El SSp es un proceso autoinmune crónico que afecta principalmente las glándulas exocrinas y conlleva una alteración de su función. Se caracteriza por un infiltrado mononuclear de localización periductal que compromete, incluso, las unidades secretoras53.
Dentro de los mecanismos responsables, se encuentra una expresión anormal de BAFF. Esta anormalidad se da principalmente por la producción excesiva de IFN-α en el infiltrado celular, mediado por la apoptosis de células epiteliales, que conlleva la inducción de la expresión de citocinas como BAFF y lleva a la estimulación de LB autorreactivos. Estos hallazgos indican que las células epiteliales tienen un papel fundamental en las lesiones autoinmunes en SSp y, más específicamente, tendrían el potencial de producir localmente de manera autocrina el BAFF, lo cual produce un microambiente propicio para la interacción entre citocinas, células epiteliales, células dendríticas, LT y LB hiperactivos, que en conjunto causan anormalidades de la inmunorregulación órgano-específica54,55.
La formación ectópica de acúmulos linfocitarios similares a centros germinales, que se da en el 17% de los pacientes con SSp, es un proceso complejo dado por la interacción de diferentes factores, dentro de los que se ha identificado el BAFF56,57. Siendo BAFF uno de los mediadores más importantes de la neogénesis de estos centros germinales en SSp, se produce una amplificación de la señalización de LB, que promueve su proliferación local y diferenciación a células plasmáticas productoras de autoanticuerpos58,59. El nivel de BAFF también se correlaciona con los títulos de anti-SSA y FR, lo que indica que BAFF tiene un papel primario o secundario en la modulación de la producción de autoanticuerpos59.
Los ratones transgénicos para BAFF, que desarrollan LES-like y posteriormente forman infiltrados glandulares semejantes y manifestaciones clínicas similares al SSp, conforme envejecen, explican como BAFF conduce a una señalización excesiva de la sobrevida de LB autorreactivos, saltando el punto de control en el bazo60.
Integrando en un modelo fisiopatológico de SSp, la citocina BAFF es secretada por las células epiteliales luego de la estimulación por IFN de tipo i, que a su vez está influido por infecciones de tipo viral, lo que hace suponer el rol de estas infecciones como disparador de la enfermedad. Es así como las células epiteliales no solo expresan y presentan autoantígenos, sino que concomitantemente pueden activar los LB al secretar BAFF localmente54,55. Esto es de gran importancia en las aproximaciones terapéuticas de SSp, en las que uno de los principales blancos son los LB y potencialmente el antagonismo de BAFF puede emerger como una nueva alternativa interesante en esta enfermedad53.
Artritis reumatoideLa célula B juega un rol nominal en la fisiopatología de la AR, al ser la célula responsable de la producción de autoanticuerpos como el FR, anticuerpos contra el colágeno de tipo iii y antipéptido citrulinado61, al igual que son esenciales en la producción de citocinas y en la estimulación de los LT62. El hecho de que ratones sin células B no desarrollen artritis inducida por colágeno y que la terapia anti-CD20 sea efectiva son indicadores adicionales de su importancia en el desarrollo de esta enfermedad62.
A pesar de variaciones individuales, diversos estudios documentan que los altos niveles de BAFF se correlacionan con la actividad de la enfermedad63–65. Las proporciones de pacientes con niveles séricos elevados de BAFF fluctúan entre el 19 y el 40%66. Esta heterogeneidad puede ser explicada por los inmunosupresores y las variaciones en las dosis de esteroides66.
BAFF y APRIL tienen efectos reguladores positivos y negativos en AR, una enfermedad en la que los LB contribuyen a la formación de 3 diferentes tipos de microarquitecturas linfoides en la sinovia inflamada: centros germinales ectópicos, agregados de células T-B que carecen de reacciones de centro germinal e infiltrados difusos desorganizados61.
Fenotípicamente la sinovitis asociada con formación de centros germinales ectópicos se caracteriza por tener niveles más altos de APRIL producidos por las células dendríticas CD83+, mientras que el BAFF se encuentra en niveles similares en todos los tipos tisulares y derivado exclusivamente de los macrófagos CD68+, lo cual significa que APRIL más que BAFF se correlaciona con la variabilidad de la función tisular de las células B35.
En cuanto a la expresión de los receptores, se sabe que estos son independientes del tipo de sinovitis: la expresión de BAFF-R es más abundante que la de TACI, pero no se correlaciona con la microestructura linfoide, mientras que de manera diferencial el TACI se encuentra en las células T presentes en agregados linfoides y está ausente en la sinovitis del centro germinal, y el BCMA se expresa en los infiltrados de LB y LT61.
Desde el punto de vista terapéutico, el tratamiento de los diferentes tipos de sinovitis con TACI: Fc (atacicept) logró disminuir la formación de centros germinales e inhibió la producción aumentada de IFN (mostrando el rol de APRIL y BAFF en el proceso de linfoorganogénesis asociada). Sin embargo, este efecto no se documentó en sinovitis que no presentaban formación de centros germinales y que poseían células T TACI+, donde se observó un incremento de la producción tisular de citocinas proinflamatorias e IFN-γ. Así, BAFF y APRIL podrían regular la inflamación sinovial en AR a través de la modulación de la función de células B y T con funciones pro- y antiinflamatorias, estas últimas mediadas por las células T con receptores TACI35.
En cuanto a la cronología de la expresión de BAFF y sus receptores en estadios iniciales de la AR (AR muy temprana y temprana) se ha establecido que la expresión del TACI, los niveles de BAFF y su expresión génica ocurren muy temprano a nivel sinovial en el inicio de la AR (desde las primeras semanas), y disminuyen de manera progresiva con el establecimiento de la enfermedad. Mientras que el BAFF-R está significativamente aumentado en estadios posteriores de AR (temprana y establecida)67.
Esclerosis sistémicaLa activación crónica de las células B es crítica no solo para la inducción de autoanticuerpos sino también para el desarrollo de esclerosis cutánea en la esclerosis sistémica68. Aunque la patogénesis aún continúa siendo incierta, se sabe que la activación celular policlonal y las anormalidades de la célula B caracterizadas por la producción de autoanticuerpos, que guardan correlación con ciertas manifestaciones específicas de la enfermedad, juegan un papel importante68.
En la esclerosis sistémica se han documentado niveles elevados de BAFF (hasta en el 66% de los casos)69. Esta elevación de BAFF se correlaciona con la extensión de la fibrosis cutánea medida por el puntaje de Rodnan modificado, el inicio o el empeoramiento del compromiso orgánico y con la variedad difusa, en comparación con la limitada, y disminuye de manera consecuente con el tratamiento esteroideo69,70. Estos datos muestran que BAFF se asocia con actividad de la enfermedad.
Los niveles de APRIL también se encuentran elevados en comparación con los controles, y se correlacionan con mayor incidencia de fibrosis pulmonar, pero no con los niveles de BAFF71.
Basados en estos datos podemos establecer severidad y perfiles de pacientes basados en niveles séricos altos de BAFF (marcador de esclerosis cutánea severa) y APRIL (marcador de fibrosis pulmonar)70,71.
Papel de BAFF en otras enfermedades y activación celular diferente a los linfocitos BNeoplasiasComo regulador, BAFF también tiene un potencial en la sobrevida, crecimiento y migración celular, y puede contribuir al proceso de transformación neoplásica, lo que pone a BAFF/APRIL y sus receptores como un importante factor en los tumores tanto sólidos como hematológicos4,5. En estos casos, la expresión de BAFF puede darse por las células tumorales (autocrina) o por células vecinas (paracrina) en el microambiente tumoral, protegiendo estas células de la muerte espontánea o inducida por agentes quimioterapéuticos. Estos hallazgos indican que el bloqueo de BAFF y sus receptores en células B malignas pudiera ser una estrategia terapéutica plausible en el área de la oncología4,5.
Es de esperar y está bien establecido que los niveles de BAFF están aumentados en cánceres linfoides. Sin embargo, y de manera interesante, se ha detectado en células no linfoides de tipo epitelial.
Se han encontrado niveles séricos de BAFF aumentados, derivados de neutrófilos, en cáncer oral72, asociados con la migración invasiva en líneas celulares hipóxicas de cáncer de mama y con un aumento de los niveles del TNF sérico, angiogénesis y mal pronóstico en mieloma múltiple73,74.
En cuanto a su valor pronóstico, tanto el BAFF como el BAFF-R podrían ser de utilidad en la leucemia linfocítica crónica combinado con el CD38, y el zeta-chain-associated protein kinase-70. En el linfoma folicular se correlaciona con una menor sobrevida libre de progresión75.
Las diferentes isoformas del BAFF/APRIL, descritas previamente, podrían tener un papel relevante en la génesis de trastornos linfoproliferativos: Δ4BAFF podría comportarse como un factor de transcripción que podría llevar a la producción exagerada autocrina de BAFF en la leucemia linfocítica crónica76. En tanto que las diferentes isoformas de APRIL (β, γ, δ, ¿) se han detectado en la leucemia linfoblástica aguda pre-B76.
En cuanto al papel de los receptores de BAFF, también se han encontrado sobreexpresados, como el TACI en mieloma múltiple y carcinoma de tiroides, el cual se ha involucrado como marcador pronóstico para linfoma77.
Como excepción, en el cáncer de próstata, el BAFF secretado por las células epiteliales tiene un papel protector sobre la sobrevida de los linfocitos periglandulares y limita la expansión tumoral78.
Enfermedades infecciosasDentro de las infecciones virales se ha visto una inducción de BAFF en infecciones por hepatitis C, virus de la inmunodeficiencia humana, virus sincitial respiratorio e influenza H1N179–81. Se ha descrito que la regulación positiva de BAFF, luego de una infección viral, es dependiente del TNF, siendo los monocitos los responsables de la liberación de BAFF como respuesta al tratamiento con IFN82. El éxito de la terapia con IFN para controlar estas infecciones se ha atribuido, en parte, al aumento de la señalización de BAFF83.
Los diferentes tipos de virus infectan distintos blancos celulares y esto se relaciona con el nivel de secreción de BAFF, que difiere de un tipo celular a otro. Por ejemplo, los macrófagos, las células dendríticas y los neutrófilos son capaces de aumentar la producción de BAFF, mientras que las células epiteliales que hacen parte de la mucosa tiene una secreción menor, resultado de una infección, sin perder su función como células efectoras de una respuesta local83. En infección por virus de Epstein Barr hay una regulación al alza de BAFF. De hecho, algunas líneas de células de LB positivas para virus de Epstein Barr producen niveles de BAFF comparables con las células mieloides84.
La importancia de este sistema BAFF/APRIL en la defensa de infecciones por bacterias se demuestra en los pacientes con inmunodeficiencia común variable, donde se documentan mutaciones en el BAFF-R, las cuales se manifiestan frecuentemente con infecciones bacterianas a nivel de tracto respiratorio superior e inferior a repetición85. Sin embargo, existen individuos con mutaciones del mismo receptor que son asintomáticos, lo que indica que hay otros factores ambientales o genéticos que contribuyen a este fenotipo85. Con relación a los modelos murinos, ratones deficientes para BAFF-R presentan un déficit de inmunidad humoral a LT Ag-independientes, incluyendo bacterias encapsuladas como Streptococcus pneumoniae86. En los neonatos, su menor capacidad de montar una respuesta protectora ante polisacaridasas bacterianas podría deberse a una menor expresión de TACI, BCMA y BAFF-R en los LB, y a una disminución de la habilidad para realizar el cambio en la respuesta de anticuerpos87.
Terapias dirigidas contra BAFF en enfermedades autoinmunesEn las secciones anteriores se ha descrito la importancia del sistema BAFF/APRIL y sus receptores en la patogénesis de la autoinmunidad. Estos hallazgos suponen que la terapia anti-BAFF/APRIL es un blanco terapéutico atractivo en estas enfermedades.
BelimumabEs una Ig humana G1-λ que tiene como blanco el BAFF soluble, que inhibe su actividad y reduce su concentración88. Esto conduce a la apoptosis de las células B autorreactivas, previniendo la proliferación y autorreplicación89,90.
Farmacodinámicamente belimumab se une específicamente al BAFF en solución, previniendo su unión al TACI, BCMA y BAFF-R. Este medicamento no tiene efecto sobre el BAFF unido a membrana, ni sobre otros miembros de la familia del TNF ligando89,90.
Su selectividad conduce a la disminución del número de los linfocitos B CD20+, células B vírgenes, células B activadas y plasmablastos, sin disminuir el número de células plasmáticas. En contraste, aumenta el número de células B de memoria hacia el día 28, pero retornan a su conteo basal para la semana 52. Este hallazgo está relacionado con el hecho de que estas células expresan niveles mayores de TACI89,90. El tratamiento con belimumab también disminuyó de manera significativa los niveles de diferentes Ig, de relevancia la IgG, y aumentó los niveles de complemento, hallazgos sugerentes de un producto biológicamente activo con un perfil de respuesta91,92. El medicamento tiene una vida media de 13-17 días, con una depuración de 4±1,56ml/día/kg, que alcanza a los 8 meses una completa eliminación y un Vss (estado basal) 68±20,8ml/kg, con un perfil farmacocinético dosis dependiente93.
Su eficacia en el tratamiento del LES fue documentada en 2 estudios pivotales de fase iii, doble ciego, aleatorizados, placebo controlados, multicéntricos en pacientes con LES activo (SLEDAI >6), lo cual llevó a que la FDA lo aprobara como tratamiento biológico para el LES94,95.
Se han reportado datos de su seguridad y eficacia sostenida a 7 años con un seguimiento de 1.745 pacientes/año, en quienes se ha documentado disminución del nivel y la presencia de anticuerpos, además de un efecto ahorrador de esteroides94,95.
En AR hasta la fecha hay publicado un estudio de fase ii, multicéntrico, doble ciego, placebo controlado, de dosificación en pacientes con AR moderada severa con falla a tratamientos previos de 24 semanas de duración, con una fase abierta de extensión, en el cual se demostró una tolerancia adecuada con mejoría en la escala ACR 20 (criterio de mejoría del 20% del Colegio Americano de Reumatología) a 24 semanas, especialmente en pacientes con enfermedad con actividad alta, FR positivo, vírgenes al tratamiento anti-TNF y que habían fallado previamente a metotrexato. Sin embargo, falló en demostrar mejoría significativa en las respuestas ACR50 y ACR70 sin relación dosis/respuesta96,97.
En SSp la eficacia y seguridad de belimumab (n=30) a una dosis de 10mg/kg en semanas 0, 2 y 4, con aplicación mensual posterior hasta la semana 24, se evaluó en un estudio abierto prospectivo a un año con desenlaces primarios de mejoría en síntomas secos, actividad sistémica o mejoría en biomarcadores de células B. El desenlace primario se alcanzó en el 60% de los pacientes con una mejoría estadísticamente significativa del índice de actividad de la enfermedad (ESSDAI: EULAR Sjögren syndrome disease activity index) del 8,8 al 6,3 (p=0,0015) y una mejoría particular en el dominio glandular de la enfermedad e inflamación parotídea no maligna, pero sin cambios en el flujo salivar o test de Schirmer, resultados alentadores que justifican la realización de estudios controlados posteriores98. En un análisis de 10 pacientes de la misma cohorte, entre las semanas 10 y 52 de tratamiento se valoraron los subtipos de célula B y la expresión de BAFF y BAFF-R, y se encontró que tenían un incremento de los LB circulantes con expansión de los subtipos virgen y transicionales (similar a los de los controles sanos), niveles mayores de BAFF, pero con menor expresión de BAFF-R, disminución en los niveles de Ig, FR, anticuerpos antinucleares e incremento de la fracción C4 del complemento, lo que evidenciaba una normalización de la frecuencia, fenotipo y función de las células B99.
AtaciceptEs una proteína de fusión quimérica recombinante conformada por la porción extracelular del receptor TACI ligado al dominio Fc de la IgG1 humana, con afinidad por BAFF y APRIL35,100. Al unirse a los heterotrímeros y homotrímeros de BAFF y APRIL causa una depleción de las células B maduras, células plasmáticas y algunos anticuerpos séricos101,102. Alcanza un pico sérico a las 16 h luego de la primera administración, su concentración vs. tiempo aumenta proporcionalmente a la dosis, sin tener un mayor efecto clínico, pero con un buen perfil de seguridad, con solo un aumento leve del 1,6% de las infecciones en algunos pacientes103,104. En autoinmunidad, el atacicept se asocia a una reducción rápida de los niveles circulantes de Ig, en especial IgM, luego de la primera dosis y persiste con la posterior administración105,106. A diferencia de belimumab, al inhibir APRIL se tiene una mayor inhibición de los niveles de Ig104.
En LES se ha evaluado su seguridad en estudios fase Ib donde disminuyeron los niveles de Ig (IgA, IgM, IgG) y el número de células B de manera dosis dependiente, con hallazgos prometedores106. Pero esto no pudo revalidarse en estudios posteriores de eficacia, aleatorizados fases ii/iii, con inicio concomitante de esteroides y micofenolato mofetilo en pacientes con nefritis lúpica activa. Dichos estudios requirieron ser suspendidos por incremento en la tasa de infecciones y disminución pronunciada de los niveles de Ig107,108.
En AR, en el estudio AUGUST se evaluó la eficacia de atacicept en pacientes con falla al tratamiento con metotrexato o terapia biológica anti-TNFα. En este estudio se demostró una reducción de los niveles séricos de Ig: IgM, IgA, IgG, los 3 tipos de FR, velocidad de sedimentación globular, proteína C reactiva, LB maduros y células plasmáticas, sin cambios en los anti-CCP. No se documentaron efectos sobre las células T ni natural killer103,104. Luego de la semana 16 las células plasmáticas aumentaron en número, sin observar nuevos cambios en las células B maduras, posiblemente por una movilización selectiva de células plasmáticas o por una transición rápida de células B maduras a células plasmáticas, que es independiente del sistema BAFF/APRIL104. Los títulos de Ig y FR disminuyen al inicio, pero retornan a lo normal a las 13 semanas de suspensión del medicamento. De manera particular se observó una mayor reducción de las fracciones IgG e IgA del FR en comparación con los niveles del mismo isotipo de Ig sérica, lo cual podría ser explicado por una mayor sensibilidad de los anticuerpos a la inhibición del BAFF/APRIL103.
A pesar de estos hallazgos, no se ha visto una mejor respuesta del ACR20-C-reactive protein (ACR20-CRP) en las primeras 26 semanas, en comparación con placebo, ya que atacicept no modula la respuesta humoral en el sitio de la inflamación lo suficiente para alcanzar un beneficio clínico103,104.
En AR, atacicept no alcanzó ningún desenlace de eficacia primario en este ni en otros estudios de fase ii, a pesar del perfil aceptable de seguridad y actividad biológica significativa. Esto fue, probablemente, por la incapacidad de alcanzar concentraciones adecuadas en el líquido sinovial en comparación con los niveles séricos, que requiere, además, una supresión local necesaria para un efecto clínico66,103,105,104,109,110. Más estudios en las diferentes enfermedades están en curso para demostrar su efecto.
TabalumabEs un anticuerpo anti-BAFF monoclonal humano tipo IgG4 que neutraliza el BAFF activo tanto en su forma soluble como unida a membrana. Tiene una farmacocinética no lineal, con una vida media de ∼25 días109,110. Causa un aumento inicial de las células B totales y maduras, con una disminución progresiva de estas a partir de la semana 16, al disminuir la concentración sérica de tabalumab, que se mantiene hasta la semana 24 en promedio111. Esta es más selectiva para los LB vírgenes en aproximadamente el 60%, con una preservación relativa de los LB maduros. También disminuye la IgM significativamente en comparación con IgG e IgA, sin cambios significativos en la proteína C reactiva y la velocidad de sedimentación globular110.
Actualmente, se encuentran en curso estudios clínicos para AR, LES, mieloma múltiple y enfermedad renal crónica terminal112,113.
En AR no alcanzó el desenlace primario a la semana 16, se observó una respuesta clínica a la semana 9, asociada a un pico del medicamento, al disminuir el disease activity score 28-C-reactive protein (DAS28-CRP)111, con posterior diminución en su eficacia y en la concentración sérica, sin tener una relación dosis respuesta. La efectividad en comparación con placebo varía, de ser igual o levemente mejor, en quienes habían tenido previamente falla a DMARD o anti-TNF, respectivamente, luego de la semana 16110,111.
BlisibimodEs una proteína de fusión polipeptídica producida utilizando E. coli que tiene como blanco el BAFF soluble y de membrana. Está compuesta de un dominio de unión novedoso ligado al extremo N-terminal de la fracción constante de la Ig humana114. La eficacia de blisibimod se evaluó en pacientes con LES activo (SLEDAI mayor de 6), en el estudio clínico, aleatorizado, doble ciego de fase IIb, denominado PEARL-SC study (n=547), con desenlace primario medido a las 24 semanas de una mejoría en el systemic lupus response index-5 mayor de 5. Si bien el desenlace primario no mejoró significativamente respecto al placebo en el grupo total, los pacientes con la dosis más alta alcanzaron respuestas mayores en comparación con placebo, con una significación estadística a la semana 20 (p=0,02); se observó además disminución significativa en la proteinuria (p>0,01), en anti-ADN y mejoría en el complemento. Se espera la realización de estudios en fase iii115.
Efectos de la depleción anti-CD 20 en niveles de BAFFRituximabEs un anticuerpo quimérico monoclonal, que incorpora la cadena pesada de la IgG1κ humana y las regiones variables de la Ig murina, dirigida contra el CD20 humano116. El CD20 es expresado desde las células pre-B hasta las células de memoria, pero no en las células plasmáticas maduras. Se encuentra aprobado para el tratamiento del linfoma de células B117. En AR tiene aprobación para su uso en pacientes que experimentan falla a terapia biológica con anti-TNF117. En LES la evidencia de su eficacia es anecdótica, particularmente en pacientes refractarios al tratamiento117. El rituximab ha sido evaluado en estudios clínicos en LES con resultados desalentadores en fase ii (conocido como EXPLORER) y fase iii (conocido como LUNAR) donde no se alcanzaron los desenlaces primarios, que podrían atribuirse en parte a fallas metodológicas de estos: la medida de actividad de la enfermedad difirió de la utilizada en los estudios de belimumab, la presencia de poblaciones heterogéneas de pacientes, y el reclutamiento y la inmunoterapia concomitante que pudo enmascarar su efecto117.
En la mayoría de los pacientes tratados con rituximab la cinética poblacional de LB muestra 2 fases:
La primera, donde se observa una depleción completa de LB, principalmente células de memoria a títulos bajos (disminución de LB de memoria autoantígeno-específicas, proinflamatorias: productoras de linfotoxina y TNF) asociado a un aumento progresivo del número de células B vírgenes y transicionales, secundario al aumento reactivo de los niveles del BAFF en respuesta a la disminución del número de receptores para este en las células B, y al retardo en la regulación del ARNm del BAFF118,119. Es en la disminución de las células vírgenes transicionales, activadas y plasmáticas de vida corta, en lo que el belimumab basa su eficacia clínica33. Esta primera fase tiene una duración variable determinada por los niveles de BAFF y la reconstitución del número de células B, que puede estar entre 6 y 12 meses33.
La segunda fase o de reconstitución: se caracteriza por la reaparición de células B de memoria, que traducido a la clínica puede ser indicativo de recaída y de retratamiento de pacientes con LES33.
Por lo tanto, se plantea que una depleción de células plasmáticas de larga vida (rituximab) combinada con una terapia que resulte en la pérdida de células B autoinmunes emergentes (belimumab) podría evitar la repoblación de células de larga vida del compartimento de células B con células plasmáticas autoinmunes, lo que nos lleva a pensar que la terapia combinada tendría mecanismos de acción complementarios, pero en teoría podrían ser mutuamente excluyentes por el aumento del riesgo de infección en un paciente con depleción completa de células B33. Esta hipótesis debe ser evaluada en estudios clínicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.








![Variantes de APRIL (a proliferation-inducing ligand) y TWEAK (tumor necrosis factor [TNF]-like weak inducer of apoptosis) humanos. Los exones están representados en cajas; los intrones, en líneas gruesas grises. DHT: dominio homología TNF; DRC: dominio rico en cisteína; DTM: dominio transmembrana; RNT: regiones 5’ y 3’ no traducidas. Fuente: Diseño y concepción Betancur et al. (2015). Variantes de APRIL (a proliferation-inducing ligand) y TWEAK (tumor necrosis factor [TNF]-like weak inducer of apoptosis) humanos. Los exones están representados en cajas; los intrones, en líneas gruesas grises. DHT: dominio homología TNF; DRC: dominio rico en cisteína; DTM: dominio transmembrana; RNT: regiones 5’ y 3’ no traducidas. Fuente: Diseño y concepción Betancur et al. (2015).](https://static.elsevier.es/multimedia/01218123/0000002300000003/v1_201609170050/S012181231630041X/v1_201609170050/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)