Generar las recomendaciones para la atención de pacientes con enfermedades reumáticas que reciben terapias inmunomoduladoras e inmunosupresoras (fármacos convencionales, biológicos y moléculas pequeñas) durante la pandemia por COVID-19.
Materiales y métodosLas recomendaciones se realizaron utilizando el método Delphi como herramienta de acuerdo. Se conformó un panel de expertos con trayectoria académica y experiencia en investigación en reumatología. Se realizó la búsqueda de la literatura y se generó el cuestionario del ejercicio Delphi conformado por 42 preguntas. El grado de acuerdo se logró con el 80% de aprobación de los participantes.
ResultadosSe conformó un grupo de 11 reumatólogos de 7 ciudades del país. La tasa de respuesta fue del 100% para las 3 rondas de consulta. En la primera ronda se logró acuerdo en 35 preguntas, en la segunda ronda 37 y en la tercera ronda se logró el acuerdo de las 42 preguntas.
ConclusiónLa recomendación para la mayoría de los tratamientos inmunomoduladores utilizados en reumatología es continuar con las terapias en pacientes que no tengan la infección y suspenderlas en aquellos con diagnóstico de SARS-CoV-2/COVID-19.
To produce recommendations for patients with rheumatological diseases receiving immunomodulatory and immunosuppressive therapies (conventional drugs, biologicals, and small molecules) during the COVID-19 pandemic.
Materials and methodsThe recommendations were determined using the Delphi method as an agreement tool. A panel of experts was formed, with academic backgrounds and research experience in rheumatology. A literature search was conducted and 42 questions were generated. The level of agreement was made with 80% of approval by the participants.
ResultsA group of eleven rheumatologists from 7 cities in the country participated. The response rate was 100% for the three consultation rounds. In the first round, agreement was reached on 35 questions, on 37 in the second round, and on 42 questions in the third round.
ConclusionThe recommendation for the majority of the pharmacological treatments used in rheumatology is to continue with immunomodulatory or immunosuppressive therapies in patients who do not have the infection, and to suspend it in patients with a diagnosis of SARS-CoV-2/COVID-19.
La enfermedad por coronavirus 19 (COVID-19) es el nombre asignado a la patología causada por la infección por el coronavirus del síndrome respiratorio agudo severo 2 (SARS-CoV-2, por sus siglas en inglés)1. Esta nueva condición emergió en diciembre del 2019 en la ciudad Wuhan, provincia de Hubei, China, y se convirtió en una emergencia sanitaria a escala mundial que ha puesto en jaque a la humanidad, desde que fuera declarada como pandemia por la Organización Mundial de la Salud (OMS) el 11 de marzo del 20202. En Latinoamérica, el primer caso de COVID-19 fue reportado en Brasil el 25 de febrero. En Colombia el primer caso se reportó el 6 de marzo3. Esta pandemia ha puesto a prueba los distintos sistemas de salud, especialmente en países en desarrollo, donde las limitaciones logísticas y económicas pueden representar un gran desafío para afrontarla.
En vista de la preocupación con el anuncio de esta infección, sumado al pronunciamiento del Ministerio de Salud mediante la circular externa 0018 del 10 de marzo del 20204, surge la necesidad de generar recomendaciones dirigidas a los profesionales de la salud en el contexto de la atención de pacientes con enfermedades reumatológicas que reciben terapias inmunomoduladoras e inmunosupresoras (fármacos convencionales, biológicos y moléculas pequeñas) en el contexto epidemiológico actual. Este documento de la Asociación Colombiana de Reumatología tiene como objetivo proporcionar una orientación para este momento de contingencia, considerando que los pacientes con enfermedades autoinmunes e inflamatorias son parte de la población de riesgo, y por consiguiente deben mantener el aislamiento social obligatorio de acuerdo con las directrices gubernamentales. La evidencia actual es limitada, lo cual impide tener suficiente claridad respecto a la relación riesgo-beneficio del uso de las terapias farmacológicas inmunomoduladoras e inmunosupresoras en este momento. Por lo tanto, las siguientes recomendaciones están sujetas a cambios y actualizaciones a medida que se vaya fortaleciendo la evidencia científica, con nuevos estudios que incluyan un mayor número de pacientes y permitan mejorar la fuerza de las recomendaciones.
Materiales y métodosEl método Delphi es un proceso iterativo, diseñado para combinar la opinión de un grupo de expertos dentro de un consenso. Se trata de una metodología estructurada para recolectar sistemáticamente opiniones de especialistas acerca de un problema, procesar la información y, finalmente, construir un acuerdo general de grupo5. El presente trabajo se llevó a cabo usando este método como herramienta de acuerdo para construir las recomendaciones. A continuación, se describen los pasos que se siguieron en este proyecto, aplicando estrictamente los lineamientos metodológicos para este tipo de ejercicio6.
Conformación del panel: por medio de una convocatoria abierta y ad honorem, a miembros de la Asociación Colombiana de Reumatología, se seleccionaron 11 reumatólogos con experiencia de por lo menos 5 años en el área asistencial, con trayectoria académica y experiencia en investigación, incluyendo una reumatóloga pediatra.
La coordinadora principal de las recomendaciones envió los objetivos, el alcance y la propuesta de las preguntas iniciales. Los 11 reumatólogos participantes seleccionaron las preguntas en reunión virtual y luego se escogió a 2 de ellos para controlar el flujo de información entre los participantes durante el proceso iterativo de consultas, haciendo la respectiva retroalimentación, analizando las respuestas de cada ronda y preparando los subsecuentes cuestionarios. Uno de los integrantes no contaba con voto, ya que era quien controlaba toda la información.
Una vez realizadas las 3 rondas para llegar al acuerdo de las preguntas, se llevó a cabo otra reunión virtual y se definieron puntos como autoría y colaboración para la redacción del manuscrito. Este último finalmente fue enviado a revisión del grupo de reumatólogos participantes para someterlo a publicación por parte del autor principal.
Revisión de la literatura: con el objetivo de identificar la literatura disponible con información sobre las posibles opciones para tener en cuenta en pacientes reumáticos con o sin COVID-19, en cuanto a la continuidad, el ajuste de dosis o el ajuste del periodo de aplicación de los diferentes medicamentos empleados para el tratamiento de las enfermedades reumáticas, se buscaron artículos en las bases de datos Medline, Embase, Clinical Key, Web of Science, Google Scholar y Scielo-Bireme. Se utilizaron los siguientes términos de búsqueda: «Coronavirus infections»; «SARS»; «SARS-CoV-2»; «MERS»; «Influenza»; «Pandemics»; «Anti-inflammatory agents, Non steroidal»; «Glucocorticoids»; «Antimalarials»; «Methotrexate»; «Leflunomide»; «Sulfasalazine»; «Cyclophosphamide»; «Azathioprine»; «Cyclosporine»; «Mycophenolic Acid»; «Colchicine»; «Immunoglobulins»; «Tumor Necrosis Factor Inhibitors»; «Abatacept»; «Rituximab»; «Tocilizumab»; «Belimumab»; «Interleukin 1 Receptor Antagonist Protein»; «Ustekinumab»; «Interleukin-17»; «Janus Kinase Inhibitors»; «Antibodies, Monoclonal, Humanized». Los resultados de la búsqueda se restringieron a artículos en inglés y español, sin establecer límite para la fecha de publicación. A partir de esta búsqueda, se identificó la información correspondiente a la prescripción de los diferentes medicamentos empleados en reumatología, en el contexto de la situación de pandemia por SARS-CoV-2, en el marco de un proceso infeccioso de etiología viral similar (SARS, MERS, influenza estacional), debido a la previsión de encontrar escasa información en el escenario de una infección nueva. A partir de dichas publicaciones se elaboró el primer cuestionario del ejercicio Delphi. No se encontró ningún resultado con respecto a la población pediátrica.
Diseño del cuestionario: mediante una reunión virtual que se llevó a cabo el 26 de marzo del 2020 por medio del software Go ToMeeting®, empleado con licencia de la Asociación Colombiana de Reumatología, el grupo de participantes definió las preguntas que conformarían el cuestionario para el presente documento, teniendo en cuenta la información que arrojó la búsqueda de la literatura. El cuestionario estaba conformado por 42 preguntas de selección múltiple con única respuesta; en cada una de ellas el reumatólogo podía hacer las observaciones que considerara pertinentes, como complemento a su respuesta.
Consultas a participantes y definición de acuerdo: se llevaron a cabo 3 rondas de consulta. Como definición de acuerdo, se consideró una pregunta como «aceptada» para inclusión en el documento si era seleccionada con la misma opción de respuesta por el 80% o más de los participantes. Las preguntas en las que no se logró acuerdo (seleccionadas por el 70% o menos de los participantes) pasaron a una siguiente ronda de consulta. El cuestionario de la siguiente ronda estaba conformado por el listado de las preguntas en las que no se alcanzó acuerdo, las respuestas emitidas por los participantes, sin que fuera posible identificar a quién correspondía cada una, el análisis estadístico de las respuestas grupales de la ronda anterior y las observaciones anotadas por los expertos, también escritas en forma anónima. A partir de este punto, se les solicitó que reevaluaran sus conceptos, teniendo en cuenta la opinión del grupo, de tal forma que quien respondía podría mantener o cambiar la respuesta dada en la ronda anterior, según lo considerara, a la luz de la nueva información que estaba recibiendo.
ResultadosEl ejercicio Delphi contó con la participación de 10 reumatólogos de 7 ciudades de Colombia (Armenia, Bogotá, Cali, Manizales, Medellín, Neiva y Pereira), con tiempo promedio de experiencia como reumatólogos de 11,6años (±6,6). Ocho de los reumatólogos trabajan con instituciones que atienden a pacientes reumatológicos en el contexto hospitalario y 5 de ellos son profesores universitarios. La tasa de respuesta del ejercicio Delphi fue del 100% en las 3 rondas de consulta realizadas. El ejercicio tuvo una duración total de 3 semanas.
A los participantes les fueron presentadas 42 preguntas. En la primera ronda se logró acuerdo en 35 de estas, y no se logró acuerdo en 7, las cuales pasaron a una segunda ronda de consulta. En la segunda ronda se presentaron 7 preguntas y se logró acuerdo respecto a 2 de estas, pero no así en relación con las otras 5. En la tercera ronda se presentaron 5 preguntas y se llegó a acuerdo en torno a todas ellas. El texto con las preguntas hace parte del material adicional (anexo) de este artículo.
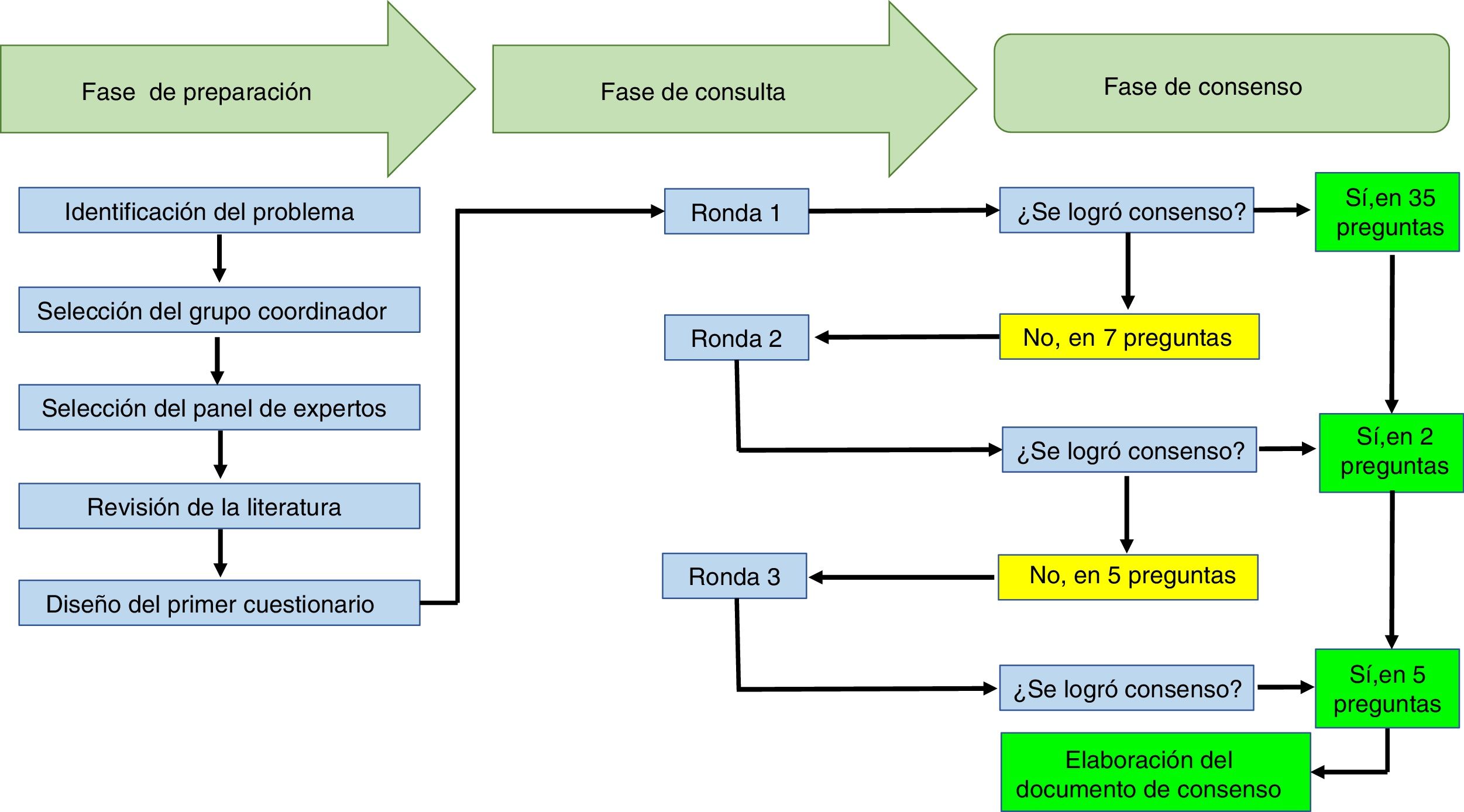
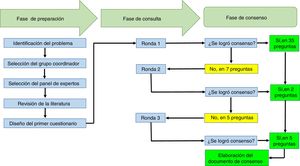
El tiempo promedio de respuesta de los participantes fue de 2,6días (±1,1). En la tabla 1 se presentan las recomendaciones de los participantes y en la figura 1 se resumen los procesos que se llevaron a cabo en el ejercicio Delphi, en el marco de las 3 fases que conforman esta técnica de acuerdo.
Recomendaciones del panel en cuanto a la continuidad o suspensión del tratamiento de enfermedades reumáticas en el contexto de la pandemia de infección por SARS-CoV-2/COVID-19
| Recomendación | Votos |
|---|---|
| Los AINE y/o inhibidores Cox 2 deben continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 9 |
| Los AINE y/o inhibidores Cox 2 deben continuarse a la misma dosis en pacientes con enfermedades reumáticas y COVID-19 | 8 |
| Los glucocorticoides deben continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 8 |
| Los glucocorticoides deben continuarse a una dosis menor en pacientes con enfermedades reumáticas y COVID-19 | 9 |
| Los antimaláricos deben continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 10 |
| Los antimaláricos deben continuarse a la misma dosis en pacientes con enfermedades reumáticas y COVID-19 | 10 |
| El metotrexato debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 9 |
| El metotrexato debe suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 10 |
| La leflunomida debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 9 |
| La leflunomida debe suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 10 |
| La ciclofosfamida debe continuarse en pacientes con enfermedades reumáticas sin COVID-19 | 9 |
| La ciclofosfamida debe suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 10 |
| La azatioprina debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 9 |
| La azatioprina debe suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 10 |
| La ciclosporina debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 8 |
| La ciclosporina debe suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 10 |
| El micofenolato debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 9 |
| El micofenolato debe suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 10 |
| La sulfasalazina debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 8 |
| La sulfasalazina debe suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 10 |
| La colchicina debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 10 |
| La colchicina debe continuarse a la misma dosis en pacientes con enfermedades reumáticas y COVID-19 | 8 |
| La inmunoglobulina debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 10 |
| La inmunoglobulina debe continuarse a la misma dosis en pacientes con enfermedades reumáticas y COVID-19 | 8 |
| Los inhibidores del factor de necrosis tumoral deben continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 10 |
| Los inhibidores del factor de necrosis tumoral deben suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 10 |
| El abatacept debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 9 |
| El abatacept debe suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 9 |
| El rituximab debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 8 |
| El rituximab debe suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 10 |
| El tocilizumab debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 10 |
| El tocilizumab debe suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 8 |
| El belimumab debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 10 |
| El belimumab debe suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 8 |
| Los inhibidores de la interleuquina 1 deben continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 9 |
| Los inhibidores de la interleuquina 1 deben suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 9 |
| El ustekinumab debe continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 9 |
| El ustekinumab debe suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 10 |
| Los inhibidores de la interleuquina 17 deben continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 9 |
| Los inhibidores de la interleuquina 17 deben suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 10 |
| Los inhibidores de janus kinasa deben continuarse a la misma dosis en pacientes con enfermedades reumáticas sin COVID-19 | 9 |
| Los inhibidores de janus kinasa deben suspenderse en pacientes con enfermedades reumáticas y COVID-19 | 8 |
Gráfico de resumen de los procesos que se llevaron a cabo en el ejercicio Delphi para establecer las recomendaciones de la Asociación Colombiana de Reumatología en torno al manejo de pacientes con enfermedades reumáticas que reciben terapias inmunomoduladoras/inmunosupresoras (convencionales, biológicas y moléculas pequeñas), en el contexto de SARS-CoV-2/COVID-19.
El panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar los AINE, salvo que durante la evolución del tratamiento de la enfermedad reumática de base presentaran los efectos adversos ya conocidos de este tipo de medicamentos. En cuanto a los pacientes con diagnóstico de COVID-19 y uso de AINE, hay información que respalda su uso, pero también información en contra, ambas de baja calidad en cuanto al nivel de evidencia. El ibuprofeno se ha relacionado con un aumento en la expresión de la enzima convertidora de angiotensina-2, cuando se usa en ratas diabéticas7, y este efecto podría, teóricamente, empeorar la susceptibilidad y el curso clínico de los pacientes con COVID-198. Una nota publicada en el British Medical Journal9 informa la alerta emitida por el Ministerio de Salud de Francia en relación con el uso de AINE, los cuales podrían empeorar los síntomas y el curso de la enfermedad de pacientes con COVID-19. Por lo tanto, sugieren el uso de acetaminofén. La Agencia Europea de Medicamentos (EMA) reporta que «no hay evidencia científica que establezca una relación entre ibuprofeno y empeoramiento del curso del COVID-19; la EMA está monitorizando de cerca la situación, y revisará cualquier información nueva que esté disponible en el contexto de la pandemia»10. En una carta al editor de la revista Science, Fitzgerald sostiene que los pacientes con COVID-19 asintomáticos, o con formas leves de la infección, no pasarán a formas severas por el uso de AINE11. La FDA en comunicado del 19 de marzo del 2020 anuncia que «no se conoce evidencia científica que los AINE, en especial el ibuprofeno, empeoren los síntomas por COVID-19»12. Aunque la evidencia actual es escasa, con documentos a favor y en contra sobre el uso de AINE en pacientes con COVID-19, el panel considera que en el contexto de COVID-19, los pacientes con enfermedades reumáticas podrían continuar el uso de AINE, de acuerdo con la situación clínica particular en cada caso.
GlucocorticoidesEl panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar los glucocorticoides a la dosis mínima necesaria para el control de su enfermedad reumática. En pacientes con enfermedades reumáticas con diagnóstico de COVID 19, los glucocorticoides deben continuarse, disminuyendo la dosis a la mínima necesaria para el control de su enfermedad reumática. Luego de revisar la literatura actual respecto al uso de glucocorticoides orales o intravenosos en pacientes con enfermedades reumáticas, no se encuentra soporte a favor ni en contra de su uso en estos pacientes. La mayoría de los artículos reportados sobre uso de glucocorticoides en la pandemia actual se enfoca en responder la pregunta sobre el uso de este tipo de medicamentos en el paciente con neumonía grave por COVID-1913. En relación con el grupo específico de pacientes con enfermedades reumáticas, hay muy pocos artículos directamente relacionados con el tema. Se encuentran recomendaciones generales respecto al riesgo alto de los pacientes con estas enfermedades de adquirir infecciones, tanto por la naturaleza de la enfermedad autoinmune como por la necesidad de un tratamiento inmunosupresor. En cuanto al uso de glucocorticoides en estos pacientes, las recomendaciones son las siguientes: no deben iniciarse si no hay una clara indicación y no deben suspenderse en forma abrupta si ya se recibían crónicamente. Estas recomendaciones previas están consignadas en los documentos oficiales de posición sobre el tratamiento de pacientes reumáticos en la pandemia por SARS-CoV-2, de la Asociación Australiana de Reumatología14 y del Servicio Nacional de Salud del Reino Unido15. Es muy poco lo que hay en la literatura en el momento respecto al uso de glucocorticoides en cada una de las enfermedades reumáticas. Se han hecho algunas recomendaciones, en particular en pacientes con artritis reumatoide16, en las que se plantea que los glucocorticoides en pacientes con infecciones virales pueden tener una disminución en la depuración de la carga viral, pero a su vez pueden disminuir la respuesta inflamatoria del huésped, uno de los causantes del síndrome de dificultad respiratoria del adulto (SDRA). Sin embargo, su papel en el manejo de la complicación pulmonar es aún incierto. En conclusión, la literatura actual es escasa y no es clara en lo que se refiere al uso o suspensión de glucocorticoides en pacientes con enfermedades reumáticas en el contexto de la pandemia por SARS-CoV-2. Como aspectos de lo hallado en la literatura que merecen ser resaltados se encuentran: no iniciar glucocorticoides si no hay una clara indicación en la situación actual; mantener la dosis mínima necesaria para el control de la enfermedad autoinmune de base, evitando el uso de dosis altas (>10mg/día); no suspender abruptamente la terapia con glucocorticoides, sino iniciar una disminución progresiva, de acuerdo con el nivel de control de la enfermedad y el tratamiento reumatológico concomitante.
Antimaláricos (hidroxicloroquina y cloroquina)El panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar con antimaláricos. No existe evidencia científica contundente para responder esta pregunta, sin embargo, hay algunas recomendaciones para pacientes, hechas por expertos de EULAR (European League Against Rheumatism)17, de acuerdo con las cuales los medicamentos inmunomoduladores son útiles para prevenir un empeoramiento de la enfermedad reumática de base, y cuando se suspenden, ello puede causar una recaída de la enfermedad. Lo anterior sugiere que se debe continuar con este tipo de medicamentos.
Con respecto al efecto de estos medicamentos en un posible cuadro de COVID-19, el Servicio Nacional de Salud del Reino Unido sostiene que los pacientes pueden continuar tomando hidroxicloroquina si están infectados con SARS-CoV-215. Los antimaláricos son considerados medicamentos seguros en el contexto de infecciones. En un estudio de casos y controles anidado dentro de una cohorte, que incluyó 23.733 pacientes con artritis reumatoide, se evaluó el riesgo de infecciones graves asociadas al uso de fármacos antirreumáticos modificadores de la enfermedad convencionales. Se demostró que el riesgo relativo (RR) para infecciones que requirieron hospitalización en pacientes que usaban antimaláricos fue de 1,06 (IC 95%: 0,94-1,19), y el RR para neumonía fue de 1,06 (IC 95%: 0,92-1,22). Por lo anterior concluyen que la hidroxicloroquina y la cloroquina no tuvieron asociación estadística con mayor riesgo de infección18. Un estudio de cohorte retrospectivo con 24.530 pacientes que tenían artritis reumatoide determinó que estos pacientes tenían mayor riesgo de infección hospitalaria, y este riesgo variaba según el tratamiento. Se encontró que la tasa de primera infección hospitalaria fue mayor en la cohorte de pacientes con artritis reumatoide, pero el uso de hidroxicloroquina se asoció con una disminución del riesgo, con un RR ajustado de 0,74 (IC 95%: 0,62-0,89)19.
Desde 1969 existe evidencia científica que demuestra la eficacia in vitro de la cloroquina como un potencial agente antiviral de amplio espectro20. Los antimaláricos (cloroquina e hidroxicloroquina) bloquean la infección viral, lo cual incrementa el pH endosomal requerido para la fusión virus-célula, al igual que interfiere con la glicosilación de los receptores celulares SARS-CoV-2, por lo que se han usado en diferentes países para el tratamiento de pacientes con COVID-19. En algunos estudios clínicos se ha evaluado su eficacia junto con azitromicina21 y medicamentos antivirales22, con resultados a favor en algunos estudios22,23, incluso con una revisión sistemática reciente24, pero con la limitación de tratarse de estudios con pequeños grupos de pacientes. Con base en lo anterior, la evidencia aún impide sacar conclusiones sobre la real efectividad de los antimaláricos en el tratamiento de los pacientes con COVID-19; sin embargo, ante las escasas opciones terapéuticas para tratar a estos pacientes, los antimaláricos se han incluido en los protocolos de tratamiento de diferentes países, entre ellos Colombia, como el Consenso Colombiano de Atención, Diagnóstico y Manejo de Infección por SARS-CoV-2, publicado recientemente en la revista de la Asociación Colombiana de Infectología25. Si se tiene en cuenta entonces que los antimaláricos hacen parte del esquema de tratamiento para COVID-19, este panel recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben continuar los antimaláricos a la dosis usual, luego de haber recibido el tratamiento específico para la infección.
Antirreumáticos convencionales (metotrexato, leflunomida, azatioprina y sulfasalazina) y otros inmunosupresores (micofenolato, ciclofosfamida y ciclosporina)El panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar con los medicamentos antirreumáticos convencionales y medicamentos inmunosupresores. El metotrexato es un medicamento con efecto inmunomodulador más que inmunosupresor a las dosis en que se prescribe para el tratamiento de las enfermedades reumáticas, y no se ha asociado con infecciones oportunistas26, incluso cuando es usado con otros medicamentos inmunomoduladores, glucocorticoides o terapias biológicas. La leflunomida tiene un perfil de seguridad similar al metotrexato27, incluso cuando estos dos medicamentos se emplean en forma combinada28. La azatioprina también ha demostrado un adecuado perfil de seguridad en cuanto a infecciones29, al igual que la sulfasalazina30. El micofenolato ha mostrado aumento en el riesgo de infección para algunos virus como herpes zóster31 y citomegalovirus32, sin embargo, esto se ha evidenciado en el contexto de pacientes con trasplante de órgano sólido, quienes reciben además otros medicamentos inmunosupresores. La información de seguridad del micofenolato, en cuanto a infecciones en el tratamiento de enfermedades reumáticas como el lupus eritematoso sistémico, ha mostrado un perfil similar al de otros antirreumáticos33. Algo similar al micofenolato sucede con la ciclosporina, medicamento que ha presentado aumento en el riesgo de infecciones en algunos pacientes postrasplante34, pero con mejor perfil en el contexto de enfermedades reumáticas, dado que no se usan otros inmunosupresores potentes en forma concomitante. En algunos estudios la ciclofosfamida se ha asociado con infecciones bacterianas, virales y gérmenes oportunistas35, con un riesgo bajo de infección pero que amerita seguimiento clínico en los pacientes que reciben este citostático para el tratamiento de enfermedades reumatológicas. En general, la probabilidad de adquirir una infección grave no se incrementa de manera sustancial en los pacientes con enfermedades reumáticas que reciben medicamentos antirreumáticos convencionales e inmunosupresores. Los datos preliminares del registro internacional de pacientes con enfermedades reumáticas no han evidenciado que el uso de este tipo de medicamentos se relacione con una mayor susceptibilidad de infección grave, como manifestación de COVID-1936. Sin embargo, en el contexto de la infección activa por SARS-CoV-2, al igual que lo recomendado en otros tipos de infecciones que se puedan presentar en un paciente reumático, el panel recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben suspender los medicamentos antirreumáticos convencionales y medicamentos inmunosupresores.
La continuidad de estos medicamentos en presencia de infección viral, bacteriana o micótica se relaciona con peores desenlaces médicos al compararse con su suspensión37–40. Al ser la COVID-19 una situación a la cual nos enfrentamos, se desconoce qué tanto impacto podría acarrear la continuidad de los medicamentos antirreumáticos convencionales y los inmunosupresores. Por consiguiente, se extrapola la información disponible de otras infecciones, particularmente por virus respiratorios, recomendando su suspensión hasta la resolución completa del cuadro infeccioso agudo.
ColchicinaEl panel recomienda que los pacientes con enfermedades reumatológicas sin COVID-19 deben continuar la colchicina. Hasta el momento no existe información sobre el efecto del uso de colchicina en un posible caso de COVID-19. Tampoco hay evidencia de que el uso de este medicamento conlleve desarrollar una enfermedad grave o tenga, por el contrario, un efecto benéfico si el paciente se infecta. Lo que sí se conoce bien es que su toxicidad aumenta en combinación con algunos antibióticos y antivirales que inhiben el citocromo P45041. Por lo tanto, debe tenerse precaución con el uso combinado de colchicina con los medicamentos empleados para el tratamiento de COVID-19. El panel recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben continuar la colchicina.
En la actualidad están en curso dos estudios multicéntricos aleatorizados doble ciego, controlados con placebo, para evaluar la eficacia y la seguridad de la colchicina en pacientes adultos diagnosticados con COVID-19, y que tienen al menos un criterio de alto riesgo. Se trata de los estudios GREECO-19 (NCT04322790) de la Universidad de Atenas42 y el estudio COLCORONA (NCT04322682) de la Universidad de Nueva York y el Instituto del Corazón de Montreal43.
InmunoglobulinaEl panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar el uso de la inmunoglobulina. La inmunoglobulina intravenosa se desarrolló por primera vez a finales de 1970, y es probablemente uno de los medicamentos inmunomoduladores más seguros para su uso a largo plazo en todas las edades43; sin embargo, puede causar reacciones adversas, muchas veces relacionadas con la dosis44. Durante el brote de SARS en el 2003, la inmunoglobulina se utilizó ampliamente en Singapur a dosis de 0,4g/kg una vez al día por 3 días, y se documentó tromboembolismo venoso como efecto adverso en un tercio de los pacientes críticos45. Esto podría deberse a que la inmunoglobulina incrementa la viscosidad en estados hipercoagulables de pacientes con SARS. Sin embargo, se ha empleado inmunoglobulina en algunos pacientes con COVID-19 con resultados variables, pero que hacen que este medicamento sea considerado una alternativa, especialmente en casos severos tratados en cuidados intensivos46. El panel recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben continuar la terapia con inmunoglobulina.
En la actualidad está en curso un ensayo clínico aleatorizado y controlado para evaluar la eficacia de la terapia de inmunoglobulina intravenosa en pacientes con COVID-19 grave (NCT04261426)47.
Anti-TNFEl panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar la terapia biológica anti-TNF (adalimumab, certolizumab, etanercept, golimumab e infliximab). La mayoría de los registros de pacientes con terapia anti-TNF se enfoca en infecciones bacterianas y por gérmenes oportunistas48, y muy pocos valoran la asociación con infecciones virales. Al igual que la recomendación acerca de los antirreumáticos convencionales y fármacos inmunosupresores, el panel consideró que no es prudente continuar las terapias biológicas anti-TNF durante procesos infecciosos activos, entre ellos COVID-19, por lo que se recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben suspender la terapia biológica anti-TNF (adalimumab, certolizumab, etanercept, golimumab e infliximab). En paciente con COVID-19 existe una sobrerregulación de citoquinas proinflamatorias, incluyendo IL-1, anti-TNF e interferón gamma. Feldmann et al. consideran que existe suficiente evidencia que soporte ensayos clínicos de anti-TNF en pacientes con COVID-1949. En la actualidad está registrado en China un estudio clínico aleatorizado del uso de adalimumab en pacientes con COVID-19 y neumonía severa50.
AbataceptEl panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar la terapia biológica con abatacept. En los ensayos clínicos las tasas de infecciones con abatacept son similares a las de los pacientes tratados con metotrexato y numéricamente inferiores a las de otros biológicos51. En un metaanálisis en red de ensayos clínicos de biológicos, el riesgo de infecciones graves con abatacept era numéricamente inferior al del resto y significativamente inferior en las comparaciones con certolizumab, infliximab y tocilizumab52. En el escenario actual de la pandemia por SARS-CoV-2, hasta la fecha no se ha publicado evidencia de que el uso de abatacept conlleve desarrollar una enfermedad grave si el paciente reumático que recibe este medicamento biológico presenta COVID-19. El panel consideró que no es prudente continuar la terapia biológica con abatacept durante procesos infecciosos activos, entre ellos COVID-19, por lo que se recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben suspender la terapia con abatacept.
RituximabEl panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar la terapia biológica con rituximab. No se ha documentado un aumento en la incidencia de infecciones oportunistas en los ensayos clínicos de rituximab para artritis reumatoide53, aunque se han reportado casos de infección por Pneumocystis jirovecci54, meningitis criptocócica55 y colitis por citomegalovirus56. En el escenario actual de la pandemia por SARS-CoV-2, hasta la fecha no se ha publicado evidencia de que el uso de rituximab conlleve desarrollar una enfermedad grave si el paciente reumatológico que recibe este medicamento biológico presenta COVID-19. El panel consideró que no es prudente continuar la terapia biológica con rituximab durante procesos infecciosos activos, entre ellos COVID-19, por lo que se recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben suspender la terapia con rituximab.
TocilizumabEl panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar la terapia biológica con tocilizumab. En los ensayos clínicos de tocilizumab para artritis reumatoide no se ha documentado un aumento en la incidencia de infecciones oportunistas57. En el escenario actual de la pandemia por SARS-CoV-2, hasta la fecha no se ha publicado evidencia de que el uso de tocilizumab conlleve desarrollar una enfermedad grave si el paciente reumático que recibe este medicamento biológico presenta infección por COVID-19.
Además de las aprobaciones para artritis reumatoide y artritis idiopática juvenil, el tocilizumab ha sido aprobado por la FDA58 y la EMA59 para el tratamiento del síndrome de liberación de citoquinas inducido por células T-CAR (del inglés CART, chimeric antigen receptor T cell). Sin embargo, esta nueva indicación no ha sido resultado de un desarrollo clínico específico, sino que se ha derivado del uso empírico del tocilizumab en el contexto de ensayos clínicos relacionados con fármacos T-CAR60. La hipótesis de una potencial utilidad de tocilizumab en pacientes con COVID-19 se vincula estrechamente a esa indicación61,62. En el estudio de Xu et al.63, sin un grupo control y con otras deficiencias metodológicas, 21 pacientes con COVID-19 y neumonía grave recibieron tocilizumab, y se reportó que la mayoría experimentó mejoría en varios parámetros (requerimiento de oxígeno, imágenes radiológicas pulmonares, recuento de linfocitos y niveles de proteína C reactiva). Otra serie de casos en China demostró resultados similares con el uso de tocilizumab en 15 pacientes con COVID-1964. En la actualidad están en curso estudios para evaluar la efectividad de tocilizumab en COVID-19: un estudio de cohorte prospectiva liderado por la Universidad de L’Aquila en Italia (estudio TOSCA), para evaluar la eficacia de tocilizumab en pacientes con SDRA y síndrome de liberación de citoquinas secundario a COVID-19 (NCT042332913)65, así como un ensayo clínico multicéntrico aleatorizado, liderado por el laboratorio Roche (estudio COVACTA), para evaluar la eficacia de tocilizumab en pacientes con COVID-19 y neumonía severa (NCT04320615)66.
El panel consideró que dada la evidencia actual no es prudente continuar la terapia biológica con tocilizumab durante procesos infecciosos activos, entre ellos COVID-19, por lo que se recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben suspender la terapia biológica con tocilizumab. Cabe resaltar que esta recomendación se dirige al manejo de pacientes con enfermedades reumáticas; no está dentro del alcance de este documento proponer opciones terapéuticas para el manejo del síndrome de liberación de citoquinas inducido por COVID-19.
BelimumabEl panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar la terapia biológica con belimumab. Los resultados conjuntos de los ensayos BLISS-52 y 76 mostraron un aumento numérico de los procesos infecciosos a expensas de las infecciones respiratorias, aunque las diferencias no fueron estadísticamente significativas, y no se observaron diferencias en el desarrollo de infecciones herpéticas, oportunistas o sepsis67. En las recomendaciones que se han generado a escala internacional, el belimumab solo se menciona en las indicaciones de los Servicios Nacionales de Salud de Reino Unido15, que lo clasifican como los otros biotecnológicos, de alto y muy alto riesgo. No se menciona una conducta específica con los pacientes que se encuentran en tratamiento con belimumab. En el escenario actual de la pandemia por SARS-CoV-2, hasta la fecha no se ha publicado evidencia de que el uso de belimumab conlleve desarrollar una enfermedad grave si el paciente reumático que recibe este medicamento biológico presenta COVID-19. El panel consideró que no es prudente continuar la terapia biológica con belimumab durante procesos infecciosos activos, entre ellos COVID-19, por lo que se recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben suspender la terapia con belimumab.
Inhibidores de IL-1El panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar la terapia biológica con inhibidores de IL-1 (anakinra y canakinumab). En el escenario actual de la pandemia por SARS-CoV-2, hasta la fecha no se ha publicado evidencia de que el uso de inhibidores de IL-1 conlleve desarrollar una enfermedad grave si el paciente reumático que recibe este medicamento biológico presenta COVID-19. El panel consideró que no es prudente continuar la terapia biológica con inhibidores de IL-1 durante procesos infecciosos activos, entre ellos COVID-19, por lo que se recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben suspender la terapia con inhibidores de IL-1 (anakinra y canakinumab).
Inhibidores de IL-12/23El panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar la terapia biológica con inhibidores de IL-12/23 (ustekinumab). Ustekinumab ha mostrado un perfil de seguridad similar con respecto a infecciones, comparado con otras terapias biológicas empleadas en el tratamiento de artritis psoriásica y psoriasis68. En el escenario actual de la pandemia por SARS-CoV-2, hasta la fecha no se ha publicado evidencia de que el uso de inhibidores de IL-12/23 conlleve desarrollar una enfermedad grave si el paciente reumático que recibe este medicamento biológico presenta COVID-19. El panel consideró que no es prudente continuar la terapia con inhibidores de IL-12/23 durante procesos infecciosos activos, entre ellos COVID-19, por lo que se recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben suspender la terapia con inhibidores de IL-12/23 (ustekinumab).
Inhibidores de IL-17El panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar la terapia biológica con inhibidores de IL-17 (ixekizumab y secukinumab). En los estudios de seguimiento a largo plazo de pacientes tratados para psoriasis, artritis psoriásica y espondilitis anquilosante con secukinumab se han reportado casos de infección oportunista por Candida a nivel cutáneo o de mucosas, todos casos de severidad leve a moderada, sin que a la fecha se reporten pacientes con candidiasis sistémica69. Resultados similares se han reportado con ixekizumab70. Se han reportado también casos de herpes zóster con el uso de inhibidores de IL-17, sin embargo, no se ha demostrado que este aumento sea estadísticamente significativo cuando se compara con placebo71. En el escenario actual de la pandemia por SARS-CoV-2, hasta la fecha no se ha publicado evidencia de que el uso de inhibidores de IL-17 conlleve desarrollar una enfermedad grave si el paciente reumático que recibe este medicamento biológico presenta COVID-19. El panel consideró que no es prudente continuar la terapia biológica con inhibidores de IL-17 durante procesos infecciosos activos, entre ellos COVID-19, por lo que se recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben suspender la terapia con inhibidores de IL-17 (ixekizumab y secukinumab).
Inhibidores de JAKEl panel recomienda que los pacientes con enfermedades reumáticas sin COVID-19 deben continuar el tratamiento con inhibidores de JAK (baricitinib y tofacitinib). Un metaanálisis que evaluó la seguridad del uso de tofacitinib en pacientes con artritis reumatoide mostró que el riesgo de infecciones serias con tofacitinib es comparable a las tasas reportadas en los estudios de terapias biológicas para artritis reumatoide72. En una reciente revisión de los estudios de baricitinib se mostraron resultados similares a favor de la seguridad en cuanto a infecciones73. En el escenario actual de la pandemia por SARS-CoV-2, hasta la fecha no se ha publicado evidencia de que el uso de inhibidores de JAK conlleve desarrollar una enfermedad grave si el paciente reumático que recibe este medicamento presenta COVID-19. El panel consideró que no es prudente continuar la terapia con inhibidores de JAK durante procesos infecciosos activos, entre ellos COVID-19, por lo que se recomienda que los pacientes con enfermedades reumáticas con diagnóstico de COVID-19 deben suspender la terapia con inhibidores de JAK (baricitinib y tofacitinib).
Janus kinasa 1 y 2 están relacionadas con inflamación, y la enzima proteína kinasa 1 asociada a AP-2 (AAK1) desempeña un papel central en la entrada del virus a la célula. Con base en la información generada por análisis bioinformáticos, baricitinib puede ayudar a inhibir la infección por SARS-CoV-2, inhibiendo la AAK1, y también inhibiendo la inflamación por el bloqueo de la vía JAK 1/274, por lo que se ha propuesto como una opción terapéutica para COVID-1975. En la actualidad está en curso un estudio abierto no aleatorizado (estudio BARI-COVID) para evaluar la eficacia de baricitinib en pacientes con COVID-19 leve a moderada, así como hallazgos radiológicos de neumonía (NCT04320277)76. Al realizar la revisión de literatura para este consenso, se encuentran dos estudios adicionales de baricitinib registrados en ClinicalTrials.org: «Safety and efficacy for baricitinib for COVID-19» (NCT04340232)77 y «Treatment of moderate to severe coronavirus disease (COVID-19) in hospitalized patients» (NCT04321993)78. Sin embargo, ninguno de estos se encontraba aún en fase de recolección de pacientes. También se encontró un estudio registrado con tofacitinib, titulado «TOFAcitinib in SARS-CoV2 pneumonia» (NCT04332042)79, el cual comenzará a recolectar pacientes a finales de abril del 2020.
ConclusiónPresentamos las recomendaciones dirigidas a los profesionales de la salud en el contexto de la atención de pacientes con enfermedades reumáticas que reciben terapias inmunomoduladoras e inmunosupresoras (fármacos convencionales, biológicos y moléculas pequeñas) en el contexto de la pandemia por COVID-19. Estas recomendaciones fueron elaboradas por un panel de miembros de la Asociación Colombiana de Reumatología.
Los pacientes con enfermedades reumáticas reciben tratamiento con medicamentos que tienen propiedades inmunomoduladoras o inmunosupresoras, y por lo tanto se consideran población de riesgo para la infección por SARS-CoV-2. Sin embargo, el uso de algunos de estos medicamentos, como los antimaláricos, los inhibidores de JAK, tocilizumab y colchicina, se está incluyendo en protocolos de estudios clínicos en diferentes centros de investigación como parte del manejo de pacientes con COVID-19.
La recomendación para la mayoría de los tratamientos utilizados en reumatología es continuar con las terapias inmunomoduladoras o inmunosupresoras en pacientes reumáticos que no tengan la infección y suspenderlas en aquellos que presenten diagnóstico de COVID-19. La elaboración y publicación de estas recomendaciones constituye una respuesta oportuna y necesaria para el enfoque terapéutico de la infección por este nuevo virus, ante la declaración de pandemia por parte de la OMS y de las iniciativas del Ministerio de Salud para enfrentar esta nueva situación en Colombia.
La información encontrada en la evidencia científica disponible se relaciona en su totalidad con pacientes adultos con enfermedades reumatológicas, y no se encuentra información en población pediátrica, por lo que el alcance de las recomendaciones de este documento debe ser tenido en cuenta solo para pacientes adultos con condiciones reumáticas. La generación de literatura sobre COVID-19 en el contexto del paciente reumático es escasa por el momento, lo cual hace de este consenso un documento dinámico que tendrá una actualización en los próximos 6 meses. Lo anterior, siendo consecuentes con la generación de nueva información para establecer recomendaciones ajustadas a la evidencia disponible.
FinanciaciónNinguna.
Conflicto de interesesNo hay conflicto de intereses.
De acuerdo con los autores y los editores, este artículo se publica simultáneamente y de forma íntegra en las siguientes publicaciones: Reumatología Clínica (https://doi.org/10.1016/j.reuma.2020.06.011) y Revista Colombiana de Reumatología (https://doi.org/10.1016/j.rcreu.2020.05.007).