La leflunomida es un agente inmunomodulador de amplio uso en artritis reumatoide y también empleado en otras enfermedades reumáticas como artritis psoriásica y lupus eritematoso sistémico. Aunque su perfil de seguridad en general es bueno, se han reportado reacciones secundarias hasta en un 20%, aunque casos severos como necrólisis epidérmica tóxica y síndrome de Stevens Johnson son de muy baja frecuencia de presentación. Reportamos un caso de síndrome de Stevens Johnson inducido por leflunomida en una paciente con lupus eritematoso sistémico.
Leflunomide is an immunomodulatory agent widely used in rheumatoid arthritis and other rheumatic diseases like psoriatic arthritis and systemic lupus erythematosus. Although its safety profile is generally good, side effects have been reported in up to 20% of cases. Severe reactions, such as toxic epidermal necrolysis and Stevens Johnson syndrome are rare. The case is presented of a leflunomide-induced Stevens Johnson syndrome in a patient with systemic lupus erythematosus.
La leflunomida es un medicamento que inicialmente fue estudiado como tratamiento para evitar el rechazo de trasplantes, sin embargo, su principal uso terapéutico actual es para el tratamiento de la artritis reumatoide (AR) como antirreumático modificador de la enfermedad, aunque también se emplea en el tratamiento de otras enfermedades reumáticas como la artritis psoriásica y el lupus eritematoso sistémico (LES). El síndrome de Stevens Johnson (SSJ) es una variante severa del eritema multiforme, en el cual se presenta un proceso de reacción de hipersensibilidad que afecta la piel y las membranas mucosas. Presentamos el caso de una paciente con LES, quien venía recibiendo tratamiento con leflunomida, formulado en forma ambulatoria por su reumatólogo tratante en su empresa promotora de salud. La paciente asiste a nuestra institución con cuadro de SSJ posterior al inicio de la administración de leflunomida.
Reporte de casoMujer de 37 años de edad quien consulta al servicio de urgencias de nuestra institución por cuadro clínico de 4 días de evolución, caracterizado por eritema y secreción conjuntival, asociado a prurito generalizado, malestar general, lesiones dolorosas en mucosa oral, eritema facial y lesiones en diana de predominio en miembros inferiores. Como antecedentes, la paciente tiene diagnóstico de LES desde hace 5 años, para lo cual había recibido previamente manejo con prednisolona 5mg/día y cloroquina 150mg/día, con poca mejoría de sus síntomas por lo que 20 días antes de la consulta en urgencias su médico tratante inició la administración de leflunomida, 20mg/día. Además de lo anterior, la paciente tiene antecedentes de acromegalia secundaria a un adenoma hipofisario resecado 8 años atrás, y toma de forma ocasional omeprazol y calcio. Sus antecedentes tóxico-alérgicos, familiares y ginecológicos son negativos.
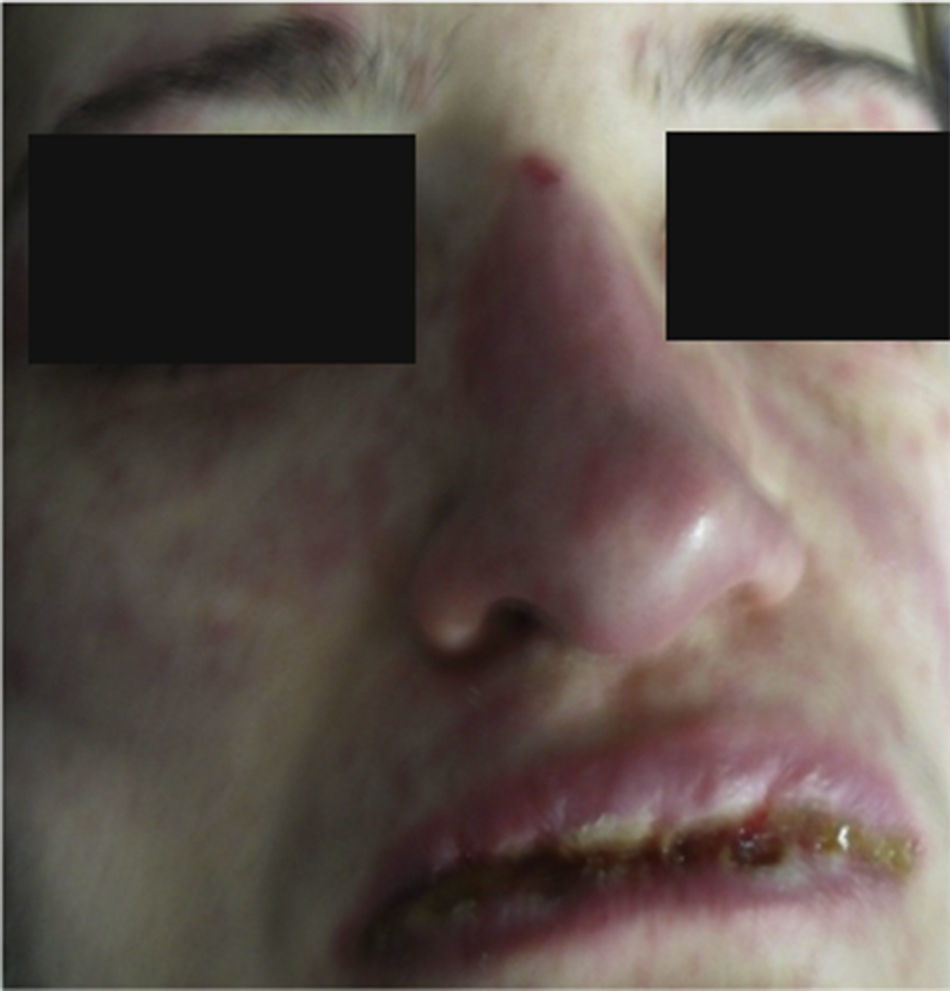
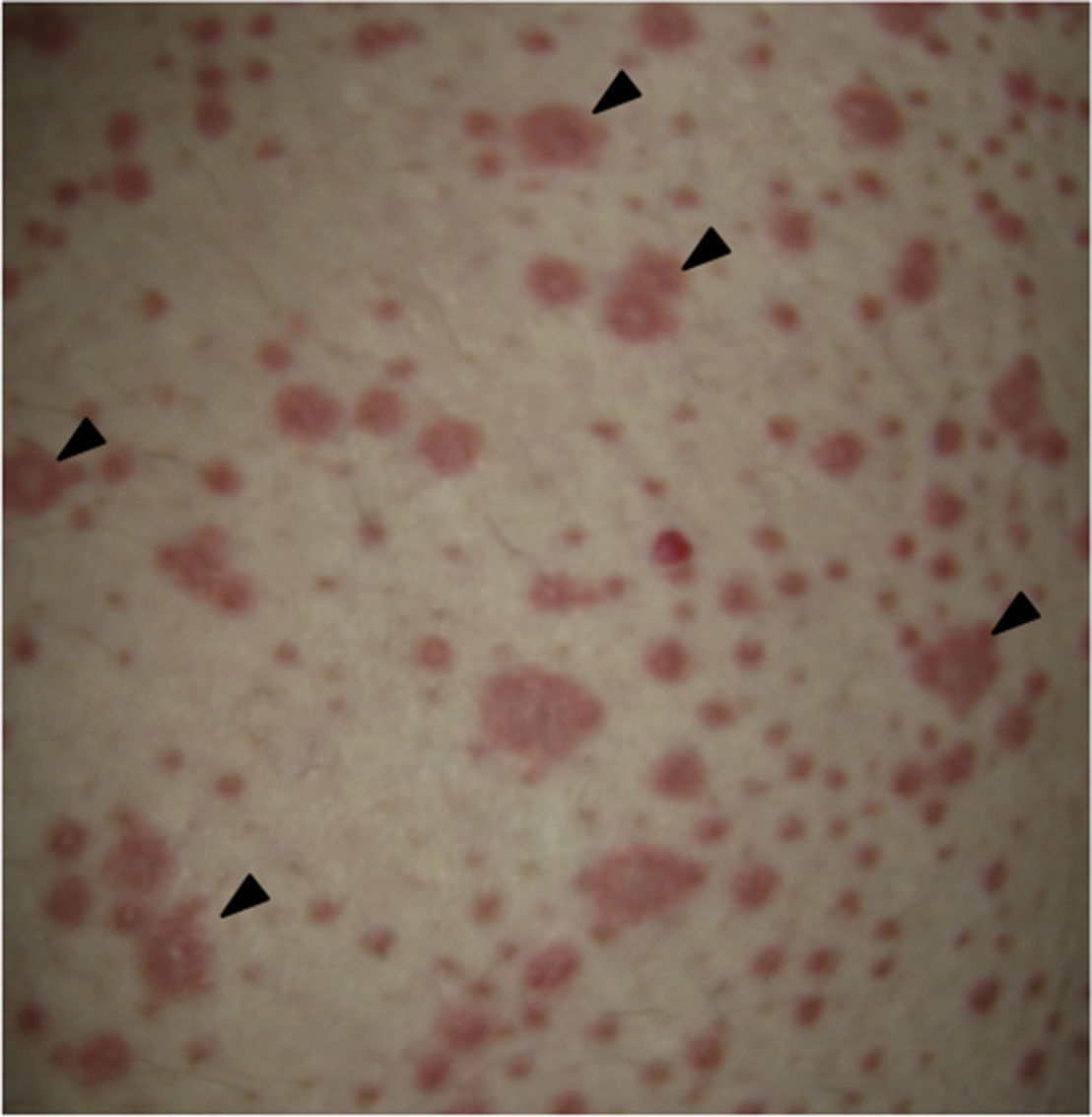
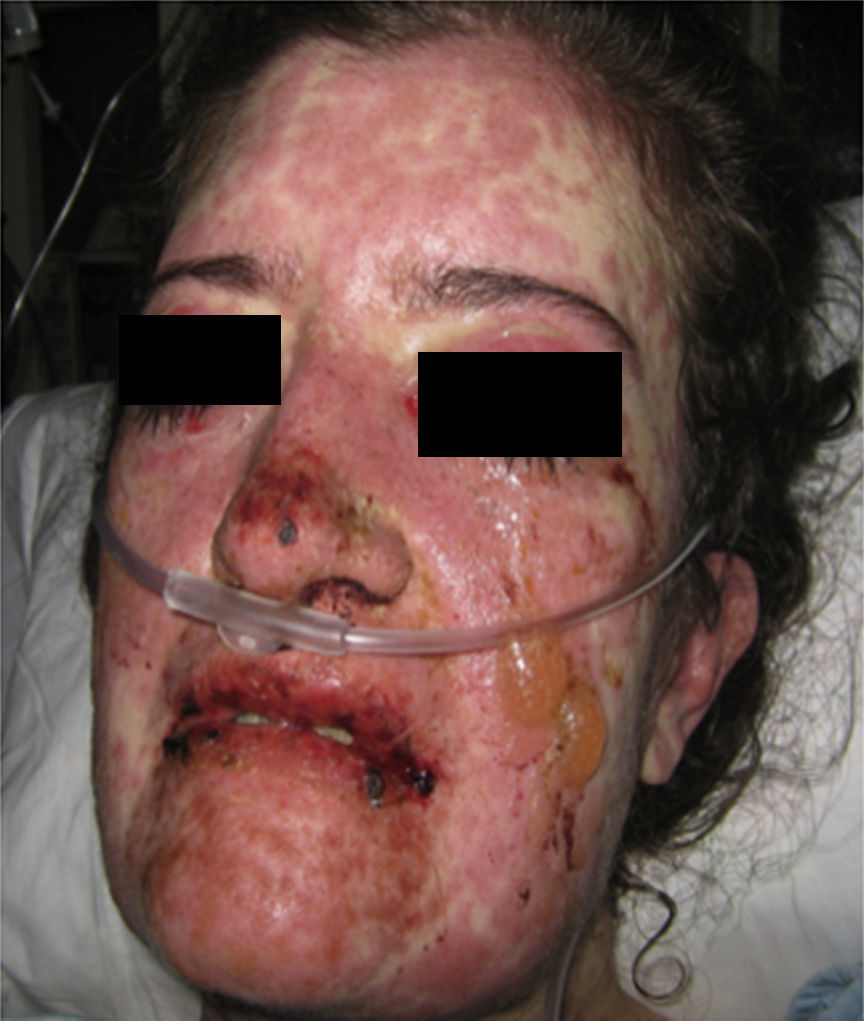
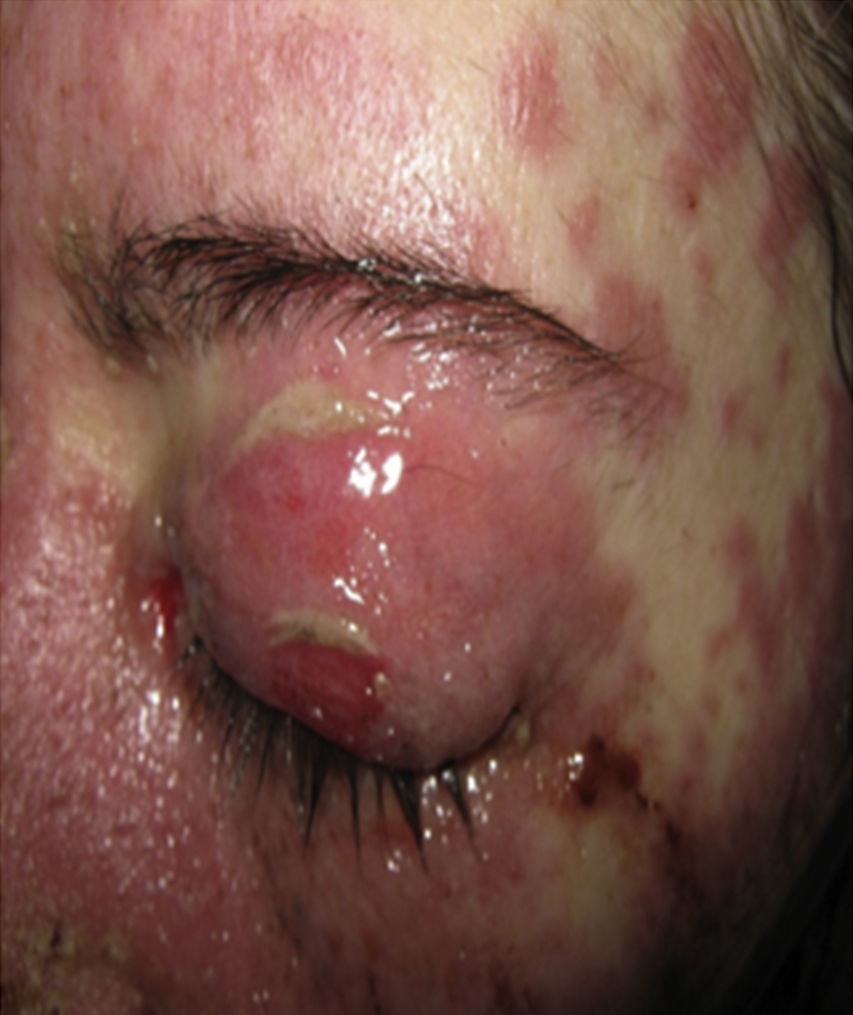
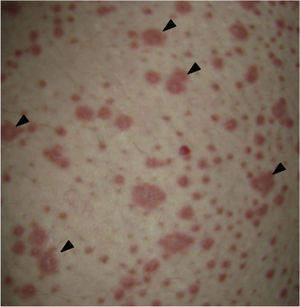
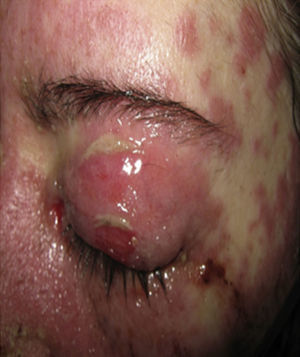
Al examen físico la paciente estaba en regular estado general, afebril, taquicárdica (FC 100 x’, TA 110/70mm/Hg, FR 16 x’) con marcado eritema conjuntival bilateral asociado a secreción purulenta en fondos de saco y edema palpebral. En la piel de mejillas, dorso y vertientes nasales presentaba placas eritematoedematosas; en los labios erosiones cubiertas por costras hemáticas y amarillentas, y en la piel del tórax y de las extremidades, incluyendo palmas y plantas, incontables pápulas eritematosas y edematosas, algunas en diana (figs. 1 y 2).
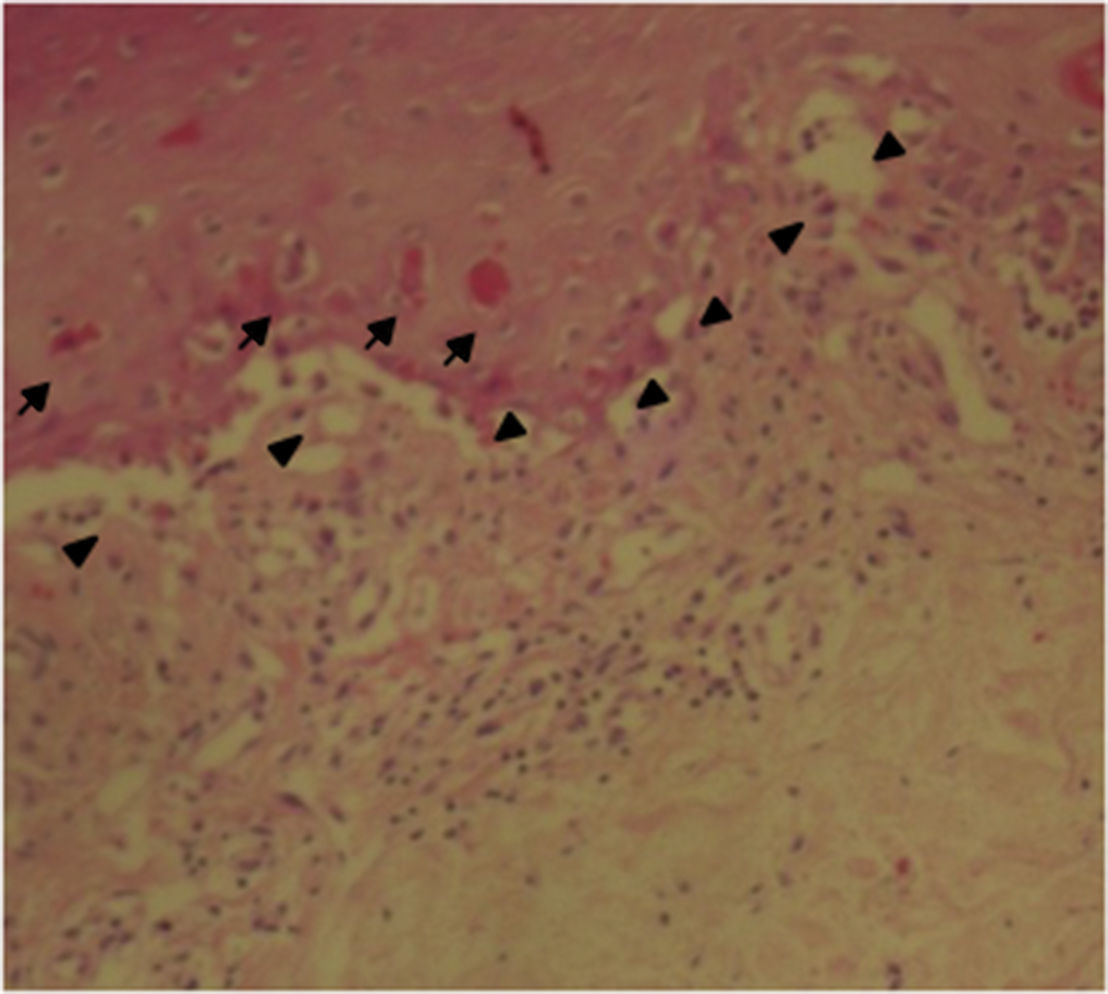
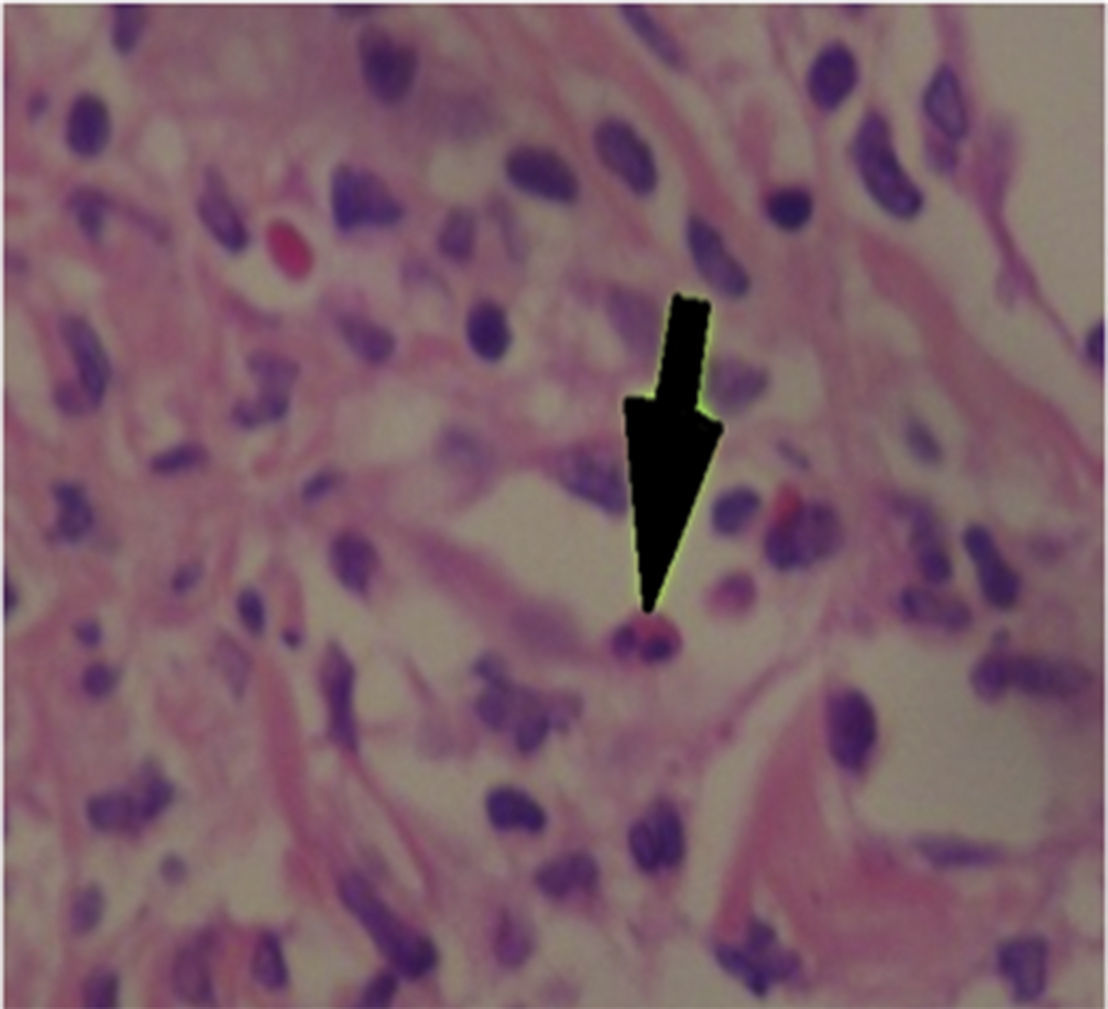
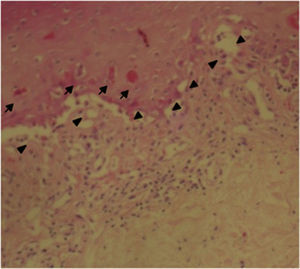
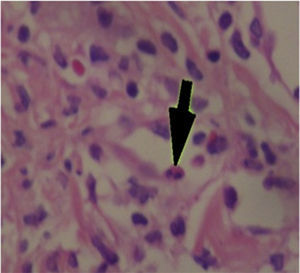
Fue valorada por el servicio de dermatología quienes consideran posible cuadro de SSJ. Se realizó biopsia de piel, la cual mostró hallazgos característicos de eritema multiforme, un daño extenso de la interfase de tipo vacuolar, asociado a numerosos disqueratocitos y a vesiculación subepidérmica. En la dermis, edema asociado a infiltrado inflamatorio perivascular de linfocitos con algunos eosinófilos (figs. 3 y 4).
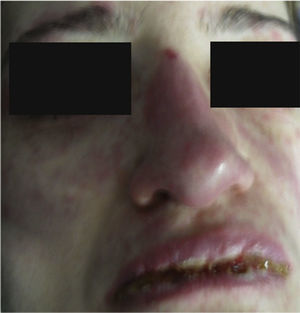
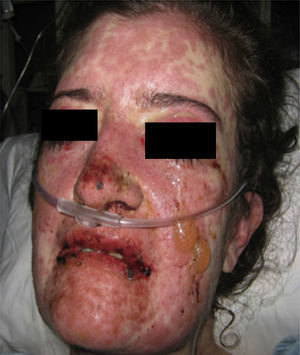
Cuarenta y ocho h después de su ingreso la paciente presentó franco deterioro clínico, con fiebre, hipotensión y taquicardia; las lesiones cutáneas aumentaron, con mayor compromiso de área corporal, aparecieron ampollas tensas y lesiones en mucosa vaginal (figs. 5 y 6). Con estos hallazgos, el compromiso cutáneo y mucoso tan extenso y con una patología de eritema multiforme que mostraba infiltrado de eosinófilos se hace diagnóstico de SSJ y al revisar la historia de la paciente encontramos que, dado que el único medicamento que venía recibiendo de reciente inicio era leflunomida, se considera que el cuadro dermatológico es secundario a este antirreumático. Desde el punto de vista de su enfermedad autoinmune de base no se documentó actividad lúpica, con complemento normal, anti-DNA negativo, hemograma, azoados y uroanálisis dentro de límites normales y sin estigmas clínicos de actividad de LES.
Con la suspensión de la leflunomida y las medidas de soporte dadas durante la hospitalización como manejo del síndrome de SSJ, a los 5 días la paciente presenta una evolución favorable, con mejoría franca de las lesiones cutáneas y mucosas, así como del compromiso general. Egresó de nuestra institución con manejo antimalario y glucocorticoides a dosis bajas.
DiscusiónLa leflunomida es un medicamento inmunomodulador de amplio uso en AR1 demostrando una efectividad similar al metotrexate2 y a sulfasalazina3, por lo que hace parte de los medicamentos antirreumáticos modificadores de la enfermedad (DMARD), empleados en el tratamiento de AR. Posteriormente, fue probado en modelos animales4 y en pacientes con LES5,6. Con su uso se han descritos algunos casos de reacciones adversas que comprometen los sistemas hematológico, hepático, respiratorio y dermatológico7.
La leflunomida es una prodroga que rápidamente se absorbe y se convierte en su forma activa: A771726. El mecanismo inmunorregulador propuesto incluye 3 puntos: A771726 inhibe una enzima clave en la síntesis de pirimidinas, la DHODH, y consecuentemente la síntesis de ADN y ARN, y así la proliferación celular8, inhibe la enzima tirosinquinasa, enzima clave en la traducción de señales durante la formación y división celular, inhibiendo la producción de citoquinas proinflamatorias como factor de necrosis tumoral alfa e IL-179, y bloquea NF-Kb mediado por TNF inhibiendo así la activación de células T10. Los efectos adversos más comunes de leflunomida incluyen diarrea, la cual se presenta en aproximadamente el 20% de los pacientes, además de náuseas, dispepsia, rash, pérdida de peso, anormalidades en pruebas de función hepática11, trombocitopenia12, neumonía intersticial13, neuropatía periférica14 y también se han documentado casos de hipertrigliceridemia15. Se han reportado algunas reacciones cutáneas serias asociadas a la leflunomida, entre las que se incluyen necrólisis epidérmica tóxica16,17, vasculitis18 y reacciones liquinoides19,20.
El SSJ es una reacción de hipersensibilidad mediada por complejos inmunes, asociado principalmente a medicamentos, que típicamente afecta piel y mucosas caracterizándose por necrosis y desprendimiento de la epidermis. El cuadro se inicia frecuentemente por un rash maculopapular con lesiones en diana, con vesículas y ampollas en piel y mucosas, con signos de Nicolsky positivo y puede evolucionar a necrólisis epidérmica tóxica. Se asocia a fiebre, cefalea, odinofagia, conjuntivitis y puede tener complicaciones sistémicas como lesión renal aguda, compromiso hematológico y sepsis. El tratamiento es la suspensión inmediata del medicamento causante del cuadro y la reanimación hídrica. La mortalidad está determinada por la extensión de las lesiones. La bacteriemia y sepsis incrementan la mortalidad21.
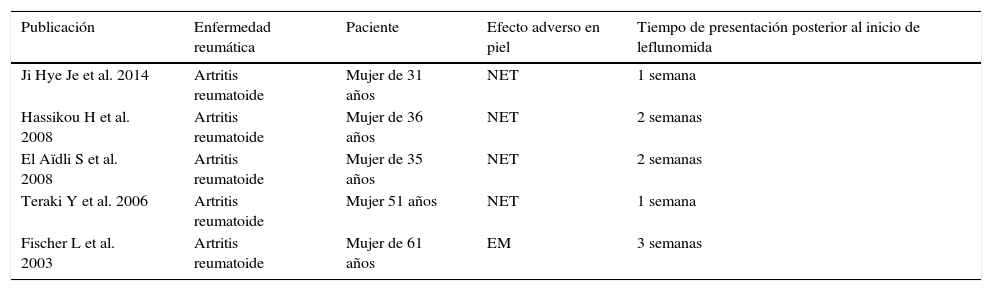
En la tabla 1 se resumen los casos reportados en la literatura de SSJ y NET.
Casos reportados en la literatura de SSJ y NET
| Publicación | Enfermedad reumática | Paciente | Efecto adverso en piel | Tiempo de presentación posterior al inicio de leflunomida |
|---|---|---|---|---|
| Ji Hye Je et al. 2014 | Artritis reumatoide | Mujer de 31 años | NET | 1 semana |
| Hassikou H et al. 2008 | Artritis reumatoide | Mujer de 36 años | NET | 2 semanas |
| El Aïdli S et al. 2008 | Artritis reumatoide | Mujer de 35 años | NET | 2 semanas |
| Teraki Y et al. 2006 | Artritis reumatoide | Mujer 51 años | NET | 1 semana |
| Fischer L et al. 2003 | Artritis reumatoide | Mujer de 61 años | EM | 3 semanas |
EM: eritema multiforme; MTX: metotrexate; NET: necrólisis epidérmica tóxica; SZ: sulfasalazina.
Los casos mencionados describen cuadros severos que amenazan la vida y requieren manejo en unidad de cuidados intensivos. En todos ellos se realiza una búsqueda minuciosa de otras posibles causas como infecciones por bacterias o virus, las cuales siempre se descartan y finalmente, dado el antecedente farmacológico de inicio reciente de leflunomida, se atribuye el cuadro a un efecto adverso al medicamento.
En Japón, se describen en registros posmarketing de 5.163 pacientes tratados con leflunomide 13 casos de SSJ, sin embargo, no se registran casos de NET17.
La mayoría de los casos aparecen dentro de las 2 semanas siguientes al inicio de leflunomida y recomiendan, dada la larga vida media del medicamento (15-18 días), administrar colestiramina en reacciones cutáneas severas para evitar circulación enterohepática y reciclaje biliar del medicamento.
Para el caso de nuestra paciente, el cuadro de SSJ se consideró secundario a leflunomida, dado que este era el medicamento de más reciente inicio (3 semanas antes de la presentación del cuadro); el antimalárico y el glucocorticoide venían siendo formulados desde 5 años antes, lo cual disminuye considerablemente la posibilidad de que el SSJ hubiese sido secundario a estos 2 últimos medicamentos. Adicionalmente, el cuadro de la paciente evoluciona hacia la resolución con la suspensión de leflunomida y la paciente egresa recibiendo tratamiento con hidroxicloroquina y prednisolona, sin presentar nuevas recaídas de su cuadro de reacción de hipersensibilidad.
ConclusiónSe describe un caso de SSJ inducido por leflunomida en paciente con LES. El cuadro es una reacción idiosincrática e imposible de predecir, por lo que el médico tratante debe estar atento ante signos de toxicidad dérmica en los pacientes tratados con leflunomida, especialmente en las primeras semanas de instaurada la terapia. A pesar de lo anterior, leflunomida es un medicamento considerado como seguro para el tratamiento de las enfermedades reumáticas para las cuales está indicado.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesConfidencialidad de los datos. Los autores declaran no tener ningún conflicto de intereses.