El compromiso gastrointestinal en pacientes con lupus eritematoso sistémico (LES) es muy diverso. Su frecuencia y ubicación a lo largo del tracto digestivo varían ampliamente. Los procesos inflamatorios secundarios a los depósitos de complejos inmunes o eventos vasculares pueden ser los causantes de este compromiso. Una de las manifestaciones gastrointestinales características en los pacientes con LES es la pseudoobstrucción intestinal, que se define como la propulsión intestinal ineficaz que se produce en ausencia de factores mecánicos u obstructivos. Esta es, sin embargo, una complicación rara y poco entendida del LES. En este artículo, reportamos el caso de un paciente masculino con diagnóstico de LES y pseudoobstrucción intestinal, que fue tratado exitosamente con esteroides e inmunoglobulinas intravenosas. Se presenta una revisión completa de la literatura y una propuesta de la fisiopatología de la manifestación.
Gastrointestinal involvement in patients with systemic lupus erythematosus (SLE) is very diverse, and the frequency of occurrence and location along the digestive tract varies widely. Inflammatory processes secondary to immune complex deposits or vascular events may cause this involvement. One of the most characteristic gastrointestinal manifestations in these patients is the intestinal pseudo-obstruction, which is defined as the ineffective intestinal propulsion that occurs in the absence of mechanical or obstructive factors. This is, however, a rare and poorly understood complication of SLE. The case is presented of a male SLE patient presenting with intestinal pseudo-obstruction, and was successfully treated with steroids and intravenous immunoglobulin. A complete review of the literature and a proposal for the pathophysiology of intestinal pseudo-obstruction are presented.
El compromiso gastrointestinal en pacientes con lupus eritematoso sistémico (LES) es muy diverso. Su frecuencia y ubicación a lo largo del tracto digestivo varían ampliamente. Los procesos inflamatorios secundarios a los depósitos de complejos inmunes o eventos vasculares pueden ser los causantes de este compromiso1. Las lesiones orales, la dismotilidad esofágica, la vasculitis mesentérica y la enteropatía perdedora de proteínas son las manifestaciones más comunes2.
La pseudoobstrucción intestinal (POI) se define como la propulsión intestinal inefectiva que resulta del deterioro del funcionamiento del músculo liso visceral, los nervios entéricos o el sistema nervioso autónomo visceral3. En muchos casos, el origen es primario, pero pueden ocurrir causas secundarias, incluidas ciertas enfermedades neurológicas, endocrinas y del tejido conectivo. Las causas incluidas en este último grupo han sido reportadas, principalmente, en pacientes con esclerosis sistémica4. Por el contrario, la asociación con LES se ha reportado en pocos casos en la literatura de idioma inglés alrededor del mundo. Esta entidad ha sido recientemente reconocida como una complicación rara y poco entendida del LES1,5. En este artículo se presenta un caso de un paciente de sexo masculino con LES que presentaba POI y que fue tratado de forma exitosa con esteroides e inmunoglobulina intravenosa.
Reporte de casoReportamos el caso de un hombre de 28 años de edad, con antecedente de LES, diagnosticado 3 meses antes del ingreso por un cuadro sistémico caracterizado por abdomen agudo secundario a apendicitis tratada con laparotomía de urgencia, con desarrollo de ascitis posoperatoria y síndrome edematoso con evidencia de nefritis lúpica de tipo iv confirmada con biopsia renal, con artritis y compromiso neurológico manifestado como un episodio convulsivo sin otra etiología. Las pruebas inmunológicas confirmaron el diagnóstico de LES (anticuerpos antinucleares positivos, anti-Sm y anti-ADN de doble cadena positivos e hipocomplementemia). En ese momento el paciente fue tratado extrainstitucionalmente con 500mg de ciclofosfamida intravenosa cada 2 semanas y, posteriormente, con 2 g de micofenolato mofetil cada 24 h, 50mg de losartán cada 12 h, 30mg de prednisolona cada 24 h y 250mg de cloroquina cada 24 h. El paciente fue remitido a nuestra institución debido a persistencia del dolor abdominal en el hemiabdomen inferior, diarrea sin disentería y disuria.
Al ingreso a nuestra institución, el paciente se encontraba estable, con los siguientes hallazgos positivos al examen físico: hipoventilación en la auscultación pulmonar de ambas bases y dolor a la palpación abdominal difusa, sin evidencia de signos de irritación peritoneal. Los laboratorios de admisión se muestran en la tabla 1.
Laboratorios de ingreso del paciente
| Paraclínicos | Interpretación |
|---|---|
| Hemograma y reactantes de fase aguda | Leucocitosis (12.810/mL) con neutrofilia (11.250/mL) y linfopenia leve (824/mL), PCR elevada (1,94mg/dL,) y VES normal |
| Función renal | Sedimento urinario activo con proteinuria y cilindros hialinos; índice proteinuria/creatinuria de 0,495; creatinina de 1,4mg/dL y BUN de 25mg/dL, elevados |
| Inmunológicos | ANA positivos (1:1.280 con patrón homogéneo); anti- Sm positivos >200 (valor normal hasta 15 U/mL); anti-RNP positivos>200 (<15 U/mL) y anti-ADN positivos en 1:1.280 por técnica de inmunofluorescencia indirecta, hipocomplementemia C3: 43,6 (90-180mg/dL); C4: 7,14 (10-40); anticardiolipinas negativas; IgM 1,2 GPL-U/mL e IgG 1,8 MPL-U/mL |
Se ordenó una ecografía renal que mostró agrandamiento difuso bilateral, con dilatación pielocalicial bilateral y engrosamiento difuso del urotelio. Se realizó una resonancia magnética cerebral que evidenció 2 lesiones hiperintensas localizadas en el lóbulo frontal izquierdo en la secuencia FLAIR y T2, con restricción de la difusión.
El ecocardiograma transtorácico evidenció hipertrofia concéntrica del ventrículo izquierdo con fracción de eyección de 50-55% y un derrame pericárdico global sin repercusión hemodinámica. La colonoscopia evidenció edema de la mucosa en el colon descendente con hallazgos negativos en la histopatología. El Systemic lupus erytematosus disease activity index (SLEDAI) al ingreso fue alto (valor: 16). Debido a la alta actividad del LES y al compromiso multisistémico, el paciente requirió manejo con pulsos de metilprednisolona (1.000mg cada 24 horas) por 3 días, con mejoría clínica inicial. La evolución del paciente se tornó tórpida, debido a la presencia de síntomas del tracto urinario bajo, con una cistoscopia que evidenció trabeculación de la pared posterior de la vejiga, con una lesión posterior del cuello de la vejiga y un divertículo en el meato ureteral izquierdo.
Debido a que el paciente presentaba emesis recurrente, distensión abdominal y, posteriormente, estreñimiento y dolor abdominal severo, se realizó una endoscopia de vías digestivas altas que mostró contenido gástrico con retención de bilis (800 cc). Estos hallazgos fueron interpretados como íleo adinámico.
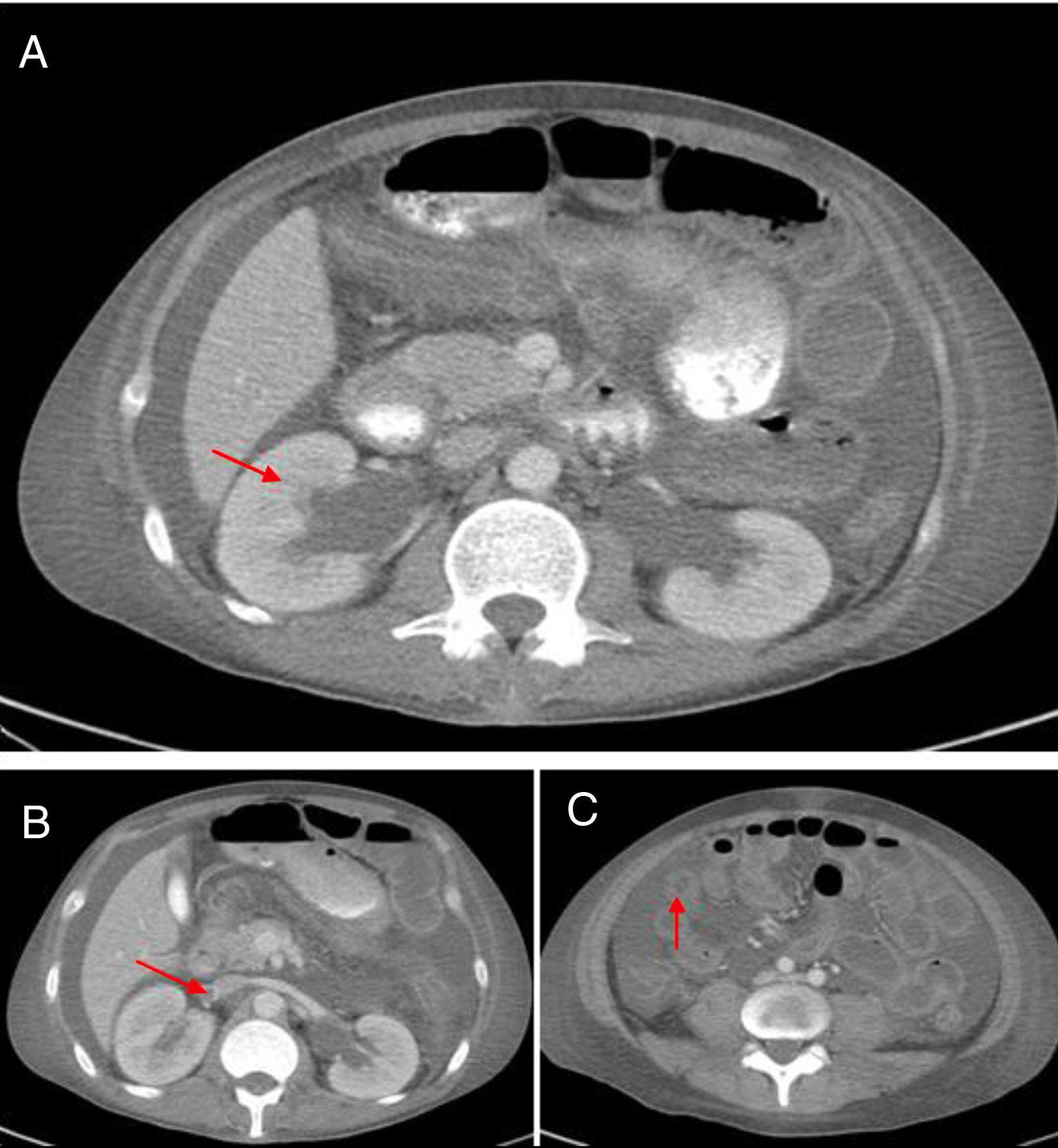
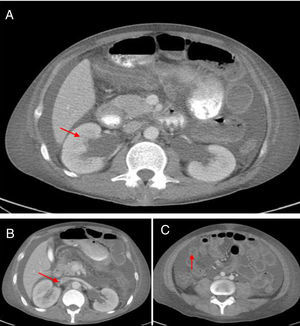
La TAC abdominal contrastada (fig. 1) mostró hepatomegalia y esplenomegalia, ascitis, signos de vasculitis intestinal, hidronefrosis leve bilateral y una imagen sugestiva de trombosis de la vena renal derecha, lo cual fue verificado por ecografía doppler. Debido a esto, se inició anticoagulación y se administró una cuarta dosis de ciclofosfamida. A pesar de estos tratamientos, el paciente persistió con pobre respuesta clínica, con aumento del dolor abdominal, estreñimiento y con la necesidad de altas dosis de opioides para controlar el dolor. Dada la posibilidad de íleo inducido por opioides, una complicación isquémica debido a trombosis intraabdominal o sangrado debido a sobreanticoagulación por warfarina, el paciente fue trasladado a la Unidad de Cuidado Intensivo. Una nueva TAC abdominal reveló una estenosis del segmento proximal del íleo con un patrón de obstrucción parcial, sin signos de perforación. Debido a la evidencia de actividad de la enfermedad, se realizó el diagnóstico de POI secundaria a LES, refractaria a manejo inmunosupresor (esteroides y ciclofosfamida), por lo que se decidió iniciar manejo con inmunoglobulinas intravenosas, dosis total de 2g/kg. El paciente presentó una excelente respuesta clínica con resolución del compromiso gastrointestinal en el curso de una semana. En los seguimientos clínicos posteriores el paciente no ha presentado recaída de la enfermedad intestinal, con descenso de dosis de esteroides hasta 5mg de prednisolona cada día.
Discusión y revisión de literaturaSe realizó una búsqueda sistemática de la literatura, usando la base de datos Medline PubMed y referencias secundarias de artículos publicados hasta julio de 2016, con los términos clave «lupus erythematosus, systemic», AND «intestinal pseudo-obstruction» OR «idiopathic intestinal pseudo-obstruction» OR «pseudoobstructive syndrome» OR «paralytic ileus» OR «enteric neuropathy» OR «visceral myopathies» AND «hydronephrosis» sin restricción del idioma. Se escogieron reportes de casos, series de casos y estudios de casos y controles que cumplieran con los criterios diagnósticos del American College of Rheumatology de 1997 o 2012 y que tuviesen POI aguda o crónica6.
La siguiente revisión y discusión está basada en nuestro caso y la comparación con los pacientes presentados en la revisión de casos de Jin et al.7, y los estudios de casos y controles de Xu et al.8 y Lingling et al.9.
El compromiso gastrointestinal en LES tiene una frecuencia que puede alcanzar el 50% de los pacientes. Generalmente estas manifestaciones se describen como compromiso sintomático, más que como entidades clínicas definidas. Los síntomas tradicionalmente más comunes son las náuseas y el vómito (53%), anorexia 49% y dolor abdominal (19%)10. Algunas veces estos síntomas son atribuidos a los efectos adversos de los medicamentos2.
También existen condiciones gastrointestinales que pueden ser amenazantes para la vida, tales como el abdomen agudo, que es producido por vasculitis mesentérica, la enfermedad hepatobiliar, gastroenteritis y apendicitis con una tasa de mortalidad que oscila entre el 9,4 y el 11% de los casos. Otras manifestaciones que considerar incluyen la alteración de la motilidad esofágica, dispepsia, úlcera péptica, anemia perniciosa debido a la presencia de anticuerpos contra el factor intrínseco, neumatosis quística intestinal, enteropatía perdedora de proteínas, peritonitis lúpica primaria y ascitis10.
La POI es un síndrome clínico raro caracterizado por propulsión intestinal inefectiva con evidencia clínica y radiológica de obstrucción intestinal, pero con ausencia de una lesión mecánica identificable11. La patogénesis de este síndrome es desconocida, aunque hay evidencia histopatológica de daño de leimiocitos que indican un proceso autoinmune sistémico que tiene como blanco las células del músculo liso. Otro mecanismo postulado es la vasculitis, que desencadena una isquemia crónica del músculo liso intestinal con el consecuente daño muscular e hipomotilidad. Otros autores postulan una dismotilidad muscular intrínseca (causada por daño miopático o neurogénico) que afecta la muscularis propia, esto basado en la alta asociación existente entre POI y ureterohidronefrosis1,4,10,12,13.
A medida que se reportan más casos en la literatura existen más datos disponibles acerca de la epidemiología de esta manifestación. Hasta la fecha hay 173 casos reportados en la literatura en idioma inglés. Derivado de estos casos, se conoce que esta manifestación tiene una predominancia femenina (n = 163; 94,21%)7–9. En alrededor del 50% de los casos, la POI ocurre como una manifestación temprana de LES (que es la manifestación inicial en un gran número de casos hasta un año antes del diagnóstico del LES)1,8–10. Los síntomas de POI incluyen el inicio agudo o subagudo de dolor abdominal, náuseas, vómito, distensión abdominal, estreñimiento, diarrea y pérdida de peso. El intestino delgado se compromete más frecuentemente que el intestino grueso12,14.
La POI se puede clasificar como aguda o crónica según la duración. La forma aguda se define como el inicio de uno o más síntomas de POI<6 meses antes del diagnóstico de la POI, que es la forma más común de presentación en los pacientes con LES (n=99; 57,23%). La POI crónica se define como el inicio de uno o más síntomas al menos 6 meses antes del diagnóstico (n=74; 42,77%)1,3,8,9,12,15.
Igualmente, existe una asociación aparente entre POI relacionada con LES y manifestaciones urológicas. Por ejemplo, la ureterohidronefrosis estuvo presente en 103 casos (59,53%) y ha sido previamente reportada en otras series hasta en el 66,7% de los casos de los pacientes con POI asociada a LES12. Este compromiso urológico es el síntoma de inicio en el 32,5% de los pacientes o puede complicar la evolución del paciente con POI, que puede ocurrir en el rango de tiempo desde un mes hasta 10 años, con una media de tiempo de aparición de 2,6 años8. Otra manifestación urológica es la cistitis intersticial crónica, una condición que fisiopatológicamente se asocia con depósito de complejos inmunes. Esta última manifestación se dio en solo 7 casos (4,05% de los pacientes). La baja frecuencia de esta manifestación es explicada por la naturaleza asintomática de esta presentación, que llega hasta el 35% de los casos, y también por la baja tasa de cistoscopias que se realizan8.
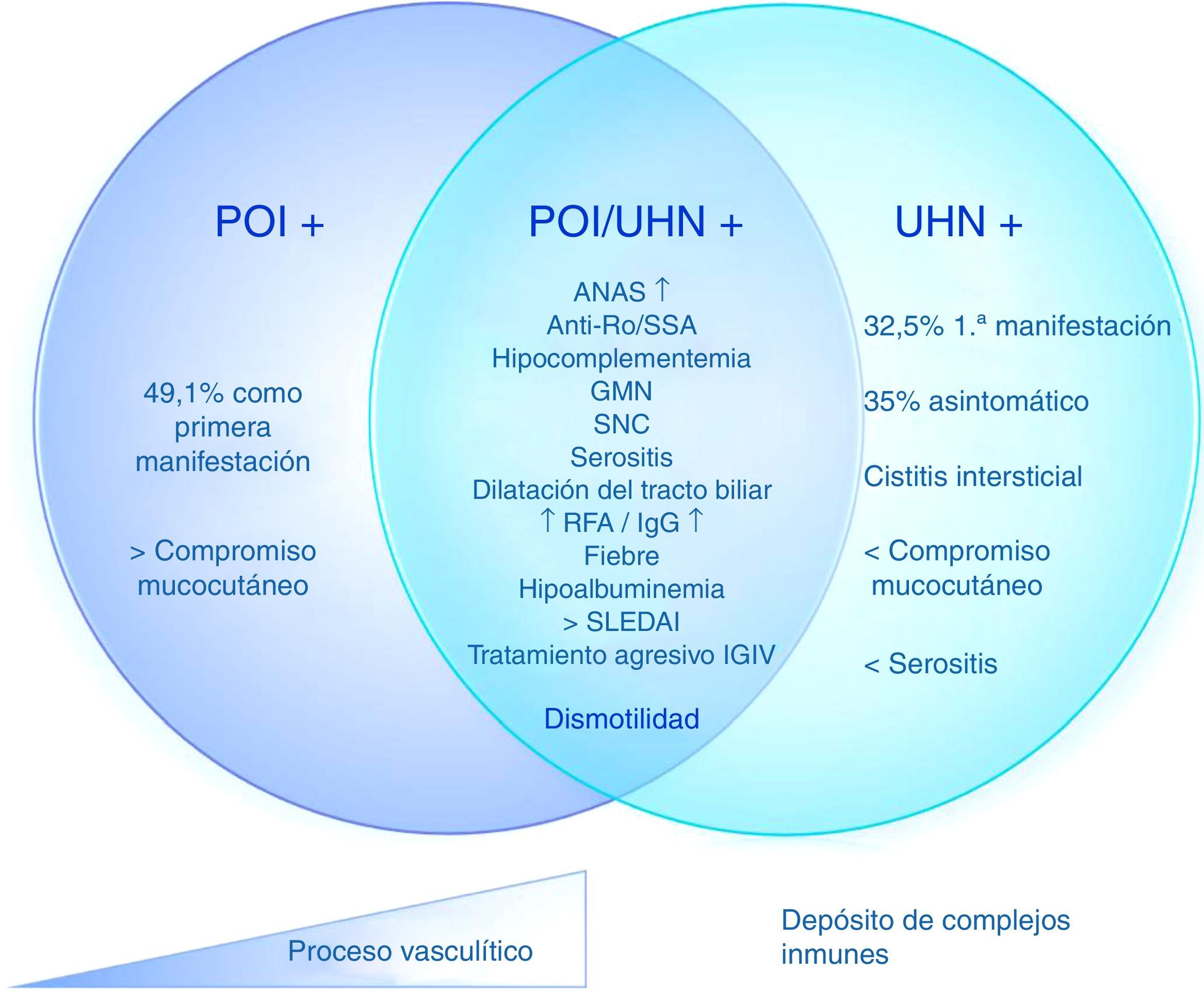
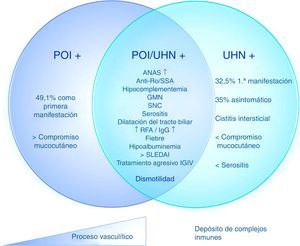
Basados en estos datos, es posible determinar 3 distintos subgrupos de pacientes con LES y POI, con un mismo mecanismo patogénico con diferentes grados de compromiso. 1) POI aislada: 2) POI con ureterohidronefrosis; 3) ureterohidronefrosis (fig. 2). Estas manifestaciones pueden deberse, entonces, a una vasculitis con compromiso progresivo del músculo liso que lleva a dismotilidad o a un diferente espectro del síndrome, en el que un proceso fisiopatológico predomina sobre otro (por ejemplo, el depósito de complejos inmunes en la cistitis intersticial o la presencia de vasculitis progresiva en la POI con o sin hidronefrosis).
Fisiopatología propuesta de los mecanismos de pseudoobstrucción intestinal en pacientes con lupus eritematoso sistémico.
ANA: anticuerpos antinucleares; GMN: glomerulonefritis; IGIV: inmunoglobulinas intravenosas; POI: pseudoobstrucción intestinal; RFA: reactantes de fase aguda; SLEDAI: Systemic lupus erythematosus disease activity index; SNC: sistema nervioso central; UHN: ureterohidronefrosis.
Otros órganos que se pueden comprometer en la POI son el esófago3 y el tracto biliar16. El compromiso del tracto biliar puede desencadenar múltiples complicaciones tales como colecistitis, colangitis y sepsis. El compromiso más severo del síndrome de dismotilidad es el denominado megavíscera generalizada del lupus, que corresponde a la presencia de dilatación visceral y disfunción, que concurre en más de un órgano en pacientes con LES, con la POI como la manifestación más común17; hay 9 casos reportados en la literatura8,16–18.
El diagnóstico definitivo de POI se basa en los signos y síntomas de obstrucción intestinal, evidencia de obstrucción intestinal en la radiografía de abdomen y en imágenes de TAC, sin evidencia de anormalidades anatómicas o estructurales2,10,13. Los estudios funcionales, tales como manometría antroduodenal, muestran hipomotilidad intestinal y aperistalsis esofágica13.
Los hallazgos de laboratorio son inespecíficos y no hay anticuerpos específicos en pacientes con LES y POI con o sin ureterohidronefrosis. Incluso los datos del perfil de anticuerpos reportados en algunos pacientes está incompleto o no se facilitan, pero, cuando son reportados, hay una mayor prevalencia de anticuerpos anti-Ro/SS-A positivos (n=110; 63,58%) en comparación con otros autoanticuerpos como anti-La/SS-B (n=62; 35,83%), RNP (n=29; 16,76%) (solo reportado en 87 casos) y anti-Sm (n=26; 15,03%) (solo reportado en 87 casos).
La prevalencia de Ro/SS-A en POI es más alta que la prevalencia de SS-A (30%) y SS-B (10%) en LES8, lo que indica que los anticuerpos anti-Ro/SS-A pudieran jugar un rol patológico en la dismotilidad muscular6. De forma interesante, la presencia de anticuerpos anti-Ro no se traduce en una más alta tasa de síndrome de Sjögren secundario, que ha sido reportado en solo 13 casos (7,5% de los pacientes)8.
En cuanto al compromiso de otros órganos, se ha reportado el compromiso renal, manifestado como glomerulonefritis en 52 pacientes (30,05%), síndrome nefrótico en 14 (8,09%) y compromiso hematológico en 102 (58,95%), el cual ha mostrado la prevalencia más alta. El compromiso mucocutáneo no es frecuentemente reportado, pero en estudios casos y controles se ha descrito uno del 68,9%8.
Otros compromisos sistémicos relevantes con reportes frecuentes en la literatura incluyen: ascitis/serositis en n=117 (67,63%); artritis en n=66 (38,15%) y compromiso del sistema nervioso central en n=28 (16,18%). El SLEDAI fue reportado en el artículo de Xu et al.8, y tuvo un promedio de 12,4±5,3 con un valor de p de 0,012, relacionado con la manifestación de POI. En el estudio de Lingling et al.9, el SLEDAI tuvo un promedio de 12,1±0,8 con un valor de p de 0,0179. A pesar de la asociación con significación estadística, la POI y la ureterohidronefrosis pueden ocurrir con un bajo índice de actividad de la enfermedad, con un puntaje SLEDAI que varía desde 5 hasta 10 (22,9%) y<5 (6,6%), incluso en un estado estable de compromiso de otro órgano8.
En cuanto al tratamiento, el común denominador es el uso de altas dosis de esteroides intravenosos en pulsos como base del tratamiento (n=45; 52,33%) (en solo 86 pacientes se describía el manejo). Casi todos los pacientes de la serie revisada respondieron rápidamente a la terapia con esteroides. Las inmunoglobulinas intravenosas fueron usadas en casos refractarios al manejo con esteroides, con una buena respuesta clínica (n=9; 10,46%).
Junto con los esteroides, otros medicamentos inmunosupresores han sido usados en 66 casos (76,74%). Entre los fármacos inmunosupresores más frecuentemente utilizados encontramos la azatioprina, la ciclosporina oral y el micofenolato mofetilo, que se utilizan con buenos resultados. La elección de uno u otro está sujeta a otros tipos de afectación sistémica como la nefritis o la afectación cerebral.
Al mismo tiempo, se deben usar medidas de apoyo, tales como nutrición parenteral, antibióticos orales de amplio espectro para disminuir el sobrecrecimiento bacteriano y la estimulación farmacológica de la motilidad intestinal con cisaprida, octreótido y eritromicina (antibiótico con propiedades procinéticas)10,13. Las dosis de la terapia a tiempo y de manera temprana son esenciales para evitar recaídas y el desarrollo de adherencias que complican el curso clínico del LES. Esto también es esencial para rehabilitar la actividad peristáltica visceral del tracto gastrointestinal y el tracto genitourinario.
Los resultados a largo plazo de la POI relacionada con LES varían. Algunos pacientes pueden tener ataques recurrentes de POI sin compromiso de otros órganos a pesar del mantenimiento de la terapia con esteroides y otros agentes inmunosupresores. La mortalidad es del 23,52%, debido al desarrollo de peritonitis fúngica y sangrado gastrointestinal8,12,19–22.
En conclusión, la POI es una manifestación poco común del LES que debe ser reconocida por los médicos debido a sus potenciales complicaciones. También puede ser la primera manifestación de LES. Representa un verdadero desafío para los médicos, ya que el cuadro clínico del paciente puede ser confundido con otras etiologías de obstrucción intestinal y el paciente puede ser llevado a tratamientos quirúrgicos innecesarios. El diagnóstico y tratamiento correcto determinarán el pronóstico del paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener conflicto de interés.