La vasculitis asociada con anticuerpos anticitoplasma de neutrófilos-ANCA puede presentarse concomitantemente con síndrome de Sjögren primario o surgir durante su evolución. Se presenta el caso de una paciente que cursó con síntomas secos, test de Schirmer positivo, perfil de autoinmunidad compatible con síndrome de Sjögren y, de forma simultánea, deterioro de la función renal, anemia y disnea, por lo que requirió biopsia renal y fibrobroncoscopia. Los estudios complementarios documentaron glomerulonefritis aguda necrosante con proliferación extracapilar y patrón membranoproliferativo con depósito de complejos inmunes. El lavado broncoalveolar fue compatible con hemorragia alveolar. Se hizo diagnóstico de síndrome de pulmón-riñón secundario a vasculitis ANCA y se instauró tratamiento con esteroide y ciclofosfamida intravenosa, con mejoría clínica y paraclínica. El compromiso renal mixto encontrado en este caso es infrecuente en pacientes con SS, y el tratamiento cambia ostensiblemente, de ahí la importancia del diagnóstico diferencial y el reporte en la literatura.
ANCA-associated vasculitis may occur concomitantly with primary Sjögren's syndrome (SS) or arise during its evolution. We present the case of a patient who underwent dry symptoms, a positive Schirmer test and an SS-compatible autoimmunity profile and, simultaneously, deterioration of renal function, anaemia, and dyspnoea, requiring renal biopsy and fibrobronchoscopy. Complementary studies documented acute necrotizing glomerulonephritis with extracapillary proliferation, and membranoproliferative pattern with immune complex deposition. Bronchoalveolar lavage was compatible with alveolar haemorrhage. Kidney lung syndrome secondary to ANCA vasculitis was diagnosed and treatment with steroid and intravenous cyclophosphamide with clinical and paraclinical improvement was instituted. Mixed renal involvement found in this case is uncommon in patients with SS, and treatment changes significantly, hence the importance of differential diagnosis and reporting in the literature.
La presentación conjunta de 2 o más entidades autoinmunes representa un reto diagnóstico en la práctica clínica, dada la diversidad de manifestaciones y la complejidad en el manejo. Dentro del conjunto de síndromes de poliautoinmunidad, la presencia conjunta de vasculitis y síndrome Sjögren (SS) es rara y tiene de base mecanismos genéticos y medioambientales. El cuadro clínico es diverso, por lo que se dificulta el reconocimiento de alguno de ellos como manifestación primaria del otro. Dentro de las complicaciones más graves están la hemorragia alveolar difusa y la glomerulonefritis rápidamente progresiva, las cuales son más frecuentes en casos de vasculitis pauciinmunes que en SS se asocian con tasas de mortalidad elevadas, si no se tratan de manera oportuna. Adicionalmente, el compromiso renal mixto encontrado en este caso (glomerulonefritis aguda necrosante y patrón membranoproliferativo) es raro y tiene implicaciones importantes en el tratamiento1–3.
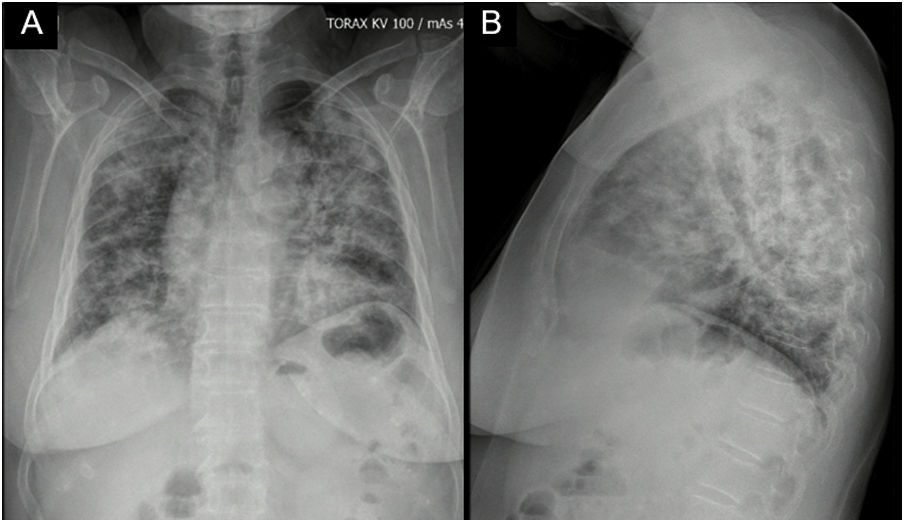
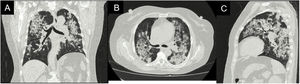
Reporte de casoPaciente femenina de 62 años con antecedente de exposición al humo de leña durante 13 años, ingresó por cuadro de 6 meses de evolución de tos seca, intermitente, no asociada con cambios de temperatura ni con el ejercicio. En los últimos 15 días se acompañó de disnea de medianos esfuerzos y odinofagia. Refiere xeroftalmia y xerostomía de 2 años de evolución, sin otros estigmas de autoinmunidad. No tiene antecedentes familiares de autoinmunidad conocidos. Ingresa normotensa, sin desaturación, taquicárdica y afebril, con estertores finos de predominio en bases pulmonares. Se toma radiografía de tórax con evidencia de opacidades alveolares multilobares (fig. 1).
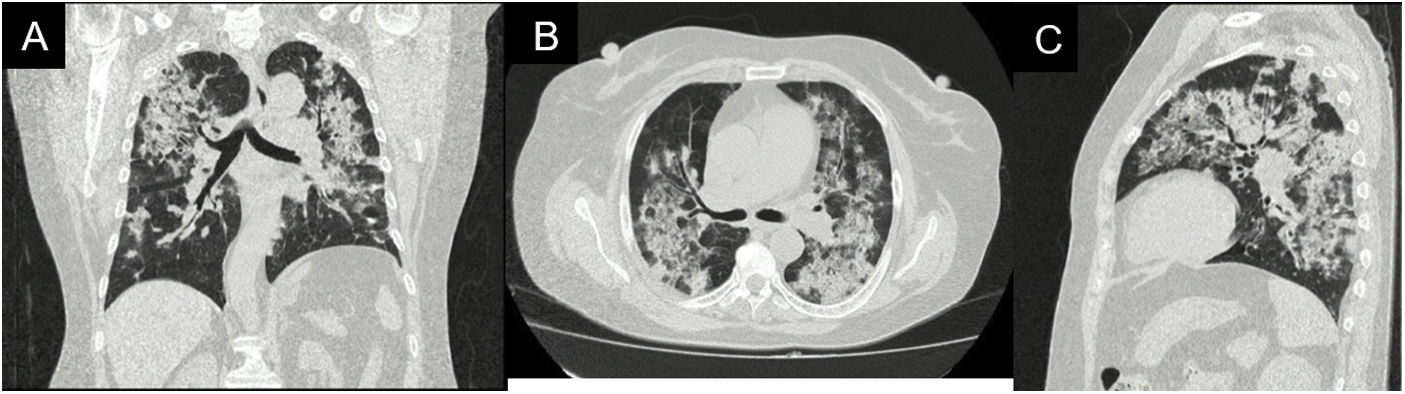
Durante su estancia, la paciente nunca presentó fiebre, expectoración purulenta o cuadro sugestivo de proceso infeccioso. Se descartó, en el contexto de pandemia, infección por SARS-CoV-2, con prueba rtPCR negativa. Dentro de los paraclínicos de ingreso se documentó anemia (hemoglobina 9,9g/dl) de volúmenes normales, homogénea y regenerativa; trombocitosis (plaquetas 507.900×103cél/ul); VSG elevada; creatinina elevada (2,29mg/dl); análisis de orina con sedimento activo y proteinuria subnefrótica; ecografía con relación corticomedular y tamaño renal conservados. Se realizó tomografía de alta resolución de tórax (fig. 2) con patrón de neumonía en organización por lo que se realizó fibrobroncoscopia en búsqueda etiológica.
Se iniciaron estudios para evaluar etiología del compromiso sistémico de la paciente, con perfil infeccioso negativo (VIH, hepatitis C, hepatitis B, RPR), y dentro de los estudios de autoinmunidad se encontró complemento normal, anticuerpos antinucleares positivos 1/320 en patrón moteado, anti-ADN 1/80, anti-Lo y anti-Ra fuertemente positivos (tabla 1). El test de Schirmer fue positivo, lo cual configuró un síndrome seco asociado con SS. La paciente presentó anemización progresiva (hasta hemoglobina de 7,8mg/dl), sin sangrado manifiesto y progresión de la lesión renal hasta creatinina de 3,4mg/dl, sin requerir terapia de soporte renal. Los hallazgos en la fibrobroncoscopia fueron compatibles con hemorragia alveolar (coloración especial de hierro positiva 30% para hemosiderófagos).
Perfil de autoinmunidad
| Paraclínico | Resultado /Título | Rango de referencia |
|---|---|---|
| ANCA por IFI | ||
| pANCA | Positivo 1:640 | Negativo |
| cANCA | Negativo | Negativo |
| ANCA por Elisa | ||
| Anti-PR3 | 2,7U/ml | Negativo: menor de 5U/ml |
| Antimieloperoxidasa | 46,1U/ml | Negativo: menor de 5U/ml |
| Anticuerpos antinucleares (Hep2000) | 1/320 dilucionesPatrón moteado | Negativo: menor 1/80 dilución |
| Anti-La (SSB) | 87,96U | Negativo: 0-20U |
| Anti-Ro (SSA) | 142,27U | Negativo: 0-20U |
| Anti-RNP | 13,87 | Negativo: 0-20U |
| Anti-Sm | 5,81U | Negativo: 0-20U |
| Anti-ADN | Positivo 1/80 diluciones | Negativo |
| C3 | 115,69mg/dl | 88-165mg/dl |
| C4 | 56,39mg/dl | 14-44mg/dl |
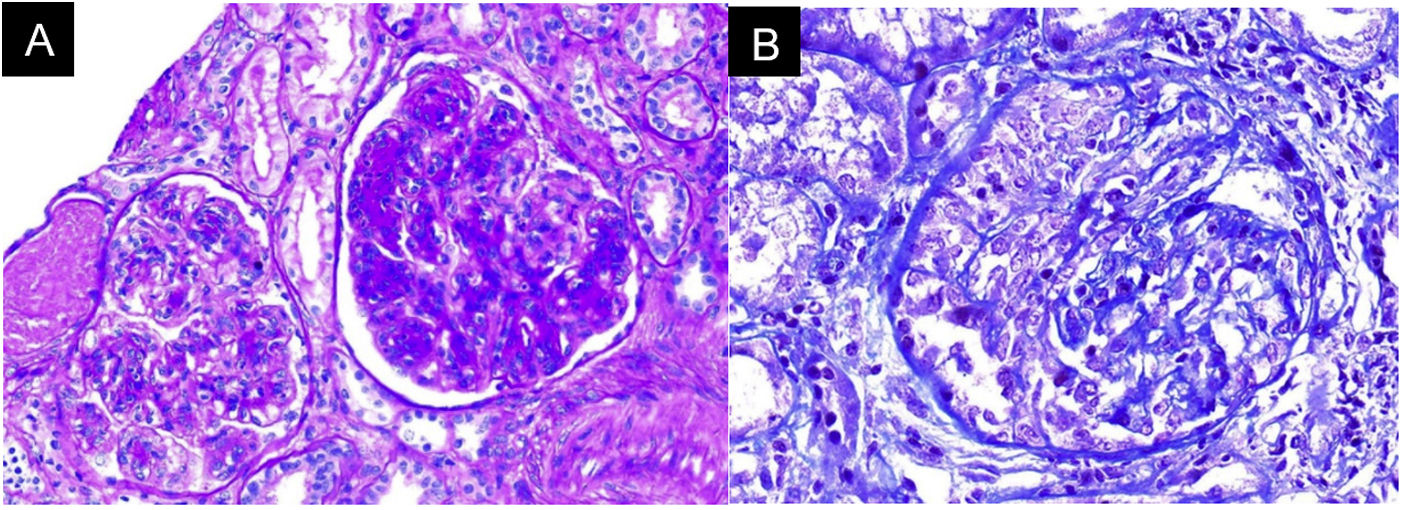
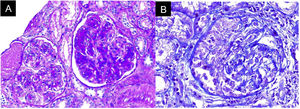
Ante la ausencia de otras noxas renales y dada la evidencia de sedimento activo con hemorragia alveolar, se planteó compromiso glomerular, probablemente secundario a glomerulonefritis rápidamente progresiva en relación con síndrome riñón-pulmón, por lo que se solicitaron anticuerpos anticitoplasma de neutrófilos (ANCA) por Elisa y biopsia renal (fig. 3). El reporte de ANCA fue positivo para anticuerpos antimieloperoxidasa (MPO) 46,1U/ml (normal<5U/ml). La biopsia mostró hallazgos de glomerulonefritis aguda necrosante con crescencias celulares, acompañado de infiltrado mononuclear en el intersticio, daño tubular activo y atrofia tubular con depósito inmune escaso y necrosis fibrinoide, la inmunofluorescencia (IFI) mostró depósitos escasos mesangiales de IgA, IgM y C3 en mesangio, C1q e IgG negativo. Debido al compromiso clínico tan severo, se consideró un cuadro pauciinmune predominante sobre el compromiso glomerular e intersticial del SS. Ante la presentación clínica del paciente asociado con la positividad de ANCA anti-MPO y los hallazgos de la biopsia renal con glomerulonefritis necrosante y proliferación extracapilar, se consideró el diagnóstico de vasculitis ANCA (VAA) adicional al SS.
Se iniciaron pulsos de metilprednisolona, con previa desparasitación con ivermectina y ciclofosfamida intravenosa basados en el esquema utilizado en el estudio Cyclops4 y bajas dosis de esteroides según el estudio Pexivas5. La evolución clínica fue satisfactoria, sin deterioro respiratorio y con estabilización de la función renal y hemoglobina, por lo que se dio egreso al día 20 de hospitalización. Se hizo control a los 2 meses de egreso, cuando llevaba 2,25g de dosis total acumulada de ciclofosfamida, con creatinina de control en 1,15mg/dl y hemoglobina en 11,3g/dL.
DiscusiónEl SS es una enfermedad autoinmune que se presenta en mujeres de edad media y afecta a las glándulas exocrinas, pero ocasionalmente puede extenderse a otros órganos como el riñón, los pulmones y el sistema nervioso2. Puede ocurrir como SS primario (SSp) o en asociación con otras enfermedades del tejido conectivo6. La lesión renal más común del SS es la nefritis intersticial con infiltración linfocítica intersticial, fibrosis y atrofia tubular; en contraste, se puede presentar glomerulonefritis, pero es rara7.
La VAA puede presentarse concomitante con el diagnóstico SSp o surgir durante su evolución7. En el caso presentado, la evidencia de valores positivos de anti-Ro y anti-La, la prueba de Schirmer positiva y la presencia de más de un dominio positivo en la escala Sjögren's Syndrome Disease Activity Index (ESSDAI) puntuaron en los criterios clasificatorios para Sjögren establecidos por la Liga Europea contra el Reumatismo (EULAR)8.
La presencia de anti-ADN en pacientes con SS es poco común; en las cohortes estudiadas varía del 2 al 10%9–11. El significado de la positividad se asocia con la probabilidad de desarrollar otras enfermedades autoinmunes más adelante. En este caso, se descartó que la paciente pudiera estar cursando con lupus eritematoso sistémico debido a una discordancia entre los marcadores de actividad y compromiso paraclínico e histopatológico renal evidenciado12, sin embargo, no se descarta que más adelante esta paciente pudiera presentar fenómeno de poliautoinmunidad sobreagregado, por lo que el seguimiento es fundamental.
En el momento del diagnóstico, es frecuente que los pacientes que cursan con VAA concomitante con SSp presenten reactantes de fase aguda elevados y anemia marcada13. Adicionalmente, aunque es raro, pueden tener compromiso renal asociado con VAA, como ocurrió en este caso. En un estudio de Borg et al.14, aproximadamente un tercio tenía VAA ANCA-MPO con compromiso renal limitado. Font et al. demostraron una asociación significativa entre la positividad ANCA del SS con fenómeno de Raynaud, vasculitis cutánea y neuropatías periféricas entre pacientes con SSp15–17; sin embargo, esta paciente no cursó con tales manifestaciones, lo que nos hace pensar que el compromiso renal de glomerulonefritis necrosante sea secundario a un compromiso por VAA como una entidad diferente al compromiso del SS.
El compromiso combinado pulmonar y renal por algunas de estas enfermedades también está descrito como síndrome pulmón-riñón18. Cuando se sospecha VAA en el contexto de SS, la tomografía de alta resolución a menudo determina el patrón predominante de lesión. De ellas, la neumonía en organización es la más comúnmente vista19. Otra anormalidad que se puede presentar es la hemorragia alveolar, la cual se puede manifestar como masas de tamaño variable con o sin signo del halo (hemorragia perinodular)20.
En el 2015, Cornec et al.14 realizaron una revisión de la literatura en búsqueda de SSp y VAA coexistente, e identificaron 22 reportes de caso; en todos ellos, el diagnóstico de VAA fue concomitante o subsecuente con el de SSp. En 5 casos, las manifestaciones de SSp y VAA empezaron al mismo tiempo. Las mujeres representaron el 86,4% de los pacientes. La edad media de diagnóstico fue de 63 años. De los 22 pacientes, 16 cumplieron los criterios de SSp propuestos por el American European Consensus Group (AECG). Dentro de los exámenes de vasculitis, el 76,2% de los pacientes presentaron pANCA con anti-MPO positivo y sus biopsias mostraron un patrón histológico típico de compromiso renal por VAA3.
El tratamiento de los casos de VAA y SS debe fundamentarse en la severidad de la enfermedad y el órgano comprometido. En este caso, debido a la presencia de hemorragia alveolar y alteración de la función renal, asociada con hallazgos de necrosis con proliferación extracapilar celular, se optó por el uso de la ciclofosfamida intravenosa según el esquema del estudio Cyclops, en vista de su eficacia en inducción de remisión en formas severas de vasculitis, con reducción considerable de la mortalidad en los estudios publicados en la literatura21,22. Adicionalmente, puesto que existen estudios observacionales que indican que las dosis altas de glucocorticoides se relacionan con aumento del riesgo de infecciones en pacientes con VAA y el compromiso glomerular del SS se asocia a su vez con mayor morbimortalidad por causas infecciosas, se optó por usar el esquema de bajas dosis de esteroides según el estudio Pexivas4,5.
Como la presencia de ANCA en el contexto de SSp es poco común y puede evolucionar a vasculitis sistémica, los pacientes deben ser monitorizados periódicamente, para realizar un control tanto clínico como paraclínico. Se recomienda realizar análisis de orina, función renal y proteína C reactiva. En pacientes con SSp con presencia de signos de respuesta inflamatoria en laboratorios se podría considerar la realización de tomografía por emisión de positrones con fluorodeoxiglucosa para discriminar entre actividad por SSp y vasculitis asociada23.
Este reporte de caso tiene como fortaleza que describe una condición que se presenta con poca frecuencia en la práctica clínica, contribuyendo a enriquecer el conocimiento sobre la expresión de estas entidades. Dentro de las limitaciones del caso se encuentra la falta de biopsia de glándula salivar, lo que hubiera podido corroborar hallazgos propios del SS. Es poco probable un caso de lupus eritematoso sistémico, debido la discordancia entre los marcadores de actividad (complemento normal y anti-ADN positivo en límite inferior) y el compromiso paraclínico e histopatológico renal evidenciado en la paciente24. No obstante, durante el seguimiento de pacientes similares a nuestro caso, se ha observado evolución secundaria de otras enfermedades autoinmunes como lupus eritematoso sistémico y enfermedad mixta del tejido conectivo25. Por tal motivo, es necesario hacer vigilancia periódica de estos pacientes.
ConclusiónAunque es raro que estas 2 entidades se presenten de manera simultánea, hay que sospecharlas y diagnosticarlas con el fin de tratarlas oportunamente, evitando así complicaciones a largo plazo que deterioren la calidad de vida y la supervivencia de las personas que las padecen.
Consideraciones éticasEl reporte de caso fue aprobado por el comité institucional de ética e investigación del Hospital Universitario San Ignacio, Bogotá (Colombia). La paciente dio el consentimiento informado para que su caso fuera publicado.
Disponibilidad de informaciónLa información relacionada con el reporte de caso se presenta dentro del manuscrito. Material adicional se pondrá a disposición posteriormente a la solicitud correspondiente al autor.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, del sector comercial o de entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses para la elaboración de este artículo.
Al Dr. Samuel Morales, patólogo del Hospital Universitario San Ignacio, Bogotá (Colombia), por el aporte de las imágenes de la biopsia renal.