La modulación de la respuesta inmune inducida por los medicamentos biológicos y los recientemente aprobados inhibidores de JAK, ha cambiado sustancialmente el tratamiento y el seguimiento de las enfermedades autoinmunes e inflamatorias crónicas1,2. Aunque estos agentes suelen ser bien tolerados, los datos obtenidos en la vigilancia posterior a su comercialización demuestran la asociación frecuente de estos medicamentos con eventos adversos que incluyen reacciones alérgicas, inmunológicas, infecciosas y otras reacciones no deseadas3. La gestión del riesgo terapéutico consiste entonces en realizar una estrecha vigilancia del caso con el fin de identificar, prevenir y reducir los eventos que potencialmente puedan afectar la seguridad del paciente durante el consumo de estos fármacos4.
En el año 2016, la Asociación Colombiana de Reumatología (ASOREUMA) publicó una serie de recomendaciones para el uso seguro de la terapia biológica en la práctica clínica5. Hoy en Colombia los pacientes con artritis reumatoide que son formulados con medicamentos biológicos e inhibidores de JAK se estiman por el 14,7% y el 1,3%, respectivamente6.
El objetivo del presente documento es suministrar información actualizada que permita a reumatólogos, especialistas de áreas afines y otros profesionales de la salud hacer una adecuada gestión del riesgo durante el uso de terapias biológicas y antirreumáticos sintéticos con blanco dirigido en pacientes que padecen enfermedades inflamatorias crónicas y autoinmunes. Un panel de expertos de ASOREUMA, luego de revisar la evidencia disponible, presenta las recomendaciones para la gestión del riesgo en la prescripción de dichas terapias en diferentes escenarios como cáncer, cirugía, tuberculosis (TB), hepatitis, vacunación, enfermedad cardiovascular, embarazo y lactancia. Con la aplicación de estas recomendaciones en la práctica clínica diaria se pretende minimizar los potenciales efectos adversos relacionados con los tratamientos y ofrecer un seguimiento adecuado para estos pacientes.
MétodosParticipantes y formulación de consensoSe conformó un grupo desarrollador multidisciplinar de ocho expertos clínicos, de reumatología, infectología y neumología, con amplia experiencia en la prescripción y el monitoreo de la terapia con biológicos o con antirreumáticos sintéticos con blanco dirigido en pacientes con diferentes patologías. Un equipo metodológico independiente (Epithink Health Consulting) apoyó el desarrollo del consenso. Todos los miembros del grupo desarrollador declararon sus intereses y ninguno presentó conflictos frente a su participación en este consenso (material suplementario 1).
El grupo desarrollador en sesión definió las preguntas objeto de actualización y nuevas preguntas como parte de este consenso, de acuerdo con los criterios de 1) relevancia para la práctica clínica actual, 2) nueva evidencia relevante sobre la efectividad y la seguridad, 3) nueva evidencia relevante de cambios en el contexto, 4) necesidad de actualización de la pregunta y 5) prioridad de actualización de la pregunta.
Búsqueda y selección de la evidenciaSe desarrollaron búsquedas sistemáticas de información para cada pregunta de investigación elaborada. La evidencia proveniente de la revisión sistemática que informa este consenso se presenta en el material suplementario. Se implementaron diferentes estrategias de búsqueda para cada temática, procurando el mejor balance entre sensibilidad y especificidad. Las estrategias fueron redactadas en inglés. Las búsquedas de evidencia se realizaron en la base de datos de MEDLINE-PubMed (incluyendo la sección In-Process & Other Non-Indexed Citations); EMBASE, desde 1947 hasta la fecha de la búsqueda; EBM Reviews-Cochrane Database of Systematic Reviews desde 2005; Database of Abstracts of Reviews of Effects y LILACS. A partir de los resultados de la búsqueda, dos expertos metodológicos tamizaron las referencias por título y resumen según los criterios de selección preestablecidos en las preguntas temáticas orientadoras (material suplementario 2). No se incluyeron póster, resúmenes o cartas al editor. Los desacuerdos entre los revisores fueron resueltos por consenso. Una vez tamizadas, se revisaron en texto completo las referencias seleccionadas, y junto con los expertos clínicos se determinó su inclusión. Los resultados de esta etapa fueron descritos mediante un diagrama de flujo PRISMA7 para cada uno de los temas revisados (material suplementario 2).
Método DelphiSe revisó la evidencia correspondiente a cada pregunta y se extrajo la información relevante para la elaboración de un cuestionario. Para la participación en esta etapa del consenso, otros ocho expertos clínicos de diferentes disciplinas se incorporaron al grupo de panelistas. La primera ronda de consenso se desarrolló de manera cegada, virtual y asincrónica. Con base en la evidencia y la experiencia clínica, los expertos valoraron en escala Likert el grado de acuerdo con enunciados de gestión del riesgo en pacientes con prescripción de terapias biológicas o con antirreumáticos sintéticos con blanco dirigido, en Colombia. El nivel de acuerdo del grupo se determinó por análisis de la primera ronda (material suplementario 3) y, posteriormente, en una sesión sincrónica, se realizó la discusión de contenidos y la segunda ronda de valoración para definir las recomendaciones finales.
Otros temas que no son objeto de actualización pueden consultarse en el documento de consenso Gestión de riesgo para la prescripción de terapias biológicas5.
Consideraciones éticasEl presente estudio no requirió aprobación de un comité de ética ni uso de consentimiento informado, ya que no hubo participación de sujetos de investigación.
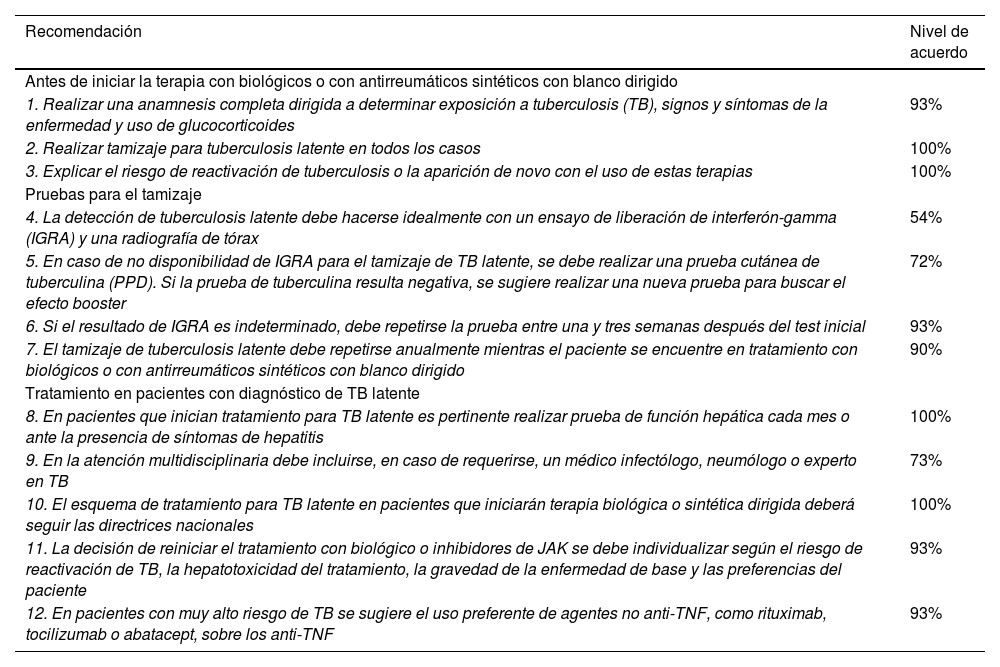
ResultadosRecomendaciones para la gestión del riesgo con el uso de terapias biológicas o de antirreumáticos sintéticos con blanco dirigidoTuberculosis latenteLas recomendaciones actuales indican tamizaje para identificar TB latente (TBL) en todos los pacientes considerados para tratamiento con agentes biológicos o sintéticos con blanco dirigido, con independencia de la presencia de factores de riesgo para TB8. La Organización Mundial de la Salud (OMS) recomienda para el diagnóstico de TBL el uso de la prueba cutánea de derivado proteico purificado (PPD) y el ensayo de liberación de interferón gamma (IGRA) para reducir los falsos negativos9. Al respecto, la evidencia, que fundamentalmente proviene de estudios observacionales, sugiere que la adición de IGRA10,11 a la práctica estándar puede aumentar la identificación de casos de TBL12–14. A efectos de este consenso, en Colombia el IGRA tiene una baja disponibilidad en las diferentes regiones del territorio nacional, por lo cual el tamizaje y el seguimiento se continúan realizando con PPD y radiografía de tórax15. Esta última debe incluirse especialmente porque un IGRA o PPD negativos pueden no excluir la TB activa o descartar la TBL. En todos los casos, se insta a los profesionales de atención clínica a evaluar de manera individual el riesgo del paciente y el tipo de terapia con relación a la probabilidad de reactivación de TB. Lo anterior, teniendo en cuenta la frecuencia de positividad de la prueba de tuberculina en pacientes colombianos con artritis reumatoide, incluso previamente al inicio de terapia biológica.16
El tamizaje debe ser reevaluado periódicamente durante la terapia con biológicos o antirreumáticos sintéticos con blanco dirigido, sobre todo si existen factores de riesgo o si estos aparecen con el tiempo. Aunque no hay datos sólidos para definir la frecuencia de reevaluación de los pacientes, se recomienda el monitoreo anual17–22, particularmente en países con alta prevalencia de TB8, incluso en quienes recibieron profilaxis con isoniazida23–25.
Se describen diversos esquemas para el tratamiento de TBL, incluyendo isoniazida9,26–28, o una combinación con rifampicina28 o rifapentina8. El panel de este consenso sugiere adherirse a las directrices nacionales que indican el tratamiento autoadministrado con isoniazida por seis meses con seguimiento mensual o un esquema corto de dosis semanal con isoniazida y rifapentina por tres meses en tratamiento supervisado15. De acuerdo con los estudios de quimioprofilaxis, no siempre se puede prevenir la reactivación de la TB durante la terapia anti-factor de necrosis tumoral (TNF) a largo plazo, por lo que se requiere una evaluación periódica para detectar casos de reactivación durante la terapia biológica29.
Existe evidencia de un mayor riesgo de reactivación de la TB con productos como anticuerpos monoclonales contra el TNF30–35, seguidos de los inhibidores de JAK y los agentes dirigidos contra la interleucina (IL) 136. Los estudios con biológicos diferentes a los anti-TNF presentan limitaciones de calidad y realización en entornos de baja prevalencia de TB, por lo que se asume un riesgo teórico, aunque menor, de reactivación de TB37–40. De hecho, parece que el riesgo de reactivación o de TB de novo es relativamente bajo con el tratamiento con apremilast, ustekinumab, secukinumab y rituximab. En todo caso, la detección de TBL siempre debe preceder al inicio de la terapia biológica o con antirreumáticos sintéticos con blanco dirigido41, considerando además que el uso de una medicación como glucocorticoides puede incrementar el riesgo de TB.
La evidencia frente al tiempo para el inicio o el reinicio de los biológicos en pacientes con tratamiento de TBL es variable23,42. Los estudios en general sugieren el inicio o reinicio de biológicos entre tres y seis semanas después de iniciar la quimioprofilaxis de TBL28,43, pero se hacen precisiones para individualizar los casos de acuerdo con el riesgo de desarrollar TB activa, el riesgo de hepatotoxicidad con el tratamiento de TBL, la gravedad de la enfermedad y la elección del paciente44. La tabla 1 resume las recomendaciones para el seguimiento y el tratamiento de la TBL.
Resumen de las recomendaciones con respecto a tuberculosis latente y el uso de terapias biológicas o de antirreumáticos sintéticos con blanco dirigido
| Recomendación | Nivel de acuerdo |
|---|---|
| Antes de iniciar la terapia con biológicos o con antirreumáticos sintéticos con blanco dirigido | |
| 1. Realizar una anamnesis completa dirigida a determinar exposición a tuberculosis (TB), signos y síntomas de la enfermedad y uso de glucocorticoides | 93% |
| 2. Realizar tamizaje para tuberculosis latente en todos los casos | 100% |
| 3. Explicar el riesgo de reactivación de tuberculosis o la aparición de novo con el uso de estas terapias | 100% |
| Pruebas para el tamizaje | |
| 4. La detección de tuberculosis latente debe hacerse idealmente con un ensayo de liberación de interferón-gamma (IGRA) y una radiografía de tórax | 54% |
| 5. En caso de no disponibilidad de IGRA para el tamizaje de TB latente, se debe realizar una prueba cutánea de tuberculina (PPD). Si la prueba de tuberculina resulta negativa, se sugiere realizar una nueva prueba para buscar el efecto booster | 72% |
| 6. Si el resultado de IGRA es indeterminado, debe repetirse la prueba entre una y tres semanas después del test inicial | 93% |
| 7. El tamizaje de tuberculosis latente debe repetirse anualmente mientras el paciente se encuentre en tratamiento con biológicos o con antirreumáticos sintéticos con blanco dirigido | 90% |
| Tratamiento en pacientes con diagnóstico de TB latente | |
| 8. En pacientes que inician tratamiento para TB latente es pertinente realizar prueba de función hepática cada mes o ante la presencia de síntomas de hepatitis | 100% |
| 9. En la atención multidisciplinaria debe incluirse, en caso de requerirse, un médico infectólogo, neumólogo o experto en TB | 73% |
| 10. El esquema de tratamiento para TB latente en pacientes que iniciarán terapia biológica o sintética dirigida deberá seguir las directrices nacionales | 100% |
| 11. La decisión de reiniciar el tratamiento con biológico o inhibidores de JAK se debe individualizar según el riesgo de reactivación de TB, la hepatotoxicidad del tratamiento, la gravedad de la enfermedad de base y las preferencias del paciente | 93% |
| 12. En pacientes con muy alto riesgo de TB se sugiere el uso preferente de agentes no anti-TNF, como rituximab, tocilizumab o abatacept, sobre los anti-TNF | 93% |
La evidencia a partir de metaanálisis de ensayos clínicos45–48 demuestra, en general, la seguridad de la terapia biológica (anti-TNF49–52, inhibidores de JAK, inhibidores IL-17A53, inhibidores IL-23A53, inhibidores IL-649,51,54, rituximab49,50,55, inhibidores IL-150 y abatacept56) en pacientes con antecedente de neoplasias malignas. Algunos registros de cohortes sugieren, de manera no contundente, un mayor riesgo de malignidad con el uso de terapia anti-TNF a largo plazo49,55. Estos autores indican que los fármacos biológicos no deben usarse en pacientes con cáncer activo49, mientras que algunas pautas no recomiendan el uso de anti-TNF en pacientes con cáncer preexistente, y se prefieren los fármacos antirreumáticos modificadores de la enfermedad (FARME) sintéticos convencionales, rituximab, abatacept y tocilizumab49.
Las variables que deben ser consideradas al momento de definir el uso o no de medicamentos biológicos o antirreumáticos sintéticos con blanco dirigido en pacientes con cáncer previo, incluyen el análisis individual de valores y preferencias de los pacientes en relación con la etapa de la enfermedad, el pronóstico, el potencial curativo, la expectativa de vida y la calidad de vida49. Por otra parte, es importante evaluar las interacciones entre la quimioterapia o los glucocorticoides y el tipo de cáncer, con el uso de biológicos o de antirreumáticos sintéticos con blanco dirigido, así como el riesgo-beneficio de iniciar estas terapias. Del mismo modo, el panel consideró que, en casos de cáncer activo y alta actividad de la enfermedad reumatológica, la participación del oncólogo es fundamental para la toma de decisiones terapéuticas. La tabla 2 resume las recomendaciones para la gestión del riesgo en pacientes con cáncer.
Resumen de las recomendaciones en el contexto del cáncer y el uso de terapias biológicas o de antirreumáticos sintéticos con blanco dirigido
| Recomendación | Nivel de acuerdo |
|---|---|
| 13. En pacientes con cáncer activo es importante la opinión de un oncólogo antes de iniciar algún FARME biológico o antirreumáticos sintéticos con blanco dirigido | 100% |
| 14. En pacientes con antecedente de cáncer que requieren el uso de terapia biológica o sintética dirigida se sugiere priorizar el uso de rituximab, abatacept y tocilizumab, sobre los anti-TNF y antirreumáticos sintéticos con blanco dirigido | 100% |
| 15. En pacientes con antecedente de cáncer en quienes se usa terapias biológicas o antirreumáticos sintéticos con blanco dirigido se deben monitorear los signos de cáncer de piel no melanoma u otros tipos de cáncer | 100% |
Con base en la evidencia, debido al riesgo potencial de reactivación del virus de la hepatitis B (VHB) relacionado con la terapia, antes de comenzar agentes biológicos o sintéticos con blanco dirigido, en todos los pacientes se deben realizar pruebas de detección de hepatitis virales57. A este efecto se recomiendan pruebas de antígeno de superficie del VHB (HBsAg), anticuerpos antiantígeno de superficie del VHB (HBsAb) o anticuerpo antinúcleo del VHB anti-core (HBcAb)58. Luego, en pacientes positivos se debe evaluar el ADN-VHB para diferenciar los portadores activos, quienes deben recibir tratamiento antes de iniciar tratamiento con biológicos o antirreumáticos sintéticos con blanco dirigido. En portadores inactivos del VHB, se recomienda iniciar la profilaxis antes de la terapia inmunosupresora59, y continuarla durante al menos seis a 12 meses después de finalizar el tratamiento inmunosupresor57,60.
Aunque los estudios indican un riesgo muy bajo de reactivación del virus de la hepatitis C (VHC), particularmente con los anti-TNF, se recomienda en todos los pacientes que reciben terapia biológica o sintéticos con blanco dirigido17,61 la medición de anticuerpos anti-VHC, y si están presentes, medición de los niveles de ARN-VHC. Los pacientes con ARN-VHC detectable deben ser monitoreados durante el tratamiento y deben ser remitidos al hepatólogo o al infectólogo para tratamiento antiviral según sea necesario62,63. La tabla 3 resume las recomendaciones en el campo de las hepatitis virales.
Resumen de las recomendaciones acerca de hepatitis viral y el uso de terapias biológicas o de antirreumáticos sintéticos con blanco dirigido
| Recomendación | Nivel de acuerdo |
|---|---|
| Antes de iniciar la terapia con biológicos o sintéticos con blanco dirigido | |
| 16. Realizar pruebas de detección del virus de HB y C, así: antígeno de superficie de hepatitis B, anticuerpos antiantígeno de superficie de hepatitis B, anti-core y antihepatitis C | 100% |
| 17. Realizar anticuerpos contra el antígeno de superficie de hepatitis B para conocer el estado de vacunación | 100% |
| 18. En pacientes con resultado positivo en cualquiera de las pruebas de tamizaje está indicado solicitar carga viral y remitir al hepatólogo o al infectólogo | 100% |
| 19. En pacientes con antecedente de hepatitis B o C se debe realizar la valoración conjunta con infectología o hepatología para determinar la mejor opción terapéutica | 93% |
La tabla 4 condensa las recomendaciones para uso de vacunas en pacientes sometidos a tratamiento con biológicos e inhibidores JAK. Los estudios de vacuna contra la influenza en pacientes tratados con anti-TNF han mostrado que los menores títulos de anticuerpos identificados no se asocian con disminución en la seroprotección64. También se han descrito respuestas inmunológicas apropiadas en pacientes tratados con rituximab, abatacept, tocilizumab64,65, secukinumab66,67 e inhibidores de JAK68–70.
Resumen de las recomendaciones de vacunación en personas con terapias biológicas o de antirreumáticos sintéticos con blanco dirigido
| Recomendación | Nivel de acuerdo |
|---|---|
| 20. En pacientes con enfermedades reumáticas inflamatorias, el equipo de reumatología debe evaluar anualmente el estado de vacunación y las indicaciones de vacunación adicional | 93% |
| 21. El programa de vacunación individualizado debe ser explicado al paciente por el equipo de reumatología y el médico de atención primaria para la toma de decisiones compartida con el paciente | 71% |
| 22. En pacientes con enfermedades reumáticas inflamatorias la vacunación debe administrarse preferentemente durante la etapa inactiva de la enfermedad | 93% |
| 23. En pacientes con enfermedades reumáticas inflamatorias las vacunas deben administrarse preferentemente antes de la inmunosupresión planificada, en particular la terapia de depleción de células B | 93% |
| 24. Las vacunas no vivas pueden administrarse a pacientes con enfermedades reumáticas inflamatorias mientras reciben tratamiento con glucocorticoides sistémicos y fármacos modificadores de la enfermedad | 93% |
| 25. Todos los pacientes que van a recibir medicamentos biológicos o sintéticos con blanco dirigido deben recibir vacunación para influenza y para neumococo (PPV13, ocho semanas después PPSV23 y a los cinco años refuerzo con la PPSV23) | 100% |
| 26. Se recomienda el uso de la vacuna contra herpes zóster recombinante en todos los pacientes con enfermedades reumáticas mayores de 50 años o de alto riesgo | 93% |
| 27. En caso de usar la vacuna contra herpes zóster viva atenuada en pacientes con enfermedades reumáticas, se debe aplicar mínimo un mes antes del inicio con el tratamiento biológico o con antirreumáticos sintéticos con blanco dirigido | 100% |
| 28. En pacientes con enfermedades reumáticas en tratamiento con biológicos o antirreumáticos sintéticos con blanco dirigido, no se recomienda el uso de la vacuna contra la fiebre amarilla | 100% |
| 29. En el paciente en terapia biológica o con antirreumáticos sintéticos con blanco dirigido, podrá administrarse la vacuna DPT en caso de requerirse | 93% |
| 30. La vacuna contra el VPH es eficaz y segura en mujeres con enfermedades reumáticas y su administración debe realizarse según los lineamientos nacionales | 100% |
| 31. Todos los pacientes con enfermedades reumáticas deben vacunarse contra el SARS-CoV-2 siguiendo las recomendaciones para la población general, manteniendo el esquema actualizado | 100% |
| 32. Para la vacunación contra el SARS-CoV2 algunas terapias requieren modificaciones para obtener una adecuada inmunogenicidad (véase tabla 1). | 100% |
Del mismo modo, la eficacia y la seguridad de la vacunación contra neumococo se han evaluado en diferentes poblaciones con enfermedades autoinmunes64,68,71–74, sin detrimento significativo de la respuesta vacunal ni eventos adversos graves con diferentes fármacos biológicos o antirreumáticos sintéticos con blanco dirigido, como rituximab, tocilizumab, abatacept, tofacitinib, baricitinib y upadacitinib. Aún no se dispone de estudios de seguimiento a largo plazo que aborden la persistencia de la respuesta humoral y la memoria inmunológica75.
Por otra parte, la evidencia con respecto a la inmunogenicidad y la seguridad de las vacunas contra herpes zóster (HZ) en los pacientes con enfermedades reumáticas reporta un mejor desempeño de la recombinante que la vacuna viva atenuada, aunque las dos cuentan con aceptable eficacia y una tasa de eventos adversos graves comparable a la de la población general76–79. La vacuna viva atenuada contra HZ tiene mayor costo-efectividad en las personas entre los 60 y los 69 años80.
Las mujeres con enfermedades reumáticas y tratamiento inmunosupresor están en mayor riesgo que la población general de infección por el virus del papiloma humano (VPH) y el posterior desarrollo de cáncer de cuello uterino81,82. La vacuna tetravalente contra el VPH es bien tolerada, razonablemente eficaz y no induce un aumento de la actividad de la enfermedad83–85. Adicionalmente, la evidencia respalda el hecho de que los anti-TNF no afectan la seroconversión posterior a la vacunación86,87.
La información actualmente disponible acerca de la correlación entre los niveles de los títulos y la respuesta inmunitaria con las vacunas contra el SARS-CoV-2 es limitada, y se conoce que la respuesta esperada para muchos pacientes con enfermedades reumáticas inflamatorias autoinmunes que reciben terapias inmunomoduladoras sistémicas está atenuada en su magnitud y duración en comparación con la población general88–92. Más allá de las alergias conocidas a los componentes de la vacuna, no se conocen contraindicaciones adicionales para la vacunación COVID-19 en esta población de pacientes, en quienes el beneficio supera el riesgo potencial de autoinmunidad de nueva aparición89. Con el propósito de obtener una adecuada inmunogenicidad se recomienda la modificación del tratamiento con FARME en relación con la vacuna89,93,94 (tabla 5). Finalmente, los casos particulares pueden evaluarse junto con infectología, siempre teniendo en consideración el riesgo-beneficio de postergar la vacunación cuando se va a iniciar un tratamiento biológico o de inhibidores de JAK, por ejemplo, ante la presencia de episodios previos de herpes o de recurrencia de este, alto uso de glucocorticoides u otros inmunosupresores. En todos los casos, se insta a los profesionales de atención clínica a revisar el inserto de cada medicamento frente a la seguridad en vacunación y otras potenciales interacciones.
Consideraciones sobre temporalidad de la terapia inmunomoduladora y la vacunación por COVID-19
| Fármaco | Consideraciones |
|---|---|
| Abatacept (IV) | Programar la vacunación para una semana antes de la siguiente dosis de abatacept (IV) |
| Abatacept (SC) | Suspender durante una a dos semanas (según lo permita la actividad de la enfermedad) después de cada dosis de la vacuna COVID-19 |
| Belimumab (SC) | Suspender durante una a dos semanas (según lo permita la actividad de la enfermedad) después de cada dosis de la vacuna COVID-19 |
| Anti-TNF, inhibidores de IL-6, IL-1, IL-17, IL-12/23, IL-23 y otros inhibidores de citoquinas | Previamente se indicó no modificar, sin embargo, actualmente no hay consenso sobre la conveniencia o no de interrumpirlas temporalmente después de cada dosis de vacuna COVID-19, incluyendo tanto la vacunación primaria como la dosis suplementaria/de refuerzo |
| Rituximab u otros agentes depletores de células B anti-CD20 | Discutir el momento óptimo de dosificación y vacunación antes de proceder. Algunos profesionales miden los linfocitos B CD19 para programar la dosis de refuerzo de COVID-19 y la posterior de rituximab, si esto no es factible, se debe proporcionar una dosis de vacuna suplementaria de dos a cuatro semanas antes de la siguiente dosis de rituximab prevista |
| Todos los demás fármacos convencionales y específicos inmunomoduladores o inmunosupresores excepto los mencionados arriba | Suspender durante una a dos semanas (si la actividad de la enfermedad lo permite) después de cada dosis de la vacuna COVID-19. |
Nivel moderado de recomendación a partir de consenso de American College of Rheumatology Guidance for COVID-19 Vaccination in Patients With Rheumatic and Musculoskeletal Diseases: Version 4
La evidencia proveniente de metaanálisis95–99 reporta un aumento del riesgo perioperatorio de infección y debe considerarse el riesgo-beneficio de la suspensión o no del biológico o antirreumáticos sintéticos con blanco dirigido. Las guías del American College of Rheumatology y la American Association of Hip and Knee Surgeons100 recomiendan la suspensión de los medicamentos biológicos con un intervalo de una a 13 semanas, según la vida media de cada medicamento (tabla 6). Metaanálisis recientes muestran un aumento significativo en la incidencia de complicaciones infecciosas posoperatorias en pacientes con anti-TNF97, y recomiendan retener un anti-TNF durante dos vidas medias del fármaco antes de la cirugía99 y reiniciar después de dos a tres semanas si la cicatrización de la herida ha sido adecuada101.
Manejo de biológicos y otros fármacos en contextos perioperatorios en pacientes con enfermedades reumáticas inflamatorias
| Medicamento* | Intervalo de dosificación | Momento recomendado de la cirugía desde la última dosis del medicamento |
|---|---|---|
| Infliximab | Cada cuatro, seis u ocho semanas | Semanas 5, 7 o 9 |
| Adalimumab | Cada dos semanas | Semana 3 |
| Etanercept | Cada semana | Semana 2 |
| Abatacept | Mensual (IV) o semanal (SC) | Semana 5; Semana 2 |
| Certolizumab | Cada dos o cuatro semanas | Semana 3 o 5 |
| Golimumab | Cada cuatro semanas (SC) o cada ocho semanas (IV) | Semana 5 SC y semana 9 IV |
| Rituximab | Dos dosis con doe semanas de diferencia cada cuatro a seis meses | Mes 7 |
| Tocilizumab | Cada semana (SC) o cada cuatro semanas (IV) | Semana 2; semana 5 |
| Anakinra | A diario | Día 2 |
| Secukinumab | Cada cuatro semanas | Semana 5 |
| Ustekinumab | Cada 12 semanas | Semana 13 |
| Ixekizumab | Cada cuatro semanas | Semana 5 |
| Guselkumab | Cada ocho semanas | Semana 9 |
| Tofacitinib | Diariamente o dos veces al día | Día 4 |
| Baricitinib | Diario | Día 4 |
| Upadacitinib | Diario | Día 4 |
SC: subcutánea; IV: intravenoso; VO: vía oral.
SUSPENDA estos medicamentos antes de la cirugía y prográmela al final del ciclo de la dosificación. REANUDAR los medicamentos como mínimo 14 días después la cirugía, en ausencia de problemas de cicatrización de heridas, infección del sitio quirúrgico o infección sistémica.
Tomado y modificado: Goodman et al.100
La vigilancia estricta a la cicatrización de la herida y a los signos de respuesta inflamatoria sistémica es importante, particularmente en cirugías de emergencia cuando no fue posible suspender el biológico, especialmente si el paciente tiene otros factores de riesgo de infección como una mayor actividad de la enfermedad, uso de glucocorticoides, tabaquismo y diabetes99 o un alto riesgo de dehiscencia102. El reinicio del medicamento deberá ser lo antes posible, tras la cicatrización completa de la herida103,104. La tabla 7 resume las recomendaciones en relación con los procedimientos quirúrgicos en pacientes que usan biológicos o inhibidores JAK.
Resumen de las recomendaciones para intervenciones quirúrgicas en personas con terapias biológicas o de antirreumáticos sintéticos con blanco dirigido
| Recomendación | Nivel de acuerdo |
|---|---|
| 33. En pacientes en tratamiento con agentes biológicos o antirreumáticos sintéticos con blanco dirigido que se van a someter a una cirugía se recomienda continuar con la dosis habitual de los siguientes fármacos durante la intervención quirúrgica: metotrexato, leflunomida, hidroxicloroquina, sulfasalazina o apremilast | 93% |
| 34. Para procedimientos quirúrgicos en pacientes en terapia biológica se recomienda suspender una dosis y programar la cirugía en el momento que corresponde la siguiente dosis (véase tabla 2) | 100% |
| 35. En pacientes en tratamiento con inhibidores de JAK que se van a someter a una cirugía se recomienda suspender el fármaco (tofacitinib, baricitinib y upadacitinib) cuatro días antes de la intervención quirúrgica | 100% |
| 36. En pacientes en quienes se suspendió el tratamiento antes de someterse a una cirugía, se deberá reiniciar el tratamiento después de la intervención quirúrgica si no hay evidencia de infección y una vez que la cicatrización de la herida sea satisfactoria | 100% |
| 37. En pacientes con cirugías no programadas, cuando no fue posible la suspensión del biológico o del inhibidor de JAK, deberá realizarse un estricto control de signos de infección y posibles complicaciones de la cicatrización | 100% |
Varios FARME, como los anti-TNF, el abatacept y los inhibidores de IL-6, parecen mejorar varios marcadores de enfermedad cardiovascular105 (reducción significativa de la leptina y la resistina y aumento de la adiponectina, reducción del índice aterogénico y del índice de resistencia a la insulina) y reducir los eventos cardiovasculares en estudios en cohortes de pacientes con enfermedades reumáticas106–108. En pacientes con aterosclerosis tratados con tofacitinib106 y en aquellos con artritis reumatoide tratados con anti-TNF o inhibidores JAK109, estudios de cohortes han mostrado una ligera disminución del grosor de la íntima-media carotídea. Sin embargo, no se sabe con certeza si se debe a la reducción de la actividad de la enfermedad en general o a efectos ateroprotectores específicos.
Ensayos clínicos con tocilizumab110 y baricitinib111 muestran un aumento significativo de los niveles de colesterol de las lipoproteínas de baja densidad (LDL) y de las lipoproteínas de alta densidad (HDL) sin diferencias significativas en desenlaces clínicos cardiovasculares mayores. Los antirreumáticos sintéticos con blanco dirigido podrían conferir un riesgo ligeramente mayor de episodios trombóticos que el tratamiento estándar en algunos pacientes, pero la evidencia es limitada y se necesitan estudios clínicos a largo plazo112.
Las recomendaciones actuales acerca de forma y frecuencia de tamizaje de riesgo cardiovascular surgen de los lineamientos de guías internacionales y consensos de expertos113. El panel enfatiza la necesidad de estratificación del riesgo para Colombia, con el uso de la escala de Framingham adaptada a nuestro país, por parte de cualquier médico del equipo multidisciplinario de atención y decisiones individualizadas de evaluación y mitigación del riesgo cardiovascular en los pacientes en terapia biológica o sintética dirigida (tabla 8).
Resumen de recomendaciones con respecto a enfermedad cardiovascular en personas con terapias biológicas o de antirreumáticos sintéticos con blanco dirigido
| Recomendación | Nivel de acuerdo |
|---|---|
| 38. Todos los pacientes con enfermedades reumáticas deben someterse a un tamizaje de factores de riesgo cardiovascular tradicionales y estratificación del riesgo cardiovascular | 93% |
| 39. Los pacientes en quienes se identifique un riesgo cardiovascular superior al esperado podrían ser remitidos a la especialidad médica correspondiente para adoptar medidas adicionales de prevención de la enfermedad cardiovascular | 86% |
| 40. En todos los pacientes con enfermedades reumáticas se sugiere realizar la evaluación del riesgo cardiovascular al menos una vez cada cinco años y reevaluar tras cambios importantes en el tratamiento antirreumático | 79% |
En general, los estudios sobre los efectos a largo plazo de los biológicos o sintéticos con blanco dirigidos durante el embarazo o la lactancia en la salud y el desarrollo infantil son escasos y a menudo de baja calidad, por lo que se deben considerar factores propios de la enfermedad (indicaciones del tratamiento, dosificación del fármaco, actividad de la enfermedad, grado de inflamación sistémica, afectación de órganos, comorbilidades, otros tratamientos farmacológicos, riesgo de brote de la enfermedad materna o de una enfermedad activa en el embarazo); factores relacionados con el medicamento (estructura molecular, probabilidad de atravesar la barrera placentaria, tiempo de exposición, momento de administración y efectos clínicamente significativos y a largo plazo sobre el neonato expuesto in utero)114 y otras consideraciones como la experiencia personal con un medicamento determinado, la disponibilidad del medicamento en el país y la clasificación teratogénica.
Los estudios muestran que las mujeres que desean embarazarse y están en tratamiento biológico no tienen tasas de abortos espontáneos y malformaciones congénitas mayores que las gestantes con uso de biológico previamente al embarazo115. Los estudios de mejor calidad que evalúan la seguridad durante el embarazo han sido reportados para algunos medicamentos. La transferencia placentaria más alta se ha reportado para infliximab y adalimumab, baja para etanercept y extremadamente baja para certolizumab116,117. Las recomendaciones acerca de los tiempos de uso de los fármacos durante la gestación obedecen a la evidencia de asociaciones potenciales con eventos adversos fetales118–121.
Según los datos disponibles, el uso materno de agentes anti-TNF es compatible con la lactancia materna122. A pesar de los datos limitados se cree que la transferencia de estos biológicos del suero a la leche materna es mínima (0,1-1%)123,124. Con relación a la seguridad de los biológicos o antirreumáticos sintéticos con blanco dirigido, la evidencia es limitada pero no se han encontrado riesgos en los lactantes, por lo que puede considerarse su uso durante este periodo.
En todos los casos, se insta a los profesionales de atención clínica a revisar el inserto de cada medicamento frente a su seguridad durante la gestación y la lactancia. En la tabla 9 se resumen los cuidados durante el embarazo y la lactancia.
Resumen de las recomendaciones para el uso de terapias biológicas o de antirreumáticos sintéticos con blanco dirigido en el contexto de embarazo y lactancia
| Recomendación | Nivel de acuerdo |
|---|---|
| 41. El certolizumab es el más seguro de los biológicos y puede usarse durante toda la gestación | 100% |
| 42. Otras opciones permitidas durante el embarazo son: infliximab o adalimumab (hasta la semana 20) o etarnecept (hasta la semana 30-32). En caso de ser necesario podrán ser usados durante todo el embarazo haciendo un balance riesgo-beneficio | 93% |
| 43. No utilizar durante el embarazo medicamentos antirreumáticos sintéticos con blanco dirigido o biológicos, como ustekinumab, rituximab, belimumab, secukinumab o tocilizumab, entre otros | 86% |
| 44. Si la madre continúa con el biológico después de las 22 semanas, las vacunas vivas atenuadas (BCG, rotavirus, poliomielitis oral) deberán administrarse al lactante después de los seis meses de edad. Las vacunas inactivas se podrán administrar según los lineamientos del país | 100% |
| 45. El uso de terapias biológicas no se contraindica durante la lactancia | 90% |
La evidencia ha indicado la asociación de la hipogammaglobulinemia con el uso repetido de medicamentos como el rituximab, dependiendo de la dosis acumulada de los fármacos125–127. El tratamiento posterior con rituximab en los pacientes ha resultado en una mayor disminución de los niveles de inmunoglobulina, por lo cual se justifica determinar sus concentraciones y monitorizar la hipogammaglobulinemia persistente.
No existe evidencia suficiente acerca de la medición de inmunoglobulinas previamente al inicio del rituximab. No obstante, en la experiencia del trabajo con inmunólogos clínicos se ha hecho la medición basal de inmunoglobulina G (IgG), como única predictora clínica de infección y una medición posterior para comparar los efectos del medicamento. Esta conducta de medición basal de IgG fue aprobada por el 43% del panel de expertos de este consenso, y el 79% consideró su evaluación previamente a cada ciclo de rituximab. El tema continúa siendo controversial, por lo que se considera que factores como la edad, el antecedente de infecciones recurrentes y las circunstancias clínicas particulares deben guiar el juicio clínico para determinar la periodicidad de la evaluación de inmunoglobulinas en cada caso.
AgradecimientosSe agradece al panel extendido de expertos su participación en el debate y selección final de las recomendaciones: Santiago Bernal Macias, médico internista, reumatólogo, especialista en epidemiología; Juan Carlos Cataño Correa, médico internista e infectólogo; Jeimmy Andrea Chaparro Sanabria, médico reumatólogo; Oscar Jair Felipe Díaz, médico internista, reumatólogo; María Constanza Latorre Muñoz, médico internista, reumatólogo; Diana Marcela Muñoz Urbano, médico reumatólogo; Jorge Luis Quinteros Barrios, médico internista, neumólogo; Luis Orlando Roa Pérez, médico internista, reumatólogo, especialista en economía; Wilmer Gerardo Rojas Zuleta, médico internista, reumatólogo.
Actualización del consensoLa evaluación de la necesidad de actualización de este consenso deberá realizarse en tres años, o antes, de acuerdo con la publicación de evidencia relevante que pueda cambiar las indicaciones. Esta decisión está sujeta a las consideraciones de ASOREUMA.
Declaración de independencia editorialEl desarrollo de la actualización del consenso fue realizado de manera independiente, transparente e imparcial por parte del grupo desarrollador. Las entidades financiadoras no tuvieron injerencia en el contenido de este consenso ni en el documento final.
FinanciaciónSe recibieron tres apoyos financieros irrestrictos de Janssen Colombia, Novartis Colombia y Abbvie S.A.S Colombia.
Conflicto de interesesLa declaración de conflicto de intereses fue realizada por todos los participantes al inicio del proceso y previamente al consenso de expertos. Las declaraciones se presentan en el material suplementario 1. Declaración de intereses.