La medición del filtrado glomerular es el mejor índice de valoración de la función renal. La creatinina sérica es el marcador de filtrado glomerular más utilizado, a pesar de estar sometido a diferentes fuentes de variabilidad. La cistatina C es una proteína de bajo peso molecular propuesta como marcador de función renal más sensible que la creatinina al detectar de forma precoz alteraciones en la función renal. La medida de cistatina C en suero en determinados grupos de pacientes como ancianos, niños o diabéticos parece aportar mayor información que la creatinina. Sin embargo, presenta alteraciones en su concentración sérica por factores diferentes al filtrado glomerular. Actualmente no hay evidencia científica suficiente que justifique el cambio de las ecuaciones de estimación del filtrado glomerular basadas en la concentración sérica de creatinina por la medida de la concentración sérica de cistatina C en la evaluación de la función renal.
Glomerular filtration is the best index for assessing renal function. Despite being subjected to several sources of variability, serum creatinine is the most common glomerular filtration marker in use. Cystatin C is a low molecular weight protein which is more sensitive than creatinine, particularly for the identification of initial small decreases in renal function. The use of cystatin C in certain groups of patients such as elderly, children or diabetics appears to provide more information than creatinine. However, serum cystatin C can be influenced by non-renal factors. Currently, there is not enough scientific evidence to recommend the use of cystatin C to assess renal function instead of creatinine and creatinine equations.
La medición del filtrado glomerular (FG) constituye el mejor índice de valoración de función renal tanto en individuos sanos como en enfermos1. Idealmente, la valoración del FG con una sustancia endógena requiere que dicha sustancia mantenga una producción y concentración constante en plasma, libre de unión a proteínas plasmáticas, baja variación biológica intraindividual, filtrado libre a nivel glomerular, sin reabsorción ni secreción tubular y sin aclaramiento extrarrenal2.
En la práctica clínica se han utilizado tanto marcadores endógenos como exógenos para la valoración del FG. Entre los marcadores exógenos destacan la inulina, reconocida como el patrón áureo, marcadores isotópicos como el 51Cr-EDTA, 125I-iodotalamato, y marcadores no isotópicos como el iohexol, entre otros. Estos marcadores tienen un uso limitado en la práctica clínica habitual, ya que son métodos costosos, incómodos para el paciente y con un consumo de tiempo elevado. Por estas razones, su uso queda relegado a situaciones en las que el FG estimado (ver más adelante) es poco fiable: pacientes con masa muscular alterada (amputados, parálisis), índice de masa corporal extremo (IMC<18,5 ó>35 kg/m2), situaciones que requieren un alto grado de exactitud en la medida del FG, como posibles donantes de riñón, dosificación de fármacos tóxicos excretados por vía renal y en investigación2–4.
La creatinina es el marcador endógeno de FG más utilizado a pesar de estar sometido a diferentes fuentes de variabilidad (edad, dieta, sexo y masa muscular), interferencias analíticas; con relación a la estandarización del procedimiento de medida, actualmente se está avanzando en el uso de la creatinina sérica estandarizada y de los procedimientos de medida con trazabilidad frente al método de referencia espectrometría de masas por dilución isotópica (IMDS)2,5.
La sensibilidad diagnóstica de la concentración sérica de creatinina para identificar estadios tempranos de disfunción renal es insuficiente, ya que su concentración en suero no se eleva hasta que el FG no está por debajo del 50% del límite superior de referencia3. Por otra parte, el aclaramiento de creatinina calculado a partir de la concentración sérica de creatinina y su excreción en orina de 24 horas es el procedimiento mayoritariamente utilizado para la medida del FG. Sin embargo, presenta inconvenientes tales como errores en la recogida de orina de 24 horas y la sobreestimación del FG debido a la secreción tubular de creatinina2. Teniendo en cuenta estas limitaciones, se han desarrollado ecuaciones para la estimación del FG a partir de la concentración de creatinina sérica y de variables demográficas y antropométricas. Las más conocidas y validadas en distintos grupos de población son la de Cockcroft-Gault (C-G)6 y la del estudio Modification of Diet in Renal Disease con 4 variables (MDRD-4)3 para la población adulta, y la de Schwartz7,8 y la de Counahan-Barratt9 para la población infantil. La mayoría de las sociedades científicas recomiendan en la población adulta la utilización de la ecuación MDRD-4 o, si el método de medida de la concentración sérica de creatinina presenta trazabilidad respecto al método de referencia IDMS, se aconseja el uso de la ecuación MDRD-IDMS y Schwartz-IDMS para la población infantil3,5. Las ecuaciones de estimación del FG presentan mayor exactitud diagnóstica para valores entre 15 y 60ml/min/1,73 m2, especialmente la MDRD. En pacientes con nefropatía incipiente o en pacientes sanos con FG superiores o iguales a 90ml/min/1,73 m2, las ecuaciones infraestiman el valor real del FG3. Por lo tanto, la ausencia de un marcador endógeno de FG preciso, exacto y no invasivo continúa siendo un factor limitante en la evaluación de la función renal. En este sentido, se han propuesto proteínas de bajo peso molecular, como la ß2-microglobulina, la proteína ß-traza, la α1-microglobulina y la proteína transportadora de retinol para la valoración del FG10–13. Sin embargo, dichas proteínas no cumplen todos los criterios de un marcador endógeno de FG, ya que su producción no es constante, presentan aclaramiento extrarrenal y están afectadas por desórdenes inmunológicos, vitamínicos y tumorales, entre otros12,13. Por ello la cistatina C, la cual a priori no presenta estas limitaciones, es la proteína de bajo peso molecular que mayor interés ha despertado entre diferentes grupos de trabajo2.
ObjetivoEl objetivo de esta revisón es proporcionar una visión general de los conocimientos actuales de la cistatina C como marcador de función renal. Para ello se realizó una búsqueda bibliográfica en la base de datos MEDLINE durante el periodo de tiempo noviembre de 2008 – julio de 2010.
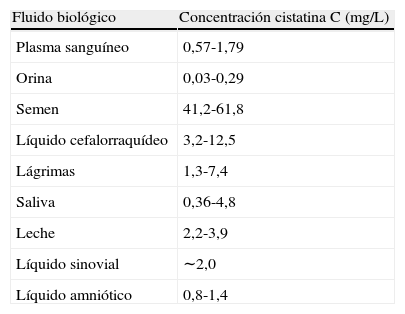
CaracterísticasLa cistatina C es descrita por primera vez en 1961 en líquido cefalorraquídeo y denominada proteína γ-traza. Es una proteína no glucosilada con un peso molecular de 13,3 kDa, constituida por una sola cadena de 120 aminoácidos con dos puentes disulfuro. Es el producto de un gen de mantenimiento, localizado en el cromosoma 20, lo cual explica su síntesis de forma constante en todas las células nucleadas del organismo y su amplia distribución tisular (tabla 1). Pertenece a la familia 2 de la superfamilia de inhibidores de cisteína-proteasas constituida por 11 miembros, de los cuales la cistatina C es el inhibidor endógeno de cisteína proteasa más importante (tabla 2)14.
Concentración de cistatina C en los fluidos biológicos.
| Fluido biológico | Concentración cistatina C (mg/L) |
| Plasma sanguíneo | 0,57-1,79 |
| Orina | 0,03-0,29 |
| Semen | 41,2-61,8 |
| Líquido cefalorraquídeo | 3,2-12,5 |
| Lágrimas | 1,3-7,4 |
| Saliva | 0,36-4,8 |
| Leche | 2,2-3,9 |
| Líquido sinovial | ∼2,0 |
| Líquido amniótico | 0,8-1,4 |
Superfamilia de las cistatinas humanas.
| Familia 1 | Familia 2 | Familia 3 |
| Cistatina A Cistatina B | Cistatina C Cistatina D Cistatina E Cistatina F Cistatina S Cistatina SA Cistatina SN | Quininógenos baja masa molecular Quininógenos alta masa molecular |
Tabla adaptada de Grubb AO14.
La cistatina C desempeña una función protectora mediante la inhibición de las catepsinas (B, H, L y S) que intervienen en el metabolismo intracelular de proteínas, catabolismo del colágeno y degradación de la matriz celular12,14,15. Además, se le ha atribuido un papel defensivo en infecciones bacterianas y víricas16. Debido a su pequeño tamaño y a que su punto isoeléctrico de 9,3 le confiere una carga positiva a pH fisiológico, la cistatina C se filtra libremente por el glomérulo y se reabsorbe en el túbulo proximal donde es catabolizada completamente por las células tubulares por lo que no retorna hacia el torrente sanguíneo. Por consiguiente, en ausencia de daño tubular, su concentración en orina es muy baja, de 0,03 - 0,3mg/L14,16.
La diferencia entre concentración sérica y plasmática de cistatina C no es clínicamente significativa, por lo que a lo largo de la revisión se hará referencia a concentración sérica de cistatina C14.
Debido a sus características fisiológicas y a que su concentración sérica no se afecta significativamente por cambios en la masa muscular, edad, sexo y dieta, la cistatina C se ha propuesto como marcador de FG desde 19852. Además, diversos estudios así como un metaanálisis sugieren su superioridad frente a la creatinina en la estimación del FG2,17.
Factores que afectan a la concentración sérica de cistatina CDel mismo modo que ocurre con la concentración sérica de creatinina, la de cistatina C se ve alterada en estados de disfunción tiroidea. Se han descrito concentraciones elevadas de cistatina C en pacientes con hipertiroidismo y disminuidas en pacientes con hipotiroidismo, respecto al estado eutiroideo, a la inversa de lo que sucede con la creatinina18–20. Esta alteración en la producción de la cistatina C se explicaría como una consecuencia del recambio celular y metabólico presente en la disfunción tiroidea. Por tanto, la función tiroidea debe ser considerada en la interpretación de resultados de la medida de cistatina C20.
Diversos estudios recogen que la concentración de cistatina C se puede elevar en diferentes tumores como el melanoma metastático, mieloma múltiple y el cáncer colorrectal21,22. No obstante es necesario la realización de más estudios en este campo para poder discernir si el aumento de la concentración sérica de cistatina C es debido al proceso tumoral en sí o al deterioro de la función renal15.
Aunque inicialmente se consideró que los estados de inflamación no afectaban a la concentración sérica de cistatina C, en los últimos años diversos estudios muestran una relación entre la inflamación y la concentración de cistatina C. En el estudio de Singh et al23 se indica que la relación entre la cistatina C y los marcadores de inflamación como la proteína C reactiva (PCR) y el fibrinógeno no es independiente de la función renal. Knight et al24 reflejan en su estudio cómo la edad avanzada, el sexo, el sobrepeso, el tabaco y la concentración de PCR están asociados con una concentración de cistatina C elevada independientemente de la función renal. Sin embargo otros autores no encuentran asociación entre el tabaco y la concentración de cistatina C25. Asimismo, se ha descrito una relación entre la interleuquina 6, la PCR o el factor de necrosis tumoral con la cistatina C y el riesgo cardiovascular15. La discrepancia existente entre los diferentes estudios podría explicarse en parte por la heterogeneidad de los mismos (diferencias de tamaño y grupo población estudiada, método de medida del FG).
Se han descrito alteraciones en la concentración de cistatina C con el uso de corticosteroides y ciclosporina A en pacientes que han recibido un transplante15,26.
Consideraciones analíticasEstabilidadLa cistatina C presenta una estabilidad en suero de 2 días a temperatura ambiente, 1 semana a 4°C, 1-2 meses a -20°C y al menos 6 meses a -80°C. Los ciclos de congelación y descongelación no parecen afectar a su estabilidad12,15,27. No existe uniformidad de conceptos respecto a la estabilidad de la cistatina C en orina. Por un lado se indica que la estabilidad no es buena debido a su degradación por enzimas proteolíticas14. Otros autores afirman que la cistatina C es estable en orina y no requiere la adición de conservantes28.
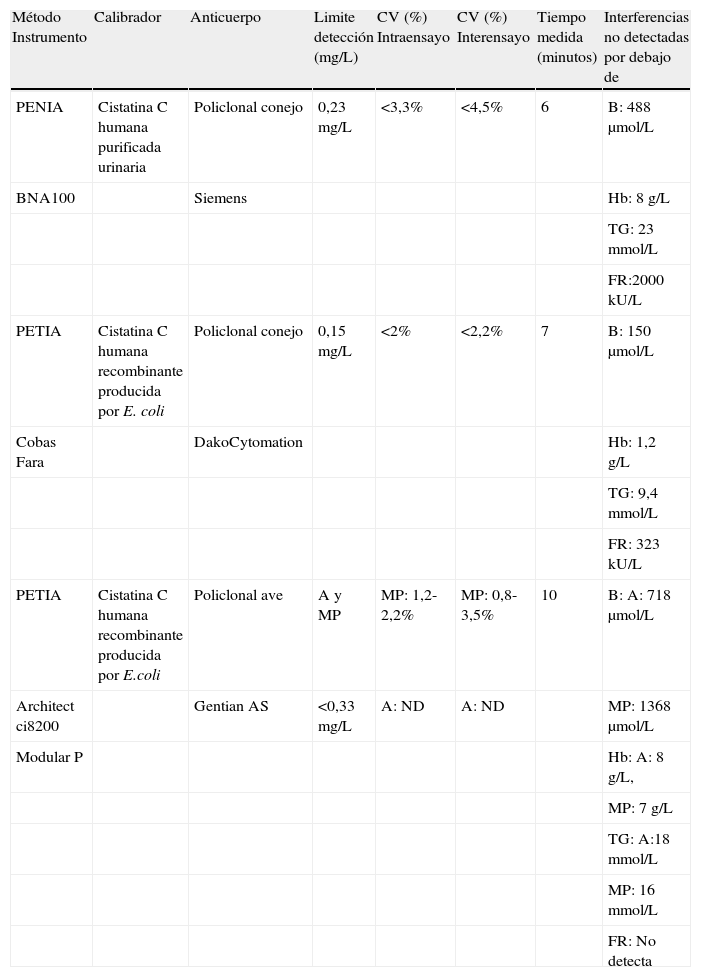
Métodos de medidaEl primer método de medida de cistatina C en fluidos biológicos, desarrollado por Löfberg y Grubb en 1979, estaba basado en una inmunodifusión radial simple con un límite de detección de 0,3mg/L y un coeficiente de variación intraensayo del 11%29. Entre 1979 y 1993 se desarrollaron diferentes métodos de medida basados en enzimoinmunoanálisis, radioinmunoanálisis y fluoroinmunoanálisis, que mejoraban la sensibilidad analítica. En 1994 se desarrollan los primeros métodos de medida de cistatina C automatizados. Son inmunoanálisis basados en una aglutinación en fase líquida de partículas de látex o poliestireno uniformes, unidas covalentemente a anticuerpos policlonales frente a cistatina C. Los principios de medida se denominan PETIA (particle-enhanced turbidimetric immunoassay) y PENIA (particle-enhanced nephelometric immunoassay), basados en turbidimetría y nefelometría, respectivamente. La evolución técnica ha permitido alcanzar una mayor rapidez y precisión en estos métodos respecto a los primeros12.
La mayor parte de los laboratorios disponen en la actualidad de analizadores de bioquímica en los que puede adaptarse la tecnología PETIA fácilmente. En cambio los procedimientos basados en PENIA solo pueden ser desarrollados en un nefelómetro12,15.
Los procedimientos de medida disponibles utilizan anticuerpos distintos (tabla 3). Existen dos tipos: un anticuerpo policlonal de conejo y un anticuerpo policlonal de ave, recientemente introducido15. Dicho anticuerpo presenta la ventaja de no establecer reacciones cruzadas con el factor reumatoide, debido a la distancia filogenética entre aves y mamíferos30. Los calibradores empleados hasta ahora son de naturaleza distinta y están constituidos bien por cistatina C humana purificada urinaria, bien por cistatina C humana recombinante producida por E. coli.
Métodos de medida de cistatina C.
| Método Instrumento | Calibrador | Anticuerpo | Limite detección (mg/L) | CV (%) Intraensayo | CV (%) Interensayo | Tiempo medida (minutos) | Interferencias no detectadas por debajo de |
| PENIA | Cistatina C humana purificada urinaria | Policlonal conejo | 0,23 mg/L | <3,3% | <4,5% | 6 | B: 488μmol/L |
| BNA100 | Siemens | Hb: 8 g/L | |||||
| TG: 23 mmol/L | |||||||
| FR:2000 kU/L | |||||||
| PETIA | Cistatina C humana recombinante producida por E. coli | Policlonal conejo | 0,15 mg/L | <2% | <2,2% | 7 | B: 150μmol/L |
| Cobas Fara | DakoCytomation | Hb: 1,2 g/L | |||||
| TG: 9,4 mmol/L | |||||||
| FR: 323 kU/L | |||||||
| PETIA | Cistatina C humana recombinante producida por E.coli | Policlonal ave | A y MP | MP: 1,2-2,2% | MP: 0,8-3,5% | 10 | B: A: 718μmol/L |
| Architect ci8200 | Gentian AS | <0,33 mg/L | A: ND | A: ND | MP: 1368μmol/L | ||
| Modular P | Hb: A: 8 g/L, | ||||||
| MP: 7 g/L | |||||||
| TG: A:18 mmol/L | |||||||
| MP: 16 mmol/L | |||||||
| FR: No detecta |
Desde 1997 el método PENIA ha sido el más evaluado y frente a él se han comparado la mayoría de los métodos de medida de cistatina C, por lo que es considerado como el método de elección15,26,32. Además, es el único aprobado por la Food and Drug Administration33. En la literatura se recogen estudios de evaluación de los diferentes métodos de medida. Se ha descrito que los procedimientos basados en PENIA son ligeramente superiores a los PETIA, en cuanto a imprecisión, interferencias y límite de detección12. Las diferencias existentes entre los métodos podrían estar más relacionadas con la heterogeneidad de los anticuerpos, concretamente diferencias de afinidad y especificidad de los epítopos, que con el procedimiento de medida (PENIA o PETIA)15,34.
EstandarizaciónEs necesaria la utilización de un material de referencia consensuado internacionalmente para asegurar la correlación entre métodos y la transferibilidad de los resultados. La Federación Internacional de Química Clínica (IFCC) y el Instituto de Referencia de Materiales y Medidas (IRMM) impulsaron la creación de un grupo de trabajo para la estandarización de la cistatina C (WG-SCC 8.3.37). Se elaboró una preparación primaria de referencia con cistatina C humana recombinante pura y homogénea con una concentración de 5200mg/L. Posteriormente se elaboró un material secundario de referencia con una concentración de cistatina C entre 5-6mg/L. La matriz de este material está constituida por una mezcla de sueros humanos preparada de la misma forma que el material certificado de referencia ERM-DA 470, utilizado para la medición inmunoquímica de proteínas humanas en suero35. Finalmente la caracterización del material, denominado ERM-DA471/IFCC, se realizó mediante inmunonefelometría, inmunoturbidimetría e inmunodifusión radial. Dicho material de referencia certificado contiene una concentración de cistatina C de 5,48mg/L con una incertidumbre de medida de 0,15mg/L36.
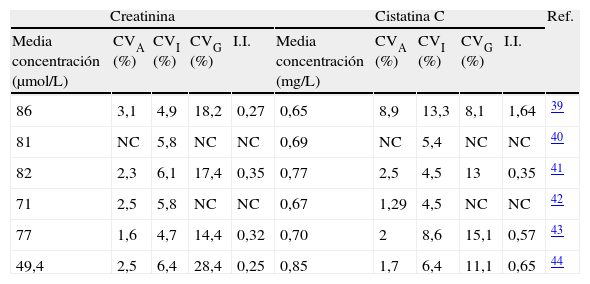
Variación biológicaLa prueba ideal, desde el punto de vista de la variación biológica, debe tener una variación intraindividual pequeña y una individualidad baja para que los valores de referencia poblacionales sean útiles37.
La creatinina posee una variación biológica intraindividual (CVI) menor que la variación biológica interindividual (CVG), de un 5,3% y de un 14,2% respectivamente, y por tanto una marcada individualidad38. Presenta un índice de individualidad (I.I.) bajo (menor de 0,6) lo que supone que los valores de referencia poblacionales no son lo suficientemente sensibles para discriminar entre un estado de salud y de enfermedad. La estratificación en función del sexo y la edad incrementa el I.I. y aumenta la utilidad de los valores de referencia en el diagnóstico y seguimiento.
Existen discrepancias respecto a la CVI y al I.I. publicado para la cistatina C (tabla 4). Por un lado, Keevil et al39 recogen una CVI del 13,3% y un I.I. de 1,64 para la cistatina C, por lo que los valores de referencia basados en la población son útiles y no es necesaria la estratificación. Según los datos de este estudio, si se tienen en cuenta los I.I. de la creatinina y de la cistatina C, ésta última presenta mejores cualidades como marcador de cribado, mientras que la creatinina es mejor parámetro para el seguimiento de cambios en el individuo con enfermedad renal confirmada. Sin embargo, estudios recientes describen que la cistatina C presenta un I.I. bajo, así la cistatina C parece ser al menos igual de útil que la creatinina en el seguimiento de la función renal41,43,44. Estas diferencias entre estudios pueden ser explicadas, en parte, por los distintos métodos de medida de cistatina C empleados.
Variación biológica de cistatina C y creatinina.
| Creatinina | Cistatina C | Ref. | ||||||||
| Media concentración (μmol/L) | CVA (%) | CVI (%) | CVG (%) | I.I. | Media concentración (mg/L) | CVA (%) | CVI (%) | CVG (%) | I.I. | |
| 86 | 3,1 | 4,9 | 18,2 | 0,27 | 0,65 | 8,9 | 13,3 | 8,1 | 1,64 | 39 |
| 81 | NC | 5,8 | NC | NC | 0,69 | NC | 5,4 | NC | NC | 40 |
| 82 | 2,3 | 6,1 | 17,4 | 0,35 | 0,77 | 2,5 | 4,5 | 13 | 0,35 | 41 |
| 71 | 2,5 | 5,8 | NC | NC | 0,67 | 1,29 | 4,5 | NC | NC | 42 |
| 77 | 1,6 | 4,7 | 14,4 | 0,32 | 0,70 | 2 | 8,6 | 15,1 | 0,57 | 43 |
| 49,4 | 2,5 | 6,4 | 28,4 | 0,25 | 0,85 | 1,7 | 6,4 | 11,1 | 0,65 | 44 |
CVA: coeficiente de variación analítica; CVG: coeficiente de variación biológica interindividual; CVI: coeficiente de variación biológica intraindividual; I.I.: índice de individualidad; NC: no consta; Ref: referencia.
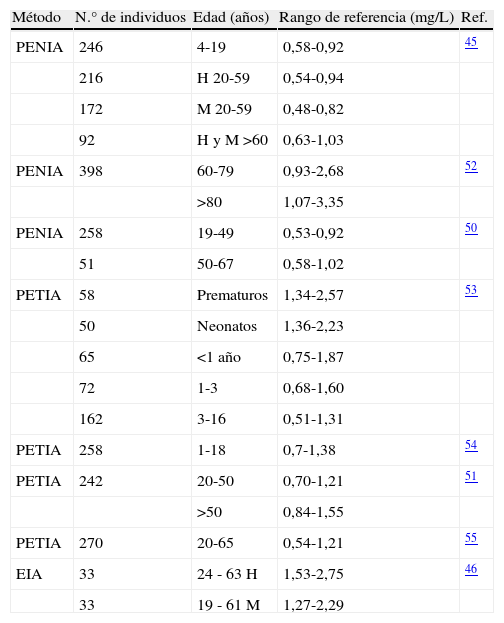
Existe publicado un amplio rango de valores de referencia según la edad y el sexo (tabla 5)45,46. Las diferencias entre los mismos se deben fundamentalmente al método de medida, tipo de anticuerpo, calibrador y población seleccionada. Por ejemplo, los valores de referencia obtenidos con PETIA son de un 20 a un 30% más altos que los obtenidos con PENIA12,15,26.
Valores de referencia de cistatina C.
| Método | N.° de individuos | Edad (años) | Rango de referencia (mg/L) | Ref. |
| PENIA | 246 | 4-19 | 0,58-0,92 | 45 |
| 216 | H 20-59 | 0,54-0,94 | ||
| 172 | M 20-59 | 0,48-0,82 | ||
| 92 | H y M >60 | 0,63-1,03 | ||
| PENIA | 398 | 60-79 | 0,93-2,68 | 52 |
| >80 | 1,07-3,35 | |||
| PENIA | 258 | 19-49 | 0,53-0,92 | 50 |
| 51 | 50-67 | 0,58-1,02 | ||
| PETIA | 58 | Prematuros | 1,34-2,57 | 53 |
| 50 | Neonatos | 1,36-2,23 | ||
| 65 | <1 año | 0,75-1,87 | ||
| 72 | 1-3 | 0,68-1,60 | ||
| 162 | 3-16 | 0,51-1,31 | ||
| PETIA | 258 | 1-18 | 0,7-1,38 | 54 |
| PETIA | 242 | 20-50 | 0,70-1,21 | 51 |
| >50 | 0,84-1,55 | |||
| PETIA | 270 | 20-65 | 0,54-1,21 | 55 |
| EIA | 33 | 24 - 63 H | 1,53-2,75 | 46 |
| 33 | 19 - 61 M | 1,27-2,29 |
H: hombres; M: mujeres; PENIA: particle-enhanced nephelometric immunoassay; PETIA: particle-enhanced turbidimetric immunoassay; Ref: referencia.
En recién nacidos la concentración sérica de cistatina C se encuentra significativamente elevada debido al grado de inmadurez de las nefronas en cuanto a su capacidad de filtración glomerular (la cistatina C no atraviesa la placenta)47. Dicha concentración disminuye progresivamente, alcanzando los valores de adulto en el primer año de vida; por lo tanto, se puede utilizar en niños mayores de un año el mismo rango de referencia que en adultos48.
Un estudio reciente describe un incremento de la concentración sérica de cistatina C con la edad, alcanzando valores superiores al 50% después de los 80 años en ambos sexos y en todos los grupos étnicos estudiados49. A pesar de encontrar en la literatura valores de referencia ligeramente diferentes según la edad y el sexo, la mayoría de los autores recomiendan utilizar un único rango de referencia para edades comprendidas entre 1-50 años, y estratificados por edad en menores de 1 año y en mayores de 50 años45,50,51.
Eficacia diagnósticaJ.F.Roos et al56 recogen en un metaanálisis una mayor sensibilidad (81%) y similar especificidad (88%) diagnóstica en la detección de daños en la función renal para la cistatina C comparada con la creatinina en suero (69 y 88%, respectivamente). Dharnidharka et al17 muestran en otro metaanálisis una correlación con los métodos de referencia de estimación del FG superior para el recíproco de la cistatina C respecto al recíproco de la creatinina (r=0,816 y r=0,742 respectivamente) y una mayor área bajo la curva de rendimiento diagnóstico para la cistatina C de 0,926 (IC del 95%: 0,892-0,960) respecto a 0,837 (IC del 95%: 0,796-0,878) para la creatinina.
Ecuaciones de estimación del filtrado glomerular basadas en la cistatina CEn los últimos años se han desarrollado múltiples ecuaciones matemáticas basadas en la medida de la cistatina C para la estimación del FG. Diversos estudios comparan estas ecuaciones con las de MDRD, C-G y Schwartz57–60. Muchos de ellos muestran su superioridad frente a las basadas en la medición de creatinina y mejor correlación con el método de referencia utilizado para la medida del FG32,58,61. Por el contrario, otros estudios no encuentran diferencias entre el uso de ecuaciones basadas en la medida de cistatina C y de creatinina61.
A pesar de que las ecuaciones de estimación del FG basadas en la medida de cistatina C parecen tener una ventaja limitada frente a las de MDRD, ya que están desarrolladas en poblaciones con un número reducido de casos, pacientes con patologías muy especificas y distintos procedimientos de medida del FG15,61, sí podrían tener utilidad en pacientes trasplantados y pediátricos15,32. En este sentido, Filler et al59 recomiendan el uso de las ecuaciones basadas en la cistatina C para la estimación del FG en niños, en lugar del uso de la ecuación de Schwartz que sobreestima el FG en pacientes con un FG bajo (< 20ml/min/1,73 m2).
Recientemente se ha propuesto el uso de ecuaciones basadas en la medida conjunta de creatinina, cistatina C y variables como la edad, el sexo y laraza, ya que aumentan la exactitud y precisión en la estimación del FG62,63.
Actualmente no existe un acuerdo sobre qué ecuación basada en la medida de cistatina C es la más adecuada para la estimación del FG, debido en parte a la falta de estandarización del método de medida de la cistatina C y a la heterogeneidad de los estudios realizados. En la tabla 6 se muestran ecuaciones de estimación del FG basadas en la medida de la cistatina C junto al tamaño y tipo población estudiada, método de medida de cistatina C y método de referencia utilizado para la medida del FG.
Ecuaciones de estimación del FG basadas sólo en la cistatina C y combinadas con creatinina y variables demográficas.
| Ecuación | Población | Tamaño muestra | Medida FG | Método cistatina C | Ref. |
| FG=127,7 x cistatina C−1,17x edad−0,13x 0,91(si mujer)x 1,06 (si raza negra) | ERC | 3418 | 125I-iodotalamato | PENIA | 63 |
| FG=177,6 x creatinina−0,65 x cistatina C−0,57x edad−0,20 x 0,82 (si mujer) x 1,11 (si raza negra) | 51Cr-EDTA | ||||
| logFG=1,962+[1,123 x log (1/cistatina C)] | Pediátrica con patología renal | 536 | 99mTc-DTPA | PENIA | 59 |
| FG=(84,6/cistatina C) -3,2 | Diabética | 125 | 99mTc-DTPA | PENIA | 66 |
| FG=80,35/cistatina C - 4,32 | Adulta | 123 | 125I-iodotalamato | PENIA | 65 |
| FG=77,24 x cistatina C−1,2623 | Pediátrica y adulta | 100 | Iohexol | PENIA | 64 |
| FG=78/cistatina C+4 | Trasplantados | 25 | 51Cr-EDTA | PENIA | 67 |
| FG=84,69 x cistatina C−1,680 x 1,384 (si< 14 años) | Adulta y pediátrica | 536 | Iohexol | PETIA | 58 |
| FG=87,62 x cistatina C−1,693 x 1,376 (si< 14 años) x 0,94 (si mujer) | |||||
| FG=99,43 x cistatina C−1,5837 | Pediátrica y adulta | 100 | Iohexol | PETIA | 64 |
| FG=79,901 x cistatina C−1,4389 | FG reducido | 94 | Iohexol | PETIA | 68 |
DTPA: dietileno triamino-penta-ácido acético; EDTA: ácido dietilendiaminotetracético; ERC: enfermedad renal crónica; FG: filtrado glomerular; PENIA: particle-enhanced nephelometric immunoassay; PETIA: particle-enhanced turbidimetric immunoassay; Ref: referencia.
Cistatina expresada en mg/L, creatinina en mg/L y edad en años.
Tabla adaptada de Seronie, et al15.
La cistatina C es capaz de detectar el fracaso renal agudo más precozmente que la creatinina, puesto que su concentración sérica se eleva entre 36 y 48 horas antes de que lo haga la concentración de creatinina sérica69,70.
La explicación a esta anticipación diagnóstica se halla en las características fisiológicas de la cistatina C: una vida media más corta que la creatinina y una menor distribución a nivel corporal (la cistatina C se ubica sólo en el volumen extracelular mientras que la creatinina se distribuye por el agua corporal total).
Los pacientes que se hallan en una Unidad de Cuidados Intensivos presentan una gran morbi-mortalidad, por ello es imperativo un diagnóstico precoz del fracaso renal agudo de cara a instaurar precozmente el tratamiento más adecuado.
Estudios recientes han demostrado que en los pacientes críticos, la cistatina C sérica, además de marcador precoz de insuficiencia renal aguda69,71, también es un predictor de mortalidad, independientemente de la función renal medida por creatinina sérica72.
Además, muchos de los pacientes críticos afectos de insuficiencia renal aguda, precisan de terapias sustitutivas continuas; en dichos pacientes el nivel de función renal residual tiene una gran importancia en su seguimiento. Las membranas de alta permeabilidad usadas en estas técnicas eliminan la creatinina sérica pero solo son capaces de eliminar menos de un 30% de la cistatina C. Por lo tanto, la cistatina C correlaciona mejor con el nivel de función renal residual que la creatinina y con el nivel de diuresis, y podría ser útil en la monitorización de los pacientes críticos con insuficiencia renal aguda sometidos a terapias depurativas continuas73,74.
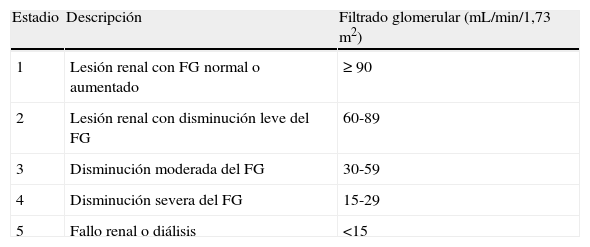
Enfermedad renal crónica en estadios precoces (FG estimado >60ml/min/1,73m2)En los estadios iniciales de la insuficiencia renal, las ecuaciones basadas en la creatinina sérica tienden a infraestimar el FG, por ello no son útiles en el diagnóstico de la enfermedad renal incipiente. En cambio, el potencial de la cistatina C se encuentra en el diagnóstico de la enfermedad renal crónica (ERC) en su segundo estadio (tabla 7). Una proporción pequeña de enfermos con ERC evolucionan hacia enfermedad renal terminal con requerimiento de tratamiento renal sustitutivo. Asimismo, suele asociarse a enfermedad cardiovascular y a una mayor mortalidad, que es más patente a medida que la función renal se halla más deteriorada75,76. El hecho de diagnosticar la ERC en estadios incipientes permite al clínico iniciar de forma precoz toda una serie de medidas encaminadas a frenar o estabilizar la progresión de dicha enfermedad así como tratar a conciencia los factores de riesgo cardiovascular que puedan coexistir en estos pacientes para prevenir los eventos cardiovasculares. De gran interés es el uso de la cistatina C en pacientes con hipertensión arterial77 y con diabetes (tipo 1 y 2)78,79 para un diagnóstico precoz de la enfermedad renal y evitar en lo posible su progresión y su comorbilidad.
Clasificación de los estadios de enfermedad renal crónica.
| Estadio | Descripción | Filtrado glomerular (mL/min/1,73 m2) |
| 1 | Lesión renal con FG normal o aumentado | ≥ 90 |
| 2 | Lesión renal con disminución leve del FG | 60-89 |
| 3 | Disminución moderada del FG | 30-59 |
| 4 | Disminución severa del FG | 15-29 |
| 5 | Fallo renal o diálisis | <15 |
FG: filtrado glomerular.
Tabla adaptada de la guía K/DOQI 2002 de la National Kidney Foundation1.
En el campo de la diabetes mellitus, recientemente se han publicado varios artículos que correlacionan la cistatina C con la albumina en orina y objetivan que ambos marcadores se hallan involucrados independientemente, pero de forma aditiva, en la mortalidad de los pacientes adultos afectos de diabetes mellitus tipo 280. Además, se ha visto que la correlación entre la concentración de cistatina C sérica y la de albúmina en orina ya se detecta aunque la concentración de albúmina en orina no se encuentre alterada o se haya normalizado con tratamiento con fármacos inhibidores del sistema renina-angiotensina-aldosterona, con lo que pequeños cambios en el FG detectados por elevaciones de la concentración sérica de cistatina C nos permiten diagnosticar la afección renal de la diabetes mellitus tipo 2 en fase todavía más incipiente81,82. Finalmente, los pacientes con diabetes mellitus tipo 2 pasan previamente por un periodo de pre-diabetes, en el que pueden presentar ligeras alteraciones de la función renal no detectables por los métodos tradicionales. En el Western New York Study realizado en 1.455 pacientes no diabéticos ni pre-diabéticos con una edad media de 56 años y seguidos durante una media de 2 años, se objetivó que los pacientes que presentaban concentraciones séricas de cistatina C más elevadas en el análisis basal tenían un riesgo 3 veces superior de progresar a pre-diabetes (mientras que la creatinina sérica o la albumina en orina no eran capaces de detectar este deterioro incipiente de la función renal que presagia o se desarrolla en paralelo con la condición de pre-diabetes)83.
Recientemente se han publicado diversos trabajos que demuestran que los pacientes mayores de 65 años y con concentraciones de cistatina C elevadas (con creatinina sérica normal y FG estimado por encima de 60ml/min/1.73m2) a largo plazo presentan mayor morbimortalidad cardiovascular que los pacientes con concentraciones de cistatina C dentro del rango de la normalidad84. Dicho hallazgo ha hecho plantear si existe un enlace fisiopatológico directo entre la cistatina C y la enfermedad cardiovascular; aunque lo más probable es que todo esté relacionado con la detección precoz de la enfermedad renal y las consecuencias cardiovasculares que dicha patología conlleva.
Pacientes pediátricosLa estimación del FG basado en la medida de la creatinina sérica y la talla es un procedimiento generalizado en la evaluación de la función renal en la población infantil85. Sin embargo, está sometido a las limitaciones de la creatinina descritas a lo largo de la revisión. La concentración sérica de cistatina C no se afecta significativamente por los cambios en la masa muscular, lo cual es una ventaja frente a la creatinina en la valoración de la función renal en la población pediátrica86.
La creatinina se halla muy elevada en el neonato debido a la inmadurez renal, disminuye sus valores hasta el año de vida y posteriormente se incrementa hasta la edad adulta, siendo más difícil detectar un deterioro en la función renal con la creatinina que con la cistatina C54.
Diversos estudios recogen la utilidad de la cistatina C en diferentes situaciones clínicas: en el seguimiento de la progresión del fallo renal en ERC, en fases iniciales del fracaso renal agudo y en pacientes con baja masa muscular85,87.
Pacientes con edad avanzadaEl envejecimiento deteriora progresivamente la función renal aunque esto no se acompañe de un incremento simultáneo de la concentración sérica de creatinina, mientras que sí existe un aumento de la concentración sérica de cistatina C88. Por ello, en pacientes de edad avanzada estaría indicado usar ecuaciones para estimar el FG basadas en la creatinina sérica (puesto que incluyen la edad en su estimación y compensaría el discreto aumento de la concentración de creatinina) o ecuaciones basadas en la cistatina C para evaluar el grado de disfunción renal.
Insuficiencia hepáticaEn los pacientes con insuficiencia hepática la creatinina sérica (o las ecuaciones basadas en ella) es un mal indicador para el diagnóstico de insuficiencia renal debido a la malnutrición, baja ingesta proteica, baja masa muscular y falta de conversión de la creatina muscular a creatinina que presentan estos pacientes. Varios trabajos han demostrado la superioridad de la cistatina C respecto a la creatinina (o las ecuaciones basadas en ella) en las poblaciones de pacientes afectos de insuficiencia hepática89,90.
Trasplante renalEn los pacientes sometidos a trasplante renal la medida de la cistatina C podría ser de utilidad en las siguientes situaciones:
- -
En el pos-trasplante renal inmediato: pasados los primeros 8 días se ha visto que es más eficiente la cistatina C que la creatinina para la detección de un retraso en la función del injerto (en los primeros días post-trasplante la cistatina C no sería útil debido a las altas dosis de corticoesteroides administradas)91,92.
- -
En el diagnóstico de un rechazo agudo: por su precocidad en la detección de la insuficiencia renal aguda.
- -
En la detección precoz de la nefropatía crónica del injerto; aunque en este punto hay controversia puesto que se han publicado artículos que demuestran su superioridad respecto a la creatinina o a las ecuaciones basadas en ésta93,94 mientras que algún otro artículo no encuentra ventajas respecto a la creatinina sérica95.
En los pacientes sometidos a hemodiálisis convencional de bajo flujo la cistatina C aumenta durante la sesión de diálisis, lo cual puede ser debido al paso de esta proteína desde el compartimiento intersticial al plasmático debido a la hemoconcentración y a que no es dializable (a diferencia de la urea y de la creatinina que tienen un peso molecular menor). Por esto, a diferencia de la creatinina sérica, la cistatina C sérica refleja la función renal residual incluso después de la hemodiálisis en los pacientes con insuficiencia renal crónica terminal96. Las técnicas de hemodiálisis que utilizan membranas de alta permeabilidad y se basan sobre todo en el transporte convectivo, como la hemofiltración on-line, permiten una mayor eliminación de la cistatina C97. En los pacientes en diálisis peritoneal se ha objetivado que mientras la urea se elimina del plasma principalmente a través de la membrana peritoneal, la cistatina C se elimina principalmente por aclaramiento renal en pacientes con función renal residual98.
En este sentido, Hoek et al describieron una ecuación simple obtenida a partir de la concentración de cistatina C sérica para estimar la función renal residual en los pacientes en hemodiálisis y en diálisis peritoneal que era más exacta y precisa que la ecuación de MDRD y sugirieron que podría ser útil cuando la recolección de orina de 24 horas no fuera posible o fuera dificultosa99.
Pacientes oncológicosEn los pacientes afectos de neoplasias sólidas o cáncer hematológico, la función renal debe monitorizarse estrechamente para reconocer la insuficiencia renal lo antes posible de cara a evitar el acúmulo de los agentes quimioterápicos y sus metabolitos. Además, los pacientes con cáncer presentan una disminución de la ingesta proteica y una pérdida de la masa muscular que pueden provocar una concentración sérica de creatinina dentro del rango normal a pesar de la disminución de la función renal. Se han realizado diferentes estudios para evaluar la utilidad de la cistatina C en los pacientes neoplásicos y conseguir una valoración más exacta de la función renal, sin embargo los resultados obtenidos son controvertidos. Hay estudios que demuestran que la cistatina C sérica es mejor marcador de función renal que la creatinina sérica en pacientes neoplásicos y que no se afecta por la progresión tumoral (presencia o no de metástasis) ni por las distintas estrategias quimioterápicas usadas100,101. Otros estudios no hallan una mayor sensibilidad y especificidad de la cistatina C respecto a las ecuaciones basadas en creatinina sérica en pacientes neoplásicos, aunque como crítica a estos estudios destacar que no usan un método de referencia para estimar simultáneamente el FG (como la inulina o radioisótopos) sino que usan ecuaciones basadas en la creatinina o en el aclaramiento de creatinina102. En los pacientes pediátricos con cáncer la concentración sérica de la cistatina C es mucho más exacta y precisa para diagnosticar un deterioro de la función renal que la creatinina sérica o las ecuaciones basadas en ella103.
Otras situaciones clínicas donde las ecuaciones de filtrado glomerular basadas en la creatinina sérica no son útilesActualmente se están realizando muchos trabajos en grupos poblacionales donde las ecuaciones basadas en la creatinina sérica no son fiables. En este sentido, la cistatina C ha demostrado su superioridad sobre las ecuaciones basadas en la creatinina en pacientes con pesos extremos (en anorexia y obesidad)104,105, en amputados y en pacientes con enfermedades neuromusculares106, y en el embarazo107. También es útil en la detección precoz de la insuficiencia renal en los pacientes afectos del virus de la inmunodeficienca humana (VIH)108.
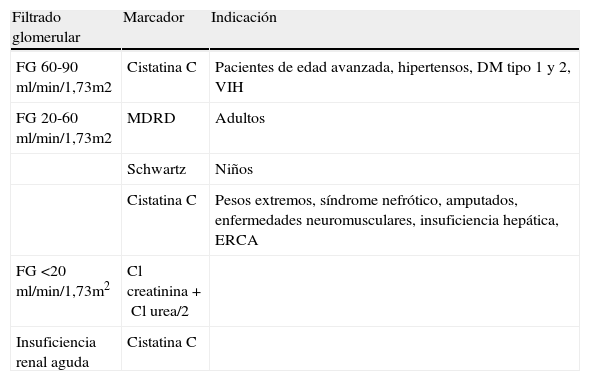
En la tabla 8, adaptada de Herget-Rossental61, se exponen aquellas situaciones y grupos de pacientes en los que la cistatina C realmente aporta un valor añadido en el diagnóstico de la insuficiencia renal.
Uso de la cistatina C según el filtrado glomerular.
| Filtrado glomerular | Marcador | Indicación |
| FG 60-90 ml/min/1,73m2 | Cistatina C | Pacientes de edad avanzada, hipertensos, DM tipo 1 y 2, VIH |
| FG 20-60 ml/min/1,73m2 | MDRD | Adultos |
| Schwartz | Niños | |
| Cistatina C | Pesos extremos, síndrome nefrótico, amputados, enfermedades neuromusculares, insuficiencia hepática, ERCA | |
| FG <20 ml/min/1,73m2 | Cl creatinina+Cl urea/2 | |
| Insuficiencia renal aguda | Cistatina C |
Cl: aclaramiento; DM: diabetes mellitus; ERCA: enfermedad renal crónica agudizada; FG: fitrado glomerular; VIH: virus de la inmunodeficiencia humana.
Tabla adaptada de Herget-Rossental, et al61.
A pesar de que la cistatina C no contribuye todavía a la estratificación de la ERC, la medida de su concentración sérica por sí sola proporciona una estimación del FG al menos tan exacta como la de la creatinina ajustada por edad, sexo y raza en la población con ERC63.
Constituye una herramienta diagnóstica superior a la creatinina en la detección de una alteración precoz de la función renal (FG 60-90mL/min/1,73m2)17,56,61. La medida de la cistatina C añade información de interés en pacientes con valores de FG entre 20 y 60mL/min/1,73m2 donde el uso de la ecuación MDRD es inadecuado (individuos con alteraciones en la masa muscular, síndrome nefrótico, insuficiencia hepática y enfermedad renal crónica agudizada)61. Además, parece aportar información útil en individuos de edad avanzada, pacientes diabéticos y portadores del VIH. La cistatina C proporciona ciertas ventajas respecto a la creatinina y a las ecuaciones de estimación de FG basadas en ella en la población pediátrica. Asimismo, es un marcador precoz en la detección de la insuficiencia renal aguda.
Entre las limitaciones de su uso cabe destacar la alteración de su concentración por factores distintos al FG como la disfunción tiroidea, cáncer y tratamientos farmacológicos.
Actualmente no existe evidencia científica suficiente que justifique la sustitución de la creatinina y sus ecuaciones de estimación del FG por la cistatina C en la evaluación de la función renal. Es necesaria la realización de estudios multicéntricos y de coste-eficacia para optimizar el uso de la cistatina C y proporcionar estimaciones más exactas del FG2.