Cuatro sociedades científicas españolas, organizadoras de programas de garantía externa de la calidad crearon un comité de expertos interdisciplinario, con el objeto de presentar a los laboratorios las especificaciones mínimas consensuadas, para asegurar una prestación equivalente en todo el territorio español.
Material y métodosLos programas estudiados son los de la Asociación Española de Farmacéuticos Analistas-Asociación Española de Biopatología Médica, la Sociedad Española de Hematología y Hemoterapia y la Sociedad Española de Bioquímica Clínica y Patología Molecular. Se tomaron los datos de los años 2005 y 2006, en los que se obtuvieron 1.262.623 resultados que corresponden a 3.688 laboratorios y 24 períodos. Para cada magnitud se calculó la diferencia absoluta entre el resultado y el valor de comparación (media del grupo homogéneo), expresada en porcentaje, a lo que se denominó «error». Se confeccionó la distribución de errores y se eligió el percentil 95 de la distribución de errores restante, como «especificación candidata». Este valor se comparó con especificaciones preceptivas en Alemania y Estados Unidos y, en caso de ser superior a cualquiera de ellas, se incrementó el valor de la especificación candidata reiteradamente, hasta que el 90% de los laboratorios participantes en los programas tuviera el 75% de sus resultados dentro del valor resultante. Este valor se consideró como la especificación y se cerró el proceso.
Resultados y conclusionesSe definen especificaciones para 37 magnitudes biológicas (3 de inmunología, 5 de fármacos, 15 de hormonas y marcadores tumorales, 14 de hematimetría y coagulación). Las especificaciones propuestas son una declaración de mínimos que todo laboratorio debería cumplir, con objeto de asegurar prestaciones analíticas de utilidad clínica. Cuando un laboratorio no pueda alcanzar estas especificaciones de la calidad, es decir, si el error de sus resultados al participar en un programa de garantía externa de la calidad excede estas especificaciones mínimas, debe revisar inmediatamente el procedimiento afectado y tomar medidas correctivas, si procede.
An Interdisciplinary Expert Committee was created by four Spanish Scientific Societies, organisers of external quality assurance programs, to provide laboratories a consensus of minimum analytical quality specifications with the aim of assuring similar analytical performance all over Spain.
Material and methodA total of 1,262,623 results was obtained from 3688 laboratories and 24 periods studied (2005 and 2006). For each analyte, the absolute difference between the result and the comparative value (peer group mean), expressed in percentage, was calculated and named “error”. From the error frequency distribution, the 95 percentile was considered as “candidate specification”. This value was compared with the specification used in Germany and USA and, in the case of being higher than one of them, the “candidate specification” value was increased iteratively, until 90% of participating laboratories had 75% of their results within the “candidate specification”. This value was considered to be the specification and the process ended.
Results and conclusionSpecifications for 37 analytes (3 immunology, 5 therapeutic drug monitoring, 15 hormones and tumour markers, 14 haematology and coagulation are proposed. They are considered to be the minimum level of quality that each laboratory had to reach, to assure common analytical performance. If the results in the external quality assurance program exceed these specifications, an immediate review should be made and, if necessary, corrective actions should be taken.
En el año 2006, 3 sociedades científicas organizadoras de programas de garantía externa de la calidad con implantación en España (Asociación Española de Biopatología Médica [AEBM], Asociación Española de Farmacéuticos Analistas [AEFA], y Sociedad Española de Bioquímica Clínica y Patología Molecular [SEQC]) crearon un comité de expertos interdisciplinario para establecer las especificaciones mínimas de la calidad analítica1, y por debajo de éstas no se podría garantizar la utilidad clínica de las determinaciones. En un primer documento se presentaron los datos para 24 magnitudes bioquímicas básicas2.
El modelo utilizado está fundamentado en la Conferencia de Consenso Internacional de Estocolmo3,4, que establece una jerarquía de criterios para definir especificaciones de la calidad; uno de éstos se deriva de los datos obtenidos en programas de garantía externa de la calidad, y otro considera los utilizados en normativas del laboratorio clínico5.
En el año 2008 se integró una cuarta organización, la Sociedad Española de Hematología y Hemostasia (SEHH), que sumó 2 expertos al grupo de trabajo.
El punto de partida del presente documento son los datos procedentes de los programas de garantía externa de la calidad de AEFA-AEBM, SEHH y SEQC, indicativos de las prestaciones de los métodos analíticos actuales, en términos de inexactitud de los resultados de cada laboratorio. La filosofía de los autores ha sido estudiar las prestaciones en España, definir especificaciones mínimas de la calidad analítica unificadas y difundir la necesidad de corrección inmediata cuando no se alcanzan los valores propuestos.
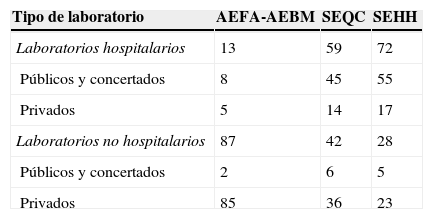
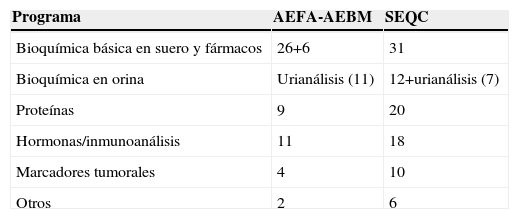
La organización de los programas es muy similar entre las sociedades (tabla 1). El tratamiento estadístico de los resultados se realiza de la misma forma: cómputo global, estratificado por método analítico y por instrumento. La distribución de participantes se complementa en titularidad y sector (tabla 2) y el número de magnitudes biológicas incluidas en los programas es similar (tabla 3).
Organización de los programas
|
Distribución de participantes expresada en porcentajes
| Tipo de laboratorio | AEFA-AEBM | SEQC | SEHH |
| Laboratorios hospitalarios | 13 | 59 | 72 |
| Públicos y concertados | 8 | 45 | 55 |
| Privados | 5 | 14 | 17 |
| Laboratorios no hospitalarios | 87 | 42 | 28 |
| Públicos y concertados | 2 | 6 | 5 |
| Privados | 85 | 36 | 23 |
AEFA-AEBM: Asociación Española de Farmacéuticos Analistas-Asociación Española de Biopatología Médica; SEHH: Sociedad Española de Hematología y Hemostasia; SEQC: Sociedad Española de Bioquímica Clínica y Patología Molecular.
Número de magnitudes incluidas en los programas (período 2005 y 2006)
| Programa | AEFA-AEBM | SEQC |
| Bioquímica básica en suero y fármacos | 26+6 | 31 |
| Bioquímica en orina | Urianálisis (11) | 12+urianálisis (7) |
| Proteínas | 9 | 20 |
| Hormonas/inmunoanálisis | 11 | 18 |
| Marcadores tumorales | 4 | 10 |
| Otros | 2 | 6 |
AEFA-AEBM: Asociación Española de Farmacéuticos Analistas-Asociación Española de Biopatología Médica; SEQC: Sociedad Española de Bioquímica Clínica y Patología Molecular.
El objeto del trabajo es presentar a los laboratorios las especificaciones mínimas consensuadas, para asegurar una prestación equivalente en todo el territorio español. El documento se presentará también a la Administración Pública Estatal y Autonómica y a las entidades evaluadoras de la calidad, para que se utilice como referencia.
Material y métodosLos programas estudiados en este trabajo, organizados por las 4 sociedades científicas (AEFA-AEBM, SEHH y SEQC), que cumplen con las recomendaciones de la International Federation of Clinical Chemistry (IFCC) como programas de garantía externa de la calidad6, tienen las siguientes características comunes:
- •
Tienen más de 25 años de experiencia
- •
Cumplen la guía ISO/IEC 43-17
- •
Son independientes de empresas comerciales
- •
Realizan formación sobre temas de calidad (promueven la implantación de sistemas de gestión de la calidad entre sus socios)
- •
Definen las especificaciones de la calidad dentro de cada organización.
Se tomaron los datos de 2 años (2005 y 2006), en los que se obtuvieron 1.262.623 resultados que corresponden a 3.688 laboratorios y 24 períodos.
Los resultados que obtuvieron todos los laboratorios participantes en los 3 programas durante los años 2005 y 2006 se almacenaron en una base de datos denominada datum8.
El trabajo se realizó en varias etapas: en la primera (año 2007) se incluyeron 24 magnitudes bioquímicas y los resultados se publicaron previamente2. En la segunda (año 2008) se añadieron 37 magnitudes biológicas (3 de inmunología, 5 de fármacos, 15 de hormonas y marcadores tumorales y 14 de hematimetría y coagulación); ésta es la etapa que se describe en el presente documento. En la tercera etapa se estudiarán las magnitudes no comunes a los diversos programas de las 4 sociedades.
Las variables del datum fueron identificación numérica del laboratorio, ciclo (año), período, nombre de la magnitud, resultado del laboratorio y valor de comparación. Éste se definió mediante la media global de los resultados de los laboratorios, al analizar una misma muestra, en las magnitudes con resultados similares entre los diversos métodos analíticos. En las magnitudes con resultados muy dispares entre distintos métodos o instrumentos analíticos, el valor de comparación fue la media del grupo específico.
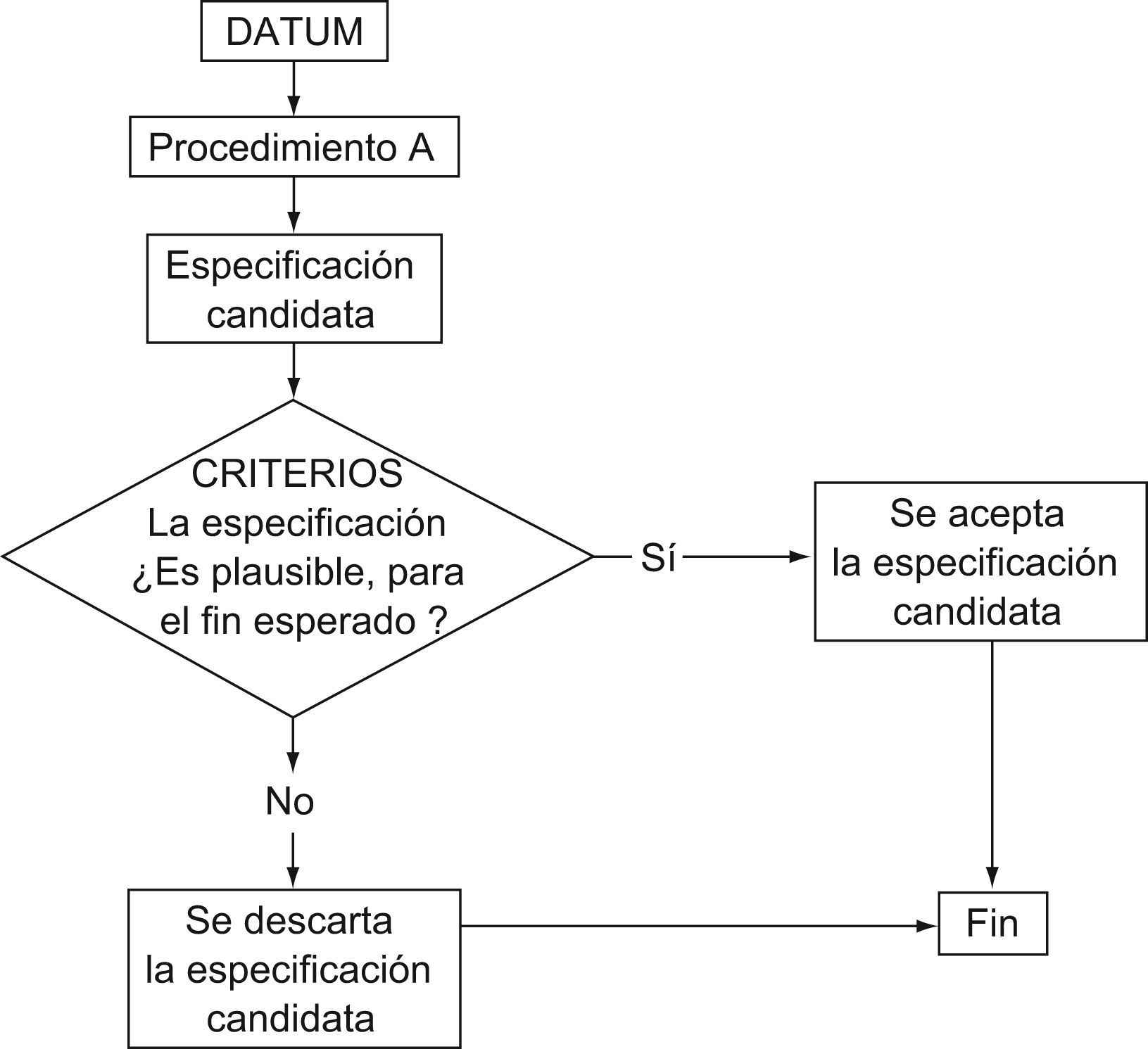
En la primera etapa se utilizó un modelo de cálculo sencillo (denominado en este artículo como procedimiento A), que se aplicó a cada magnitud y cada resultado conforme al siguiente esquema:
- •
Cálculo del error (diferencia absoluta entre el resultado y el valor de comparación, expresada en porcentaje)
- •
Confección de la distribución de errores
- •
Segregación de la distribución del 5% de los errores con mayor valor
- •
Elección del percentil 95 de la distribución de errores restante, como valor de la especificación
- •
Redondeo de la especificación a valores enteros
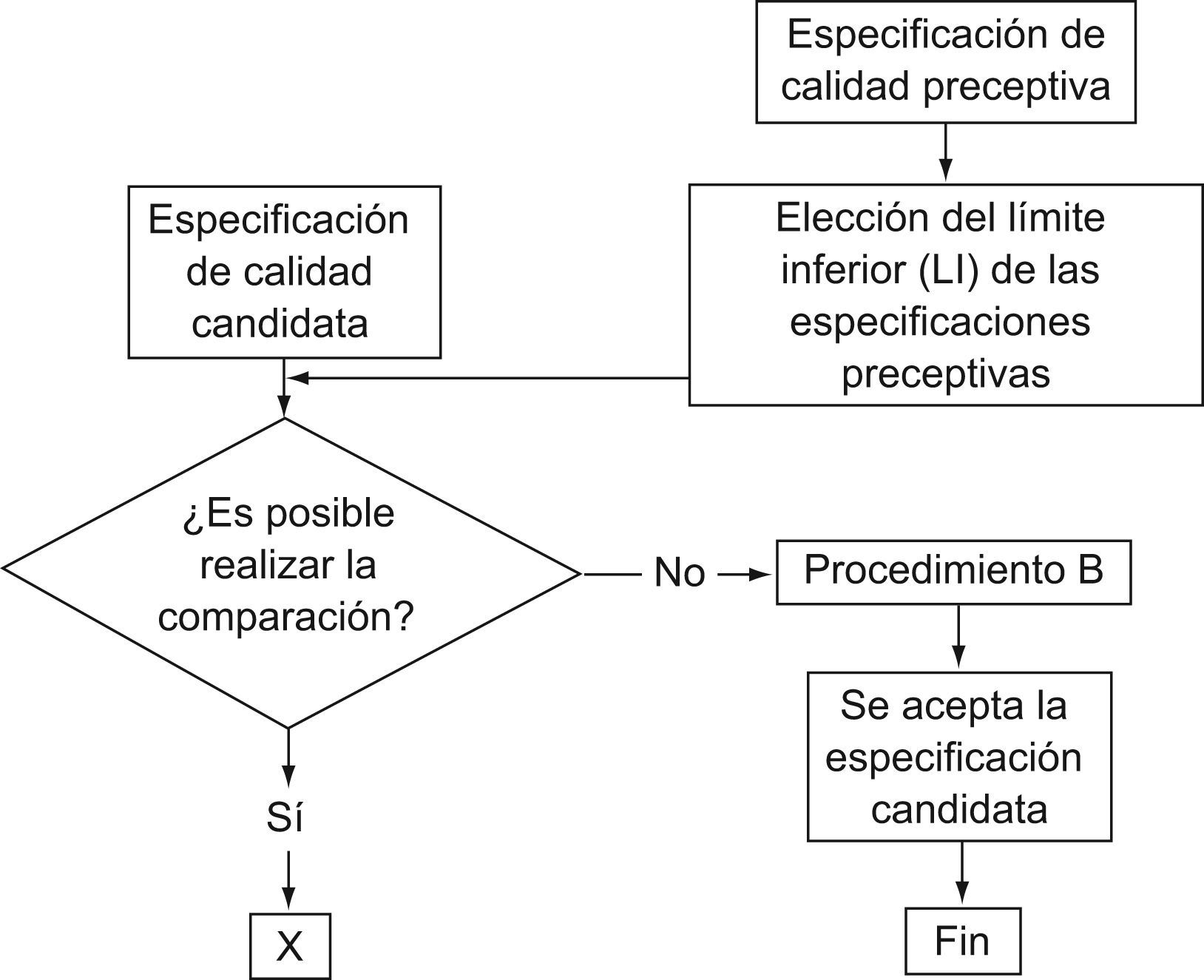
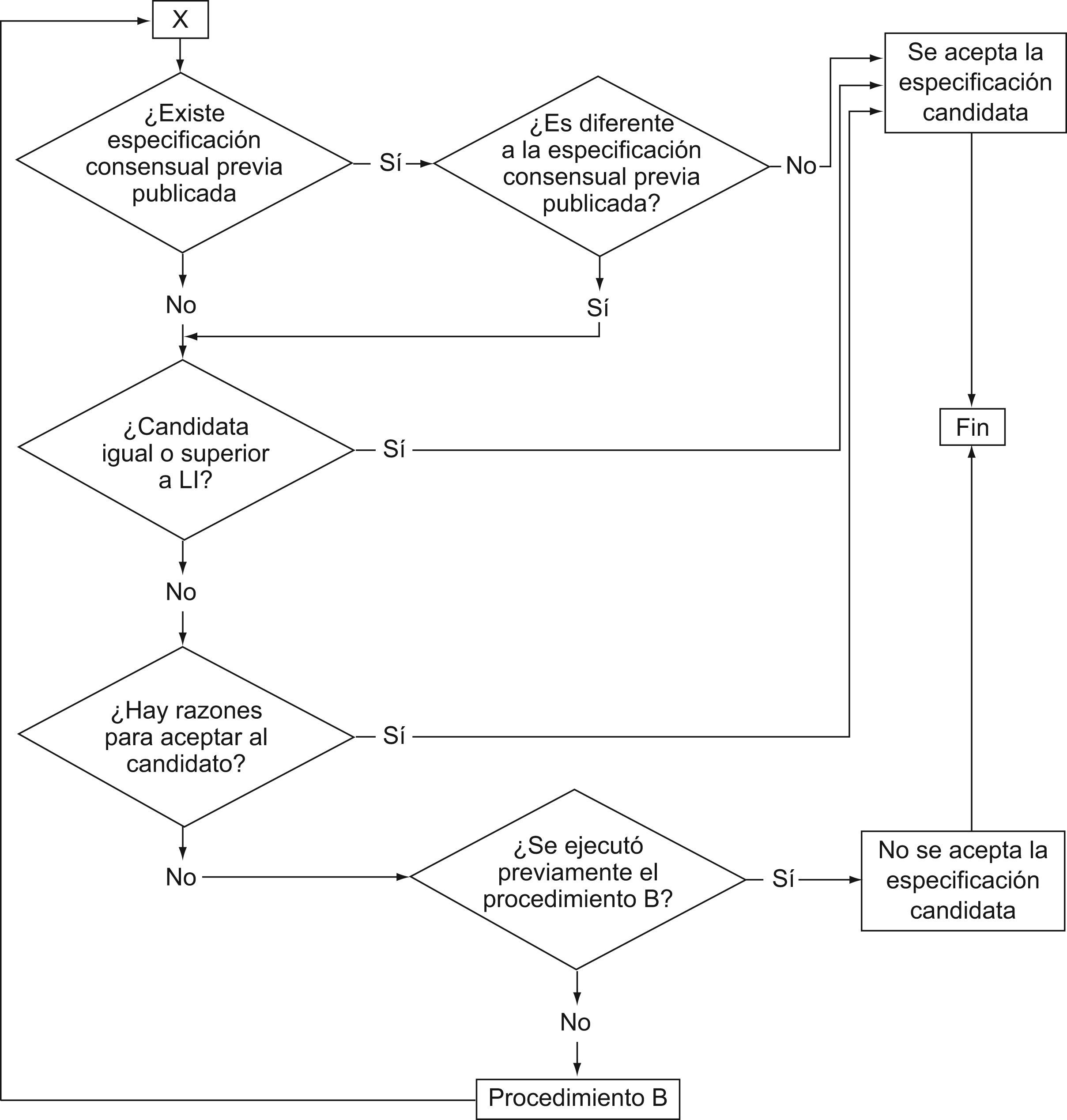
En la segunda etapa se empleó un modelo más complejo consistente en comparar, para cada magnitud, la especificación «candidata» resultante del modelo anterior con especificaciones de obligado cumplimiento en Alemania9 y EE. UU.10 (figs. 1–3). Si son del mismo orden, en función del criterio previamente decidido por el comité de expertos que se muestra en las figuras 2 y 3, se acepta la especificación candidata y el cálculo finaliza.
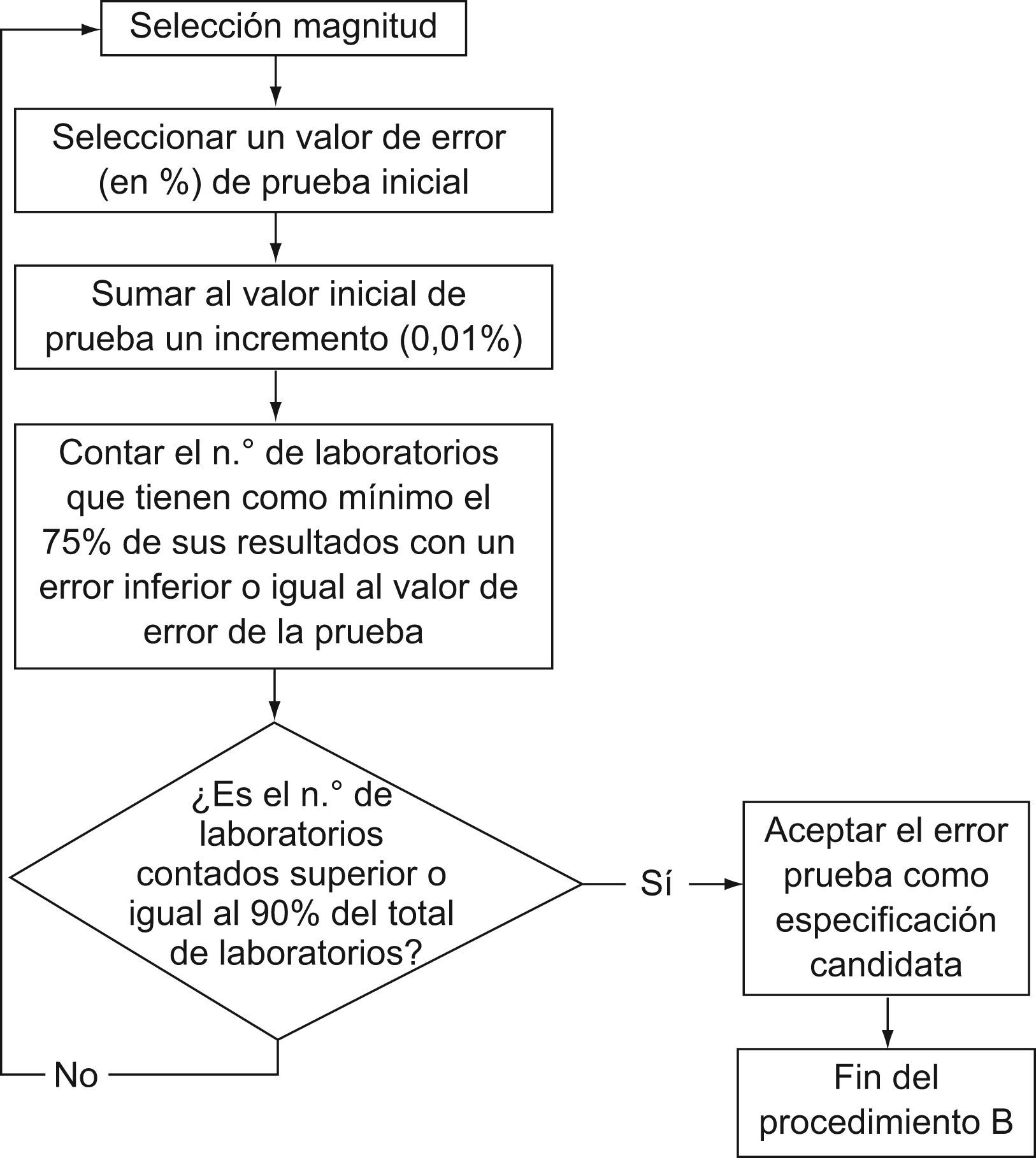
Si la candidata resulta más restrictiva y, a juicio del comité, no es plausible su utilización en forma generalizada por parte de los laboratorios clínicos españoles, se acopla un segundo cálculo (procedimiento B en figura 4), consistente en incrementar el valor de la especificación candidata (valor «error prueba») y contar el número de laboratorios que obtienen el 75% de sus resultados dentro de esta nueva especificación. Este proceso se reitera hasta que el 90% de los laboratorios participantes en los programas tenga el 75% de sus resultados dentro del valor error-prueba. Este valor se considera ahora como la especificación y se cierra el proceso.
ResultadosPara cada magnitud, se obtuvieron entre 5.158 y 54.528 resultados (34.523 de media).
Las especificaciones preliminares para 24 magnitudes de bioquímica básica se debatieron en el año 2007 en el I Congreso Nacional del Laboratorio Clínico y, a nivel internacional, en el 20th International Congress of Clinical Chemistry and Laboratory Medicine (Fortaleza, Brasil 2008)11. También se publicaron en la Revista del Laboratorio Clínico, como se ha mencionado anteriormente2.
Las especificaciones obtenidas para las 37 magnitudes de la segunda etapa se presentaron en el Simposio de Organizadores Europeos de Programas de Garantía Externa de la Calidad en el Laboratorio Clínico (Symposium, Berlín 2009)12 y se debatieron en el 2009 en el III Congreso Nacional del Laboratorio Clínico.
Del total de 61 magnitudes estudiadas, en 31 se obtuvieron las especificaciones con el procedimiento A y en 30 se obtuvieron con el procedimiento B. Las 24 magnitudes de bioquímica básica estudiadas en la primera etapa obtuvieron las mismas especificaciones cuando se sometieron al modelo de cálculo utilizado en la segunda etapa.
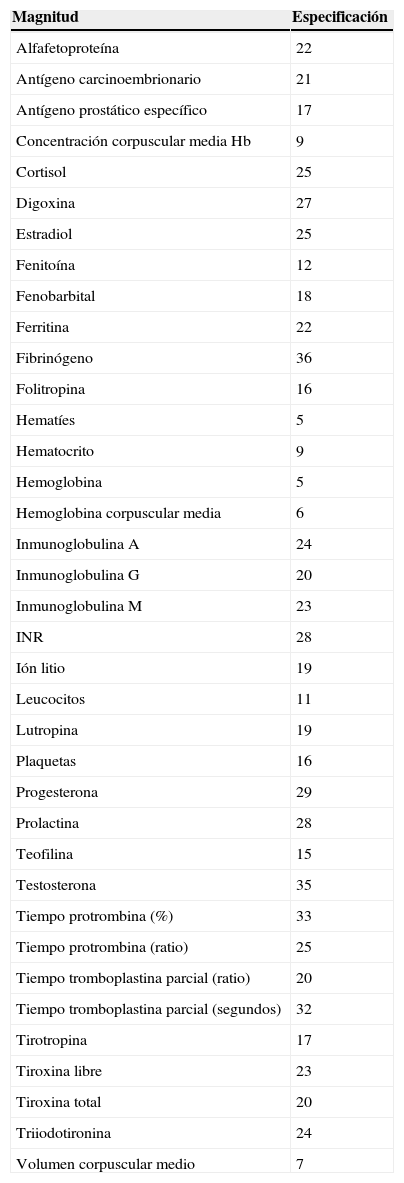
Las especificaciones propuestas para las 37 magnitudes de la segunda etapa se muestran en la tabla 4.
Consenso especificaciones mínimas (magnitudes estudiadas en la segunda etapa)
| Magnitud | Especificación |
| Alfafetoproteína | 22 |
| Antígeno carcinoembrionario | 21 |
| Antígeno prostático específico | 17 |
| Concentración corpuscular media Hb | 9 |
| Cortisol | 25 |
| Digoxina | 27 |
| Estradiol | 25 |
| Fenitoína | 12 |
| Fenobarbital | 18 |
| Ferritina | 22 |
| Fibrinógeno | 36 |
| Folitropina | 16 |
| Hematíes | 5 |
| Hematocrito | 9 |
| Hemoglobina | 5 |
| Hemoglobina corpuscular media | 6 |
| Inmunoglobulina A | 24 |
| Inmunoglobulina G | 20 |
| Inmunoglobulina M | 23 |
| INR | 28 |
| Ión litio | 19 |
| Leucocitos | 11 |
| Lutropina | 19 |
| Plaquetas | 16 |
| Progesterona | 29 |
| Prolactina | 28 |
| Teofilina | 15 |
| Testosterona | 35 |
| Tiempo protrombina (%) | 33 |
| Tiempo protrombina (ratio) | 25 |
| Tiempo tromboplastina parcial (ratio) | 20 |
| Tiempo tromboplastina parcial (segundos) | 32 |
| Tirotropina | 17 |
| Tiroxina libre | 23 |
| Tiroxina total | 20 |
| Triiodotironina | 24 |
| Volumen corpuscular medio | 7 |
Magnitudes en orden alfabético, especificación expresada en porcentajes.
Hb: hemoglobina; INR: cociente internacional normalizado
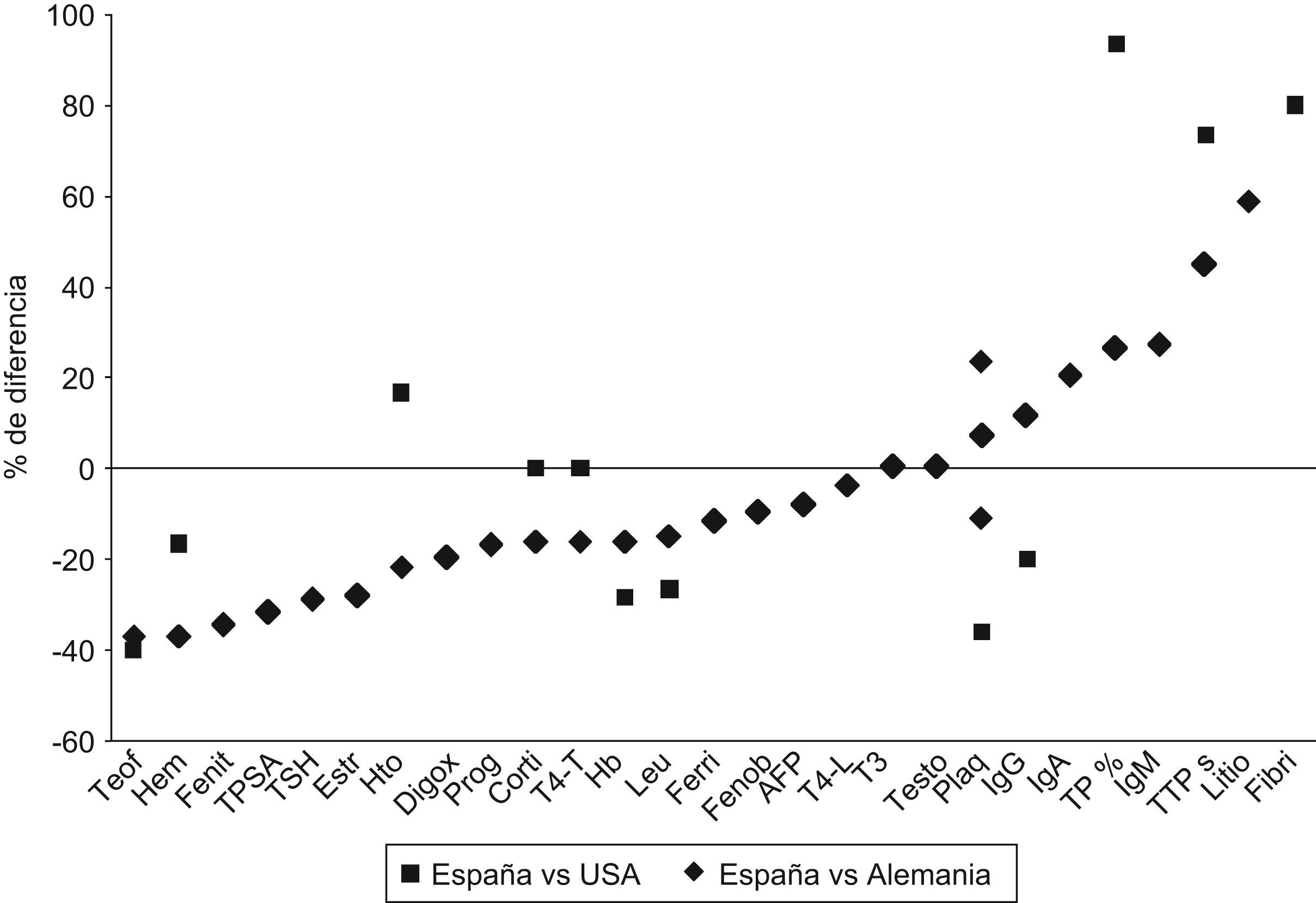
Las diferencias entre las especificaciones propuestas y las de Alemania y EE. UU. se exponen en la figura 5.
Por ejemplo, para hematocrito, la especificación «candidata» según el procedimiento A es del 7%; se compara con la especificación alemana (9%) y la norteamericana (6%) (fig. 2). Ésta es el límite inferior de una especificación preceptiva; como que la candidata la supera, se acepta la candidata como especificación en España (fig. 3).
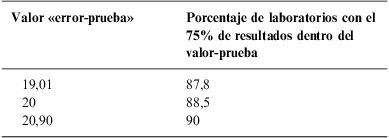
Otro ejemplo es el antígeno carcinoembrionario, en que la especificación candidata (19%), proveniente del procedimiento A (fig. 1), es susceptible de compararse frente a la única preceptiva (alemana) (fig. 2), que es del 24%. Como resultado de la comparación, al ser la candidata inferior a la perceptiva, y a juicio del comité de expertos no haber razones para aceptar esa divergencia (fig. 3), se ejecuta el procedimiento B (fig. 4). En la tabla 5 se muestra cómo, al incrementar paulatinamente el valor «error-prueba» se incrementa el porcentaje de laboratorios con el 75% de los resultados dentro del valor «error-prueba» hasta llegar al 90%, objetivo del procedimiento B.
Relación entre el valor «error-prueba» y el porcentaje de laboratorios con el 75% de resultados dentro del valor-prueba en la determinación de antígeno carcinoembrionario
| Valor «error-prueba» | Porcentaje de laboratorios con el 75% de resultados dentro del valor-prueba |
| 19,01 | 87,8 |
| 20 | 88,5 |
| 20,90 | 90 |
El último «valor prueba» cumple el criterio del comité de expertos y, una vez redondeado (del 20,9 al 21%), constituye la especificación de este consenso español para el antígeno carcinoembrionario.
DiscusiónEl trabajo del comité de expertos se ha podido realizar gracias a las características comunes de los programas de garantía externa de la calidad de las 4 sociedades, que las hacen compatibles.
El modelo de cálculo permite combinar no sólo el factor resultado (procedimiento A), sino también el factor laboratorio (procedimiento B), y es comparable con especificaciones de obligado cumplimiento en otros países (Alemania y EE. UU.). Es un criterio del comité aplicar un modelo transparente (se trabaja con los resultados reales de los laboratorios españoles) y responsable (se averigua cuántos laboratorios quedarían afuera de las especificaciones propuestas).
El 70% de los laboratorios contesta más del 75% de las respuestas posibles, con lo que se obtiene un promedio de 34.523 resultados por magnitud, como se ha mencionado anteriormente. Esto garantiza la representatividad del modelo de cálculo utilizado. Los resultados obtenidos se pueden considerar una foto real de la situación a nivel nacional.
Las especificaciones propuestas son comparables a las especificaciones utilizadas en Alemania y EE. UU., como se ilustra en la figura 5. En ella se muestran las magnitudes ordenadas según el valor de las discrepancias entre las especificaciones propuestas en este documento y las utilizadas en Alemania y EE. UU.
ConclusionesÉste es un documento de consenso de 4 sociedades científicas nacionales del ámbito del laboratorio clínico, que versa sobre especificaciones de la calidad basadas en el «estado del arte» de los resultados de los programas de garantía externa de la calidad de AEFA-AEBM, SEHH y SEQC.
El modelo actual es el fruto de una estrategia diseñada por un comité de expertos multidisciplinario; está fundamentado en la realidad constatada a través de los programas de garantía externa de la calidad españoles, y es comparable con especificaciones de obligado cumplimiento en países desarrollados.
Las especificaciones propuestas son una declaración de mínimos que todo laboratorio debería cumplir, con objeto de asegurar prestaciones analíticas de utilidad clínica. Cuando un laboratorio no pueda alcanzar estas especificaciones de la calidad, es decir, si el error de sus resultados al participar en un programa de garantía externa de la calidad excede estas especificaciones mínimas, debe revisar inmediatamente el procedimiento afectado y tomar medidas correctivas, si procede.
Estas recomendaciones de consenso no implican cambios en las líneas que tradicionalmente recomienda cada sociedad, como especificaciones para mejorar las prestaciones de los laboratorios clínicos.
El trabajo realizado aporta un criterio para armonizar los laboratorios en su implicación en sistemas de gestión de la calidad. Adicionalmente, simplifica la tarea de los auditores al evidenciar el cumplimiento de especificaciones comunes.
En el espíritu de este comité está el colaborar en el futuro con otras sociedades, de otros campos del laboratorio clínico, organizadoras de programas de garantía externa de la calidad de amplia implantación nacional.