A través de Internet recientemente se han comercializado algunas sustancias estimulantes estructuralmente parecidas a neurotransmisores derivadas de medicamentos ya retirados, que potencialmente pueden causar cuadros clínicos de diversa gravedad. Su efecto estimulante y el hecho de que aparecen antes de prohibirse su consumo explican la denominación genérica de legal highs. La exposición a estas sustancias se manifiesta como cuadros parecidos a los del consumo de productos como fenciclidina, anfetaminas o cocaína, ya que muy probablemente compartan mecanismos de acción sobre la recaptación de dopamina en los núcleos cerebrales implicados en el comportamiento de gratificación. La escasez de información médica contrastada, y las dificultades para disponer de material de calibración constituyen un reto diagnóstico. El desoxipipradol, sintetizado hace más de 6 décadas para el tratamiento del trastorno hipercinético, fue relegado por el metilfenidato, un compuesto análogo. En 2009 reapareció como droga recreativa responsable de algunos cuadros clínicos de intoxicación.
Stimulant substances previously used for therapeutic purposes, and are currently banned, have recently been marketed through the Internet. These drugs, structurally similar to neurotransmitters, can potentially cause severe clinical conditions. Exposure to these “legal highs” results in symptoms similar to those of well-known substances such as phencyclidine, amphetamines or cocaine, probably because they share mechanisms of action related to dopamine reuptake in brain nuclei involved in the regulation of reward behavior. The limitations of medical evidence, as well as difficulties in obtaining calibration material, constitute an analytical challenge. Desoxypipradol was synthesized more than six decades ago for the treatment of hyperkinetic disorder, but was surpassed by methylphenidate, a similar compound with a better pharmacokinetic performance. In 2009 desoxypipradol appeared as a recreational drug involved in several cases of clinical intoxication.
Las drogas recreativas que se agrupan bajo la denominación de legal highs (subidones legales) son un grupo heterogéneo de sustancias psicoactivas formado por compuestos químicos de síntesis, o procedentes de hongos o plantas. La estructura de estas sustancias es semejante a neurotransmisores, con quienes comparten la capacidad funcional de provocar reacciones estimulantes, alucinatorias o sedantes. Se comercializan a través de Internet1–3 como base libre o clorhidrato de pureza 99,9%4, advirtiendo ocasionalmente que «no son adecuadas para el consumo humano». Se pueden encontrar comercializadas como «fertilizantes para plantas», «productos de limpieza», «productos químicos para investigación», o «sales de baño», de donde procede también la denominación genérica en argot. Durante 2011 se identificaron en Europa más de 40 sustancias pertenecientes a diversas familias de compuestos químicos como mefedrona y catinonas, derivados de la ketamina y de la fenciclidina, triptaminas sintéticas y naturales, agonistas de los receptores opiáceos o feniletilaminas5–8. Por lo general existe poca literatura científica sobre las características fisiológicas, farmacológicas, toxicológicas, epidemiológicas y analíticas de estas drogas.
El difenilprolinol (D2PM) utilizado en clínica para el tratamiento de la depresión, la narcolepsia y los síntomas de la demencia, la difenilmetilpirrolidina y el pipradrol, antiguamente utilizado en el tratamiento de la depresión, la narcolepsia, el blefarospasmo, la tortícolis espasmódica y la obesidad9–12 integran el grupo de derivados feniletilamínicos y son estructuralmente afines al metilfenidato (Concerta®, Equasym®)13–14. El desoxipipradrol (2-DPMP) es una piperidina inhibidora de la recaptación de noradrenalina y dopamina, desarrollada por la compañía CIBA-Geigy (actualmente Novartis) en los años 50 para el tratamiento de la narcolepsia, el síndrome de déficit de atención e hiperactividad (ADHD)14 y la recuperación de la anestesia15 debido a sus propiedades estimulantes cardiovasculares, metabólicas y de la capacidad intelectual16,17. CIBA patentó en 1955 el metilfenidato con una semivida más corta y una farmacocinética más predecible, razones por las que la compañía priorizó su uso y relegó en poco tiempo el 2-DPMP. En la actualidad no tiene utilidad terapéutica y solo sería utilizado en investigación. Sin embargo, en marzo de 2007 comenzó a consumirse como droga recreativa y desde entonces ha ido implantándose lenta pero irregularmente. En el Reino Unido e Irlanda se popularizó como sustituto del metilfenidato en 2009. En el verano de 2010 se describieron casos de pacientes con síntomas físicos y psíquicos de intoxicación aguda que requirieron ingreso en servicios de urgencias, incluyendo 3 muertes atribuidas al consumo de 2-DPMP.
En este artículo se pretende revisar los conocimientos existentes en la literatura científica. Para ello se han revisado los artículos publicados en revistas indexadas, especialmente, y se han consultado algunas páginas web que habían sido mencionadas en artículos convencionales que no cuestionasen su credibilidad.
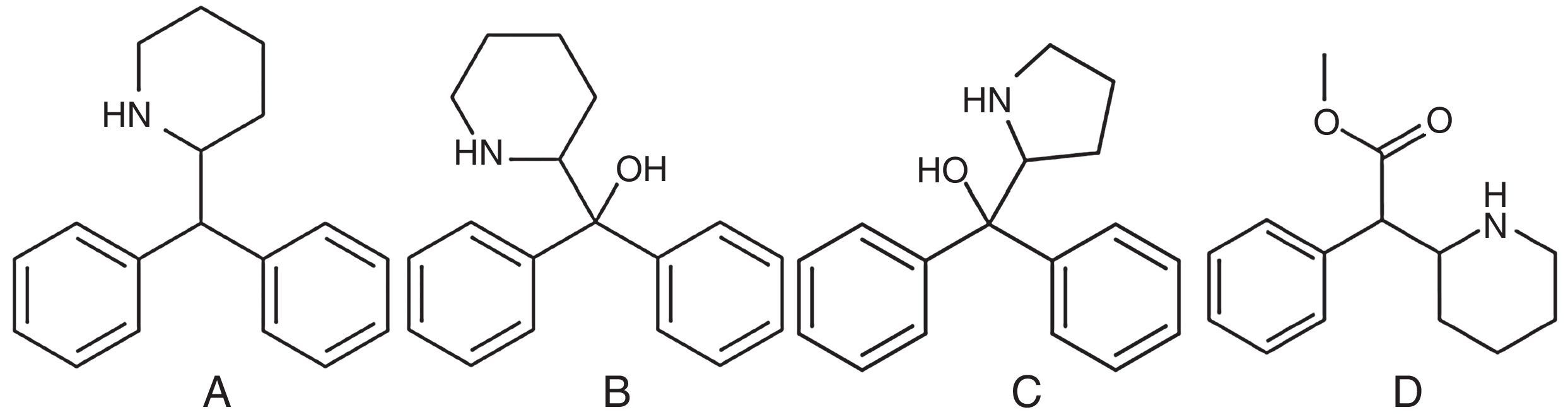
QuímicaEl 2-DPMP es una molécula quiral del grupo de las piperidinas, que se presenta en forma de polvo blanco. La estructura química de algunos integrantes del grupo se representa en la figura 1, y en la tabla 1 se presentan algunas propiedades químicas.
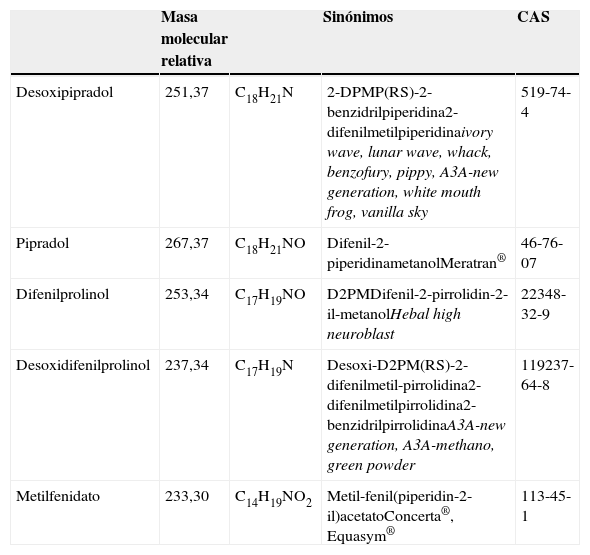
Algunas propiedades químicas de sustancias relacionadas con el desoxipipradol
| Masa molecular relativa | Sinónimos | CAS | ||
|---|---|---|---|---|
| Desoxipipradol | 251,37 | C18H21N | 2-DPMP(RS)-2-benzidrilpiperidina2-difenilmetilpiperidinaivory wave, lunar wave, whack, benzofury, pippy, A3A-new generation, white mouth frog, vanilla sky | 519-74-4 |
| Pipradol | 267,37 | C18H21NO | Difenil-2-piperidinametanolMeratran® | 46-76-07 |
| Difenilprolinol | 253,34 | C17H19NO | D2PMDifenil-2-pirrolidin-2-il-metanolHebal high neuroblast | 22348-32-9 |
| Desoxidifenilprolinol | 237,34 | C17H19N | Desoxi-D2PM(RS)-2-difenilmetil-pirrolidina2-difenilmetilpirrolidina2-benzidrilpirrolidinaA3A-new generation, A3A-methano, green powder | 119237-64-8 |
| Metilfenidato | 233,30 | C14H19NO2 | Metil-fenil(piperidin-2-il)acetatoConcerta®, Equasym® | 113-45-1 |
El 2-DPMP se consume de forma semejante a la cocaína: por inhalación (snorting, sniffing), por vía intravenosa o rectal, disuelta en agua, aunque la vía preferente es la oral mediante una forma peculiar de deglutirla envuelta en tejido de papel (bombing)4,18. Las dosis que se consumen habitualmente son de 1-50mg, unas 100 a 1.000 veces inferiores a las dosis de anfetaminas6, pero también 10-20mg19 o incluso 1-10mg18, una cantidad tan pequeña que convierte el 2-DPMP en una sustancia potencialmente peligrosa. Sin embargo, se especula que la dosis óptima está entre 5 y 10mg4.
Mecanismo de acciónEl 2-DPMP actúa estimulando la liberación e inhibiendo la recaptación de dopamina y adrenalina13, y también inhibiendo el transportador de dopamina (DAT)20. Su actividad farmacológica es comparable, o incluso más potente21, a la de sustancias estructuralmente parecidas mencionadas anteriormente como el metilfenidato, D2PM y pipradrol o la metanfetamina.
En general, las drogas de abuso facilitan la liberación de dopamina en el núcleo accumbens, el centro del prosencéfalo basal relacionado con la gratificación y las adicciones22–24. En cortes de cerebro de rata, tras la estimulación eléctrica, el 2-DPMP aumenta hasta 7 veces la Cmáx de dopamina en los terminales dopaminérgicos, mientras una droga adictiva tan potente como la cocaína solo la multiplica por 322. Puesto que la anfetamina potenciaría la liberación basal no estimulada de la dopamina, parece ser que el mecanismo de acción del 2-DPMP se aproxima más al de la cocaína que al de las anfetaminas.
El 2-DPMP es uno de los más potentes inhibidores de los transportadores de dopamina (DAT) y noradrenalina (NET)22 entre 14 de las nuevas sustancias detectadas recientemente25. Respecto a la actividad noradrenérgica, que se relacionaría con los efectos presores del 2-DPMP, solo puede estudiarse en la región caudal del núcleo accumbens, donde este neurotransmisor se halla en cantidades significativas y no en el centro del núcleo26.
El esteroisómero R podría ser el principal responsable de los efectos farmacológicos, al igual que sucede con sustancias semejantes (MDMA, MDA, difenilprolinol)27–28.
Gran parte de la información sobre sus efectos procede de informes de primera mano presentados en foros de discusión en Internet, de centros de control de tóxicos o de informes de atención hospitalaria a intoxicados4,29,30. Problemas adicionales son la coingestión frecuente con otras drogas recreativas (cocaína, MDMA, anfetamina o ketamina) y las dificultades para disponer de metodología analítica que confirme la presencia de esta sustancia. Su uso prolongado se ha asociado a ansia (craving) y necesidad de repetir la administración4.
En la tabla 2 se resumen los efectos «deseables», comparables a otros estimulantes del grupo de feniletilaminas, y los efectos «indeseables»4,19, muchos de ellos similares a los producidos por el metilfenidato.
Efectos biológicos del desoxipipradol
| Efectos «deseables» |
| Euforia |
| Excitación |
| Aumento de la energía y de la vigilia |
| Locuacidad |
| Empatía |
| Sensibilidad |
| Efectos «indeseables» |
| Psiquiátricos |
| Alucinaciones (auditivas y táctiles) |
| Inquietud |
| Insomnio |
| Agitación |
| Paranoia |
| Ansiedad |
| Agresividad |
| Pérdida de concentración |
| Bruxismo |
| Neurológicos |
| Distonía |
| Hemibalismo |
| Acatisia |
| Cefalea |
| Anorexia |
| Temblor y otros movimientos anormales |
| Cardiovasculares |
| Taquicardia |
| Vasoconstricción (hipertensión) |
| Dolor torácico |
| Palpitaciones |
| Musculares |
| Aumento de la concentración de CK |
La biodisponibilidad del 2-DPMP es alta, un 90%, tras la administración oral (se desconocen datos de otras vías de administración). El tiempo requerido para el inicio de los efectos farmacológicos es de unos 60min4. La mediana de la duración de estos efectos es de 24-48h4, aunque algunos pacientes manifiestan trastornos psiquiátricos hasta 7 días después del consumo18–19.
Se han identificado hasta 6 metabolitos del 2-DPMP producidos en la fase i del metabolismo por hidroxilación, deshidrogenación y oxidación a través de estudios in vitro con microsomas hepáticos humanos y de análisis de orinas positivas a un cribado31 y posterior confirmación32 procedentes de individuos consumidores33. Dadas las circunstancias legales del 2-DPMP es plausible no haber encontrado en la literatura información sobre cinética o actividad farmacológica de estos metabolitos.
La semivida de eliminación es larga si se compara con otros psicoestimulantes: 16-20h14, por ejemplo es considerablemente superior a la de la cocaína, 1-1,5h34, y explicaría algunos efectos, incluyendo los indeseables, más persistentes. La larga semivida podría ser explicada por su naturaleza hidrofóbica y lipofílica por la ausencia de grupos polares funcionales que acostumbran a ser la diana de enzimas metabólicas18,35.
ToxicologíaSe desconocen los efectos a largo plazo y el perfil de seguridad del 2-DPMP. Tampoco se han establecido concentraciones definitivas correspondientes a efectos tóxicos o muerte en seres humanos. En foros de discusión se especula que la toxicidad aparece con dosis superiores a 500mg. Desde 2009 hasta la actualidad se han publicado diversas observaciones relacionadas con el tráfico y consumo de 2-DPMP. En el mes de febrero de 2009, en el Aeropuerto de Helsinki se decomisó el primero de 6 paquetes postales que contenían 2-DPMP en polvo4. También fue en el sur de Finlandia donde varios jóvenes fueron hospitalizados con síntomas de psicosis y lesión orgánica grave, como insuficiencia renal o rabdomiólisis, tras consumir esta sustancia bajo la denominación de daisy. Entre octubre de 2010 y mayo de 2012 se detectaron 106 casos de muestras positivas a 2-DPMP (1,7% de los positivos) procedentes de conductores arrestados por conducir bajo influencia de sustancias, la mayoría acompañadas de resultados positivos a benzodiacepinas o anfetaminas. La concentración en suero estaba entre 0,006 y 0,89mg/l. En 5 necropsias (0,05%) el resultado analítico fue positivo, y en 2 de ellas la muerte fue atribuible directamente al consumo de 2-DPMP36. También en 2009 en Escocia, y posteriormente en Liverpool, se localizó un producto envasado en plástico y rotulado literalmente como «desoxipipradrol 20mg».
En Irlanda, entre el 30 de mayo y el 16 de junio de 2010, el National Poisons Information Service (NPIS) recibió 49 consultas relacionadas con una sustancia denominada whack. Los síntomas referidos fueron agitación (4 individuos), psicosis (13 individuos), taquicardia (12 individuos) e hipertensión (10 individuos) coincidiendo con frecuencia, con otros fenómenos psiquiátricos (alucinaciones y delirios) de hasta 5 días de duración, e insomnio de varios días. Esta sustancia contenía fluorotropacocaína y posiblemente 2-DPMP, que no pudo ser identificado por falta de material de referencia. Después del mes de septiembre de aquel año las consultas disminuyeron notablemente37.
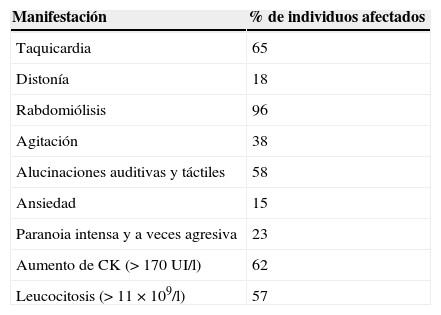
El primer caso de intoxicación por ivory wave conteniendo 2-DPMP en el Reino Unido se registró el 30 de julio de 2010 en la Royal Infirmary of Edinburgh. Hasta entonces se tenía el convencimiento de que el ivory wave contenía metilén dioxipirovalerona (MDPV) o lignocaína1,3,30. Al cabo de un mes se habían atendido 34 episodios en Urgencias (4 fueron ingresos dobles). Se trataba de individuos de entre 16 y 44 años y 70% varones. De estos 34 episodios 19 requirieron ingreso hospitalario. Durante estas mismas fechas en el vecino hospital psiquiátrico de Frimley Park se produjeron otros 12 ingresos con predominio de sintomatología psiquiátrica. Trece individuos admitieron la coingestión de otras sustancias: anfetamina (2), cannabis (3), cocaína, mefedrona, vanilla sky, venlafaxina, butano, herbal recovery pill… Entre el consumo y el ingreso en urgencias transcurrieron de 0 a 7 días, con una media de 2,7 días. En la tabla 3 se presentan la frecuencia de hallazgos clínicos y de laboratorio. En el 85,3% de casos no se dispuso de análisis confirmatorios, pero cuando fue posible la confirmación analítica el 80% fueron resultados positivos2,38.
Frecuencia de hallazgos clínicos en los primeros casos tratados hospitalariamente en Edimburgo, en 2010
| Manifestación | % de individuos afectados |
|---|---|
| Taquicardia | 65 |
| Distonía | 18 |
| Rabdomiólisis | 96 |
| Agitación | 38 |
| Alucinaciones auditivas y táctiles | 58 |
| Ansiedad | 15 |
| Paranoia intensa y a veces agresiva | 23 |
| Aumento de CK (>170UI/l) | 62 |
| Leucocitosis (>11×109/l) | 57 |
Dadas las circunstancias una aproximación pragmática es aplicar las mismas medidas terapéuticas empleadas para intoxicaciones agudas por estimulantes (cocaína, anfetamina y MDMA).
Toxicología analíticaEspecímenesSe han descrito procedimientos analíticos para especímenes de sangre completa, suero o plasma19,36,39,40, en orina19,41 y en tejidos y en otros líquidos biológicos42.
Procedimientos analíticosLos procedimientos cromatográficos descritos en la literatura para realizar determinaciones analíticas de 2-DPMP en líquidos biológicos utilizan fase gaseosa con detección por espectroscopia de masas (CG MS)19,42, o en fase líquida (HPLC) con detección UV19,39 o MS19,36,40,41. En la tabla 4 se presenta un resumen esquemático de estos procedimientos.
Procedimientos analíticos para la determinación de desoxipipradol
| 1 ref. | muestra | Estd. int. | Tampón | solvente | Reconstituir con | Iny. | |
|---|---|---|---|---|---|---|---|
| GC | |||||||
| Lelièvre et al.19, 2013 | Plasma, orina1,0ml | RN127 1g/l50μl | Carbonato 1M0,5mlNaOH 1M50μl | Diclorometano5ml | Evaporar a sequedad a 50°C bajo N2 | Hexano/isopropanol 85:15100μl | 2μl |
| Lavins et al.42, 2013 | Tejidos, líquidos orgánicos | (Alcalinizar) | Etilacetato | ||||
| 2 | Columna | Transp. (flujo) | Temp. inyector | Temp. columna | Temp. detector | Splitless | m/z | t. r. |
|---|---|---|---|---|---|---|---|---|
| Lelièvre et al.19, 2013 | Ultra 125m ×0,32mm; 0,17μm | 2-PDPM 250,2;161,1;84,2Difenilmetano 165Piperidina: 81 | 8,7min | |||||
| Lavins et al.42, 2013 | Restek Rxi®-5ms30m ×0,25mm; 0,25μm | He (1,2ml/min) | 250°C | 70°C durante 0,5min70-300°C a 50°C/min300°C durante 6,9min | Fuente: 230°CCuadrupolo: 150°C | Sí | 40-500 |
| 1 | Muestraa | Estándar interno | Tampón | Solvente LLEColumna SPE | Volumen inyectado | ||
|---|---|---|---|---|---|---|---|
| HPLC | |||||||
| Lelièvre et al.19, 2013; 1 | Plasma, orina 0,5ml | Prazepam 20mg/l25μl | NaOH 1N30μl (hasta pH 11) | Diclorometano5ml | Evaporar a sequedad a 50°C bajo N2Residuo+MeOH 50μl | HCl 0,02M20μl | 10μl |
| Lelièvre et al.19, 2013; 2 | Plasma, orina 0,5ml | Metilimilmacipram25μl | NaOH 4N100μl | Hexano/isoamilalcohol 98:24ml | HCl 0,02M100μlCentrifugar; calentar 3min a 50°C bajo N2 | 25μl | |
| 2 | Columna | Fase móvil | Gradiente | Flujo | Detección (nm) | t. r. | |
|---|---|---|---|---|---|---|---|
| Lelièvre et al.19, 2013; 1 | Guard: Uptisphere ODB10×2,1mmUptisphere ODB100×2,1mm×5μm | Acetonitrilo/tampón fosfato 20mM pH 6,0 con trietanolamina15:85 | 45:55 a 6,5min80:20 por 16minMantener 2min | 210230254 | 225/260 | 7,49min | |
| Lelièvre et al.19, 2013; 2 | DA |
| 3 | Precisión intra | Precisión inter | Exactitud | Linealidad | LOQ |
|---|---|---|---|---|---|
| Lelièvre et al.19, 2013; 1 | |||||
| Lelièvre et al.19, 2013; 2 | 0,1-2,0mg/l | 50μg/l (CV<20%) |
| 1 | Espécimen | Estándar interno | Tampón | SPE | Inyección | ||
|---|---|---|---|---|---|---|---|
| HPLC MS/MS | |||||||
| Kriikku et al.40, 2011 | Suero 0,2ml | MDEA-d5b en metanol 0,5mg/l20μl | Ácido acético 0,1M0,8ml | Agitar durante 10sCentrifugar a 13.000rpm durante 3min | Oasis HLBc (Waters)30mg | Cargar el sobrenadante en el cartucho de SPELavar con 1ml de H2O/metanol/amoniaco (93:5:2) y 1ml de H2O/metanol/amoniaco (78:20:2)Secar los cartuchos (10min) y eluir con 1ml metanol/ácido acético (95:5)Evaporar bajo corriente de nitrógeno a 45°CReconstituir con 0,5ml de metanol/acetato NH4 10mM en ácido fórmico 0,1% (80:20) | 5μl |
| Kriikku et al.36, 2013 según Kriikku et al.40 | MDPV-d8d | ||||||
| Lelièvre et al.19, 2013 | Plasma, orina0,1ml | Metilimilmacipram 1mg/l150μl | Centrifugar y diluir el sobrenadante con H2O (1:4) | 5μl | |||
| O’Byrne et al.41, 2013 | orina0,1ml | centrifugar y diluir el sobrenadante con H2O (1:9) | 20μl | ||||
| Tyrkko et al.33, 2013 basado en De castro et al.31 | Orinab1ml | Dibenzepina 10mg/l10μL | Fosfato 0,1MpH 62ml | Isolute HCX-5 (Biotage)1130mg 3 mle | Cargar en el cartucho de SPELavar con 1ml de tampón fosfato y 1ml de ácido acético 1ml secando entre lavadosEluir la fracción ácida y neutra con 3ml de hexano/etilacetato (75:25)Lavar con 1ml de metanol y secarEluir la fracción básica con 3ml de hidróxido amónico 2% en etilacetatoEvaporar bajo corriente de N2 a 40°CReconstituir con 150μl de metanol/ácido fórmico 0,1% (1:9) | 3μl | |
| 2 | Columna | Tampón | Fase móvil | Gradiente | Flujoml/min | Detección | m/z | ||
|---|---|---|---|---|---|---|---|---|---|
| Kriikku et al.40, 2011 | Phenomenex fenil-hexil50×3,0mm, 3μm40°C | Solvente A: metanolSolvente B: acetato NH4 10mM en ácido fórmico 0,1% | Modo gradiente | 0,5 | Modo ión positivo al voltaje de ionización de 4.200V. Temperatura de la fuente: 550°C | MDPV | 276/126 y 276/135MDEA-d5 | 213/163 | |
| Kriikku et al.36, 2013 según Kriikku et al.40 | |||||||||
| Lelièvre et al.19, 2013 | Acquity UPLC® BEH C1850×2,1mm, 1,7μm; 40°C | Formato amónico 2 mM+ácido fórmico 0,1%/MeOH | Modo ión positivo | 2-DPMP | 252,2>91,1252,2>167,0 e.i. | 261,3>142,8 | |||
| O’Byrne et al.41, 2013 | Guard: XTerra RP18 10×4,6mmXTerra RP18100×4,6mm, 3,5μm30°C | Formato amónico 25 mM+ácido fórmico 0,5% pH 10 | Solvente A: acetonitrilo/tampón/H2O(1:1:8)Solvente B: acetonitrilo/tampón(9:1) | A (100%): 1min;a B (100%): en 8min | 0,5 | 252,291,2 | |||
| Tyrkko et al.33, 2013, basado en de Castro et al.31 | Guard: Luna PFPf (Penomenex)4×2mmLuna PFPf (Penomenex)100×2mm, 3μm40°C | Solvente A: metanolSolvente B: acetato amónico 2mM en ácido fórmico 0,1% | A: | 5% durante 5min5% a 40% en 5min40% a 75% en 13,5min75% a 80% en 16min80% durante 2min | 0,3 | Modo ión positivo al voltaje de ionización de 4.500 VTemperatura de la fuente: 200°C | 50-800 |
| 3 | Precisión intra | Precisión inter | Exactitud | Recuperación | Linealidad | LOD | LOQ |
|---|---|---|---|---|---|---|---|
| Kriikku et al.40, 2011 | N=2×8 días0,015 y 0,400μg/l: 9,5%-11,8% | N=2×8 días0,015 y 0,400μg/l: 9,5% -11,8% | 3,9 -5,2% | 20μg/l: 89,8%200μg/l: 67,9% | 10-500μg/l | MDPV: 3μg/l | MDPV 11μg/l |
| Kriikku et al.36, 2013 según Kriikku et al.40 | 15μg/L y 400μg/L: 6,1% | 15μg/L y 400μg/L: 10,3% | 0,3-1,2% | 20μg/l: 80,8%200μg/l: 85,2% | <500μg/l | 3μg/l | 9μg/l |
| Lelièvre et al.19, 2013 | <4,5% | <10% | <15% | 10-1.000μg/l | 10μg/l(CV<20%) | ||
| O’Byrne et al.41, 2013 | 5-500μg/l | 5-10μg/l(s/r>10) | |||||
| Tyrkko et al.33, 2013 basado en De Castro et al.31 |
| Reactivo | Composición | Color |
|---|---|---|
| Determinaciones cualitativas rápidas | ||
| Mandelin | Vanadato amónico+SO4H2 concentrado (10g/l) | Amarillo/verde pálido |
| Marquis | Formaldehído 40%+SO4H2 concentrado (50ml/l) | Amarillo |
| Mecke | Ácido selenioso+SO4H2 concentrado (10g/l) | Amarillo |
Otros procedimientos utilizados no específicos para 2-DPMP se pueden ver en las referencias 32 y 47.
No se dispone de información acerca de sensibilidad ni especificidad analítica de estos procedimientos.
No ha sido posible encontrar datos de estabilidad del 2-DPMP en suero, plasma, sangre completa ni orina. Se sabe que es una molécula más estable que el metilfenidato36, que en sangre completa a temperatura ambiente presenta una desviación del 13% a las 6h43. Una molécula análoga, el desoxi-D2PM refrigerada es estable al menos durante un día39. Por todo ello parece razonable la recomendación de procesar los especímenes sin demoras, y en cualquier caso mantener las muestras refrigeradas o congeladas.
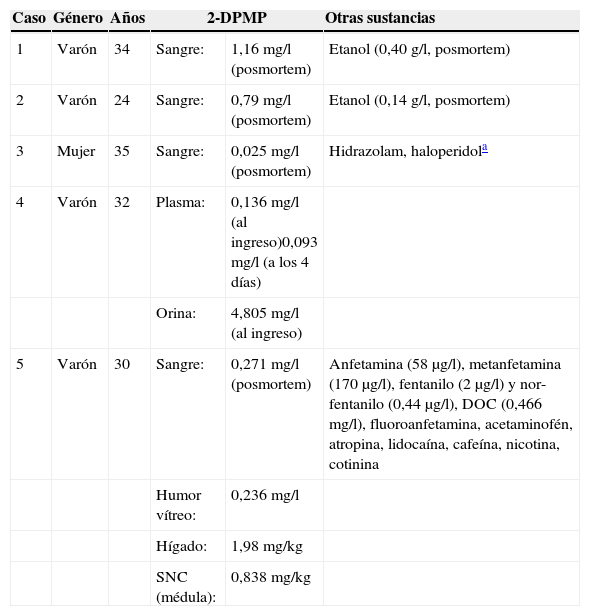
Resultados esperadosLa confirmación cuantitativa por CG-MS32 de 10 muestras de orina que resultaron positivas en un cribado estaba dentro del intervalo 0,29-42mg/l33. No obstante, teniendo en cuenta la limitada experiencia existente, resulta más instructivo examinar los resultados en el contexto de la presentación clínica. A continuación se resumen 5 casos clínicos publicados entre 2011 y 2013 con un resumen de los resultados analíticos en la tabla 5. Los 3 primeros casos corresponden a 3 muertes relacionadas con el consumo de 2-DPMP comunicados en agosto de 2011 por el National Programme on Substance Abuse Deaths (NPSAD) en el Reino Unido. El cuarto caso fue el primero documentado en Francia, en 2013. El quinto corresponde una comunicación procedente del departamento forense del condado de Cuyahoga, Ohio, también en 2013.
Observaciones analíticas en 5 casos clínicos publicados
| Caso | Género | Años | 2-DPMP | Otras sustancias | |
|---|---|---|---|---|---|
| 1 | Varón | 34 | Sangre: | 1,16 mg/l (posmortem) | Etanol (0,40 g/l, posmortem) |
| 2 | Varón | 24 | Sangre: | 0,79 mg/l (posmortem) | Etanol (0,14 g/l, posmortem) |
| 3 | Mujer | 35 | Sangre: | 0,025 mg/l (posmortem) | Hidrazolam, haloperidola |
| 4 | Varón | 32 | Plasma: | 0,136 mg/l (al ingreso)0,093 mg/l (a los 4 días) | |
| Orina: | 4,805 mg/l (al ingreso) | ||||
| 5 | Varón | 30 | Sangre: | 0,271 mg/l (posmortem) | Anfetamina (58 μg/l), metanfetamina (170 μg/l), fentanilo (2 μg/l) y nor-fentanilo (0,44 μg/l), DOC (0,466 mg/l), fluoroanfetamina, acetaminofén, atropina, lidocaína, cafeína, nicotina, cotinina |
| Humor vítreo: | 0,236 mg/l | ||||
| Hígado: | 1,98 mg/kg | ||||
| SNC (médula): | 0,838 mg/kg | ||||
Varón blanco de 34 años, 1,83m de altura y 86kg de peso, hallado en avanzado estado de descomposición en un armario de un yate que estaba reparando, 6 días después de haber sido visto por última vez. Junto al cadáver se halló un paquete abierto de ivory wave. Se detectó 2-DPMP en sangre, humor vítreo, hígado y contenido gástrico (tabla 5). El diagnóstico forense fue de muerte por causa incierta, especulando que podría haber experimentado asfixia o crisis cardiaca, quizás como consecuencia de una crisis paranoica inducida por 2-DPMP4.
Caso 2Varón blanco de 24 años, 1,83m de altura y 68kg de peso, con historia previa de paranoia y alucinaciones atribuidas a 2-DPMP, mefedrona y alcohol. Se le había visto correr con los brazos extendidos por el filo de un acantilado de 100m de altura el día antes de hallar su cadáver flotando en el mar. La muerte se atribuyó a lesión cerebral, traumatismo craneal, o lesiones multiorgánicas4.
Caso 3Mujer blanca de 35 años, 1,6m de altura y 57kg de peso, diabética de tipo 1. Diez meses antes del ingreso se informó en Internet de las propiedades anorexígenas del 2-DPMP y comenzó a inhalar ivory wave para adelgazar. A los 4 meses había perdido el equivalente a 6 tallas, se había vuelto insomne, paranoica, agorafóbica, abandonada y agresiva. Tras ser hallada inconsciente fue hospitalizada. Se le diagnosticó edema cerebral por TAC. A los 12 días en coma se le retiró el soporte vital. La muerte se atribuyó a sobredosis de 2-DPMP4.
Caso 4Varón de 32 años con antecedentes de consumo de múltiples sustancias (cocaína, MDMA, anfetaminas, cannabis) y de etilismo crónico. En el momento del ingreso afirmó que 3 días antes había consumido 250mg de 2-DPMP adquirida a través de Internet. Presentaba agitación, alucinaciones auditivas y visuales, discurso incoherente, anorexia, insomnio y cefalea, una sintomatología coincidente con la descrita en la literatura2,4,29. En la exploración física se observó ligera midriasis, taquicardia (84latidos/minuto), tensión arterial 114 y 91mmHg y ECG normal. Analíticamente presentaba una actividad CK aumentada (535UI/l), concentraciones de hemoglobina de 17g/l, y de ácido láctico de 0,7mmol/l. El pH en sangre de 7,4, pCO2 de 40mmHg y pO2 de 73mmHg. La concentración de 2-DPMP en plasma era de 0,136mg/l y en orina de 4,805mg/l. No se detectó presencia de etanol, por lo que la agitación plantea el diagnóstico diferencial con la abstinencia alcohólica. Se inició tratamiento con oxazepam. A los 4 días del consumo la concentración plasmática de 2-DPMP era de 0,093mg/l. A los 5 días estaba más calmado y habían cesado las alucinaciones, aunque aún manifestaba cefaleas. A los 7 días habían desaparecido todos los síntomas19.
Caso 5Varón de 30 años que pide ayuda a un amigo tras consumir 4-cloro-2,5-dimetoxianfetamina (DOC). Los servicios de urgencias lo encuentran tendido en posición supina, respirando pero sin responder a estímulos, convulsionando, con la piel extremadamente caliente y sudorosa. Es conducido al hospital donde se le diagnosticó una sobredosis aguda de drogas, que según todos los indicios se produjo 3h antes del ingreso. A las 42h el paciente falleció. En la necropsia se encontró miocardiopatía dilatada (460g) y edema cerebral y pulmonar. En la sangre ventricular postmortem se detectó acetaminofén, atropina, lidocaína, cafeína, nicotina, cotinina, anfetamina (58μg/l), metanfetamina (170μg/l), fentanilo (2μg/l), nor-fentanilo (0,44μg/l), DOC (0,466mg/l), fluoroanfetamina y 2-DPMP (0,271mg/l). El diagnóstico forense fue de muerte accidental por encefalopatía metabólica tóxica debida a intoxicación mixta. El análisis de la parafernalia confiscada como prueba judicial da como resultado: cannabis, metanfetamina, 2-fluoro-metil-anfetamina, alprazolam, 2-(1-pirrolidinil)-(4-metil-fenil)-1-propanona (MPPP), fenciclidina, dimetiltriptamina, psilocina, DOC y LSD42.
Aspectos legalesEl 2-DPMP es una sustancia controlada actualmente en muchos estados occidentales. Ya en octubre de 2010 fue declarada sustancia controlada en Polonia44, en marzo de 2011 en Finlandia y en noviembre de 2011 el Home Office del Reino Unido prohibió su importación, siguiendo la recomendación del Advisory Council on the Misuse of Drugs45,46. El 13 de junio de 2012 se hizo efectivo un decreto del Home Office del Reino Unido46 por el que el 2-DPMP pasa a ser una droga clasificada de clase B (de acuerdo con la Misuse of Drugs Act de 1971), lo que implica que la tenencia, fabricación y distribución está penada judicialmente. Desde julio de 2012 es una sustancia controlada además en Irlanda, Finlandia, Suecia y por analogía legislativa, probablemente en EE. UU., Australia y Nueva Zelanda4 entre otros estados.
ConclusionesLa literatura científica acerca de la farmacología (dosis y dosis letales en humanos), farmacocinética (semivida, volumen de distribución aparente) y toxicología (aguda y a largo plazo) del 2-DPMP sigue siendo muy limitada en la actualidad, por lo que no es extraño hallar dificultades en la identificación de pacientes intoxicados por 2-DPMP y otras drogas «recreativas», tanto en los servicios de urgencias como en los laboratorios de toxicología clínica. Además, hay que recordar que con una determinación analítica no es posible establecer ni el instante, ni la vía, ni la cantidad del consumo.
Existe cierta correspondencia entre los efectos secundarios del 2-DPMP y el metilfenidato. Un rasgo relevante del 2-DPMP son los efectos psiquiátricos prolongados que puede producir. Sin embargo, con la excepción del caso clínico 3, hasta 2012 no había constancia de muertes directamente atribuibles al 2-DPMP.
Finalmente, hay que tener en cuenta que puede haber cambios en la composición de sustancias: el ivory wave empezó conteniendo metilén dioxipirovalerona (MDPV) y lignocaína para después contener 2-DPMP2,37.
Conflicto de interesesNinguno.