La citometría de flujo ha mostrado en los últimos años su utilidad en el cribado de infección urinaria y su integración en los Servicios de Microbiología podría evitar la siembra de hasta el 60% de las muestras del área. El propósito de este trabajo es valorar su utilidad en el cribado universal y la rentabilidad diagnóstica en diferentes subpoblaciones.
Material y métodosSe analizaron 1.338 muestras mediante citometría de flujo (Sysmex UF-1000i) y urocultivo en agar CPS. Se informaron como positivos los cultivos con 1 o 2 uropatógenos y recuentos superiores a 105 UFC/ml y en poblaciones especiales, recuentos inferiores con un solo uropatógeno.
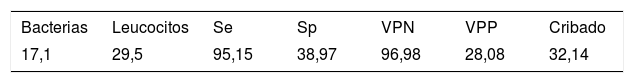
ResultadosUtilizando un punto de corte de>17,1 bacterias/μl o>29,5 leucocitos/μl se consiguió una sensibilidad del 95,15% y un porcentaje de cribado del 32,14%. De los once falsos negativos, seis presentaban recuentos bajos y en uno se cultivó Candida glabrata. En el estudio por subgrupos se encontraron variaciones estadísticamente significativas respecto al género y la procedencia. El punto de corte en los varones fue inferior con respecto a las mujeres. Sin embargo, se mantuvo estable en las muestras de Atención Primaria, reduciéndose sustancialmente en las hospitalarias. El valor predictivo negativo permaneció siempre por encima del 95%.
ConclusiónEl sistema de citometría de flujo puede evitar la siembra del 32% de las muestras aplicando criterios estrictos de positividad. En nuestro hospital, habría evitado la siembra de 13.705 orinas en 2016, y podría aumentar combinando los puntos de corte con la procedencia y el género de las muestras.
Flow cytometry has shown to be useful for ruling out urinary tract infection over the last few years. Its integration into the Microbiology Laboratories could avoid the urine culture of 60% of the samples. The aim of this study is to evaluate the usefulness of flow cytometry in the universal screening, as well as to improve its efficacy by using specific cut-off points in different groups.
Material and methodsA total of 1338 urine samples were analysed by flow cytometry (Sysmex UF-1000i), as well as a urine culture in CPS agar. Cultures with one or two pathogens and more than 10,000 CFU/ml, and special cases with less counts but just one pathogen, were considered as positive.
ResultsA cut-off of >17.1 bacteria/μl or >29.5 leucocytes/μl resulted with a sensitivity of 95.15% and a screening yield of 32.14%. Eleven false negative were obtained, but six of them showed low counts, and another was due to Candida glabrata. On the other hand, statistically significant variations were found as regards gender and origin of the patients. The cut-off of male samples was lower than female ones. However, it remained stable in the samples from Primary Care, and it decreased notably in those from the hospital. The negative predictive value always remained over 95%.
ConclusionAutomated flow cytometry can avoid the culture of 32% of samples, even after applying tight positive criteria. In the study hospital, it would have avoided the culture of 13,705 urine samples in the year 2016. These results could improve by combining cut-off points, gender, and origin of patients.
La infección del tracto urinario (ITU) es una de las patologías infecciosas más frecuentes y que demanda un importante volumen de muestras en el Laboratorio de Microbiología. El método de elección en el diagnóstico de la ITU es el cultivo, a pesar de que solo un 17-37% presenta un crecimiento clínicamente significativo1–4. El uso de medios cromogénicos permite la identificación rápida de los patógenos en muchas muestras, especialmente en el caso de Escherichia coli (E. coli), pero también supone un gasto adicional importante en comparación con los medios de cultivo clásicos. Por este motivo se han buscado métodos alternativos que permitan descartar los urocultivos sin crecimiento valorable de microorganismos en el menor tiempo posible. El sedimento es imprescindible para la detección de piuria y la valoración de afectación renal, sin embargo, carece de la especificidad adecuada para su utilización como prueba diagnóstica5. La presencia de nitritos es altamente específica de bacteriuria (97%), pero presenta baja sensibilidad (0-44%)6. La tinción de Gram es quizá el método más simple y barato para identificar orinas con recuentos elevados, aunque su baja sensibilidad y falta de automatización lo hacen en muchos casos impracticable como método de rutina en el laboratorio5. La introducción de los diferentes sistemas automatizados para el cribado de ITU, con una sensibilidad y especificidad generalmente aceptables7–9 ha supuesto un paso adelante en este sentido. Su principal problema es que no permiten descartar las muestras contaminadas y retrasan el procesamiento, ya que obligan a conservar todas las muestras refrigeradas hasta la obtención de los resultados.
En nuestro hospital se realizaron 42.831 cultivos de orina en el año 2016 (36% del total de muestras enviadas al servicio de Microbiología), lo cual supone una considerable carga de trabajo. Los sistemas de citometría de flujo han demostrado en los últimos años su utilidad en el cribado de las orinas y algunos estudios indican que pueden evitar la siembra de hasta el 60% de las orinas en población adulta no gestantes de Atención Primaria. La integración de estos sistemas en los Servicios de Microbiología Hospitalaria permitiría adelantar 24 h resultados negativos y evitar la siembra de muchas muestras, por lo que es una importante herramienta de cribado, alternativa a otras técnicas como la detección de ATP bacteriano. No hay datos, sin embargo, sobre su utilización en otras poblaciones como gestantes, pediatría y pacientes hospitalizados.
El propósito de este trabajo es valorar la utilidad de la citometría de flujo en el cribado de las muestras de orina en la población general y evaluar la rentabilidad del estudio de distintas subpoblaciones. Como objetivos secundarios se estudian la utilidad de las células epiteliales como marcador de contaminación10 y la capacidad de la citometría para diferenciar las características morfológicas de las bacterias causantes de ITU.
Material y métodosDesde septiembre de 2016 hasta enero de 2017 se recogieron, a días alternos, todas las muestras de orina que llegaron al Laboratorio de Microbiología. Se analizaron un total de 1.338 muestras, 940 de mujeres y 396 de varones. De estas, el 46,6% procedían de Atención Primaria, el 19,5% de urgencias, 17% de consultas externas y el 24,7% correspondieron a muestras hospitalarias, principalmente de pacientes hospitalizados en Medicina Interna, aunque también procedentes de plantas de Obstetricia, Pediatría, UCI y Neurología (tabla 1). Las muestras fueron recogidas tanto por micción espontánea como por sonda, aunque estas últimas no supusieron más del 3% por lo que no se pudo hacer un estudio independiente. Todas las muestras fueron transportadas en tubos de 10ml de vacío con ácido bórico como conservante (BD Vacutainer Plus C&S) y procesadas el mismo día de su recepción (máximo 12 h), manteniendo la cadena de frío. Ninguna muestra estuvo más de 2 h sin refrigerar. Se procesaron muestras de todos los perfiles de pacientes, aunque no se recibieron muestras de pacientes inmunodeprimidos. Se incluyeron pacientes pediátricos, que se analizaron junto con el resto de muestras y que representaron un 5%. Se excluyeron solo las orinas hematúricas o con alta turbidez, y volúmenes por debajo de 5ml. Todas las muestras fueron analizadas mediante citometría de flujo (Sysmex UF-1000i). Como método de referencia se utilizó el cultivo en placa con asa calibrada estéril de 10μl en medio cromogénico agar CPS (BioMerieux, España), incubado 24h a 36°C. Se informaron como positivos todos los cultivos con 1 o 2 uropatógenos y recuentos superiores a 10.000UFC/ml. En poblaciones especiales como pacientes urológicos, mujeres con síntomas de ITU, varones y pacientes sondados, se informaron también como positivos cultivos con recuentos inferiores (102-104 UFC/ml) con un solo uropatógeno.
Número de pacientes en función del género y la procedencia. Entre paréntesis se muestra el número de infecciones
| Atención Primaria | Consultas externas | Hospitalaria | Urgencias | Obstetricia-Ginecología (consultas) | |
|---|---|---|---|---|---|
| Mujer | 462 (119) | 123 (25) | 41 (11) | 164 (38) | 150 (10) |
| Varón | 162 (30) | 109 (12) | 28 (5) | 97 (17) | 0 (0) |
Mediante la curva ROC se calculó el punto de corte para las bacterias/μl y los leucocitos/μl, fijando una sensibilidad del 95%, condición necesaria para un método de cribado óptimo. A partir de este se calcularon los parámetros de valor predictivo positivo (VPP) y negativo (VPN).
La identificación del patógeno se realizó por espectrometría de masas (MALDI-TOF, BrukerBiotyper) directamente sobre colonias aisladas del cultivo.
Se estudiaron el recuento de bacterias, levaduras y leucocitos/μl como marcadores de infección, la morfología de las bacterias y el recuento de células epiteliales/μl como posible marcador de contaminación.
ResultadosDe las 1.338 muestras analizadas, 268 (20%) fueron positivas basándonos en el cultivo: 13 con un recuento entre 102 y 103 UFC/ml, 13 con 103 -104 UFC/ml, 43 con 104-105 UFC/ml y 199 con >105 UFC/ml. El 53% de los aislamientos correspondieron a E. coli, que es el principal causante de ITU. El 14% correspondió a Klebsiella pneumoniae(K. pneumoniae), 6% a Proteus spp., 6% Enterococcus spp. y 5% a Streptococcus agalactiae. El otro 16% fueron cultivos de diferentes patógenos. Se consideraron contaminadas 87 (6,5%) muestras.
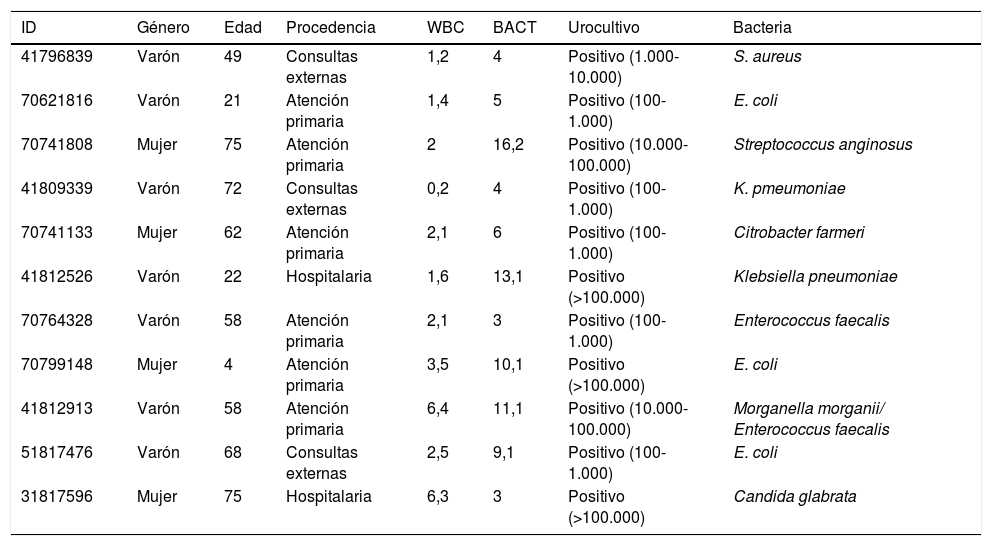
Para una sensibilidad del 95,15%, se obtuvieron unos puntos de corte de >17,1 bacterias/μl o >29,5 leucocitos/μl, con un valor predictivo negativo del 97% y una especificidad del 38,97%. Esto supone que en el 32% (430 muestras) de las muestras podría haberse evitado el cultivo. Los resultados se presentan en la tabla 2. Se obtuvieron once falsos negativos. Seis correspondieron a cultivos con recuentos relativamente bajos y uno se debió al crecimiento de una Candida glabrata (C. glabrata), que se rescató por presentar una lectura de 220,9 levaduras/μl. Solo uno se presentó en un paciente hospitalizado, en cuyo urocultivo crecieron >105 UFC/ml de K. pneumoniae (tabla 3).
Falsos negativos en población general (práctica clínica habitual)
| ID | Género | Edad | Procedencia | WBC | BACT | Urocultivo | Bacteria |
|---|---|---|---|---|---|---|---|
| 41796839 | Varón | 49 | Consultas externas | 1,2 | 4 | Positivo (1.000-10.000) | S. aureus |
| 70621816 | Varón | 21 | Atención primaria | 1,4 | 5 | Positivo (100-1.000) | E. coli |
| 70741808 | Mujer | 75 | Atención primaria | 2 | 16,2 | Positivo (10.000-100.000) | Streptococcus anginosus |
| 41809339 | Varón | 72 | Consultas externas | 0,2 | 4 | Positivo (100-1.000) | K. pmeumoniae |
| 70741133 | Mujer | 62 | Atención primaria | 2,1 | 6 | Positivo (100-1.000) | Citrobacter farmeri |
| 41812526 | Varón | 22 | Hospitalaria | 1,6 | 13,1 | Positivo (>100.000) | Klebsiella pneumoniae |
| 70764328 | Varón | 58 | Atención primaria | 2,1 | 3 | Positivo (100-1.000) | Enterococcus faecalis |
| 70799148 | Mujer | 4 | Atención primaria | 3,5 | 10,1 | Positivo (>100.000) | E. coli |
| 41812913 | Varón | 58 | Atención primaria | 6,4 | 11,1 | Positivo (10.000-100.000) | Morganella morganii/ Enterococcus faecalis |
| 51817476 | Varón | 68 | Consultas externas | 2,5 | 9,1 | Positivo (100-1.000) | E. coli |
| 31817596 | Mujer | 75 | Hospitalaria | 6,3 | 3 | Positivo (>100.000) | Candida glabrata |
Además del recuento de bacterias y leucocitos se analizó el recuento de levaduras. Tomando como referencia el crecimiento del cultivo solo se identificaron 7 muestras con crecimiento puro de Candida spp., por lo que no se pudo realizar el estudio estadístico en este grupo.
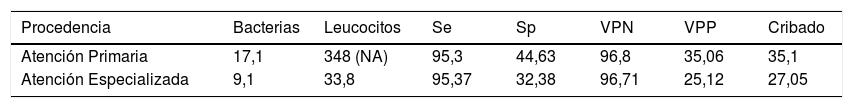
Así mismo se hicieron diferentes subgrupos con el objetivo de encontrar puntos de corte más específicos para cada tipo de población. Para ello se dividieron las muestras en dos grupos según su origen: Atención Primaria y Atención Especializada. Las muestras de Atención Primaria no mostraron variación significativa con respecto al análisis general y se conservó el punto de corte en >17,1 bacterias/μl. En este caso el punto de corte de los leucocitos se establece en torno a los 348 leucocitos/μL, lo cual lo hace una variable secundaria redundante en esta subpoblación. Para el análisis de muestras de Atención Especializada se decidió excluir a las pacientes de obstetricia-ginecología, ya que las modificaciones anatómicas y funcionales en el embarazo aumentan el riesgo de ITU con ausencia de piuria y pueden tener una repercusión importante tanto para la madre como para el feto11. No obstante, debido al bajo número de casos positivos (n=10), no se pudo calcular un punto de corte para estas pacientes. Se incluyeron sin embargo muestras de consultas externas, hospitalarias y de urgencias, que supusieron un 42% (562) de la población total. Para conseguir una sensibilidad del 95,4% se redujo el punto de corte hasta >9,1 bacterias/μl o >33,8 leucocitos/μl (tabla 4).
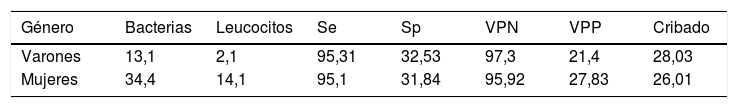
También se estudiaron los pacientes según el género, encontrando diferencias estadísticamente significativas entre ambos grupos: para los varones, con un corte de >13,1 bacterias/μl, se obtuvo un VPN del 97,3%. Los 3 falsos negativos que se obtuvieron con este punto de corte tuvieron un crecimiento en placa menor a 105 UFC/mL.
En el caso de las mujeres, al igual que en el caso de las muestras de Atención Especializada, se decidió excluir a las pacientes obstétricas. Se obtuvo un punto de corte estable en ≥ 21,2 bacterias/μL, dando lugar a una sensibilidad del 95,3% y especificidad del 35%, con un VPN del 95,9%. Se obtuvieron 7 falsos negativos, de los cuales dos presentaron crecimiento de 102-103 UFC/mL y otros dos correspondieron a candidiuria (tabla 5).
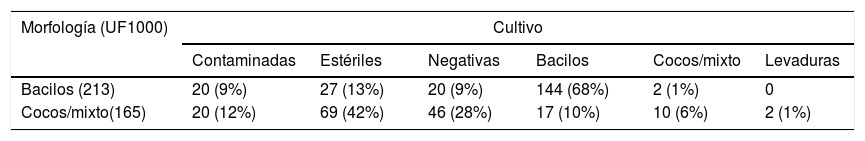
La citometría de flujo utiliza un canal independiente con una tinción específica para bacterias que permite distinguir su morfología, lo que podría resultar de especial interés para dirigir el tratamiento precoz. Para el estudio de esta función solo se tuvieron en cuenta aquellas muestras donde el análisis por citometría revelaba presencia de bacteriuria y clasificaba su morfología. Se excluyeron, por tanto, todos los falsos negativos en bacteriuria y las muestras en las que incluso con un valor significativo de bacterias/μL, la citometría no distinguía la forma bacteriana. Siguiendo este criterio se incluyeron 385 (28,7%) muestras, aunque no todas correspondían a cultivos con crecimiento positivo en placa. De ellas, 165 fueron clasificadas en el citómetro como bacilos con una especificidad del 71% y una sensibilidad del 67%. Los 165 restantes se clasificaron como cocos/mixto con una especificidad del 6% y una sensibilidad del 58% (tabla 6).
DiscusiónLa citometría de flujo ha demostrado ser una prueba de cribado útil en el diagnóstico de la infección urinaria1–3, mejorando el valor predictivo de las tiras de orina donde la detección de nitritos presenta una baja sensibilidad, incluso en combinación con el estudio microscópico, debido a la subjetividad asociada a la prueba2,3. Ferry et al. evaluaron la utilidad de estas técnicas en el cribado de ITU y obtuvieron una sensibilidad del 95% y una especificidad del 41%12.
Sin embargo, aunque la fiabilidad y el coste-efectividad de la citometría de flujo están claramente probados, los diferentes estudios sugieren una alta variabilidad en los puntos de corte y eficacia10,13–16, lo cual indica una diversidad poblacional que requiere un estudio más personalizado en su interpretación. Estas discrepancias podrían deberse tanto a las diferencias anatómicas de ambos sexos, como a la prevalencia y los uropatógenos causantes de la infección en los diferentes grupos poblacionales. En cualquier caso, parece razonable pensar que el establecimiento de un algoritmo que recoja estas variables podría suponer un incremento en la rentabilidad diagnóstica de la citometría de flujo. De hecho, algunos autores ya han estudiado distintas poblaciones según su situación clínica, sexo y edad4,16,17.
Según los resultados de este estudio, en las muestras de procedencia hospitalaria es necesario ajustar el punto de corte para mantener la sensibilidad (tabla 4). Parece que el recuento de bacterias/μl es significativamente inferior en pacientes hospitalizados o de urgencias, lo que podría deberse a la concentración antibiótica en el ambiente hospitalario. En este caso se obtuvieron 3 falsos negativos y solo uno con crecimiento >105 UFC/ml, que correspondió a una C. glabrata, con alto recuento de levaduras en la citometría de flujo. Por lo tanto, a pesar de que este punto de corte reduce mucho la especificidad de la prueba, tiene un elevado valor predictivo negativo, validando el uso de la citometría incluso en estas poblaciones. Hay pocos estudios que avalen el cribado de muestras en pacientes hospitalarios, pero nuestros datos demuestran que la aplicación de un punto de corte estricto podría permitir su utilización en el futuro. Aún así, ciertas subpoblaciones como los pacientes inmunocomprometidos o con alta sospecha diagnóstica4 quizá deberían excluirse del cribado.
Geerts et al. encontraron diferencias importantes al dividir la población según el sexo, ya que el punto de corte aumentaba al doble en los varones, sin perjuicio del VPN. En nuestro estudio el punto de corte en los varones disminuyó a 13 bacterias/μl o 2,1 leucocitos/μl. No es un punto de corte tan robusto como el resto debido a la diferencia en el tamaño muestral (solo el 30%). Sin embargo, todos los falsos negativos correspondieron a cultivos con recuentos bajos, lo que le diferencia de los resultados obtenidos por Geerts. Dado que la contaminación es menos factible en muestras masculinas, y que la SEIMC considera recuentos clínicamente significativos >103 UFC/ml, consideramos importante mantener un criterio de positividad estricto en esta población. En el caso de las mujeres, sin embargo, el punto de corte se elevó hasta ≥21,2 bacterias/μl (tabla 5), mejorando la rentabilidad diagnóstica respecto a la población general.
Aunque la aplicación de los algoritmos diferenciales en función de la procedencia y el sexo de los pacientes no conllevó un aumento del rendimiento de cribado, sí lo hizo en el valor predictivo negativo, consiguiendo reducir el número de falsos negativos clínicamente significativos. Seguramente se habría rentabilizado más si se hubieran estudiado otros subgrupos, como pacientes con alta sospecha clínica, pero la diversidad de la procedencia de las muestras, y el sistema informático del laboratorio hacían difícil definir el diagnóstico de presunción, e impidió que se hiciera el estudio.
Por otra parte, cabe destacar que los datos recogidos muestran variaciones importantes con otros estudios, donde el porcentaje de cribado varía entre el 45 y el 60%10,13–16. El motivo de esta diferencia radica principalmente en el criterio de positividad de los cultivos, ya que la relación sensibilidad/especificidad para la identificación de cultivos con >105 UFC/ml es muy buena pero empeora drásticamente en muestras con recuentos inferiores3. En este sentido, a pesar de que la SEIMC recomienda un punto de corte de 50 bacterias/μl18, se bajó el rango para detectar los cultivos con recuentos inferiores y mantener la sensibilidad del 95%, óptima para la prueba de cribado. Esto comprometió el rendimiento de cribado de forma importante, por lo que haría falta hacer más estudios para valorar su coste-efectividad bajo estos criterios. Finalmente es necesario tener en cuenta que el número de leucocitos, eritrocitos y bacterias varía en función del uropatógeno aislado19, lo que puede alterar la reproducibilidad de los resultados.
En cuanto a los objetivos secundarios planteados en el estudio se analizó la capacidad de la citometría de flujo para la diferenciación de la morfología microbiana. La especificidad encontrada fue del 71% para los bacilos y 6% para los cocos. Estos resultados concuerdan con los ensayos de Geerts et al. con una tasa de categorización del 68% y 29% respectivamente20,21, por lo que parece que este parámetro no muestra una especificidad suficientemente alta para su utilización clínica. Por otro lado, los resultados obtenidos respecto al empleo de células epiteliales como marcadores de contaminación no fueron concluyentes, y a diferencia de otros estudios10 no se alcanzó una especificidad suficiente para su utilización en la práctica clínica.
En conclusión, el sistema de citometría de flujo podría evitar la siembra de un 32% de las muestras de orina incluso aplicando criterios estrictos de positividad en urocultivos con recuentos bajos. En nuestro hospital, la citometría de flujo habría evitado la siembra de 13.705 orinas en el año 2016. El uso combinado de los puntos de corte con la procedencia y el de los pacientes no supone un incremento importante en la rentabilidad de cribado, pero asegura una máxima sensibilidad y un alto valor predictivo negativo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.