Hay aspectos no bien aclarados en el postoperatorio de cirugía extracorpórea infantil, como la importancia de las alteraciones de la agregación plaquetaria.
ObjetivoAnalizar las alteraciones de agregación plaquetaria presentes en el postoperatorio de circulación extracorpórea pediátrico y ver su evolución temporal en primeras 24h.
Material y métodosEstudio analítico, de cohortes, prospectivo, observacional en niños de un mes a 14 años, sometidos a cirugía cardiaca mediante circulación extracorpórea entre 2010-2011. Muestras de sangre previo a la intervención (PRE), tras 1h del desclampaje (PO1) y tras 18-20h (PO2). Se analiza la agregación plaquetaria inducida por colágeno, araquidónico y ADP, valorando su correlación con los tiempos quirúrgicos y de clampaje aórtico.
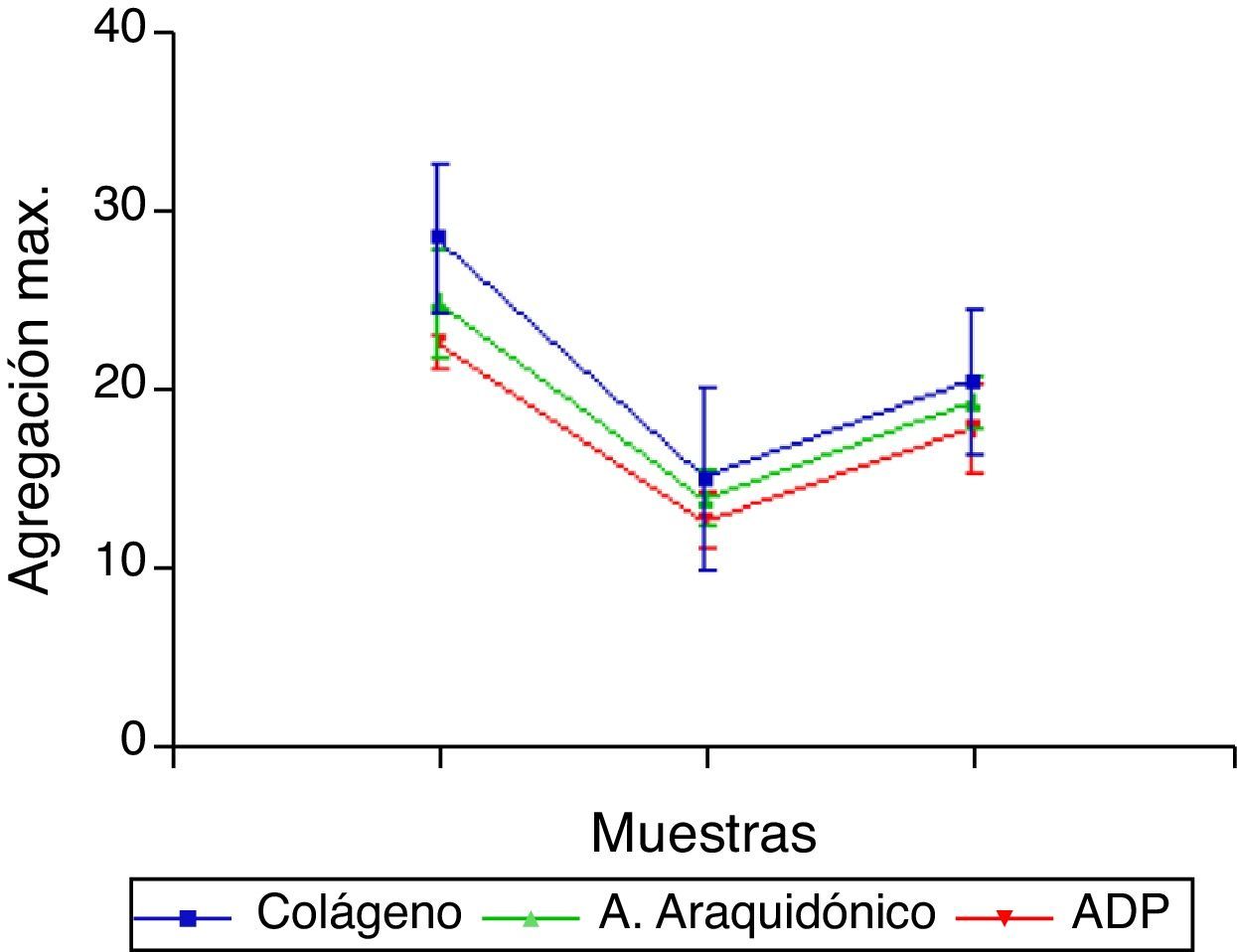
ResultadosTreinta pacientes; mediana 4,1 años (IQ: 2,7; 8,0); 62,1% niñas; mediana de desviaciones estándar de peso -0,39 (IQ: -0,76; 0,24), de talla -0,22 (IQ: -0,74; 0,27) y de IMC -0,43 (IQ: -1; 0,45). Mediana de tiempo quirúrgico 79min (IQ: 52,5; 125,5), mediana de clampaje 38,5min (IQ: 22, 59). La agregación inducida por colágeno es menor en PO1 (15,20±5,07) que en PRE (28,60±4,22) y en PO2 (20,60±3,98) empieza a ascender, pero aún es menor que en PRE; igual pasa con la inducida por araquidónico (25,00±2,94; 14,10±1,52; 19,50±1,43) y por ADP (22,90±1,66; 12,90±1,52; 18,00±2,49).
ConclusionesLa circulación extracorpórea infantil genera disfunción plaquetaria grave, máxima en postoperatorio inmediato y aún persistente tras 24h, independiente de tiempos de cirugía o clampaje; esto puede facilitar el sangrado en postoperatorio e influir en el uso de hemoderivados.
Some aspects of Cardiac Surgery with Extracorporeal Circulation in children are still not clear, one of which is impaired platelet aggregation.
ObjectiveTo analyze the Influence of Extracorporeal Circulation on changes in platelet aggregation in children<15 years in our center, and to observe these changes over time in first 24hours.
Material and MethodsAnalytical, cohort, prospective, observational study in children aged 1 month to 14 years, weight >5kg, undergoing cardiac surgery using cardiopulmonary bypass between 2010 and 2011. Blood samples were taken just before the intervention (PRE), after 1h of declamping (PO1), and after 18-20h (PO2). Platelet aggregation induced by collagen, arachidonic acid‘, and ADP were measured, assessing their correlation with surgery times and aortic clamping.
ResultsA total of 30 patients were included, with a median age of 4.1 years (IQR:2.7,8.0), 62.1% female, median weight of standard deviations of -0.39 (IQR:-0.76,0.24) of size -0.22 (IQR:-0.74,0.27) and BMI -0.43 (IQR:-1,0,45). Median surgery time 79min (IQR:52.5,125.5), clamping median 38.5min (IQR:22,59). Collagen induced aggregation is lower in PO1 (15.20±5.07) than in PRE (28.60±4.22), and rises again in PO2 (20.60±3.98), but is still less than in PRE; similarlywith arachidonic acid (25.00±2.94, 14.10±1.52, 19.50±1.43), and ADP (22.90±1.66, 12.90±1.52, 18.00±2.49).
ConclusionsCardiopulmonary bypass activates inflammatory mediators and causes a severe platelet dysfunction, which is maximum in immediate postoperative, and persistent even after 24hours, regardless of surgery and clamping times, which may lead to postoperative bleeding and determine the use of blood and even furher surgery.
El sangrado postoperatorio es la principal causa de morbimortalidad en cirugía cardíaca mediante circulación extracorpórea (CEC). Ocurre en un 5-25% de los pacientes, es una complicación seria de la cirugía cardíaca y se asocia a una incidencia aumentada de fallo cardíaco, hipotensión, shock, arritmias, infección y mortalidad. La hemostasia requiere de un buen control quirúrgico de los vasos sanguíneos traumatizados, revertir adecuadamente la heparinización, así como una buena función de las plaquetas y de los factores de coagulación. Muchos defectos hemostáticos se pueden observar en los pacientes después de CEC, pero el defecto más predecible que resulta de la cirugía de corazón abierto es la disfunción plaquetaria. Un serio problema en cualquier postoperatorio de CEC es el sangrado posquirúrgico en las primeras 6-8h, necesitándose manejar multitud de medicamentos y hemoderivados, con su consiguiente morbimortalidad y gasto económico.
Aunque las deficiencias plaquetarias cuantitativas y cualitativas son producidas por una variedad de factores que ocurren durante el perioperatorio1, la CEC es la principal causa de trastornos plaquetarios iatrógenos. La disfunción plaquetaria es la alteración hemostática más importante y es la principal causa de sangrado excesivo, produciéndose la activación de las plaquetas durante el paso de la sangre a través de los tubos plásticos, bombas de rodillo, oxigenador, aspiradores y filtros del circuito de CEC2. Varios mecanismos han sido propuestos para explicar este defecto de agregación plaquetaria, incluyendo productos de degradación de la fibrina, lesión de la membrana plaquetaria, liberación de gránulos de las plaquetas y lesión causada por altos flujos y cambios en la velocidad del flujo de sangre3.
La medición de la agregación de las plaquetas o agregometría plaquetaria fue inicialmente descrita en 1962 por Born4 por medio de turbidimetría (medición de la turbidez o densidad óptica). En la actualidad existen 2 métodos diferentes: el método óptico original con plasma rico en plaquetas y el método de impedancia con sangre completa5,6, que es el que se emplea en nuestro estudio. En estudios comparativos se reporta que esta última técnica proporciona resultados similares a los que se obtienen con el método clásico y que es superior para vigilar tratamientos antiplaquetarios y en el diagnóstico y seguimiento de estados de hiperactividad plaquetaria. Al igual que la agregometría convencional, la agregación por impedancia en sangre completa es relativamente insensible a la presencia de agregados de plaquetas.
ObjetivosAnalizar la evolución de la función de agregación plaquetaria en las primeras 24h tras el postoperatorio de cirugía cardiovascular pediátrica mediante CEC y valorar su correlación con los tiempos de CEC y de clampaje aórtico, así como contextualizar su repercusión e ritmo de sangrado y necesidad de transfusiones de hemoderivados.
Material y métodosEstudio longitudinal prospectivo de seguimiento clínico. Criterios de inclusión: pacientes pediátricos menores de 15 años de edad y más de 5kg de peso, que se intervinieron de cardiopatía congénita mediante CEC en nuestro centro, ingresando en unidad de cuidados intensivos pediátricos (UCIP).
Los 3 momentos de extracción de analítica son: preoperatorio, antes de la cirugía; postoperatorio 1 (PO1), tras 1h de desclampaje aórtico (en quirófano o en ya en UCIP, según el caso); postoperatorio 2 (PO2), en UCIP, tras 18-20h del final de la cirugía.
La agregación plaquetaria se mide mediante impedancia eléctrica, técnica en la que se coloca una muestra de sangre en una cubeta o recipiente a 37°C, se introducen 2 electrodos de platino a distancia fija y entre los electrodos se aplica una corriente eléctrica. La adición de un agonista (en nuestro estudio hemos empleado secuencialmente ADP, colágeno [Col] y ácido araquidónico [AA]) estimula la agregación de las plaquetas en la superficie de los electrodos, lo que impide el flujo de la corriente eléctrica. El aumento en la resistencia al flujo de electricidad es proporcional a la agregación de las plaquetas en torno a los electrodos y se genera una curva de agregación (medida en Ohmios).
Se realizó un análisis descriptivo de las variables con estimación puntual e intervalo de confianza para el 95% de seguridad, tratándose las variables continuas como medias, desviación estándar o medianas y rango intercuartílico, según la distribución de la variable. Las variables categóricas se presentarán en frecuencias y porcentajes. Se realizó un análisis multivariante con regresiones logísticas para identificar variables predictivas de entre las variables dependientes de interés, controlando por posibles factores de confusión e interacciones. Análisis estadístico bivariado mediante t de Student, siendo empleado para variables categóricas la diferencia de proporciones con Chi Cuadrado y finalmente la prueba de los rangos con signo de Wilcoxon, que es una prueba no paramétrica empleada para comparar la media de la agregación plaquetaria en sus diferentes tiempos, al ser 2 muestras relacionadas, y así determinar si existen diferencias entre ellas. Se utiliza como alternativa a la prueba t de Student cuando no se puede suponer la normalidad de dichas muestras.
ResultadosEn el actual trabajo fueron incluidos 30 niños, con una edad mediana de 4,1 años (IQ: 2,7-8,0); 11 varones (37,9%), 18 mujeres (62,1%). Las cirugías realizadas han sido 11 cierres de comunicaciones interauriculares, 2 cirugías de estenosis pulmonar, 3 correcciones completas de tetralogía de Fallot, 3 correcciones de canales AV, 6 cierres de comunicación interventricular, 2 cirugías de estenosis aórtica, 2 correcciones de corazón univentricular (una mediante técnica de Glenn y otra mediante Fontan) y una corrección anatómica de transposición de grandes arterias. Por grupos, podemos dividir las cirugías en: shunt I-D, que eran 22 casos (73,3%), shunt D-I, correspondiendo a 3 casos (10%), y obstrucción de tracto de salida de VD o de VI, 5 casos (16,6%).
Los tiempos quirúrgicos finales empleados son divididos en 2 apartados: un tiempo total de CEC, con una mediana de 79 (IQ: 52,5-125,5) min y un tiempo de clampaje aórtico, que está incluido dentro del anterior, con una mediana de 38,5 (IQ: 22-59) min.
Los valores indicativos de la agregación plaquetaria (fig. 1) demuestran una caída en la resistencia en los tiempos postoperatorio 1 y 2, en las 3 formas diferentes de medición. Además se encuentran diferencias entre los tiempos PRE y PO1, entre los PO1 y PO2 y aún entre los PRE y PO2, mediante aplicación de la prueba no paramétrica de Friedman y test de Wilcoxon (tabla 1), siendo diferencias estadísticamente significativas entre los valores de la agregación plaquetaria en las 3 formas de medición (Col, AA, ADP) comparando los 3 tiempos (p<0,001 en los 3 casos). Se efectúan comparaciones múltiples y se describe igualmente que los datos difieren significativamente (p<0,016) entre sí en los 3 momentos tras aplicar la prueba de Wilcoxon aplicando la corrección de Bonferroni para controlar la tasa de error.
Tabla de valores de agregación plaquetaria (inducida por colágeno [Col], araquidónico [AA] y ADP, medidas en Ohmios) y análisis estadístico (prueba de Friedman y de Wilcoxon). Resultados como mediana y rango intercuartílico
| Col | AA | ADP | |
| PRE | 29,0 (26,0-31,5) | 25,0 (23,25-28,0) | 23,0 (21,7-24,2) |
| PO1 | 13,5 (11,0-20,2)* | 14,0 (13,0-15,2)* | 13 (11,7-14,0)* |
| PO2 | 19,5 (17,7-24,2)*a | 19,0 (18,0-21,0)*a | 17,5 (16,0-20,2)*a |
PRE representa preoperatorio; PO1, tras 1h de desclampaje aórtico; PO2, en UCIP, tras 18-20h del final de la cirugía.
La mediana del ritmo de sangrado de las primeras 8hposquirúrgicas es de 1,00 (IQ: 0,37–1,74) ml/kg/h frente a 0,61 (IQ: 0,18–0,95) ml/kg/h de las siguientes 10h, con diferencia estadísticamente significativa (p<0,05) y con correlación estadísticamente significativa (rho de Spearman 0,66; p<0,0001) entre ellos.
Todos los pacientes recibieron transfusión de plaquetas en quirófano, pero analizando lo recibido exclusivamente tras su llegada a la unidad de intensivos, 9/30 pacientes recibieron transfusión de hematíes, pero solo 2/30 requirieron plaquetas y 6/30 de plasma fresco congelado. Entre los que recibieron plaquetas posquirúrgicas no se apreciaba diferencia en agregabilidad con respecto a los no transfundidos.
La media de drenaje en ambos períodos es mayor en los que necesitaron transfusión (1,56±0,96 en primeras 8h; 0,85±0,54 en siguientes 10h) que en los que no la necesitaron (0,79±0,58; 0,43±0,36), con diferencias estadísticamente significativas.
Tras haberles aplicado test estadísticos de correlación no paramétricos se puede apreciar que la agregación plaquetaria (en sus 3 formas de medirse en nuestro trabajo) y los tiempos de CEC y clampaje aórtico son completamente independientes. Sin embargo, las variables con correlación estadísticamente significativa con el drenaje en primeras 8h son tiempo de CEC (Rho Spearman 0,63, p<0,0001), el de clampaje aórtico (Rho 0,46, p=0,014), agregación inducida por araquidónico (Rho -0,655, p=0,05) y por ADP (Rho -0,75, p=0,019), mientras que con el drenaje en segundas 10h solo los tiempos de CEC (Rho 0,69, p<0,0001) y de clampaje aórtico (Rho 0,55, p=0,002).
DiscusiónLa mayoría de los estudios de agregación plaquetaria en humanos se han realizado en adultos, siendo aislados los encontrados en niños7. Nuestro trabajo está realizado en la edad pediátrica, que siempre tiene el serio problema de la amplia variabilidad en cuanto a diferentes grados de maduración de los sistemas enzimáticos corporales, lo cual puede hacer en diferentes trabajos que no haya posibilidades de comparar grupos etarios diferentes, para lo cual es una ventaja que nuestro grupo sea bastante homogéneo en términos de edad.
La cirugía cardíaca constituye un escenario ideal para el estudio del daño inducido por isquemia-reperfusión, al ser procesos reproducibles, con una isquemia larga y una reperfusión controlada tras el clampaje aórtico8. La CEC no es un modelo puro, pues está «maquillado» por los efectos de la anestesia, la hipotermia, la cardioplejia y la propia circulación extracorpórea, que pueden resultar factores de confusión. En nuestro modelo, al realizar la primera determinación una vez realizada la inducción anestésica, ya habiendo empleado los medicamentes que se van a mantener en el resto de la CEC, creemos que ese factor queda solventado, al estar todas las muestras obtenidas tras haberse iniciado la anestesia.
Ya otros trabajos demuestran que la alteración en la activación plaquetaria postoperatoria es similar tanto en cardiopatías cianóticas como en no cianóticas9, al igual que ocurre en nuestra serie, pese al bajo número de cianóticas que aportamos. Sin embargo algunas publicaciones encuentran mayor afectación en los cianóticos, aunque afirman que no es por la cianosis en sí sino por otras circunstancias10. Las plaquetas descienden en números absolutos, consecuencia, por una parte, de la adhesión a las superficies del circuito y filtros, y por otra, por efecto de la hemodilución11. Se ha publicado que estos descensos alcanzan como término medio un 45% de los valores iniciales. La hipotermia que se aplica en algunos casos puede colaborar a la trombocitopenia por un efecto de secuestro transitorio en el organismo. Cuando se utilizan oxigenadores de burbuja, la interfase sangre-aire da lugar a la destrucción de un buen número de plaquetas. Las plaquetas que persisten presentan un cierto grado de trastorno funcional (trombocitopatía adquirida)12 consecuencia de la degranulación, de la hipotermia, por pérdida de los receptores de membrana, situaciones que hacen que las plaquetas respondan con una menor sensibilidad a los agentes inductores de la adhesión y agregación plaquetaria (Col, ARA, ADP)13. Por ello suele ser normal ver niveles no muy bajos de plaquetas en el postoperatorio de CEC pero con mala función de las mismas.
Como agonistas plaquetarios, en nuestro trabajo, se ha empleado el ADP al ser una sustancia liberada por los gránulos densos, araquidónico por ser liberado por la propia plaqueta para convertirse en tromboxano A2 y Col por ser un componente endotelial, y así haber podido explorar las diferentes formas de agregación14. Se justifica el descenso de actividad plaquetaria por una posible preactivación in vivo.
Ya otros trabajos demuestran que en el postoperatorio inmediato hay una clara alteración de la agregabilidad plaquetaria con ascenso paulatino sin llegar a la normalidad aún en las primeras 24h10, similar a lo encontrado en nuestro estudio.
Se demuestra en nuestro trabajo que la alteración de la agregabilidad plaquetaria persiste durante las primeras 24h pero no se correlaciona de forma importante con el ritmo de sangrado, dado que esos pacientes reciben frecuentemente fármacos (como protamina como inhibidor de la heparina empleada en la CEC) y transfusiones de plaquetas en quirófano y plasma en otras ocasiones, ya en la unidad de intensivos
Como es lógico, en nuestro estudio se comprueba que los pacientes con mayor drenaje en las primeras 24h del postoperatorio son los que mayor necesidad de hemoderivados tienen. Además se demuestra que la alteración en la agregación no es dependiente de los tiempos de CEC ni de clampaje aórtico, pero sin embargo que la hipoagregación plaquetaria sí contribuye al mayor ritmo de sangrado en primeras 8h, pero no al tener en cuenta el drenaje en las primeras 24h acumuladas de estancia en cuidados intensivos; este drenaje sí es claramente dependiente del tiempo de CEC y en menor grado del tiempo de clampaje15, siendo por todo ello necesario el manejo adecuado del resto de factores hemostáticos, con su consiguiente consumo de recursos sanguíneos, como plasma, fibrinógeno o plaquetas, y de fármacos, como factor VII, de alto impacto económico.
ConclusionesEn la CEC infantil se aprecia un grado de disfunción plaquetaria grave, siendo máximo tras el clampaje aórtico y mejorando algo a las 24h. Sin saberse bien los mecanismos, esta disfunción parece facilitar claramente el sangrado en el postoperatorio inmediato, que es algo que puede complicar en gran medida el manejo clínico en la UCIP, pero sin llegar a poner en riesgo de necesidad de reintervención y su tratamiento no es determinante en el cese del sangrado. El sangrado posquirúrgico depende en menor grado de la alteración de la agregabilidad plaquetaria que de los otros factores implicados en la hemostasia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.