Los procesos febriles constituyen uno de los motivos de consulta más frecuentes en las urgencias pediátricas, siendo las infecciones bacterianas una de las principales causas responsables de los mismos. Su diagnóstico es un reto a superar pues representan una importante causa de morbimortalidad. Entre los biomarcadores séricos utilizados, es la procalcitonina la que aparece en el suero con anterioridad a otros biomarcadores inflamatorios agudos tales como el número de leucocitos en circulación periférica y la proteína C reactiva.
Material y métodosSe utilizaron muestras de 135 pacientes pediátricos recogidas mediante punción en el dedo o talón. Las determinaciones se realizaron respectivamente en plasma y sangre seca recogida sobre papel (DBS), en la misma muestra de cada uno de ellos.
ResultadosEl estudio estadístico comparativo realizado entre los resultados obtenidos en ambos tipos de muestras, nos indica la existencia de una correlación estadísticamente significativa entre muestras analizadas por ambas metodologías. El test U de Mann-Whitney aplicado asimismo, manifiesta la no existencia de diferencias estadísticamente significativas entre los resultados.
ConclusionesLas muestras DBS tienen una gran utilidad para la cuantificación de los niveles de procalcitonina en la población pediátrica donde, con frecuencia, la extracción de sangre venosa presenta dificultades. La obtención de este tipo de muestra por simple punción en el talón o yema del dedo evita este problema, contribuyendo al diagnóstico rápido de los procesos infecciosos.
No obstante, podría mejorarse la sensibilidad del método realizando determinaciones seriadas en aquellas muestras con valores iniciales bajos (menores de 0,650 ng/mL).
Fever processes constitute one of the main reasons for pediatric emergency department visits, being bacterial infections one of the principal causes of this process. Its diagnosis represents a challenge to overcome, due to the high morbidity and mortality rates related to these infections. Among analyzed serum biomarkers, procalcitonin shows an earlier appearance in serum than others inflammatory biomarkers such as peripheral blood leukocytes number and C-reactive protein.
Materials and methodsBlood samples were collected by finger or heel puncture from 135 pediatric patients. Procalcitonin was measured in plasma and in dried blood specimen (DBS) for each blood sample.
ResultsThe comparative statistical analysis has revealed a significant correlation between the two procalcitonin assays. The Mann-Whitney U test has demonstrated that there was no difference on the procalcitonin results obtained by both techniques.
ConclusionsDBS represent a useful tool for quantifying procalcitonin levels in pediatric population, where venous blood collection is usually difficult. The extraction of this type of blood sample, by finger or heel puncture, avoids this problem, contributing to a rapid diagnosis of this kind of infectious processes. However, method sensitivity could be improved by performing serial measurements in samples with low basal levels (lower than 0.650 ng/mL).
La procalcitonina (PCT) es un péptido de 116 aminoácidos, uno de los precursores de la calcitonina1, proteína codificada por el gen CALC1 (11p15.4) cuya función fisiológica permanece incierta. Las infecciones bacterianas inducen un incremento ubicuo en la expresión del gen CALC-I y la subsiguiente liberación de precursores de calcitonina en los diferentes tejidos del organismo2.
Los procesos febriles constituyen uno de los motivos de consulta más frecuentes en las urgencias pediátricas, siendo las infecciones bacterianas una de las principales causas. Su diagnóstico es un reto a superar pues representan una importante causa de morbimortalidad3,4.
El diagnóstico de las infecciones bacterianas es a veces complicado, debido a la similitud en la presentación clínica de procesos infecciosos originados por diferentes agentes causales (bacterias o virus), e incluso por otros estados inflamatorios de diferente etiología.
El diagnóstico preciso de las mismas se realiza mediante pruebas específicas bacteriológicas o inmunológicas que originan un retraso en el conocimiento de sus resultados. Así, es de especial interés el uso de biomarcadores séricos cuya rápida determinación evidencie, precozmente, la existencia del proceso infeccioso. Entre estos, es la PCT la que aparece en el suero de los pacientes con anterioridad a otros marcadores inflamatorios agudos tradicionalmente utilizados como el aumento en el número de leucocitos periféricos y/o la proteína C reactiva5.
El principal estímulo para la liberación de PCT durante un proceso infeccioso es la endotoxina bacteriana responsable, produciendo un incremento en las concentraciones séricas de PCT a las 3-4h del mismo, alcanzando concentraciones máximas a las 6-8h y permaneciendo elevada al menos durante 24-30h6. La proteína C reactiva, por el contrario, requiere de 12 a 24 h para elevarse y de 20 a 72 h para llegar a una meseta, manteniéndose elevada durante 3 a 7 días7.
La PCT es un excelente biomarcador de infecciones bacterianas en niños, mostrando buena correlación con la severidad de la enfermedad, pudiendo utilizarse asimismo como marcador pronóstico8–10, decreciendo inmediatamente tras la administración específica de antibióticos11.
Es bien conocida la dificultad que aparece en la mayoría de los casos, de obtener un volumen adecuado de muestra en recién nacidos y niños pequeños, y la preocupación de realizar una extracción excesiva de sangre, pudiendo así provocar una anemia inducida por flebotomía. Este hecho está facilitando que se busquen y adopten otras alternativas para solucionar estos posibles problemas.
Las muestras de sangre seca recogida sobre papel (DBS) de pacientes con una posible infección constituyen un método accesible de toma, almacenaje y envío de muestras al laboratorio de referencia. La experiencia del cribado en neonatos empleando DBS, ha mostrado ser eficaz y sencilla12. Las muestras DBS también han sido empleadas en el diagnóstico de diversas enfermedades genéticas, metabólicas e infecciosas12,13.
El uso de este tipo de muestras presenta la misma precisión y reproducibilidad que las muestras líquidas, siendo muchos los metabolitos cuantificables en las mismas y, entre ellos, la PCT.
La determinación de PCT en DBS presenta muchas ventajas en relación con las muestras de sangre líquida14, empleándose volúmenes de sangre significativamente menores recogidos mediante una pequeña punción en el talón o en el dedo, evitando el uso de jeringuillas y reduciendo el gasto de infraestructuras, de material de laboratorio y permitiendo, asimismo, el envío a los laboratorios mediante el correo ordinario.
ObjetivoEstudiar la posible aplicación de las muestras DBS en el diagnóstico y monitorización de infecciones bacterianas mediante la determinación del biomarcador PCT, comparándolo con el método tradicional de electroquimioluminiscencia (ECLIA) en plasma utilizado en nuestro laboratorio.
Material y métodosPoblación de estudioEl trabajo de selección de los pacientes y de recogida de las muestras se realizó desde el laboratorio de urgencias de nuestro hospital. Se recogieron las muestras de sangre enviadas para determinación de PCT de aquellos pacientes con sospecha de infección bacteriana comprendidos entre 0 a 14 años de edad, procedentes en su mayoría del Servicio de Urgencias Pediátricas con fiebre como principal síntoma, y de la Unidad de Cuidados Intensivos.
Se distribuyeron en diferentes grupos según la interpretación clínica de sus resultados (tabla 1).
Interpretación de los resultados de PCT
| Niveles de PCT | Interpretación |
|---|---|
| < 0,5ng/mL | Individuo sano Proceso inflamatorio crónico Infecciones víricas y bacterianas localizadas |
| 0,5 a 2,0ng/mL | Infecciones víricas y bacterianas localizadas Posible sepsis Sepsis severa o shock séptico improbable |
| 2,1 a 10,0ng/mL | Infección bacteriana sistémica (sepsis) muy probable |
| > 10,0ng/mL | Sepsis severa o shock séptico muy probables, existiendo riesgo de fallo multiorgánico |
Se analizaron un total de 135 muestras de sangre recogidas en BD Microtainer® de 500μL conteniendo EDTA-dipotásico, obtenidas mediante punción venosa y/o capilar en la yema del dedo o talón en el Hospital Infantil Virgen del Rocío de Sevilla. Estas se procesaron como muestras urgentes, en el mismo día.
Para la obtención de la muestra de DBS se usó papel cromatográfico Whatman 903® utilizado para la realización del programa de cribado neonatal.
Con la muestra, una vez extraída, se procedió del siguiente modo: tras la realización del hemograma en un autoanalizador Sysmex XE-2100™ se realizó la impregnación del papel con 60μL de la sangre total en cada uno de los círculos de 1,5cm de diámetro que contiene, teniendo especial cuidado en que se rellenasen completamente, así como que la sangre traspasase a la cara posterior del papel. De este modo, aseguramos una buena homogeneidad de la muestra. Tras dejarse secar a temperatura ambiente durante 4 h se introdujeron, de modo individual, en bolsas de plástico perfectamente cerradas, guardándose preservadas de la humedad a 4°C hasta la determinación analítica.
A continuación, se procedió a la centrifugación de los microtainers a 3.500rpm durante 5 min en centrífuga de microtainers. En el plasma obtenido, y conservado a 4°C hasta la determinación analítica, se llevó a cabo la determinación de PCT siguiendo el procedimiento normalizado para cualquier tipo de muestra, en el mismo día.
El procesamiento de las muestras de DBS se realizó del siguiente modo:
- 1)
Se troquelaron cada una de ellas, utilizando un puncher de 3,2mm de diámetro, obteniéndose 5 discos para cada una de las muestras. Cada disco contiene absorbido un volumen de sangre de 3,42μL.
- 2)
Los 5 discos de cada muestra se introdujeron en tubos de ensayo de 12×75mm, añadiéndose 250μL de agua destilada para la elución completa de los mismos.
- 3)
El proceso de elución se realizó en un agitador orbital sometiéndose a una agitación de 1.000rpm durante 30 min. Posteriormente se centrifugaron a 3.500 rpm en centrífuga refrigerada a 4°C durante 5 min.
- 4)
El sobrenadante obtenido se utilizó para cuantificar la PCT mediante un ensayo de ECLIA con el kit Elecsys BRAMMS PCT de Roche Diagnostics, en un autoanalizador cobas e601.
- 5)
Los cálculos finales para obtener las concentraciones de PCT de nuestras muestras se realizaron de la siguiente forma:
Dado que utilizamos 5 discos por muestra, cada uno conteniendo 3,42μL, el volumen final de sangre utilizado fue de 17,1μL. No obstante, y puesto que la PCT es de localización extracelular, este volumen fue corregido teniendo en cuenta el valor hematocrito de cada una de ellas.
La elución se realizó siguiendo la metodología tradicional para la determinación de múltiples analitos e incluso DNA15–17 con 250μL de agua destilada, calculándose el factor de dilución total a que fue sometida la muestra. El resultado obtenido en el eluido en nuestro autoanalizador fue multiplicado, en cada caso, por el factor de dilución final.
La determinación de la PCT en las DBS se realizó en tandas de 15 muestras, una vez por semana, para asegurar así un buen control del pretratamiento de las mismas y obtención del eluido final sobre el que se determinó el nivel de PCT mediante la metodología ECLIA.
El estudio estadístico se realizó mediante el programa SPSS v.20 (IBM).
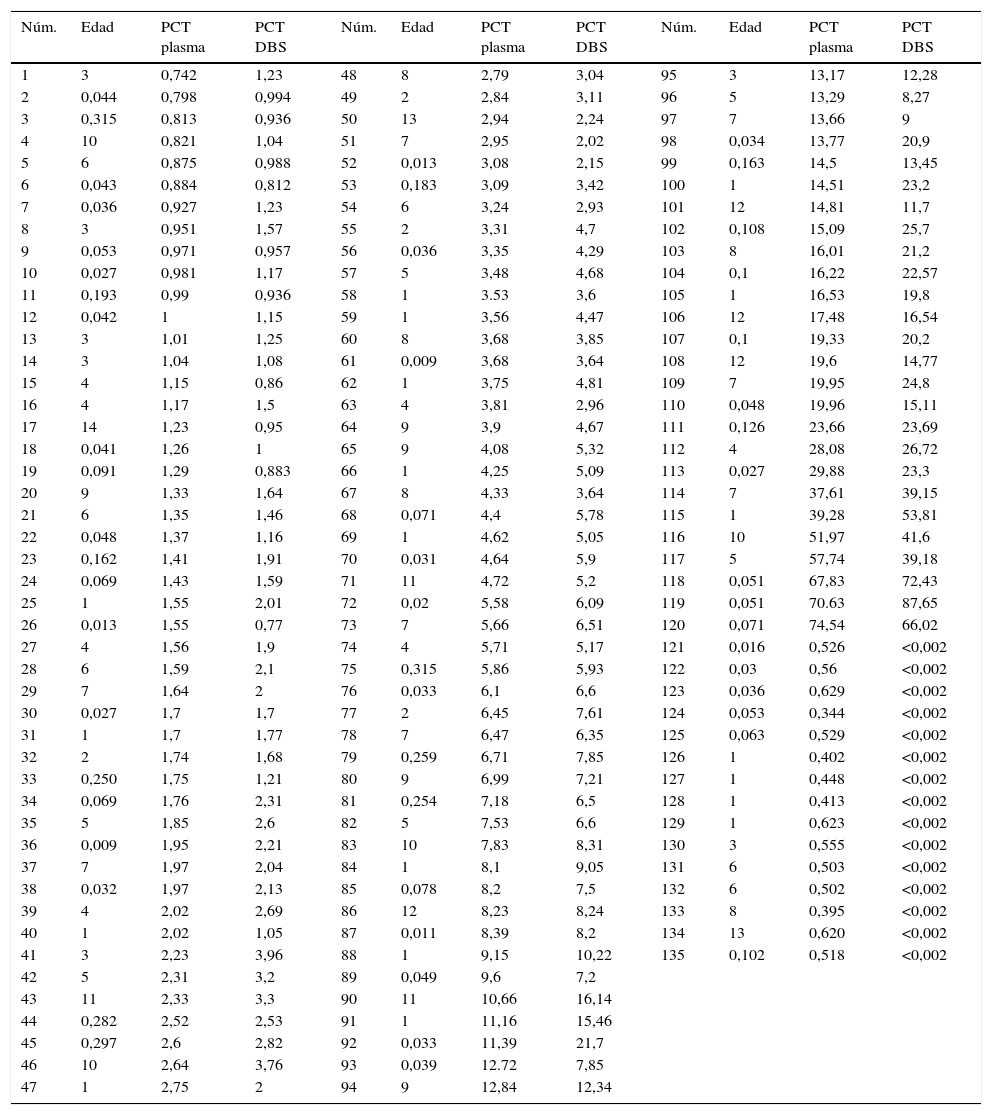
ResultadosEn este estudio se analizaron un total de 135 muestras de sangre, a las que se les determinaron los niveles de PCT en plasma y en sangre seca en papel, utilizando la metodología establecida en nuestro laboratorio (ECLIA).
Las muestras estudiadas fueron agrupadas en 4 grupos en función del nivel de PCT presentado. Grupo1: <0,740ng/mL (n=15), grupo 2: 0,740-1,99ng/mL (n=38), grupo 3: 2-10ng/mL (n=51) y grupo 4:>10ng/mL (n=31), comprendidos en el rango de edad de 0 a 14 años.
Aunque nuestra n total es de 135 muestras, pudimos observar que muestras con niveles de PCT inferiores a 0,650ng/mL no pueden ser cuantificadas mediante la metodología en DBS ya que, en las 15 estudiadas, los valores estaban por debajo del límite de detección de la técnica tradicional cuyo valor es de 0,020ng/mL. En la tabla 2 se muestran los valores obtenidos por ambos métodos para la totalidad de las muestras.
Muestras de procalcitonina analizadas
| Núm. | Edad | PCT plasma | PCT DBS | Núm. | Edad | PCT plasma | PCT DBS | Núm. | Edad | PCT plasma | PCT DBS |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 3 | 0,742 | 1,23 | 48 | 8 | 2,79 | 3,04 | 95 | 3 | 13,17 | 12,28 |
| 2 | 0,044 | 0,798 | 0,994 | 49 | 2 | 2,84 | 3,11 | 96 | 5 | 13,29 | 8,27 |
| 3 | 0,315 | 0,813 | 0,936 | 50 | 13 | 2,94 | 2,24 | 97 | 7 | 13,66 | 9 |
| 4 | 10 | 0,821 | 1,04 | 51 | 7 | 2,95 | 2,02 | 98 | 0,034 | 13,77 | 20,9 |
| 5 | 6 | 0,875 | 0,988 | 52 | 0,013 | 3,08 | 2,15 | 99 | 0,163 | 14,5 | 13,45 |
| 6 | 0,043 | 0,884 | 0,812 | 53 | 0,183 | 3,09 | 3,42 | 100 | 1 | 14,51 | 23,2 |
| 7 | 0,036 | 0,927 | 1,23 | 54 | 6 | 3,24 | 2,93 | 101 | 12 | 14,81 | 11,7 |
| 8 | 3 | 0,951 | 1,57 | 55 | 2 | 3,31 | 4,7 | 102 | 0,108 | 15,09 | 25,7 |
| 9 | 0,053 | 0,971 | 0,957 | 56 | 0,036 | 3,35 | 4,29 | 103 | 8 | 16,01 | 21,2 |
| 10 | 0,027 | 0,981 | 1,17 | 57 | 5 | 3,48 | 4,68 | 104 | 0,1 | 16,22 | 22,57 |
| 11 | 0,193 | 0,99 | 0,936 | 58 | 1 | 3.53 | 3,6 | 105 | 1 | 16,53 | 19,8 |
| 12 | 0,042 | 1 | 1,15 | 59 | 1 | 3,56 | 4,47 | 106 | 12 | 17,48 | 16,54 |
| 13 | 3 | 1,01 | 1,25 | 60 | 8 | 3,68 | 3,85 | 107 | 0,1 | 19,33 | 20,2 |
| 14 | 3 | 1,04 | 1,08 | 61 | 0,009 | 3,68 | 3,64 | 108 | 12 | 19,6 | 14,77 |
| 15 | 4 | 1,15 | 0,86 | 62 | 1 | 3,75 | 4,81 | 109 | 7 | 19,95 | 24,8 |
| 16 | 4 | 1,17 | 1,5 | 63 | 4 | 3,81 | 2,96 | 110 | 0,048 | 19,96 | 15,11 |
| 17 | 14 | 1,23 | 0,95 | 64 | 9 | 3,9 | 4,67 | 111 | 0,126 | 23,66 | 23,69 |
| 18 | 0,041 | 1,26 | 1 | 65 | 9 | 4,08 | 5,32 | 112 | 4 | 28,08 | 26,72 |
| 19 | 0,091 | 1,29 | 0,883 | 66 | 1 | 4,25 | 5,09 | 113 | 0,027 | 29,88 | 23,3 |
| 20 | 9 | 1,33 | 1,64 | 67 | 8 | 4,33 | 3,64 | 114 | 7 | 37,61 | 39,15 |
| 21 | 6 | 1,35 | 1,46 | 68 | 0,071 | 4,4 | 5,78 | 115 | 1 | 39,28 | 53,81 |
| 22 | 0,048 | 1,37 | 1,16 | 69 | 1 | 4,62 | 5,05 | 116 | 10 | 51,97 | 41,6 |
| 23 | 0,162 | 1,41 | 1,91 | 70 | 0,031 | 4,64 | 5,9 | 117 | 5 | 57,74 | 39,18 |
| 24 | 0,069 | 1,43 | 1,59 | 71 | 11 | 4,72 | 5,2 | 118 | 0,051 | 67,83 | 72,43 |
| 25 | 1 | 1,55 | 2,01 | 72 | 0,02 | 5,58 | 6,09 | 119 | 0,051 | 70.63 | 87,65 |
| 26 | 0,013 | 1,55 | 0,77 | 73 | 7 | 5,66 | 6,51 | 120 | 0,071 | 74,54 | 66,02 |
| 27 | 4 | 1,56 | 1,9 | 74 | 4 | 5,71 | 5,17 | 121 | 0,016 | 0,526 | <0,002 |
| 28 | 6 | 1,59 | 2,1 | 75 | 0,315 | 5,86 | 5,93 | 122 | 0,03 | 0,56 | <0,002 |
| 29 | 7 | 1,64 | 2 | 76 | 0,033 | 6,1 | 6,6 | 123 | 0,036 | 0,629 | <0,002 |
| 30 | 0,027 | 1,7 | 1,7 | 77 | 2 | 6,45 | 7,61 | 124 | 0,053 | 0,344 | <0,002 |
| 31 | 1 | 1,7 | 1,77 | 78 | 7 | 6,47 | 6,35 | 125 | 0,063 | 0,529 | <0,002 |
| 32 | 2 | 1,74 | 1,68 | 79 | 0,259 | 6,71 | 7,85 | 126 | 1 | 0,402 | <0,002 |
| 33 | 0,250 | 1,75 | 1,21 | 80 | 9 | 6,99 | 7,21 | 127 | 1 | 0,448 | <0,002 |
| 34 | 0,069 | 1,76 | 2,31 | 81 | 0,254 | 7,18 | 6,5 | 128 | 1 | 0,413 | <0,002 |
| 35 | 5 | 1,85 | 2,6 | 82 | 5 | 7,53 | 6,6 | 129 | 1 | 0,623 | <0,002 |
| 36 | 0,009 | 1,95 | 2,21 | 83 | 10 | 7,83 | 8,31 | 130 | 3 | 0,555 | <0,002 |
| 37 | 7 | 1,97 | 2,04 | 84 | 1 | 8,1 | 9,05 | 131 | 6 | 0,503 | <0,002 |
| 38 | 0,032 | 1,97 | 2,13 | 85 | 0,078 | 8,2 | 7,5 | 132 | 6 | 0,502 | <0,002 |
| 39 | 4 | 2,02 | 2,69 | 86 | 12 | 8,23 | 8,24 | 133 | 8 | 0,395 | <0,002 |
| 40 | 1 | 2,02 | 1,05 | 87 | 0,011 | 8,39 | 8,2 | 134 | 13 | 0,620 | <0,002 |
| 41 | 3 | 2,23 | 3,96 | 88 | 1 | 9,15 | 10,22 | 135 | 0,102 | 0,518 | <0,002 |
| 42 | 5 | 2,31 | 3,2 | 89 | 0,049 | 9,6 | 7,2 | ||||
| 43 | 11 | 2,33 | 3,3 | 90 | 11 | 10,66 | 16,14 | ||||
| 44 | 0,282 | 2,52 | 2,53 | 91 | 1 | 11,16 | 15,46 | ||||
| 45 | 0,297 | 2,6 | 2,82 | 92 | 0,033 | 11,39 | 21,7 | ||||
| 46 | 10 | 2,64 | 3,76 | 93 | 0,039 | 12.72 | 7,85 | ||||
| 47 | 1 | 2,75 | 2 | 94 | 9 | 12,84 | 12,34 |
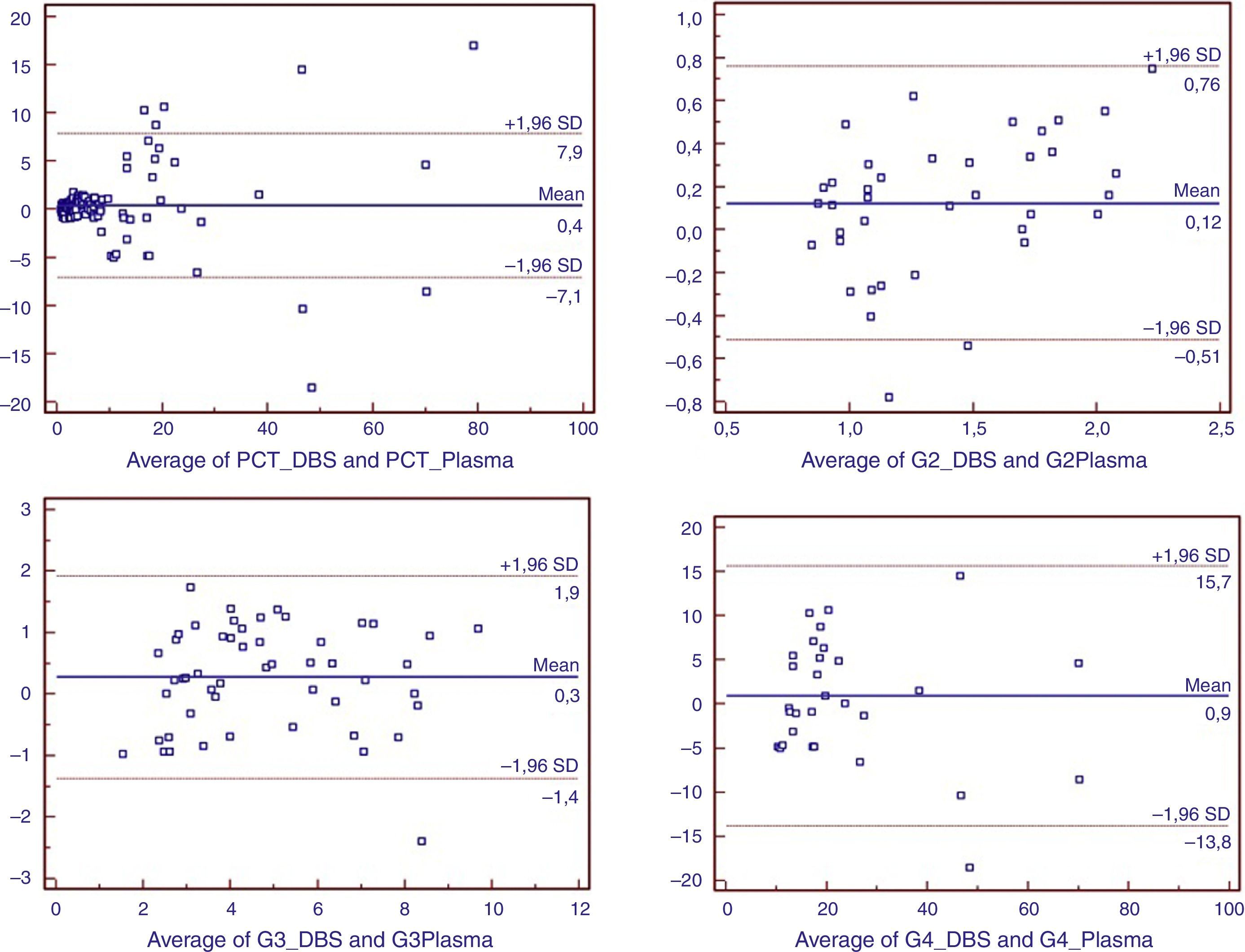
Puesto que la muestra analizada no seguía una distribución normal (test de Kolmogorov-Smirnov, p<0,001), y con el fin de explicar la variabilidad obtenida entre ambos métodos, se analizaron el coeficiente de correlación de Spearman, el método de regresión Passing-Bablock y el análisis de Bland-Altman para evaluar la concordancia entre ambos métodos.
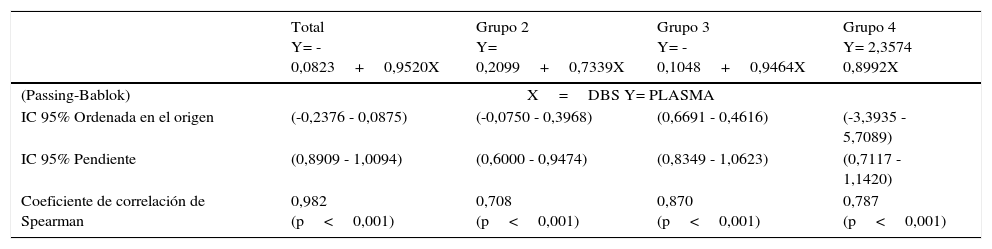
Los resultados del coeficiente de correlación de Spearman y el análisis de Passing-Bablock se expresan en la tabla 3.
Resultados Passing-Bablock y correlación de Spearman
| Total Y= -0,0823+0,9520X | Grupo 2 Y= 0,2099+0,7339X | Grupo 3 Y= -0,1048+0,9464X | Grupo 4 Y= 2,3574 0,8992X | |
|---|---|---|---|---|
| (Passing-Bablok) | X=DBS Y= PLASMA | |||
| IC 95% Ordenada en el origen | (-0,2376 - 0,0875) | (-0,0750 - 0,3968) | (0,6691 - 0,4616) | (-3,3935 - 5,7089) |
| IC 95% Pendiente | (0,8909 - 1,0094) | (0,6000 - 0,9474) | (0,8349 - 1,0623) | (0,7117 - 1,1420) |
| Coeficiente de correlación de Spearman | 0,982 (p<0,001) | 0,708 (p<0,001) | 0,870 (p<0,001) | 0,787 (p<0,001) |
Finalmente, y para comprobar si existían diferencias entre las medias de ambas poblaciones se aplicó el test U de Mann-Whitney mostrándonos (p=0,200) la no existencia de diferencias entre las mismas.
En la figura 1 se representa el análisis de Bland-Altman de la totalidad de las muestras así como distribuidas por grupos.
DiscusiónEl diagnóstico de los procesos infecciosos febriles presenta un especial interés ya que, hasta en un 30% de las ocasiones, pueden suponer una infección bacteriana masiva de la que deriven graves consecuencias18.
Entre los diferentes biomarcadores utilizados, la PCT es el parámetro más utilizado actualmente en las urgencias hospitalarias. La PCT es un compuesto estable en las muestras obtenidas19 y, su fácil determinación, su moderado coste, y la rapidez en la obtención de los resultados, hacen que constituya una valiosa herramienta adicional para el diagnóstico y manejo de las infecciones bacterianas en pediatría20,21.
Diferentes estudios señalan la gran sensibilidad y especificidad que presenta, mostrando mayor coste-efectividad que otros parámetros analíticos en diferentes procesos infecciosos22,23. Aún no es considerado como el parámetro «gold standard» para este tipo de eventos debido a que su valor predictivo negativo no es siempre del 100%, pudiendo conducir, en algunas ocasiones, a interpretaciones erróneas.
Diferentes metaanálisis realizados para la evaluación de procesos febriles en poblaciones pediátricas24,25 concluyen que los niveles de PCT plasmáticos deben utilizarse en combinación con criterios de predicción clínica para aumentar la eficacia de los datos obtenidos. En nuestro estudio, puede observarse la utilidad del empleo de este biomarcador corroborado por el diagnóstico definitivo posterior. La excelente correlación existente entre los niveles de PCT analizados en ambos tipos de muestras (plasma/sangre seca en papel) en el mismo paciente, la concordancia entre las mediciones (según el análisis de Bland-Altman realizado) así como la falta de significación estadística entre sus resultados, es clara expresión de la utilidad de la muestra DBS. No obstante el estudio presenta una limitación cuando estamos ante valores bajos de PCT. Como se muestra anteriormente en los resultados, en 15 de nuestras muestras no se pudieron determinar los valores de PCT, siendo el valor mínimo medido en DBS de 0,650ng/mL. Por ello, a pesar de la buena correlación que existe entre métodos, se deben manejar los resultados con cautela en estos casos para tomar decisiones clínicas siendo recomendable, en caso de valores iniciales bajos, el repetir la determinación pasadas 4-5 h, por si nos encontrásemos ante el inicio precoz de un proceso séptico grave26.
El hecho de poder determinar este marcador mediante DBS tiene un especial interés para la población pediátrica donde, con frecuencia, la extracción de sangre venosa presenta dificultades. La obtención de la muestra por punción en el talón o yema del dedo evita este problema contribuyendo al diagnóstico rápido de este tipo de procesos infecciosos, permitiéndonos instaurar el tratamiento específico que disminuirá las complicaciones que estas pueden originar.
La obtención de valores de PCT en los niveles de la normalidad permitirá una mejor optimización de los recursos hospitalarios evitando ingresos, así como el uso inadecuado de antibióticos en procesos inflamatorios no infecciosos, donde no solo son ineficaces sino que contribuyen al desarrollo de resistencias, aumentan los costes, y añade los riesgos de toxicidad y reacciones alérgicas derivadas de su uso.
Podemos concluir de nuestro estudio la existencia de una buena correlación entre métodos, y las ventajas que aporta el uso de las muestras DBS. No obstante podría mejorarse la sensibilidad del método ya que no podría excluirse la presencia de infección en aquellas muestras con resultados bajos (inferiores a 0,650ng/mL), siendo recomendable realizar determinaciones seriadas en estos casos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.