El test combinado del primer trimestre permite seleccionar a las gestantes con un riesgo elevado de portar un feto con cromosomopatía con una sensibilidad y especificidad elevadas. Estas gestantes tras consejo genético pueden decidir someterse a una técnica invasiva para confirmar el diagnóstico. El objetivo de este trabajo es calcular la sensibilidad, el valor predictivo negativo y la tasa de falsos positivos del test combinado del primer trimestre en nuestro laboratorio.
Material y métodosSe estudiaron 4.494 gestantes (incluidas tanto las de embarazo único como gemelar) a las que se realizó el test combinado del primer trimestre: PAPP-A, b-HCG libre y translucencia nucal. Se comprobó el resultado del cariotipo en las gestantes cuyo cribado fue de riesgo elevado para Síndrome de Down (SD), de Edwards (SE) o ambos. En aquellas gestantes que decidieron no someterse a técnicas diagnósticas invasivas, se utilizó el cariotipo de los recién nacidos. El riesgo se calculó con el programa Prisca v.4.0.15.9® de DPC Dipesa® considerándose elevado un riesgo >1/270.
ResultadosDe todas las gestantes estudiadas, 260 mostraron un riesgo elevado: 201 para SD, 39 para SE y 20 para ambos. Se obtuvieron para SD y SE, respectivamente: verdaderos positivos (VP): 5 y 5; falsos positivos (FP): 216 y 54; verdaderos negativos (VN): 4273 y 4435; falsos negativos (FN): 0 y 0; Sensibilidad (S): 100% para ambos; Especificidad (E): 95% y 99%. Valor predictivo positivo (VPP): 2% y 8%; valor predictivo negativo(VPN): 100% para ambos. La tasa de falsos positivos fue del 4,83% para SD y de 1,20% para SE.
ConclusionesEl cribado del primer trimestre es una herramienta eficaz que permite seleccionar a las gestantes con un riesgo >1/270 de portar un feto con cromosomopatía con una sensibilidad, especificidad y valor predictivo negativo elevados. Además su realización conlleva una disminución del número de técnicas diagnósticas invasivas.
First trimester combined screening test for chromosomal anomalies, with its high sensitivity and specificity, can help predict the risk of carrying a foetus with a chromosomal anomaly. Those pregnant women with a high risk can, after genetic advice, then decide to have an invasive diagnostic test. The aim of this article was to determine the sensitivity, negative predictive value and false positive rate of the first trimester combined screening test in our laboratory.
Material and methodsFirst trimester combined screening test was performed on 4494 pregnant women. The test consists of determining PAPP-A, free β-HCG and nuchal translucency. Karyotype was found in all pregnant women who had a high risk for Down's Syndrome (DS), Edward's Syndrome (ES) or both. Karyotype of the newborn was used for pregnant women who decided not to have the invasive diagnostic test. Risk was calculated with Prisca Software v.4.0.15.9® (DPC Dipesa®), considering >1/270 as high risk.
ResultsOut of the total of pregnant women, 260 first trimester screenings had a risk >1/270; 201 for DS, 39 for ES and 20 for both. The data obtained for DS and ES, respectively, were: true positives (TP): 5 and 5; false positives (FP): 216 and 54; true negatives (TN): 4273 and 4435; false negatives (FN): 0 and 0; Sensitivity: 100% for both; Specificity: 95% and 99%. Positive predictive value (PPV): 2% and 8%; negative predictive value (NPV): 100% for both. False positive rate was 4.83% for DS and 1.20% for ES.
ConclusionThe first trimester combined screening test is an efficient tool that reduces the number of invasive diagnostic tests, due to its high sensitivity, specificity and negative predictive value.
El creciente interés clínico por el conocimiento de la evolución fetal y por la detección precoz de las alteraciones cromosómicas que pudieran incidir negativamente en el correcto desarrollo físico y psíquico del feto, ha conducido a los investigadores al estudio de nuevos marcadores que ligados al embarazo, nos ofrezcan de una forma rápida, segura y fiable la información necesaria para su detección.
La trisomía 21, anomalía citogenética causante del Síndrome de Down (SD), es la aneuploídia más frecuentemente observada al nacimiento en la especie humana1 y su incidencia aumenta conforme lo hace la edad materna. Así, el riesgo de tener un hijo con SD aumenta de forma lineal hasta los 30 años y de forma exponencial a partir de dicha edad2. Estudios más recientes señalan que la prevalencia podría declinar en lugar del incremento exponencial clásicamente admitido a partir de los 45 años3,4.
A partir de estas curvas y de la edad materna puede estimarse el riesgo teórico de cualquier gestante individual de portar un feto con SD en el momento del parto.
Considerando una población con una edad materna media en el momento del parto de 27 años±5 años, la prevalencia de SD al nacimiento se estima en 1,3 por 1.000 nacidos vivos. Esta distribución poblacional se considera estándar para evaluar la eficacia del cribado de cromosomopatías.
La diferente distribución de edad materna en distintas poblaciones influye de forma relevante en la incidencia global de SD y por tanto, en las tasas de detección y de falsos positivos de cualquier estrategia de cribado de SD.
Debido a que el riesgo de SD se incrementa con la edad materna, este fue el primer parámetro utilizado como variable para seleccionar a la población de riesgo para ser sometida a amniocentesis. El «punto de corte» de edad materna se consensuó en la década de los 70 y se situó en los 35 años5, por el hecho de que, a esta edad, se produce la confluencia de 2 tipos de criterios: uno económico y otro ético. El criterio económico, usado en países con sistemas públicos de salud, se dirigió a acotar el coste que supondría la realización extensiva de las técnicas invasivas. El criterio ético, en uso en países con sanidad fundamentalmente privada, considera como aceptable que el número de pérdidas fetales que ocasione la técnica invasiva sea similar al de casos de SD detectados, y se sustentó en que a los 35 años de edad el riesgo de trisomía 21 en el segundo trimestre (1 en 270) se igualaría aproximadamente al riesgo de pérdidas fetales relacionadas con la amniocentesis.
Sin embargo, dado que el número de embarazadas menores de 35 años es muy superior al de las que superan dicha edad, la estrategia basada en ofrecer una técnica invasiva para el diagnóstico de cromosomopatías a las embarazadas añosas solo permite conseguir una tasa de detección del 30%.
En cuanto a la utilización de marcadores bioquímicos como cribado, en un principio se propuso la determinación de la alfafetoproteína (AFP) y la subunidad beta total de la HCG (βHCG total) en el segundo trimestre de embarazo. Sin embargo, para permitir un diagnóstico más precoz de los fetos afectados, se estudiaron nuevos de marcadores que pudieran ser útiles en fases más precoces de la gestación, entre los que destacaron la subunidad beta libre de la HCG (βHCG libre) y la Proteína A Plasmática Asociada al Embarazo (PAPP-A)6.
Estos 2 marcadores bioquímicos son realmente útiles si además se acompaña de la medición ecográfica del grosor de la translucencia nucal (TN), aumentando la sensibilidad y especificidad en la detección de cromosomopatías fetales6,7.
La TN se evaluó en los primeros estudios mediante un punto de corte fijo, pero pronto se observó que se incrementa con la edad gestacional. En 1996 se publicó la primera curva de valores de referencia de TN respecto de la Longitud Cefalo-Caudal (LCC), para evitar la imprecisión de la edad gestacional derivada de la amenorrea. En dicho estudio se observó que el tipo de regresión que mejor se ajustaba era la ecuación cuadrática logarítmica8.
La demostración de que la medida de la TN es independiente de PAPP-A y de β-HCG libre tanto en fetos cromosómicamente normales como en fetos con alteraciones cromosómicas6, hizo posible la combinación de estos marcadores bioquímicos con el marcador ecográfico de la medición de la TN en un solo algoritmo de cálculo, mediante una prueba que se ha denominado «Test Combinado».
Además de la medición de la TN también se ha propuesto como marcador la aplasia o hipoplasia del hueso nasal como un marcador muy especifico de SD29–32, sin embargo su uso no está establecido debido a su baja tasa de detección.
Hay que tener en cuenta que los marcadores usados en el cribado del SD presentan patrones diferenciados en caso de otras trisomías; en el primer trimestre en gestantes portadoras de fetos con SD las concentraciones séricas de PAPP-A están más bajas y las de β-HCG libre están más elevadas que en gestantes que portan fetos sin cromosomopatías, mientras que las concentraciones séricas tanto de PAPP-A como de β-HCG libre están más bajas en gestantes con fetos afectados de trisomía 18 o 13 y en las triploidías, que en gestantes que portan fetos sin cromosomopatías. En base a lo descrito, se han publicado estudios que sugieren que al cribado del SD se puede añadir un algoritmo específico de cálculo del riesgo para las trisomías 18 y/o 13 en el primer trimestre7,9–11.
Para estandarizar los marcadores se usa como unidad de medida el Múltiplo de la Mediana (MoM), que se obtiene dividiendo la concentración sérica del marcador entre la mediana propia del laboratorio para ese marcador, en base a la edad gestacional de la embarazada.
Esta operación permite la comparación de los valores entre distintos laboratorios que usen técnicas de medición diferentes. La edad gestacional, necesaria para la conversión en MoM, se obtiene a partir de datos ecobiométricos fetales o, cuando no se dispone de estos datos, por la fecha de la última regla (FUR)12.
Para poder realizar el cálculo de la razón de probabilidad, es necesario que la distribución de cada marcador tanto en la población general de sujetos normales como en la de sujetos afectados, sea de tipo Gaussiana. Los MoMs no se distribuyen de forma Gaussiana, pero sí lo hacen aproximadamente su transformación logarítmica en base 10, por lo que se debe proceder a efectuar dicha transformación. Además, los valores extremos de los marcadores no suelen ajustarse a la distribución Gaussiana, por lo que es necesario truncarlos si exceden de los correspondientes límites.
Se han descrito algunos factores que afectan a la precisión de los marcadores bioquímicos: peso materno13, ascendencia étnica14, hábito tabáquico15, gestación múltiple16, diabetes17 y embarazo por FIV18; por lo que se han propuesto ajustes o correcciones para tenerlos en cuenta durante el cálculo. La forma más simple de ajuste consiste en multiplicar el valor del marcador (expresado en MoM) por un factor de corrección.
Las tasas de detección del test pueden verse afectadas también por la imprecisión en la medida de la TN por lo que se requiere un entrenamiento que aporte una cierta experiencia así como la utilización de unos ecógrafos precisos y un continuo control de calidad externo22. Hay disparidad de opiniones en cuanto a si se debe usar una mediana de TN única para todos los ecografistas que participen en un programa de cribado o si existe la necesidad de usar medianas propias para cada centro, o incluso medianas específicas para cada ecografista23,24.
La mediana de los MoMs de TN en fetos normales se suele representar por un valor común (la unidad) para todo el periodo comprendido entre las semanas 11–13. Sin embargo, se ha demostrado que la mediana de los MoM de TN en los fetos afectados de SD decrece conforme avanza la gestación. Así las medianas de los MoM de la TN en fetos afectados serían de 2,31 (en la semana 11), 2,10 (en la semana 12) y 1,91 MoM (en la semana 13). Este descubrimiento implica que la medición de la TN, en contra de lo que se creía, es más eficaz cuanto más precozmente se realice dentro de los límites aceptados para el cribado del primer trimestre25.
El objetivo de este trabajo es calcular la sensibilidad y el valor predictivo negativo (VPN) del test combinado del primer trimestre en nuestro laboratorio así como la tasa de falsos positivos (TFP).
Material y métodosPacientesEn el estudio retrospectivo se incluyeron las 4.494 gestantes a las que se realizó el test combinado del primer trimestre entre el 01/01/2006–15/01/2007 en el laboratorio de análisis clínicos del Hospital Universitario Virgen de la Arrixaca (Murcia).
Test combinadoEl test combinado del primer trimestre se realiza en un paso e incluye la determinación de parámetros bioquímicos (PAPP-A y β-HCG libre) y de parámetros ecográficos (medición de la TN).
La determinación de PAPP-A y β-HCG libre se realiza en el Immulite 2000 de DPC Dipesa® de acuerdo al protocolo del fabricante. Se trata de un ensayo enzimático inmunométrico quimioluminiscente en fase sólida, siendo para la β-HCG un ensayo secuencial con 2 sitios de unión.
La TN se mide ecográficamente por el ginecólogo de cada gestante entre 11.a –14.a semana de gestación (LCC entre 45–84mm) según las recomendaciones de la Sociedad Española de Ginecología y Obstetricia (SEGO)19.
Además de la TN también se debe medir la LCC, que nos permitirá determinar la edad gestacional correcta.
El ginecólogo también debe aportar los datos epidemiológicos que pueden afectar a los MoM como son el peso materno, ascendencia étnica, hábito tabáquico, gestación múltiple y diabetes.
El riesgo se calcula con el software Prisca v.4.0.15.9® de DPC Dipesa®, que calcula los MoM del PAPP-A, β-HCG y TN. Utiliza el algoritmo de Spencer et al6 para calcular el riesgo de SD en el primer trimestre y el algoritmo de Tul et al7 para calcular el riesgo de Trisomía 18 o Síndrome de Edwards (SE) en el primer trimestre. Una vez que se ha obtenido el valor de los MoM, se calcula el ratio para esos valores, y la combinación de todos los posibles ratios junto con el riesgo relacionado con la edad materna darán el cálculo del riesgo definitivo, considerándose elevado un riesgo >1/270.
CariotipoLos cariotipos se realizaron en el Centro de Bioquímica y Genética Clínica, Sección de Citogenética (Murcia) a partir de las metafases obtenidas del cultivo celular de líquido amniótico, vellosidad corial o aborto procedente de las gestantes que se habían sometido a técnicas invasivas y de sangre periférica de los recién nacidos con sospecha de cromosomopatía.
Se realizó bandeo GTG de las extensiones de metafases y se contaron al microscopio los cromosomas de unas 20–30 metafases, de las cuales se capturaron 3 con el software Ikaros (Karyotiping System v5.0., Metasystems GMBH) para determinar el cariotipo.
Recopilación de datosTodos los datos fueron recopilados de la base de datos de Omega 2000 (Roche diagnostics®) y de la base de datos de citogenética.
En la base de datos de Omega 2000 se seleccionaron aquellos cribados con un riesgo >1/270 para SD, SE o ambos entre 01/01/2006–15/01/2007. Se comprobó si las gestantes con dichos riesgos elevados se habían sometido a una técnica invasiva; para ello se consultó en la base de datos de citogenética, si se había realizado algún estudio de liquido amniótico, vellosidad corial o aborto de dichas gestantes y además, en aquellas que aparecían en la base de datos, se comprobó el resultado para determinar tanto los VP como los FP.
De esta forma obtuvimos el porcentaje de gestantes con riesgo elevado que se habían sometido a una técnica invasiva.
Por otra parte se recopilaron de la base de datos de citogenética entre 1/01/06–1/02/07 aquellos cariotipos con alteraciones cromosómicas de líquido amniótico o biopsia de vellosidad corial y se comprobó el riesgo de todas ellas en la base de datos Omega 2000 (Roche diagnostics®) para determinar el número de estas gestantes con un riesgo bajo (<1/270) que serían FN.
También se recopilaron de la base de datos de citogenética las gestantes con un aborto con cariotipo con alteraciones cromosómicas entre 1/01/06–25/06/07. Se comprobó el riesgo de ellas en la base de datos Omega 2000 (Roche diagnostics®) para determinar el número de estas con un riesgo bajo (<1/270) que serían FN.
Además también se recopilaron de la base de datos de citogenética los cariotipos de sangre periférica de los recién nacidos con alguna alteración cromosómica entre 1/01/06–30/07/07 y se comprobó el riesgo de las gestantes portadoras de los mismos para determinar si alguna de ellas tenía un riesgo <1/270 y por tanto determinar los otros posibles FN; o si alguna de ellas tenía un riesgo >1/270 y por tanto era VP y había decidido no realizarse técnica diagnóstica invasiva o había decidido llevar el embarazo a término.
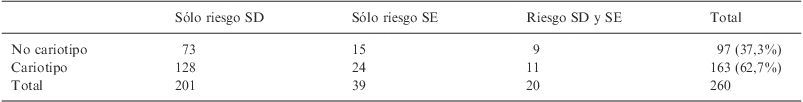
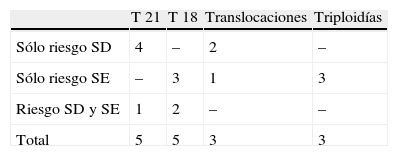
ResultadosDurante el periodo descrito se estudiaron 4.494 gestantes, a las que se calculó el riesgo teórico con el Test Combinado del primer trimestre entre las semanas 11–14 de gestación. Del total de gestantes estudiadas 260 mostraron un riesgo elevado; 201 para SD, 39 para SE y 20 para ambos (tabla 1). De las gestantes con riesgo elevado solo para SD, 128 pacientes decidieron realizarse el estudio del cariotipo resultando 4 con trisomía 21 y 2 con translocación. De las gestantes con riesgo elevado solo para SE, se realizaron el cariotipo 24 pacientes resultando 3 con trisomía 18, 3 con cariotipo triploide y 1 con translocacion. Entre las gestantes con riesgo elevado para ambos, resultó 1 cariotipo con trisomía 21 y 2 con trisomía 18 (tabla 2).
Distribución de riesgos elevados del Test Combinado del primer trimestre y de realización de cariotipo
| Sólo riesgo SD | Sólo riesgo SE | Riesgo SD y SE | Total | |
| No cariotipo | 73 | 15 | 9 | 97 (37,3%) |
| Cariotipo | 128 | 24 | 11 | 163 (62,7%) |
| Total | 201 | 39 | 20 | 260 |
SD: Síndrome de Down; SE: Síndrome de Edwards.
Distribución de cariotipos con alteraciones cromosómicas según el riesgo elevado del Test Combinado del primer trimestre
| T 21 | T 18 | Translocaciones | Triploidías | |
| Sólo riesgo SD | 4 | – | 2 | – |
| Sólo riesgo SE | – | 3 | 1 | 3 |
| Riesgo SD y SE | 1 | 2 | – | – |
| Total | 5 | 5 | 3 | 3 |
SD: Síndrome de Down; SE: Síndrome de Edwards; T21: Trisomía 21; T18: Trisomía 18.
Se obtuvieron para SD y SE, respectivamente: VP: 5 y 5; FP: 216 y 54; VN 4273 y 4435; FN: 0 y 0; sensibilidad: 100% para ambos; especificidad: 95% y 99%. VPP: 2% y 8%; VPN: 100% para ambos. La TFP fue del 4,8% para SD y de 1,20% para SE.
El 84,32% de las gestantes que realizaron el test combinado eran menores de 35 años y el 15,68% tenían 35 años o más.
Las embarazadas con riesgo elevado que portaban fetos con SD, 2 eran mayores de 35 años y 3 menores de 35 años; y de las pacientes con fetos con SE, 3 eran mayores de 35 años y 2 eran menores de 35 años.
En el laboratorio de citogenética se diagnosticaron 60 trisomías 21 (32 por amniocentesis o biopsia de vellosidad corial y 28 por cariotipo de sangre periférica en los recién nacidos) y 13 trisomías 18 (11 por amniocentesis, biopsia de vellosidad corial o aborto y 2 por cariotipo de sangre periférica en los recién nacidos).
Entre las gestantes que portaban un feto con SD, diagnosticado por amniocentesis o biopsia de vellosidad corial, únicamente 6 tenían realizado el cribado prenatal, 5 por test combinado del primer trimestre y 1 por doble test bioquímico del segundo trimestre (AFP+βHCG total), resultando el riesgo para todas ellas mayor de 1/270. El resto se habían realizado la amniocentesis por edad materna avanzada o por signos ecográficos alterados.
De las gestantes con feto con SE, 5 se habían realizado el cálculo del riesgo por test combinado del primer trimestre, resultando el riesgo para todas ellas mayor de 1/270. El resto se habían realizado la amniocentesis por edad materna avanzada o por signos ecográficos alterados.
El 60% de las gestantes con fetos con cariotipo de trisomía 21 eran mayores de 35 años mientras que en el caso de las embarazadas con fetos con trisomía 18, el 70% eran mayores de 35 años.
Hubo 2 gestantes con un riesgo normal que decidieron someterse a una amniocentesis con el resultado una de Síndrome de Turner y la otra con cariotipo con polimorfismo por una inversión en el cromosoma Y.
DiscusiónEl test combinado del primer trimestre se realiza entre las semanas de gestación 10–14, midiendo la TN del feto por ecografía y determinando los parámetros de βHCG libre y PAPP-A en el suero materno. Para este test se ha establecido una sensibilidad de entre un 83 y más de un 90% y una TFP entre un 4–5%, sin embargo en nuestro hospital se han identificado el 100% de los fetos con trisomía 21 y 18 cuyas madres se habían sometido al cribado, con una TFP del 4,83% para SD y 1,20% para SE.
Además también se han detectado 3 translocaciones y 3 triploidías, lo cual sugeriría la utilidad del test combinado para detectar otras alteraciones cromosómicas además del SD y del SE.
Existe una significativa variación temporal de los MoM de los marcadores bioquímicos usados en el cribado de SD a lo largo de la gestación20,21, lo cual hace que cada marcador tenga un perfil de eficacia distinto en cada momento de la gestación. Por ello, cuando se usan varios marcadores, se debe elegir el periodo de tiempo ideal en el que su determinación conjunta aumente su eficacia. En la semana 11 se consigue aumentar la sensibilidad y especificidad del test, así como disminuir la TFP; por ello se debería establecer un protocolo por el cual todas las gestantes se realizaran el test combinado del primer trimestre en la semana 11 en lugar de entre las semanas 11–14. Además, los algoritmos de cálculo deben tener en cuenta estas variaciones temporales para determinar el riesgo de cada embarazo con mayor exactitud.
Diferentes estudios sugieren que el test con una mayor tasa de detección sería el test integrado (primer trimestre: TN, βHCG libre y PAPP-A; segundo trimestre: alfafetoproteina, estriol conjugado, βHCG total e inhibina A) con una sensibilidad del 94–96% y una TFP inferior a la del programa combinado del primer trimestre26,27. Sin embargo este test tiene varias desventajas, por una parte un mayor coste, las dificultades organizativas en cuanto a la obligada visita de la paciente en 2 momentos diferentes para que sea posible su realización y también otras de carácter ético, dado que en ocasiones debería aplazarse la información sobre hallazgos significativos, ecográficos o de laboratorio, en el primer trimestre a la espera de completar el cribado en el segundo.
En nuestro caso la ventaja del test integrado no sería su mayor sensibilidad, puesto que con el test combinado hemos detectado todas las pacientes con fetos con SD que se han sometido al cribado, sino que sería la reducción de la TFP, ya que reduciría el número de amniocentesis a realizar y por tanto la morbilidad del test combinado.
Actualmente la SEGO recomienda la realización de una ecografía en el primer trimestre para fijar la edad gestacional, descartar alteraciones estructurales, y determinar si es una gestación única, gemelar o múltiple. Aunque en el test combinado del primer trimestre, el mejor momento para la medición de la TN es la semana 11, en tanto que la determinación de los marcadores bioquímicos es óptima a la semana 1028, estos se determinan en nuestro caso en el mismo día que la ecografía, facilitando así la realización del test combinado pues si no tendríamos el mismo problema que el test integrado, ya que se debería citar a la paciente en 2 ocasiones.
La determinación precoz del riesgo con el test combinado permite anticipar las actitudes diagnósticas y propuestas terapéuticas además de la aplicación de técnicas invasivas más precoces que la amniocentesis como es la biopsia de vellosidades coriales. La reducción del tiempo de espera en obtener información diagnóstica conlleva una menor repercusión psicológica y morbilidad materna en caso de la realización de la interrupción voluntaria del embarazo.
El hecho de que en nuestro estudio el 60% de las mujeres con fetos con SD y el 70% con fetos con SE sea mayor de 35 años deja constancia del hecho del mayor riesgo de alteraciones genéticas en gestantes de mayor edad, aunque estos datos no concuerdan con lo publicado, que propone que de los casos de SD, únicamente el 30% son en mujeres gestantes mayores de 35, ya que aunque estas tienen mayor riesgo de portar un feto con SD, el número de gestantes es mucho menor que el de mujeres menores de 35 años.
Un aspecto muy importante a tener en cuenta del test combinado del primer trimestre es la reducción del número de técnicas invasivas que su realización conlleva, puesto que en nuestro caso se aconsejó la realización de las mismas a 260 gestantes (número de gestantes con riesgo >1/270 para SD y/o SE) y si se hubieran realizado a todas las gestantes mayores de 35 de este estudio, el número de técnicas invasivas hubiera sido de más de 700.
El que solo 6 de los 60 casos con SD y 5 de los 13 casos con SE diagnosticados en la sección de citogenética del Centro de Bioquímica y Genética Clínica de la Región de Murcia se hayan realizado cribado prenatal indica que todavía está en fase de implantación el Test Combinado del primer trimestre en nuestra región y que todavía no está en conocimiento de toda la población su disponibilidad. Por ello, es necesario que se siga una política en la que todas mujeres gestantes tengan acceso a este sistema de cribado. De esta forma se disminuirá el número de amniocentesis innecesarias, con la consiguiente disminución del coste tanto económico como en posibles pérdidas fetales que conlleva su práctica.
ConclusionesEl test combinado del primer trimestre es una herramienta eficaz que permite seleccionar a las gestantes con un riesgo >1/270 de portar un feto con cromosomopatía con una sensibilidad, especificidad y valor predictivo negativo, elevados. Además su realización conlleva una disminución del número de técnicas diagnósticas invasivas.