La electroforesis capilar es una técnica rápida y automatizada que permite la detección de componentes monoclonales en suero con alta sensibilidad, estando ampliamente instaurada en los laboratorios clínicos. Se han descrito sin embargo, falsos positivos y negativos que plantean problemas a la hora de interpretar el trazado electroforético. Los falsos positivos son debidos fundamentalmente a sustancias exógenas no proteicas presentes en la muestra que absorben radiación en la región ultravioleta dando lugar a picos anómalos en el proteinograma. Los falsos negativos se deben en su mayoría a la baja concentración del componente monoclonal, aunque se han descrito también cuando se encuentran en alta concentración, debidos principalmente a las propiedades físico-químicas de la paraproteína que provocan una separación incorrecta de la misma. Presentamos una serie de casos con componentes monoclonales de tipo IgA e IgM, detectados inicialmente por electroforesis de acetato de celulosa y presentes en la muestra en alta concentración, en los que la electroforesis capilar tuvo problemas para su detección.
Capillary electrophoresis is a fast, automated and highly sensitive technique for the detection of monoclonal components in serum that is being increasingly introduced in clinical laboratories. Nevertheless, false negative and positive results have been reported, and thus the electrophoretic pattern may be difficult to interpret. False positive results are chiefly due to exogenous substances other than proteins present in serum, which absorb at UV wavelengths and can produce an abnormal spike. False negative results are mainly due to very low concentrations of monoclonal components. However, high concentration monoclonal components may not be correctly detected due to the physicochemical properties of the paraproteins, which may cause anomalous separation. In this work, we study three cases with high concentration monoclonal components of the IgA and IgM classes. They were initially detected on cellulose acetate electrophoresis, but the capillary electrophoresis was not able to correctly detect them.
La electroforesis capilar (EC) es ampliamente utilizada en los laboratorios clínicos como técnica de rutina para la separación de las proteínas séricas, siendo una técnica rápida, automatizada y de alta sensibilidad para la detección de componentes monoclonales1,2. La separación de las proteínas por EC se realiza en un medio líquido y se caracteriza por la utilización de volúmenes muy reducidos de muestra que se hacen pasar por un tubo capilar de sílice expuesto a voltajes muy altos. La migración es dependiente de la carga neta de la proteína y está muy influenciada por el flujo electroosmótico. A diferencia de las técnicas electroforéticas en soporte sólido, la detección de las proteínas se basa en la lectura directa en el ultravioleta (200nm, 214nm) de la absorbancia de las uniones peptídicas.
La técnica sin embargo, está sujeta a interferencias que dan lugar a falsos positivos y negativos en la detección del componente monoclonal (CM) y que pueden plantear problemas en la interpretación del trazado electroforético. Los falsos positivos, se deben principalmente a interferencias por sustancias no proteicas exógenas, tales como antibióticos y contrastes radiológicos que absorben a esas longitudes de onda3–5 dando lugar a la aparición de picos estrechos en el proteinograma sugerentes de un CM. Respecto a los falsos negativos, la mayoría de las ocasiones se deben a que el CM se encuentra en muy baja concentración o bien a que está superpuesto con otra banda6. También se han descrito casos excepcionales en los que la EC no detectó el CM a pesar de estar presente en la muestra en alta concentración, debido a características físico-químicas de la paraproteína tales como un alto punto isoeléctrico, grado de polimerización o tamaño molecular, que provocan una separación incorrecta en los equipos de EC7,8.
El objetivo del trabajo es describir tres casos de pacientes con CM de tipo IgA e IgM, detectados inicialmente por electroforesis de acetato de celulosa y presentes en las muestras en alta concentración, en los que la EC presentó problemas para su detección.
Material y métodosLa detección del CM en los pacientes en el momento del diagnóstico, se realizó mediante electroforesis en acetato de celulosa en el sistema automático Hite 320 (Olympus GmbH). El CM se identificó mediante inmunofijación (Helena Bioscience Europe). El proteinograma sérico e inmunosustracción en el seguimiento posterior se realizó por EC en un analizador Paragon CZE® 2000 (Beckman Coulter). La confirmación de la presencia del CM se hizo mediante inmunofijación en el sistema Hydrasys Automate (Sebia). La cuantificación de las inmunoglobulinas en el diagnóstico y seguimiento se realizó por inmunonefelometría en un nefelómetro Immage® 800 (Beckman Coulter). Los valores de referencia de las inmunoglobulinas establecidos para adultos son: IgA 0,7–4,0g/l, IgG 7–16g/l, IgM 0,4–2,5g/l.
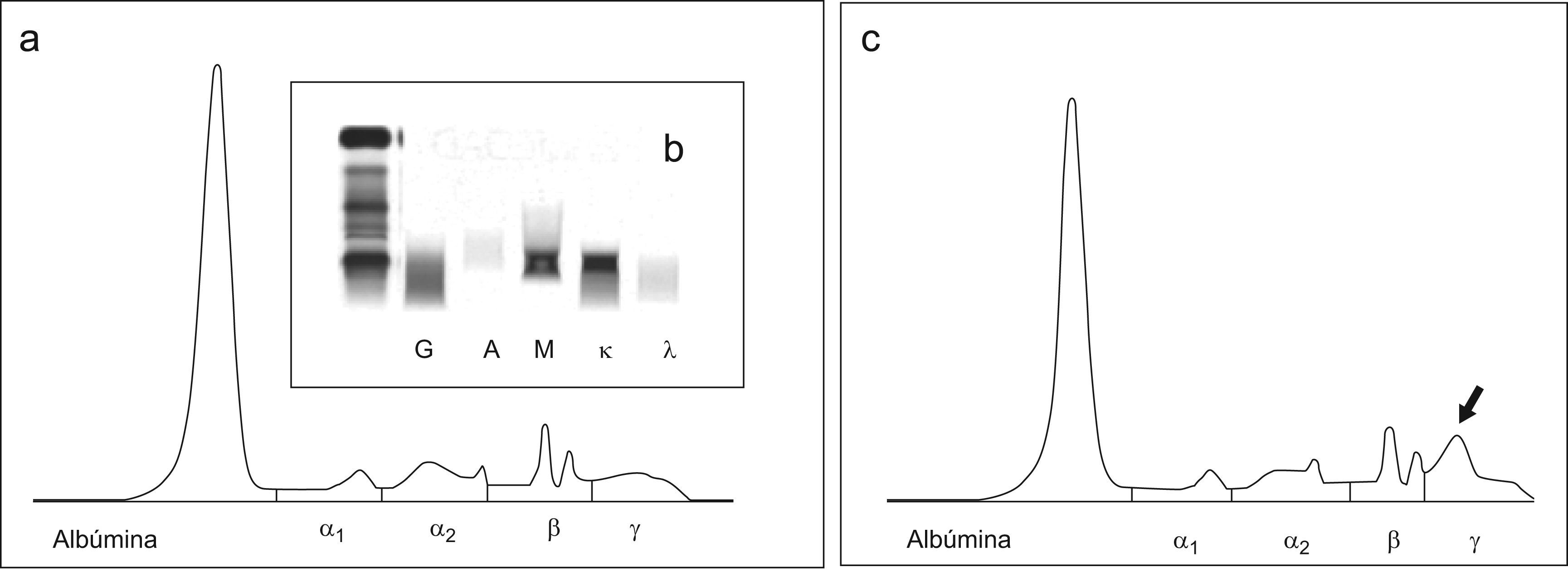
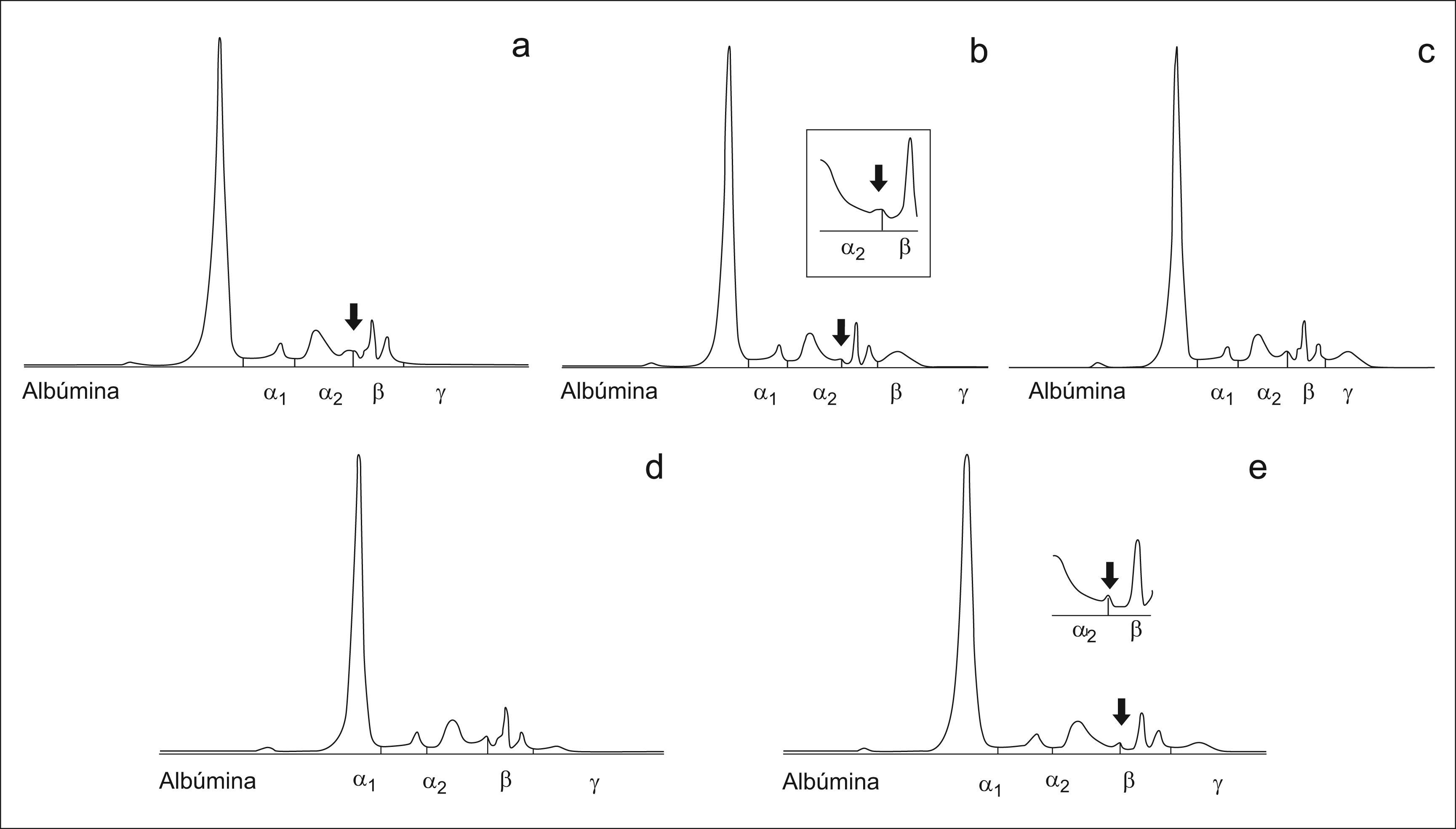
ResultadosCaso 1El primer caso es un varón de 82 años, diagnosticado en 1993 de macroglobulinemia de Waldenström. En el momento del diagnóstico se detectó mediante electroforesis en acetato de celulosa un CM tipo IgM kappa con migración en zona gamma. Los niveles de inmunoglobulinas medidos fueron de IgG 8,32g/l, IgA 1,99g/l, IgM 21,0g/l. En un seguimiento posterior, una vez instaurada en el laboratorio la EC, al realizar el proteinograma se obtuvo un trazado electroforético normal, sin evidencia de la presencia de un CM (fig. 1a). La cuantificación de la fracción gamma por EC fue de 5,8g/l. Por inmunonefelometría las concentraciones de inmunoglobulinas de la muestra fueron: IgG 5,77g/l, IgA 0,66g/l, IgM 25,30g/l. Ante esta disparidad de resultados en la cuantificación de las inmunoglobulinas, se realizó una inmunofijación, confirmándose la presencia de un componente monoclonal IgM kappa en alta concentración (fig. 1b). Se trató la muestra con β–mercaptoetanol con el fin de provocar la ruptura de los puentes disulfuro y se volvió a realizar la electroforesis, observándose tras el tratamiento, la presencia del componente monoclonal en la zona gamma. La cuantificación de la fracción gamma fue de 11,6g/l (fig. 1c).
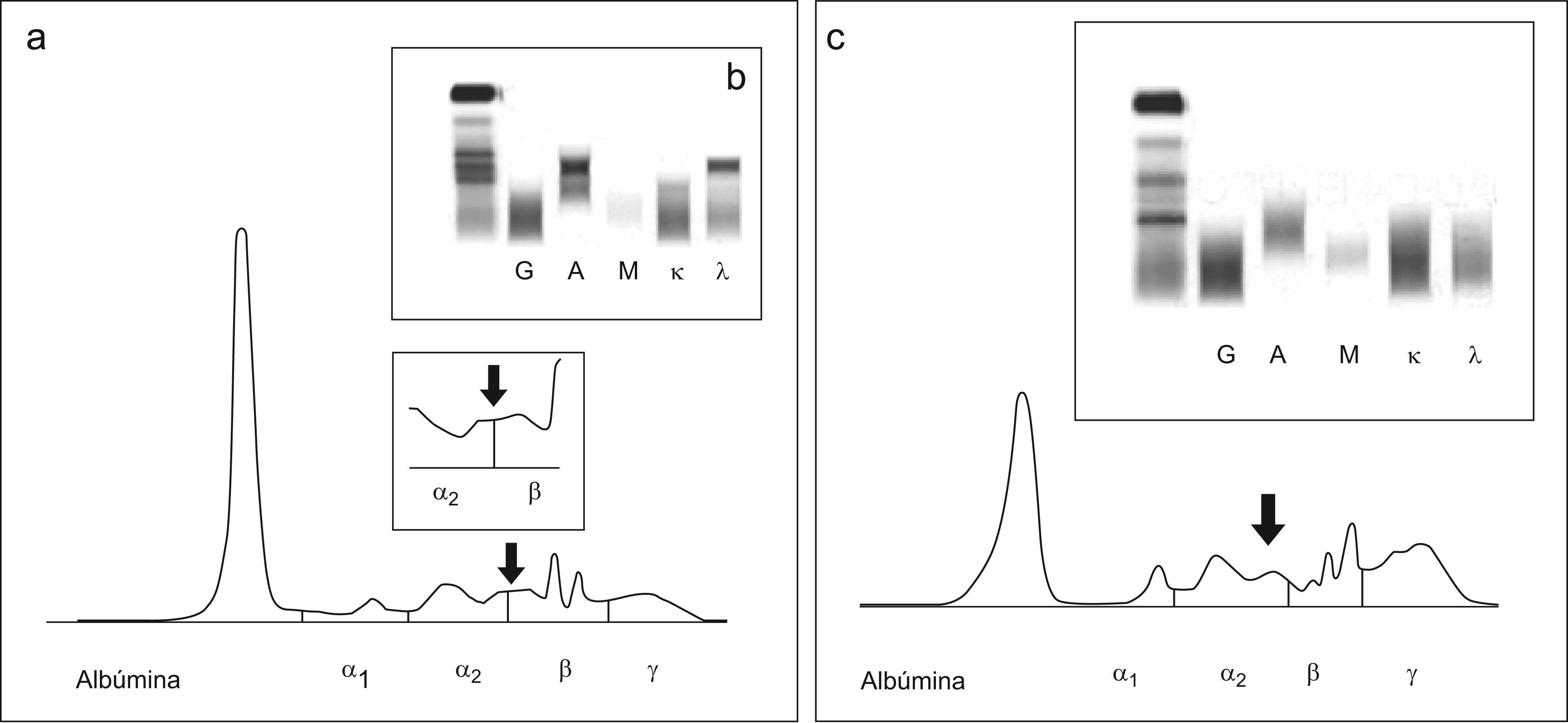
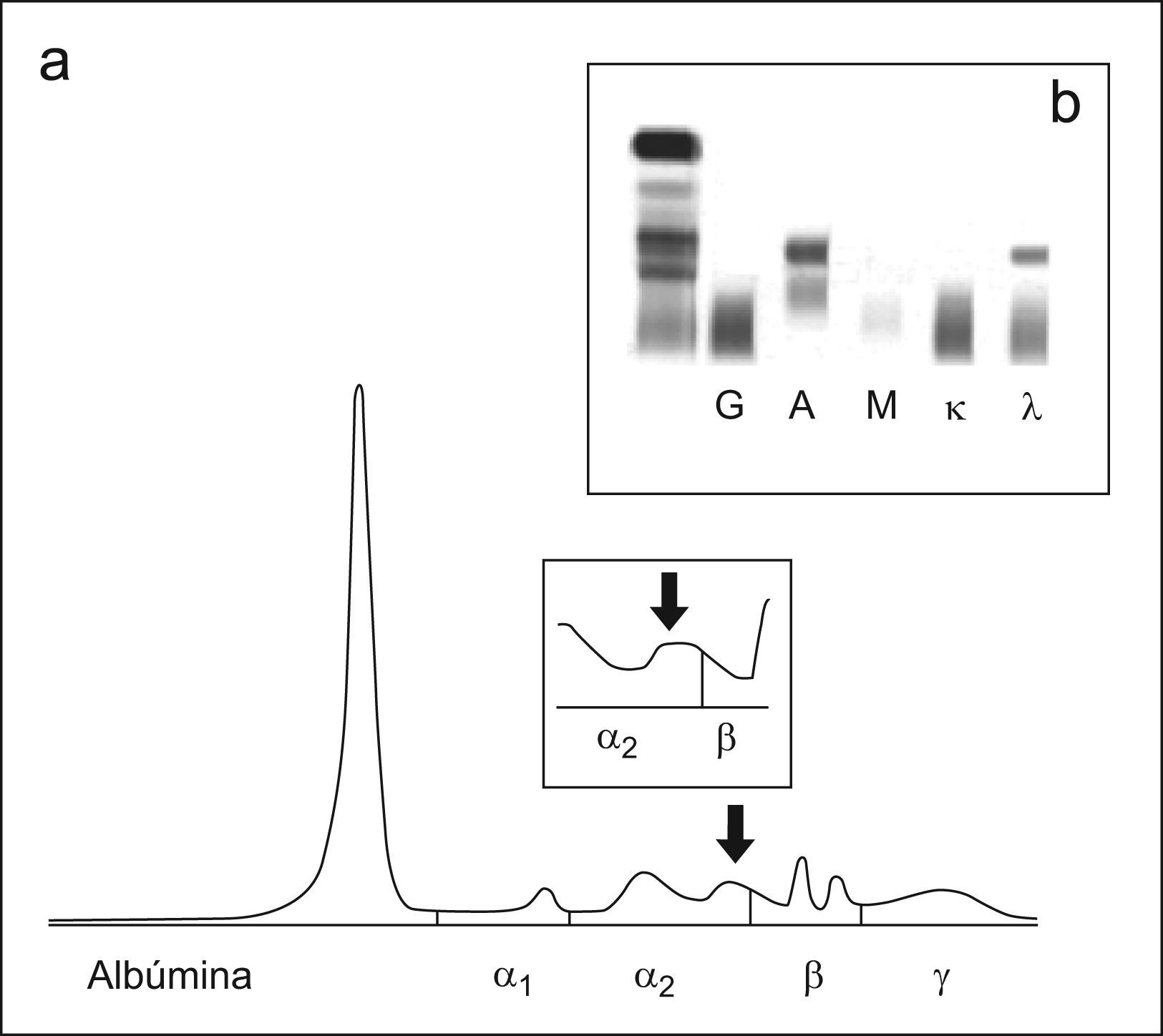
Caso 2El segundo caso es de una mujer de 59 años diagnósticada de gammapatía monoclonal de significado incierto (GMSI) IgA lambda en 2001. En la electroforesis de acetato de celulosa presentaba un CM en la zona β. Las concentraciones de inmunoglobulinas fueron de IgG 8,32g/l, IgA 10,90g/l, IgM 0,8g/l. La paciente permanecía estable sin evidencia de evolución. Al realizar el seguimiento por EC se observó una imágen entre α2 y β (fig. 2a) semejante a la obtenida con muestras con alta concentración de bilirrubina (fig. 2c), no observándose ningún pico sospechoso de CM. La cuantificación de las inmunoglobulinas por inmunonefelometría fue de IgG 8,57g/l, IgA 7,39g/l, IgM 0,46g/l. Al comprobar que la concentración de IgA era elevada se realizó una inmunosustracción (figs. 3a–e) donde se observó que la zona sospechosa desaparecía al enfrentarla a los antisueros anti-IgA y anti cadena ligera lambda (figs. 3b y e). Se realizó una inmunofijación en la muestra que confirmó la presencia del CM (fig. 2b).
a) Proteinograma del suero del paciente del caso 2; en el recuadro pequeño se muestra una ampliación de la zona comprendida entre α2 y β b) Inmunofijación del suero del paciente del caso 2. c) Proteinograma e inmunofijación de una muestra de suero con una concentración alta de bilirrubina.
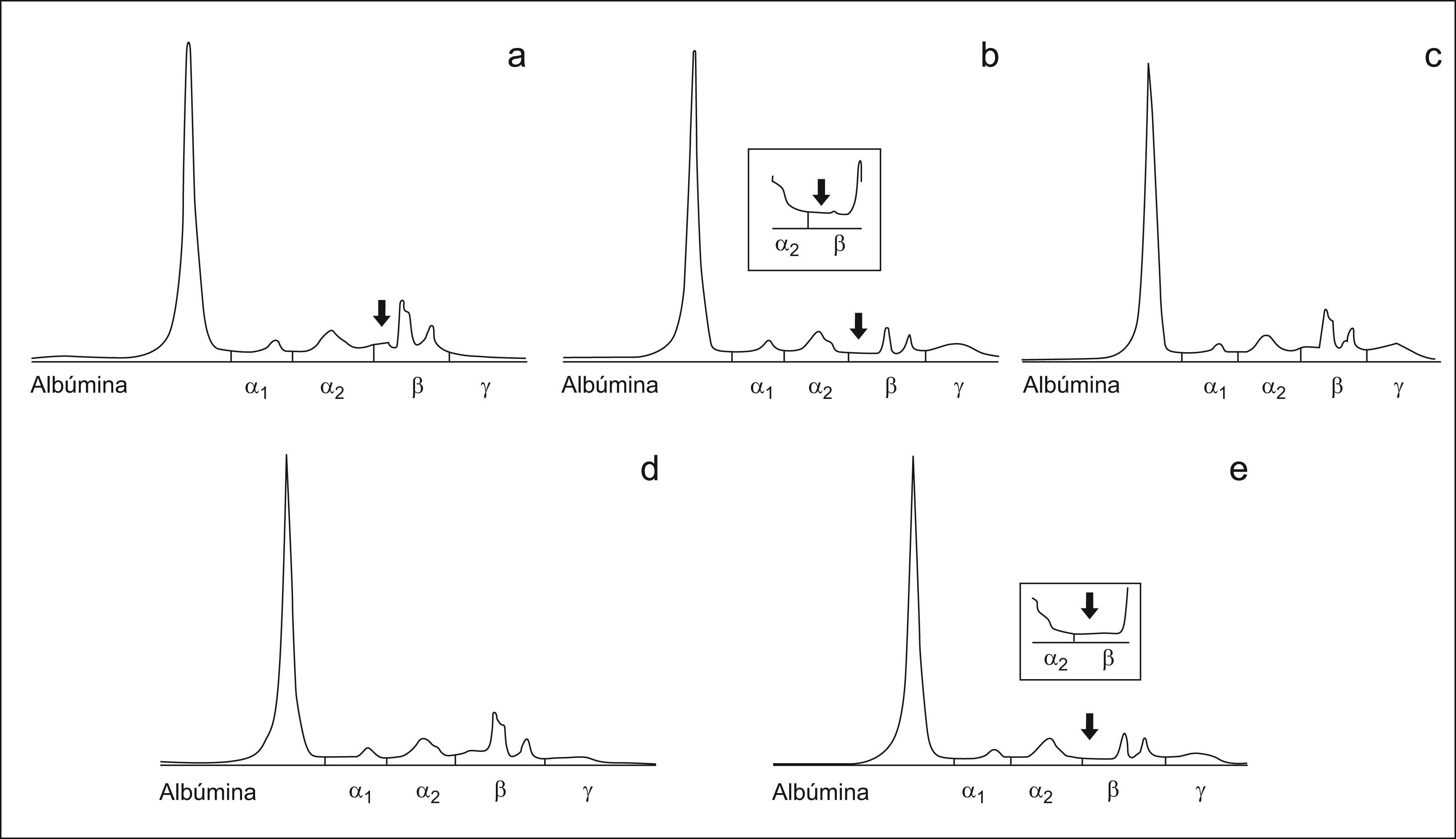
Inmunosustracción realizada al suero del paciente del caso 2. En el trazado electroforético se observa que además de la zona de estudio parece que existe componente monoclonal superpuesto a la transferrina. a) Tratamiento del suero con antisuero anti-IgG. b) Tratamiento del suero con antisuero anti-IgA observándose que se produce la inmunosustracción de la banda que aparecía entre α2 y β, mostrándose en el recuadro pequeño una ampliación de la zona. c) Tratamiento del suero con antisuero anti-IgM. d) Tratamiento del suero con antisuero anti cadena ligera kappa. e) Tratamiento del suero con antisuero anti cadena ligera lambda observándose que se produce la inmunosustracción de la banda que aparecía entre α2 y β, mostrándose en el recuadro pequeño una ampliación de la zona.
El tercer caso es de un varón de 88 años con un diagnóstico de mieloma múltiple IgA lambda en 1999. Por electroforesis de acetato de celulosa presentó una banda monoclonal en posición α2. Las inmunoglobulinas fueron de IgG 0,45g/l, IgA 19,40g/l, IgM 0,34g/l. Permaneció estable hasta 2004, fecha en la que se inició el tratamiento. Por EC en el seguimiento se observó una imágen entre α2 y β (fig. 4a) semejante al caso anterior. Las concentraciones de inmunoglobulinas por inmunonefelometría fueron: IgG 6,46g/l, IgA 3,04g/l, IgM 0,63g/l. Dado que el paciente estaba en tratamiento se realizó una inmunofijación con el fin de evaluar el grado de respuesta (fig. 4b). En la inmunofijación se observó que el paciente mantenía en suero niveles apreciables de IgA lambda monoclonal. Para confirmar que la imágen se correspondía con el CM se realizó una inmunosustracción (figs. 5a–e) donde se observó que se trataba de IgA lambda (figs. 5b y e).
Inmunosustracción realizada al suero del paciente del caso 3. a) Tratamiento del suero con antisuero anti-IgG. b) Tratamiento del suero con antisuero anti-IgA observándose que se produce la inmunosustracción de la banda que aparecía entre α2 y β, mostrándose en el recuadro pequeño una ampliación de la zona. c) Tratamiento del suero con antisuero anti-IgM. d) Tratamiento del suero con antisuero anti cadena ligera kappa. e) Tratamiento del suero con antisuero anti cadena ligera lambda observándose que se produce la inmunosustracción de la banda que aparecía entre α2 y β, mostrándose en el recuadro pequeño una ampliación de la zona.
En el seguimiento de las gammapatías monoclonales la cuantificación del CM se realiza en el proteinograma, mediante densitometría en la electroforesis en soporte sólido o por espectrofotometría ultravioleta si se trata de EC6. La cuantificación por inmunonefelometría o inmunoturbidimetría se utilizan como métodos complementarios de apoyo.
La medición de las inmunoglobulinas por inmunonefelometría da lugar a concentraciones superiores a las obtenidas mediante la densitometría o la espectrofotometría en la región ultravioleta, sobre todo si se trata de IgM donde la diferencia puede llegar a ser muy notable9. Sin embargo, una diferencia tan acusada como la encontrada en la muestra del primer caso, hizo sospechar la posibilidad de un problema en la detección de un CM, como posteriormente reveló la inmunofijación. La aparición del CM y el aumento de la fracción gamma sugieren que la estructura polimérica del CM dificultó la elución por el capilar. El tratamiento con el agente reductor permitió detectarlo por EC tras obtener un monómero de menor tamaño. Así pues, al valorar un CM IgM es conveniente el tratamiento de la muestra con un agente reductor como el β-mercaptoetanol o la penicilamina10 cuando exista una gran discrepancia entre las concentraciones de IgM cuantificadas por nefelometría y el trazado electroforético obtenido por EC.
En cuanto a los dos últimos casos, el trazado electroforético es similar al obtenido cuando la muestra contiene altas concentraciones de bilirrubina, ya que en los casos presentados el CM no aparece como un pico estrecho, sino como una imágen entre α2 y β sugerente de esa interferencia. La ausencia de bilirrubina alta en las muestras, junto a la cuantificación de las inmunoglobulinas por inmunonefelometría y la historia previa del paciente nos alertó sobre la necesidad de realizar una inmunofijación para confirmar o descartar la presencia del CM. Destaca que en ambos casos el CM era del tipo IgM lambda. Por tanto ante cualquier imágen que haga sospechar una hiperbilirrubinemia es importante confirmar la misma y en caso negativo contemplar la posibilidad de que se trate de un componente monoclonal y realizar los métodos necesarios para su detección.
Los tres casos descritos son un ejemplo de cómo el análisis del proteinograma junto a las concentraciones por inmunonefelometría de las inmunoglobulinas y la historia clínica previa del paciente, evita falsos negativos en la detección de CM presentes en alta concentración y con problemas de separación por EC. Asimismo, ante la sospecha clínica de un CM y tras obtener un trazado electroforético normal, es conveniente la cuantificación de las inmunoglobulinas y si alguna está alterada realizar una inmunofijación.