La administración de contrastes yodados puede interferir en la electroforesis capilar (EFC) de proteínas séricas. El objetivo fue realizar un estudio in vitro para confirmar la presencia de interferencias por Iomeron® en la EFC y otro in vivo en pacientes sometidos a coronariografías, estudiando la cinética de eliminación del contraste yodado.
Material y métodosSe preparó un pool de sueros libres de componente monoclonal (CM), con patrón electroforético anodino, añadiéndose Iomeron® hasta alcanzar una concentración de 5,4g/100ml. Partiendo de esta solución (A) se realizaron cuatro diluciones decrecientes (2,70g/100ml, 1,35g/100ml, 0,67g/100ml y 0,33g/100ml); y se procesaron por EFC para confirmar la interferencia y observar que disminuye proporcionalmente a su concentración.
Se extrajo sangre, pautadamente (5–10min, 1, 3, 5 y 8h postadministración del contraste) a pacientes sometidos a coronariografías. Se procesaron las muestras de plasma por EFC, y se realizó la inmunofijación (IF) de la obtenida entre los 5–10min para demostrar que la imagen electroforética no se correspondía con un CM.
ResultadosLa EFC reveló picos similares a los observados ante un CM en la fracción β, que desaparecieron en la dilución 0,33g/100ml en el estudio in vitro, y a las 8h postadministración del Iomeron® en el estudio in vivo (una paciente). Por otra parte, en la electroforesis de referencia del gel de agarosa empleado en la IF no se detectó imagen sugerente de CM.
ConclusionesSe demuestra que los picos observados correspondían a una interferencia producida por el Iomeron® en la fracción β de la EFC, no observada en la electroforesis en gel de agarosa.
The administration of iodinated contrast media may interfere with the capillary electrophoresis (CE) of serum proteins. The aim of the study was to perform an in vitro study to confirm the interference caused by lomeron® administration followed by an in vivo study in patients undergoing coronary angiographies, evaluating the kinetics of iodinated contrast elimination.
Material and methodsA serum pool free from monoclonal component (MC) and with an anodyne electrophoretic pattern was prepared. lomeron® up to a concentration of 5.4g/100mL was added to this pool and afterwards, four decreasing dilutions were prepared (2.70g/100mL, 1.35g/100mL, 0.67g/100mL and 0.33g/100mL); all of them were processed by CE to confirm the interference and its decreasing effect as the concentration diminishes.
Blood was drawn from patients undergoing coronary angiographies, at several time intervals (5–10min, 1, 3, 5 and 8h post-administration of contrast). Plasma samples were processed by CE, and immunofixation (IFx) of the first sample (5–10min) was performed in order to show that the electrophoretic image did not correspond to a MC.
ResultsIn the in vitro study, CE revealed β fraction-MC peaks, which disappeared at the 0.33g/100mL dilution, and 8h after lomeron® administration in the in vivo study (one patient). On the other hand, no image suggestive of MC was detected on the reference agarose gel electrophoresis (AGE) used for the IFx.
ConclusionsPeaks were observed that corresponded to an interference produced by lomeron® in the β fraction of CE, which was not found in AGE.
La electroforesis (EF) de proteínas séricas constituye un estudio analítico frecuentemente solicitado en el laboratorio. La principal indicación de la EF la constituye la detección de proteínas o componentes monoclonales (CM)1 asociados a aumentos de la proliferación de un clon específico de células B. Estas proliferaciones clonales se corresponden con un conjunto de trastornos diversos, conocidos como gammapatías monoclonales, caracterizados, con alguna excepción (mieloma no secretor), por la secreción de proteínas (inmunoglobulinas intactas o fragmentadas) homogéneas desde el punto de vista inmunológico y electroforético2. Las dos entidades prototípicas asociadas a trastornos de células plasmáticas o a procesos linfoproliferativos son el mieloma múltiple y la macroglobulinemia de Waldenström.
La inmunoglobulina monoclonal suele detectarse, en la electroforesis capilar (EFC), por un pico alto y muy bien delimitado en la regiones β o γ del proteinograma, y más rara vez, en otras zonas. Un aumento policlonal de las inmunoglobulinas, por el contrario, produce una banda ancha en la región γ.
La importancia de la detección e identificación de estos CM radica en poder saber si ese CM se asocia a un mieloma múltiple o a una gammapatía monoclonal de significado incierto, grupo en el que se ven incluidos la mayoría de los CM detectados actualmente en el laboratorio.
Por otra parte, en el medio hospitalario se emplean contrastes yodados, sustancias que se caracterizan por presentar en su estructura uno o más átomos de elevado número atómico y de alta densidad que actúan absorbiendo los rayos X. Existen diversos tipos de contrastes3–6 y su administración puede producir interferencias en la EFC de proteínas séricas debido a que absorben en la región del enlace peptídico, con un máximo entre 237–244nm7,8.
En el área de proteínas del Servicio de Bioquímica Clínica del Hospital de la Santa Creu i Sant Pau (HSCSP) se sospechó de una posible interferencia en la EFC debida al uso de contrastes, a raíz de un caso en un paciente al que se le había practicado una coronariografía. La inspección visual del proteinograma por EFC puso de manifiesto la presencia de una imagen altamente sospechosa de monoclonalidad por las características del pico observado. De acuerdo a la estrategia diagnóstica de los CM en el laboratorio, se procedió a la realización de una inmunofijación (IF), sin que ésta pudiera evidenciar la presencia de proteína monoclonal alguna enfrentando la muestra a los antisueros habituales. La consulta de la historia clínica del paciente permitió confirmar que éste había sido ingresado para la realización de una coronariografía, practicada la misma mañana en que se obtuvo la muestra de sangre para el análisis. Asimismo, se pudo constatar que para dicha coronariografía se había utilizado como contraste yodado, Iomeron®.
El presente estudio se diseñó en dos fases, la primera in vitro y la segunda in vivo. En el estudio in vitro se quiso verificar que realmente el tipo de contraste utilizado absorbía a longitudes de onda similares a las que absorben los enlaces peptídicos de las proteínas. En el estudio in vivo se pretendía evaluar estas interferencias en pacientes sometidos a coronariografías, estudiando además la cinética de eliminación del contraste.
Material y métodosEstudio in vitro de la interferenciaPara poder verificar que realmente el tipo de contraste utilizado absorbía a longitudes de onda similares a las que absorben los enlaces peptídicos de las proteínas, se realizó un estudio in vitro de la interferencia, con Iomeron® (BRACCO s.p.a. Milan-Italia, Iomeprol 81,65g/100ml, 50ml Iomeron® 400 vía intravascular inyectable). La solución preparada para inyectar es de concentración 81,65g iomeprol/100ml. En un paciente, que se someta a la realización de una angiocardiografía, la cantidad de Iomeron® a administrar no debe superar los 250ml y el volumen de cada inyección única depende del área vascular a examinar. Las cantidades inyectadas, normalmente, están entre 50–250ml y se reparten entre los, aproximadamente, 5 litros de volumen sanguíneo, alcanzándose una concentración en sangre de 0,81g/100ml a 3,89g/100ml, respectivamente.
Así, se preparó un pool de sueros de aproximadamente 9–10ml (libres de CM y con patrón electroforético anodino), se tomaron 2,8ml del mismo y se le añadieron 0,2ml de Iomeron® de 81,65g/100ml. A partir de esta solución madre de concentración 5,4g/100ml (A) se prepararon las correspondientes diluciones: 2,70g/100ml (B), 1,35g/100ml (C), 0,67g/100ml (D) y 0,33g/100ml (E).
Una vez preparadas las diluciones, éstas se procesaron por EFC en el sistema Capillarys de Sebia®.
Estudio in vivo de la interferenciaPacientesEn el presente estudio se pretendía incluir pacientes (mínimo 5) a los que se les hubiesen inyectado contrastes radioopacos en el curso de cateterismos por diversos motivos. A cada paciente se le extraería sangre de manera seriada: la primera extracción se realizaría inmediatamente antes de la inyección del contraste y en las siguientes 24h se obtendrían las 8 muestras restantes. Se realizaría la EF de todas las muestras y además la IF de la primera muestra obtenida después de la inyección del contraste, en cada paciente, para confirmar que la banda monoclonal detectada por EFC no se correspondía realmente con un componente o inmunoglobulina monoclonal.
En todos los pacientes se recogería la información referente al tipo de contraste utilizado y la cantidad administrada; serían debidamente informados y firmarían la hoja de consentimiento para su inclusión en el estudio. El estudio ya fue previamente aprobado por el Comité de Ética del HSCSP.
Extracción de las muestrasLas muestras de sangre se obtuvieron por punción venosa a partir de una vía periférica distinta a la utilizada para la inyección del contraste, en tubos con anticoagulante (heparina-Li, BD Vacutainer®). Las extracciones de las mismas se obtuvieron de manera seriada: la primera extracción se llevó a cabo previamente a la administración del contraste yodado, y las posteriores fueron recogidas después de la administración de dicho contraste a intervalos de tiempo pautados: a los 5min, a la hora, a las 3h, a las 5h, a las 8h, a las 12h, a las 18h y a las 24h.
Tratamiento de las muestrasSegún se iban recibiendo las muestras en el laboratorio, éstas se centrifugaban a 1771g durante 20min (Jouan G 4.12). Se recogieron los sobrenadantes en tubos de ensayo correctamente identificados, y se guardaron tapados en la nevera a 4°C. Al día siguiente, previamente a la EFC, se trataron los plasmas con etanol9 (dilución 1/10) para obviar la interferencia producida por la presencia de fibrinógeno, ya que podría confundirse con un CM (en la EFC la presencia de fibrinógeno se corresponde con la aparición de un pico adicional en la zona β-γ del proteinograma).
Análisis de las muestrasElectroforesisPara la separación de las proteínas se utilizó el sistema de EFC Capillarys de Sebia® (reactivos ref. 2003). Esta técnica permite realizar de manera automática todas las etapas de la EF desde la introducción de la muestra hasta la obtención del perfil proteico. Las muestras se sitúan en los cargadores, y se diluyen con 160μl de tampón al 1/5. La inyección en los capilares se realiza poniendo en contacto un extremo de los capilares con las muestras diluidas y aspirando después, hacia el interior de cada capilar, un volumen muy pequeño de cada muestra diluida (40μl). La migración se realiza a temperatura constante de 35°C controlada por un sistema de efecto Peltier; y la detección de las proteínas se efectúa directamente en una célula de detección situada al final del capilar mediante fotometría de absorbancia a 200nm.
El tratamiento de los resultados se lleva a cabo utilizando el mismo programa: la detección directa proporciona automáticamente una cuantificación relativa precisa de cada fracción, y los perfiles electroforéticos deben analizarse visualmente para detectar las anomalías.
InmunofijaciónLa IF de la muestra obtenida a los 5–10min, después de la inyección del contraste, se realizó en gel de agarosa en el sistema Hydrasys de Sebia® (reactivos ref. 4808). Se aplica la muestra en los seis canales del gel y se somete a EF. Las muestras se diluyen antes de su aplicación para prevenir el efecto prozona, consecuencia de elevados niveles de antígeno. La dilución habitual es al 1/3 excepto para la Ig G que es al 1/6, con el diluyente HYDRAGEL IF de Sebia®. Se aplican 10μl de muestra diluida en los pocillos del aplicador y se dejan difundir durante 5min. La migración tiene lugar a 20°C estando la temperatura controlada por efecto Peltier. En cinco carriles de migración electroforética se aplican distintos antisueros frente a cadenas pesadas (γ, α, μ) y a cadenas ligeras (κ,λ) en cantidades de 25μl en cada carril. En el primer carril se aplican 40μl de solución fijadora para obtener un proteinograma de referencia. La incubación tiene lugar a 20°C durante 5min (termostatización mediante efecto Peltier). Los antisueros difunden durante 15 segundos (a 20°C temperatura controlada mediante efecto Peltier) dentro del gel y se produce la precipitación de los complejos antígeno-anticuerpo que quedan inmunofijados en la matriz de agarosa. Las proteínas solubles no precipitadas se eliminan mediante un lavado y el complejo antígeno-anticuerpo precipitado queda fijado en la matriz del gel. Se procede a la tinción de la placa con el colorante negro amido, posterior decoloración con solución decolorante (el colorante sólo permanecerá allí donde existan proteínas fijadas o precipitadas) y un secado a 50°C, controlado por efecto Peltier, durante 6min. Finalmente, se realiza una inspección visual para evaluar los patrones obtenidos y detectar así la presencia o no de reacciones específicas entre los antisueros y las proteínas.
Para la determinación de proteínas totales y albúmina de todas las muestras se procesó directamente el plasma por el analizador MODULAR DPE de Roche®. Las proteínas totales se cuantificaron por el método de Biuret a punto final (reactivos ref. 11929933 216, reacción de los enlaces peptídicos de las proteínas con iones cobre en solución alcalina dando lugar a un compuesto coloreado que absorbe a 540nm). El método para la determinación de albúmina en suero, (reactivos ref. 11970925 216), se basa en la unión de la proteína a un colorante aniónico, el verde de bromocresol, con lectura a 570nm.
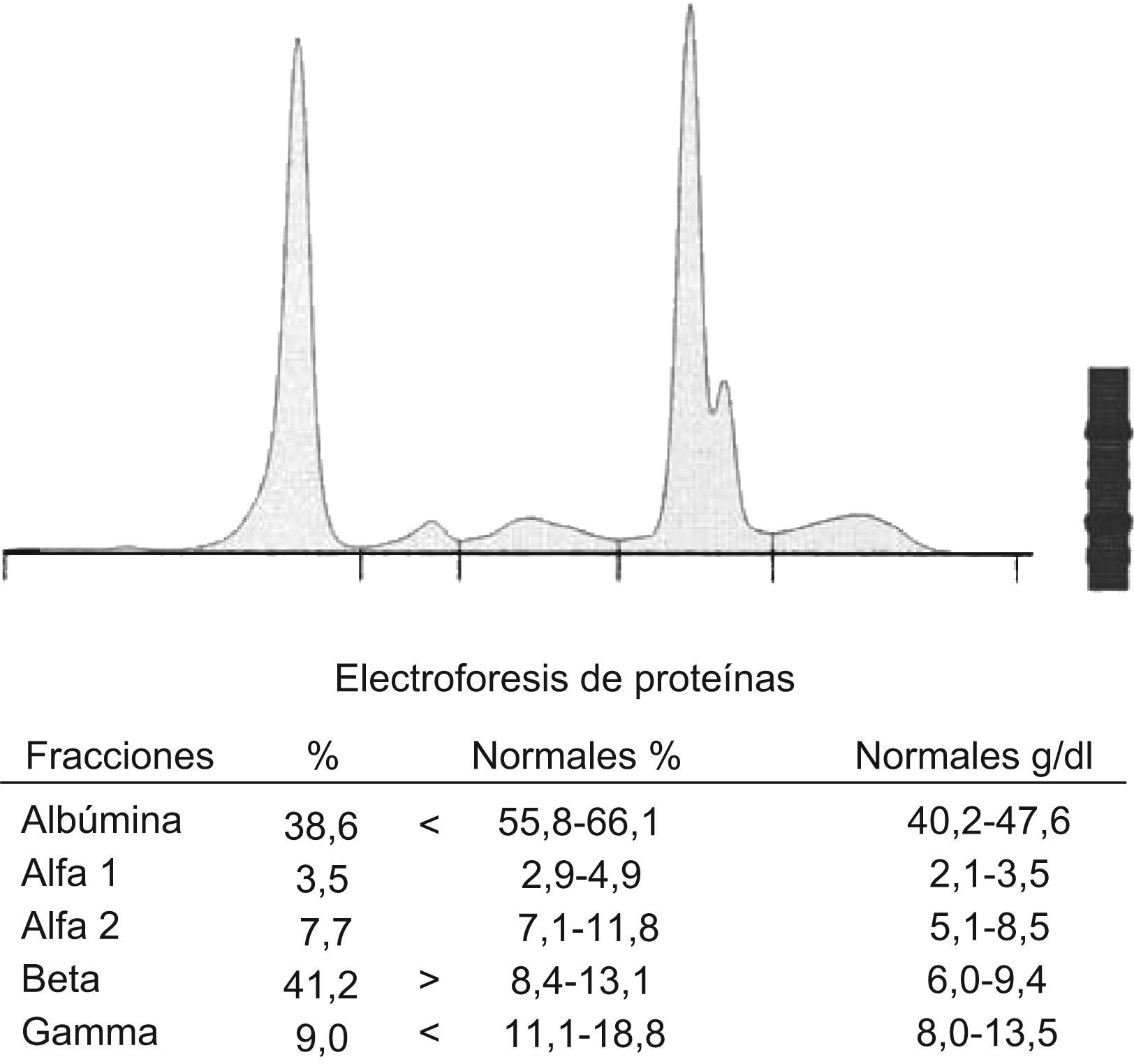
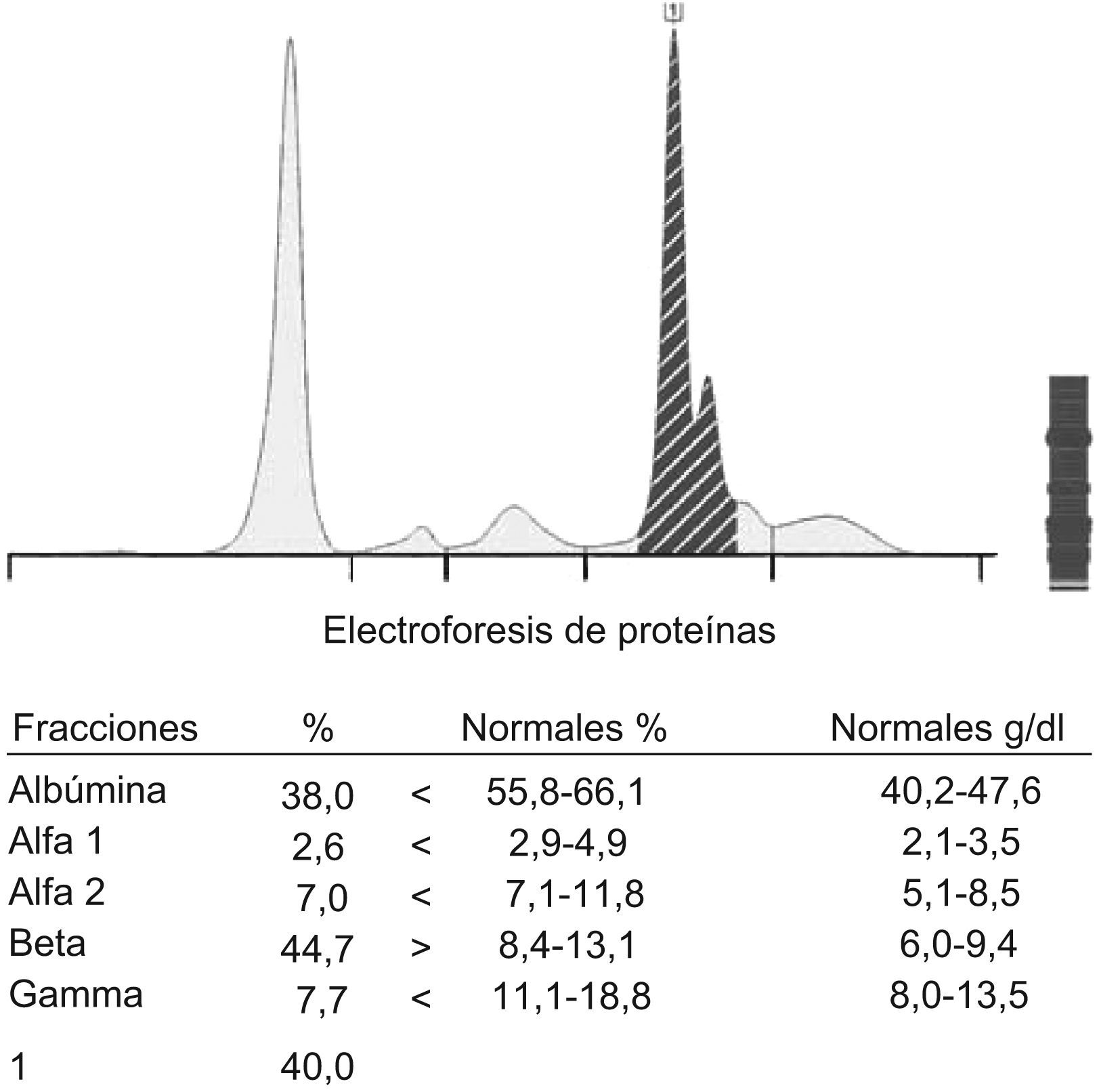
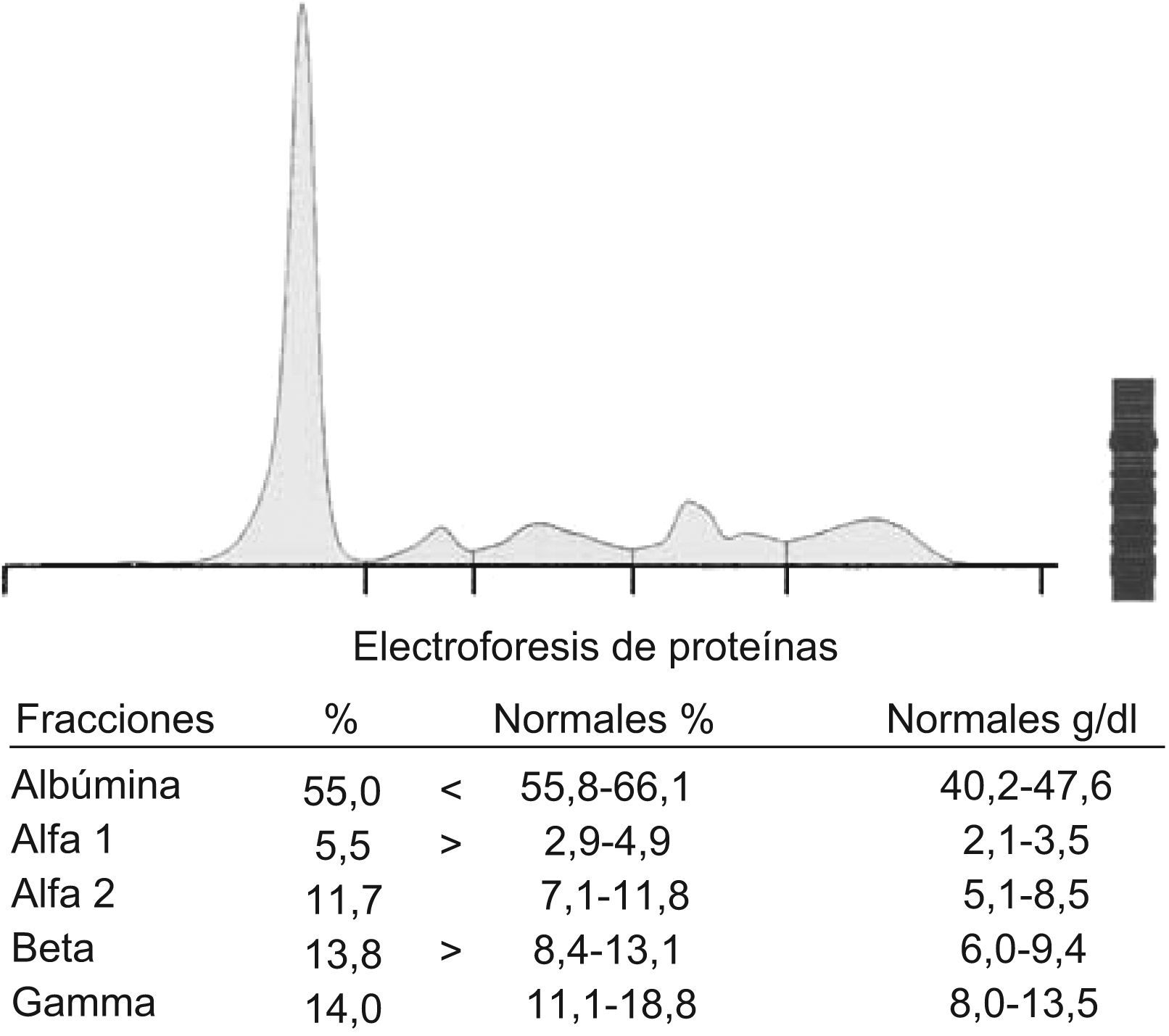
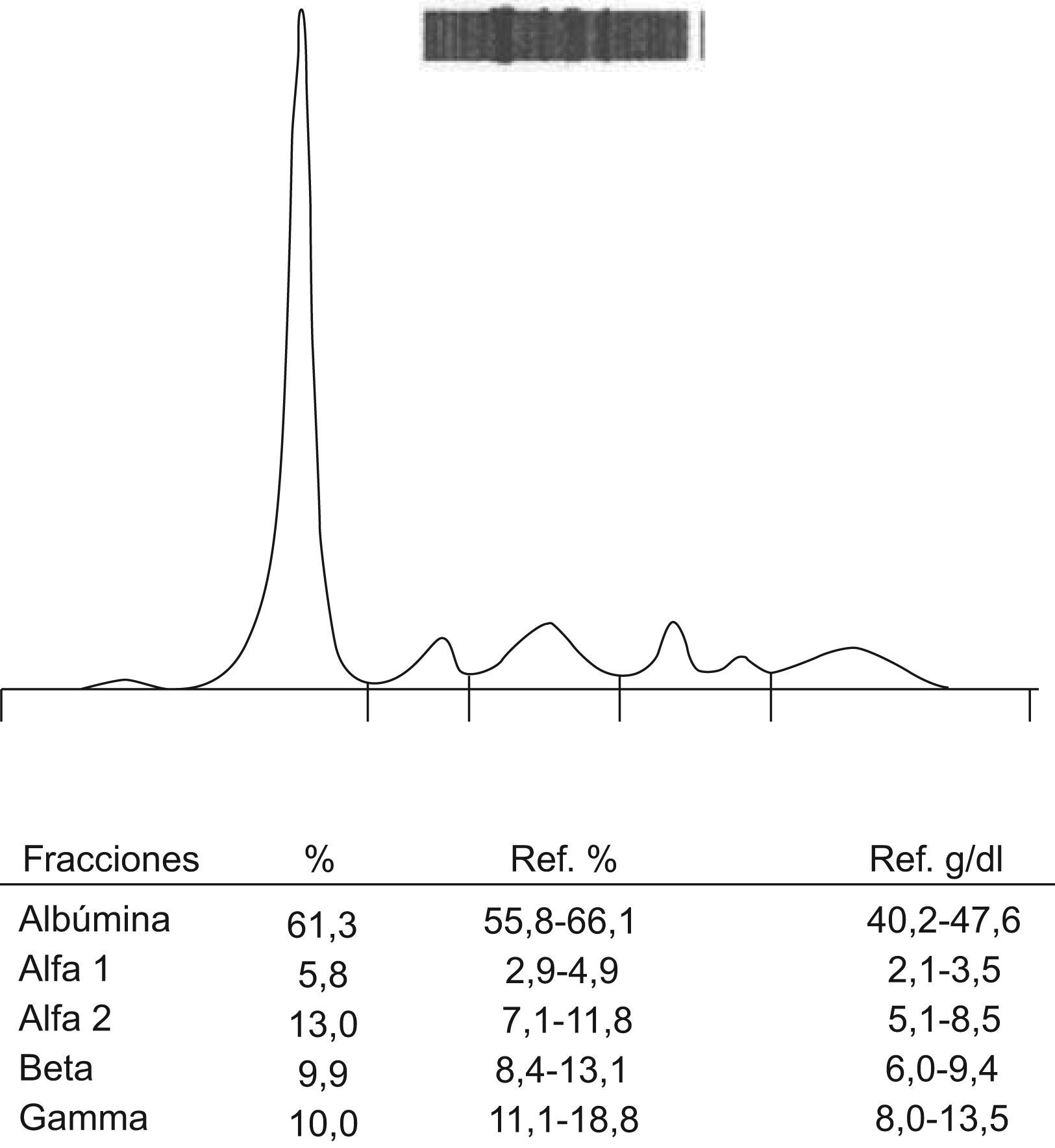
ResultadosLos resultados del procesamiento de las muestras correspondientes al estudio in vitro mostraron con claridad que el medio de contraste Iomeron® absorbía fuertemente a la longitud de onda 200nm produciendo un pico monoclonal (imagen prácticamente idéntica a la de una proteína monoclonal), en la zona β de la EFC. Además, el pico de la solución A (fig. 1) fue idéntico al del caso índice (fig. 2). Las sucesivas EF mostraron que la magnitud del pico observado iba disminuyendo, según disminuía la concentración del contraste, hasta desaparecer a 0,33g/100ml (fig. 3).
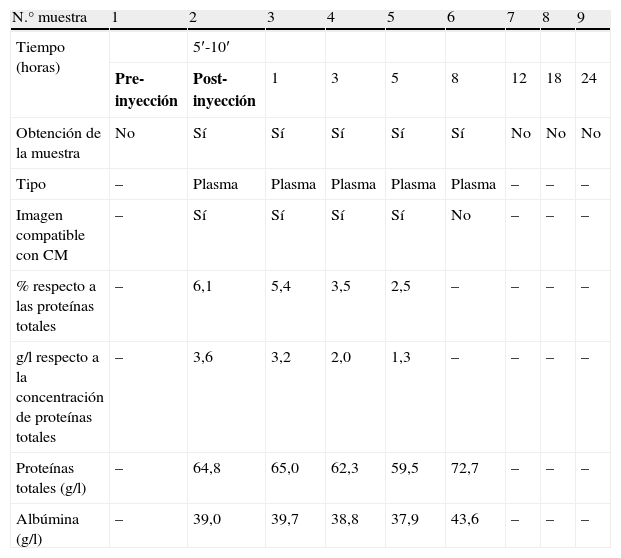
Respecto al estudio in vivo (ver tabla 1), debido a diversas complicaciones, entre ellas, el elevado número de muestras requeridas en un plazo corto de tiempo (9 muestras en 24h), resultó bastante dificultoso obtener el consentimiento de los pacientes por parte del médico responsable. Por ello tan solo se pudieron recolectar 5 muestras de una única paciente que aceptó participar en el estudio.
Datos con las características principales de las muestras recibidas
| N.° muestra | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Tiempo (horas) | 5′-10′ | ||||||||
| Pre-inyección | Post-inyección | 1 | 3 | 5 | 8 | 12 | 18 | 24 | |
| Obtención de la muestra | No | Sí | Sí | Sí | Sí | Sí | No | No | No |
| Tipo | – | Plasma | Plasma | Plasma | Plasma | Plasma | – | – | – |
| Imagen compatible con CM | – | Sí | Sí | Sí | Sí | No | – | – | – |
| % respecto a las proteínas totales | – | 6,1 | 5,4 | 3,5 | 2,5 | – | – | – | – |
| g/l respecto a la concentración de proteínas totales | – | 3,6 | 3,2 | 2,0 | 1,3 | – | – | – | – |
| Proteínas totales (g/l) | – | 64,8 | 65,0 | 62,3 | 59,5 | 72,7 | – | – | – |
| Albúmina (g/l) | – | 39,0 | 39,7 | 38,8 | 37,9 | 43,6 | – | – | – |
A la paciente se le inyectaron 145ml del contraste Iomeron® para la realización de una coronariografía.
Los resultados mostraron
- 0.
No se dispuso de la muestra basal previa administración del contraste.
- 1.
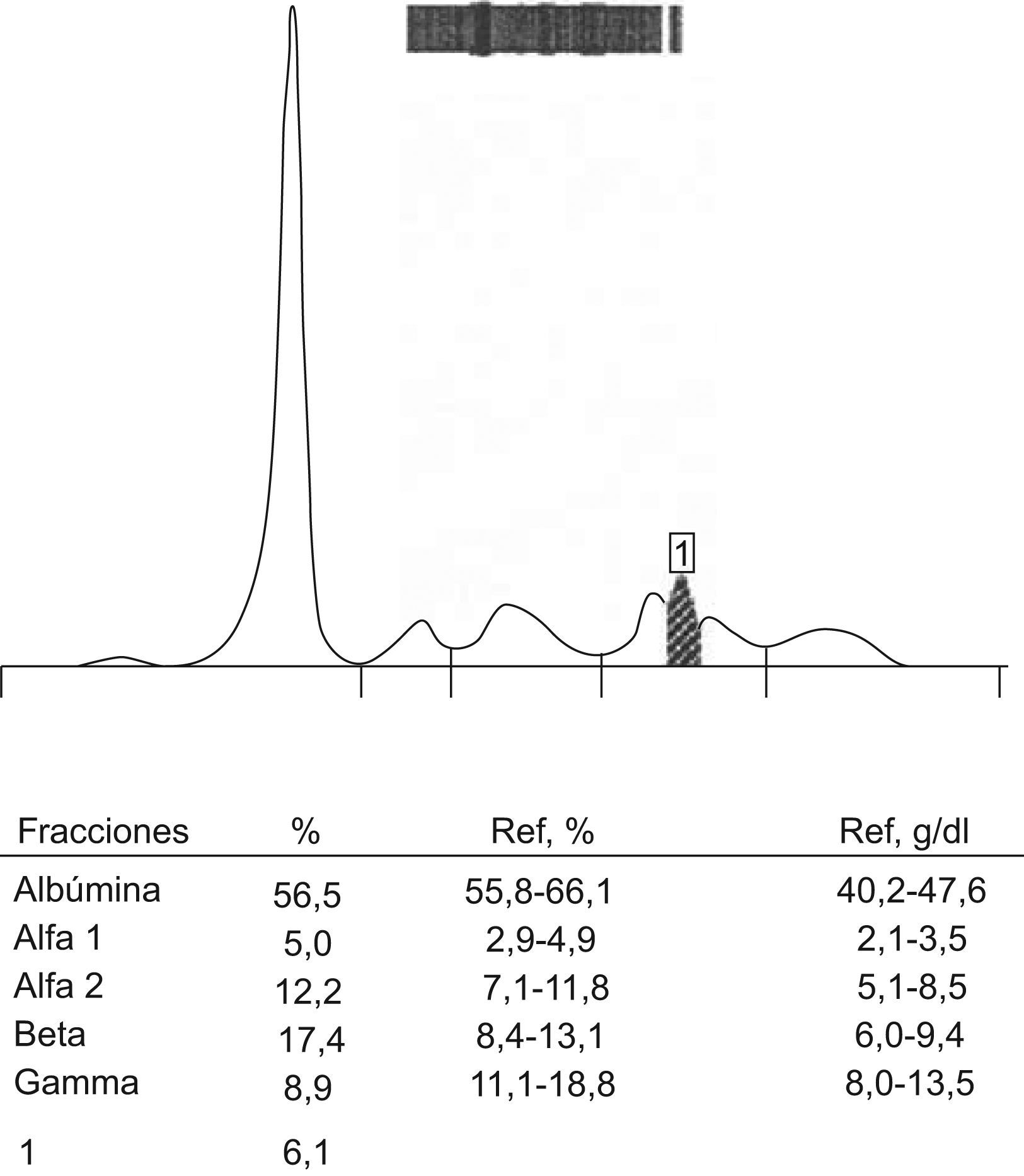
Un pico, en la EFC, de la muestra obtenida a los 5–10min de la post-inyección del contraste. Dicho pico se localizó en la región β del proteinograma y su morfología (alto y delgado) hizo sospechar de la presencia de un CM (fig. 4).
Figura 4.Electroforesis de la muestra a los 5–10min de la inyección del Iomeron®. Se puede observar un pico1 en la zona β que hace sospechar de la presencia de un CM.
(0.12MB). - 2.
Que el pico monoclonal de la región β del proteinograma disminuía progresivamente hasta desaparecer a las 8h post-administración del contraste, momento en el que ya no se observaba ninguna imagen compatible con un pico monoclonal (fig. 5), por lo que puede suponerse que la paciente en cuestión consiguió eliminar totalmente el agente de contraste de la circulación.
- 3.
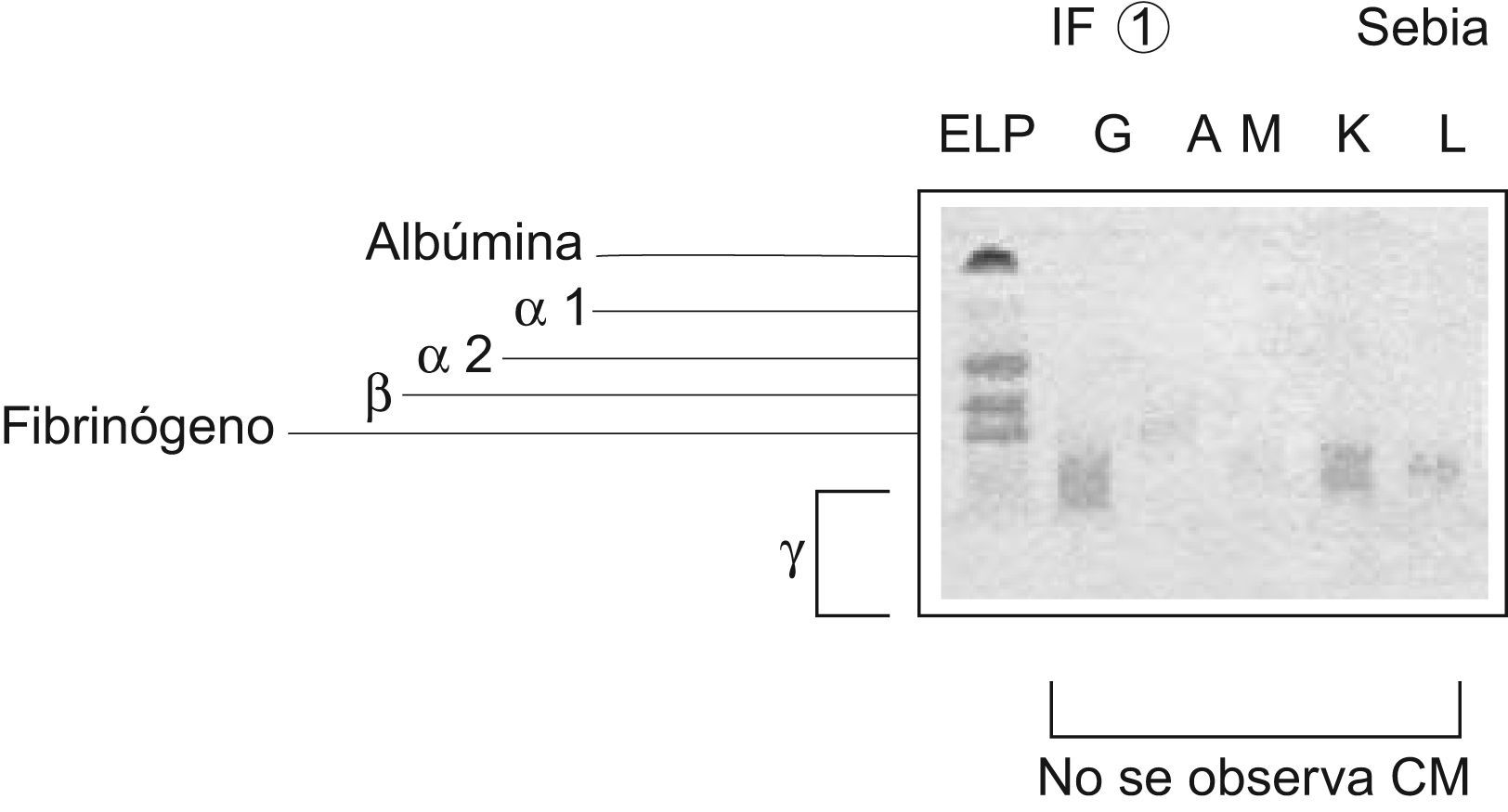
Debido a la presencia de un pico en la región β del proteinograma al procesar la muestra correspondiente a los 5–10min post-inyección del contraste, se realizó la IF de dicha muestra para confirmar o descartar la existencia de un CM. En la placa de IF no se visualizó reacción antígeno-anticuerpo en ningún canal (fig. 6).
- 4.
Además, no se observó ningún CM en la EF de referencia (primer canal de la placa de agarosa para IF, en el que se aplicó fijador). Por lo que se pudo suponer que el pico que se observaba en la EFC y que se correspondía con una interferencia producida por el Iomeron® no producía el mismo efecto sobre las EF realizadas en gel de agarosa.
En la tabla 1 se muestran los datos con las características principales de las muestras recibidas de la paciente, destacando la disminución de la concentración de «la banda» interferente de 3,6g/l a los 5–10min post-inyección hasta 1,3g/l a las 5h post-inyección.
DiscusiónEl Iomeron® produce una interferencia en el proteinograma al ser procesadas, por EFC, las muestras de plasma de pacientes a los que se les ha administrado dicho contraste.
La existencia de interferencias en la EF de proteínas plasmáticas debida a la administración de contrastes yodados ya ha sido descrita previamente.
Van der Watt y Berman realizaron un estudio sobre la presencia de pseudoparaproteínas después de la infusión de iopamidol para angiografía coronaria10. La muestra de sangre recogida 6h después de la angiografía mostraba un pico en la región α-2-globulina de la EFC, pero la IF resultó ser negativa. Las EF a las 2 y 5h posteriores reflejaban una disminución del pico inicial. Concluyeron que los agentes radioopacos se eliminaban rápidamente del suero, pero en el caso de este paciente se retardó por la existencia de fallo renal.
Bossuyt y et al estudiaron las interferencias causadas por los agentes radioopacos (Urografin®, Telebrix® y Omnipaque®) en la EFC11. En cada uno de los 3 electroferogramas observaron un pico en la fracción α-2-globulina, pero ninguno presentó bandas cuando se procesaron las muestras por EF en gel de agarosa. Esta última observación puso de manifiesto que los agentes de contraste no producían interferencias en todos los tipos de EF. Esta particularidad se ha podido comprobar en el estudio in vivo de la paciente reclutada y en el caso índice.
Tampoco observaron ningún pico en especímenes recogidos de 2 a 6 días posteriores a la administración del contraste, lo que significó que después de todo ese tiempo el contraste había sido eliminado del torrente sanguíneo. Concluyeron que la interferencia producida por los medios de contraste podía ser confundida con proteínas monoclonales y que las muestras de sangre no debían ser recogidas poco tiempo después de haber recibido el medio de contraste en el caso de procesarlas por EFC.
Arranz-Peña y et al8 encontraron que el medio de contraste Omnitrast® producía una interferencia dando lugar a un pico en la región α-2 del electroferograma. Estudiaron 12 agentes radioopacos yodados, entre ellos el Iomeron® y vieron que todos producían un pico en la EFC. Sin embargo, no se observaron bandas al realizar la EF en gel de agarosa. Concluyeron que si se hubiese de realizar una EFC, las muestras de sangre no deberían ser recolectadas en pacientes que recibieran los medios de contraste durante los últimos 2–6 días8. Este período de tiempo coincide con lo descrito por Bossuyt y et al11.
Blessum et al. realizaron un estudio acerca de la eliminación de interferencias por contrastes yodados en la EFC12. A 2 pacientes les fue inyectado meglumina ioxitalamato de sodio intravenoso, contraste que absorbe a 214nm, y una vez procesadas las muestras, por EFC, observaron un pico en la región α-2 del electroferograma, lo que daba lugar a confusión respecto a la existencia de un CM. Para corroborar que se trataba de una interferencia procedieron a la desalinización de las muestras mediante columnas de intercambio iónico. Realizaron una nueva EF y observaron que el pico desaparecía, confirmando la ausencia de un supuesto CM (según los autores, el hecho de eliminar, por desalinización, la sustancia que producía la interferencia en la EFC, permitió concluir que la sustancia en cuestión era de bajo peso molecular y no podía tratarse de una paraproteína).
El estudio in vitro demostró que en la solución A el Iomeron® absorbía fuertemente a la longitud de onda 200nm produciendo una imagen (fig. 1) prácticamente idéntica a la de una proteína monoclonal, concretamente en la zona β de la EFC; esta interferencia dejó de observarse a una concentración de 0,33g/100ml de Iomeron® en el pool de sueros (fig. 3). El pico de la solución A fue idéntico al del caso índice (fig. 2) que hizo sospechar de la existencia de una interferencia producida por el Iomeron®. Nótese que la intensidad del pico es incluso superior a la de la albúmina. Ante estas observaciones se concluyó que había una relación directamente proporcional entre la concentración de contraste y la magnitud del pico observado en la EFC. De manera que, al disminuir la concentración de Iomeron® disminuía también la magnitud del pico.
En el estudio in vivo el análisis de muestras seriadas de la paciente reveló la progresiva disminución del pico en la fracción β de la EFC hasta su desaparición a las 8h postadministración del contraste. Estos resultados están en concordancia con lo que describía Eisai Co en13, que afirmaban que, a las 8h de haber administrado el contraste la concentración del mismo en sangre era alrededor del 5% del total administrado.
Cabe destacar que la cantidad de contraste administrado al caso índice detectado debía de ser muy elevada con respecto a la cantidad administrada a esta única paciente dadas las características (intensidad) del pico detectado (40,0% caso índice frente a 6,1% en la paciente incluida). También es posible, y más probable, que la gran diferencia en el porcentaje de la banda interferente se debiera a que la muestra se obtuviese directamente de la misma vía utilizada para la inyección del contraste, mientras que para la paciente reclutada la muestra de sangre se obtuvo de una vía venosa periférica.
Se concluye que los picos observados en los proteinogramas correspondían a una interferencia producida por el Iomeron® en la fracción β de la EFC, no observada en la EF en gel de agarosa. El motivo por el que el Iomeron® produce un pico en la EFC, y no en el carril de la IF con fijador, puede atribuirse seguramente a que el Iomeron® absorbe a la longitud de onda 200nm pero no presenta afinidad por el colorante utilizado en el gel de agarosa.
Para un paciente dado, el análisis de las muestras de sangre obtenidas de manera seriada a lo largo del período de estudio también ha de revelar la progresiva desaparición de la interferencia causada por el contraste. Por otra parte, resultaría de interés el hecho de conocer si un deterioro de la función renal (creatinina elevada con filtrado glomerular disminuido) prolonga la semivida del contraste in vivo y por lo tanto, al mantenerse más tiempo en circulación, la interferencia persiste durante un período de tiempo mayor del esperado.
La bibliografía consultada acerca de la cinética de eliminación no es homogénea; hay quien recomienda esperar más de 2–6 días8,11 para realizar la EF, y quien ha observado que a las 8h queda alrededor de un 5%13 de contraste yodado administrado.
Vermeersch y et al14 publicaron un trabajo en el que se relacionaba la pseudoparaproteinemia con la administración de iomeprol después de una angiocardiografía. La EFC mostró un pico sospechoso en la fracción β pero la IF no pudo demostrar la existencia de una proteína monoclonal. Además, los autores evaluaron in vivo la interferencia causada por el iomeprol en 2 pacientes, con función renal normal, que se sometieron a angiocardiografía. Después de 24h, no pudieron observar ninguna interferencia residual en ningún paciente. Podría esperarse, sin embargo, que la interferencia persistiese durante más de 24h en pacientes con disfunción renal, porque el iomeprol se elimina por los riñones.
Los resultados obtenidos con la única paciente estudiada están muy en concordancia con lo que exponían estos autores.
A pesar de que no se haya podido completar el estudio con más pacientes y con distintos grados de la función renal, se puede, seguramente, recomendar que no procede solicitar un estudio de proteínas plasmáticas a aquellos pacientes sometidos a coronariografías (y por extensión, a otras exploraciones análogas) con Iomeron® hasta transcurridas 8h después de haberlo administrado al paciente, en el caso de que su función renal sea normal. Ante disminuciones de funcionalismo renal, no debería solicitarse el citado estudio hasta transcurrido un período de tiempo superior. El diseño de esta estrategia de estudio por parte del laboratorio aporta una serie de ventajas, tanto para los pacientes, como para el propio laboratorio. Así, los pacientes se ahorran extracciones de sangre que no redundarán en ningún informe concluyente respecto a la EF, y simultáneamente el laboratorio optimiza la gestión de sus recursos.
Agradecemos la colaboración de Marià Cortés Rius y la asistencia técnica de Purificación Giner Ruiz, María Ángeles Ramos Avilés y Josep Torres Nicolau.
Este trabajo corresponde a una comunicación científica presentada y premiada en el III Congreso Nacional del Laboratorio Clínico celebrado en Valencia del 14 al 16 de octubre de 2009.