Las enfermedades de depósito lisosomal son errores congénitos del metabolismo originados por la deficiencia hereditaria de hidrolasas lisosomales, causando un acúmulo progresivo de moléculas complejas que no pueden degradarse. El diagnóstico definitivo de estas patologías consiste en la determinación de la actividad enzimática específica en leucocitos, fibroblastos u otros tipos celulares, además del diagnóstico molecular. Estos métodos son complejos y presentan incomodidades para los pacientes. En los últimos años, la determinación de la actividad enzimática en muestras de sangre seca recogida sobre papel ha facilitado enormemente tanto la toma de muestras, su envío a los centros de referencia, así como la manipulación de las mismas.
En este trabajo, presentamos la determinación de la actividad enzimática β-galactosidasa en muestras de sangre seca recogida sobre papel, como un parámetro de gran utilidad que nos asegura la estabilidad de la muestra remitida a los laboratorios para el diagnóstico de cualquier tipo de enfermedad lisosomal.
The lysosomal storage diseases are inborn errors of the metabolism originated by the hereditary deficiency of lysosomal hydrolases, which cause a progressive accumulation of complex molecules that cannot be degraded. Besides the molecular diagnosis, the definitive diagnosis of these pathologies consists of the determination of specific enzymatic activities in leukocytes, fibroblasts or other types of cells. These methods are complex and may be inconvenient for the patients. In the last few years, the determination of enzymatic activity in dried blood specimen (DBS) has facilitated sampling, their shipment to the reference laboratories, as well as their manipulation.
In this work, we present the determination of the enzymatic β-galactosidase activity in DBS as a very useful parameter to ensure the stability of the sample sent to the laboratories for the diagnosis of any lysosomal disease.
Las enfermedades de depósito lisosomal constituyen un grupo de alteraciones hereditarias severas con un amplio espectro de manifestaciones clínicas que se originan por el acúmulo de sustancias específicas en diferentes tejidos del organismo1. Se trata de una serie de trastornos incluidos dentro del grupo de las enfermedades raras que, poco a poco, a medida que se avanza en su conocimiento, van cobrando protagonismo en la comunidad científica.
En general son enfermedades cuyo cuadro clínico y sintomatológico viene determinado por la distribución y acúmulo de estas moléculas no degradadas en diversos tejidos puesto que, a pesar de que las enzimas afectas se hallan presentes en prácticamente todas las células, el acúmulo se produce solamente en aquellos órganos de la economía corporal en los que el sustrato está presente. Consiste siempre en un proceso crónico con una velocidad de progresión inversamente proporcional a la actividad enzimática residual que presente la enzima deficiente en cada caso2.
La prevalencia global de estas enfermedades no se conoce con exactitud, pero de forma general la incidencia de cada una de ellas por separado es siempre baja. Podemos citar como ejemplos la enfermedad de Gaucher con una prevalencia de 1/50.000 recién nacidos vivos o 1/250.000 para la enfermedad de Morquio B3.
Hay que tener en cuenta que algunas de estas patologías son más frecuentes en determinadas poblaciones como el caso de la enfermedad de Gaucher y la enfermedad de Tay Sachs en los judíos Ashkenazi (incidencia 1/6.000 y 1/2.500 respectivamente) o la aspartilglucosaminuria y la enfermedad Salla en poblaciones concretas de Finlandia (frecuencia estimada de portadores alrededor de 1/40 para ambas enfermedades)4.
En España, la incidencia sigue las mismas líneas de prevalencia general de estas enfermedades que en el resto de países, siendo aún relativamente pocos los clínicos que en la actualidad están especializados en el diagnóstico y seguimiento de estos trastornos.
El diagnóstico de estas enfermedades se basa en la determinación de las diferentes actividades enzimáticas responsables en células, tejidos y fluidos corporales. Estas técnicas suponen el uso de métodos invasivos en la toma de muestras, dificultades para el envío a los laboratorios especializados, así como métodos complejos para el análisis y procesamiento de dichas muestras.
En los últimos años, es posible determinar estas actividades enzimáticas en muestras de sangre seca recogida sobre papel (DBS)5. El desarrollo de esta técnica, introducida por Chamoles et al en 2001, ha supuesto un importante avance en el diagnóstico de estas enfermedades6.
Una de estas enzimas es la β-galactosidasa ácida (β-D-galactohidrolasa, EC 3.2.1.23; β-Gal), una hidrolasa lisosomal codificada por un gen localizado en el locus 3p21.33. La deficiencia genética de la β-Gal es la responsable del desarrollo de dos enfermedades autosómicas recesivas: GM1-gangliosidosis y la enfermedad de Morquio B (también denominada mucopolisacaridosis MPS IV-B)7,8.
La actividad β-Gal determinada en este tipo de muestras (DBS) tiene igualmente la utilidad de servir como control de calidad de la misma9, debiendo analizarse simultáneamente en todas aquellas situaciones en las que se lleve a cabo la medición de cualquier actividad enzimática para el diagnóstico de este tipo de enfermedades.
Material y métodosSe han utilizado 30 muestras de sangre seca recogida sobre papel Schleicher and Schuell, 903 remitidas a nuestro laboratorio para el diagnóstico de diferentes enfermedades lisosomales.
Los compuestos químicos utilizados en la determinación fueron: 4-methylumbelliferyl-β-D-galactoside, 4-methylumbelliferone y ethylenediamine dihydrochloride proporcionados por Sigma-Aldrich. Ácido cítrico, fosfato dibásico de sodio y cloruro sódico procedentes de Merck Darmstadt.
La determinación de la actividad enzimática se llevó a cabo de modo similar al descrito por Chamoles et al6. Se utilizaron discos de 3mm de diámetro obtenidos mediante el empleo de un puncher manual Punchline (McGill Inc.) Todas las medidas se realizaron por duplicado en placas microtiter Greiner bio-one, que se colocaron sobre un agitador orbital termostatizado Heidolph 1.000 con humedad regulada a 1.000 r.p.m. durante 3 horas.
El ensayo consistió en colocar en cada pocillo: 1 disco de 3mm de DBS, 20μl de solución de sustrato 4-methylumbelliferyl-β-D-galactoside 0,8mM, 40μl de tampón citrato-fosfato 0,1M pH 4,4.
La reacción analítica finalizó tras la incubación mediante la adición de 300μl de una solución de ethylenediamine dihydrochloride 0,13M pH 11,3.
Para cada muestra se utilizó un blanco procesado del mismo modo, pero en el que la solución de sustrato (4-methylumbelliferyl-β-D-galactoside 0,8mM) se añadió tras parar la reacción con la solución de ethylenediamine dihydrochloride 0,13M pH 11,3.
La lectura se llevó a cabo en un espectrofluorímetro para microplacas Beckman Coulter DTX 880 (360nm de excitación y 450nm de emisión), y los resultados se interpolaron en una curva de calibración construida con diferentes soluciones de 4-methylumbeliferone.
Los resultados se expresaron en μmol/l/hora, considerándose como normales los valores incluidos en el rango de 10 a 40μmol/l/hora.
Como control de calidad de la determinación analítica se analizaron simultáneamente diferentes controles de calidad (High, Medium y Low-Control) de muestras de DBS suministrados por el CDC de Atlanta.
Las diferentes muestras de DBS se procesaron del siguiente modo:
- –
La primera determinación se realizó en las primeras 24 horas de la llegada de la muestra al laboratorio.
- –
La segunda determinación se llevó a cabo a los 7 días, habiéndose mantenido la muestra a temperatura ambiente (20-25°) resguardada de la luz y la humedad.
- –
La tercera determinación se realizó a los 14 días, manteniendo la muestra en las mismas condiciones descritas anteriormente.
Asimismo, y con objeto de calcular los coeficientes de variación intra e interensayo se llevaron a cabo por triplicado, determinaciones en discos procedentes de 5 de las muestras analizadas (que se habían mantenido a 4°C desde su llegada al laboratorio protegidas de la humedad) durante tres días seguidos con el mismo protocolo antes enunciado.
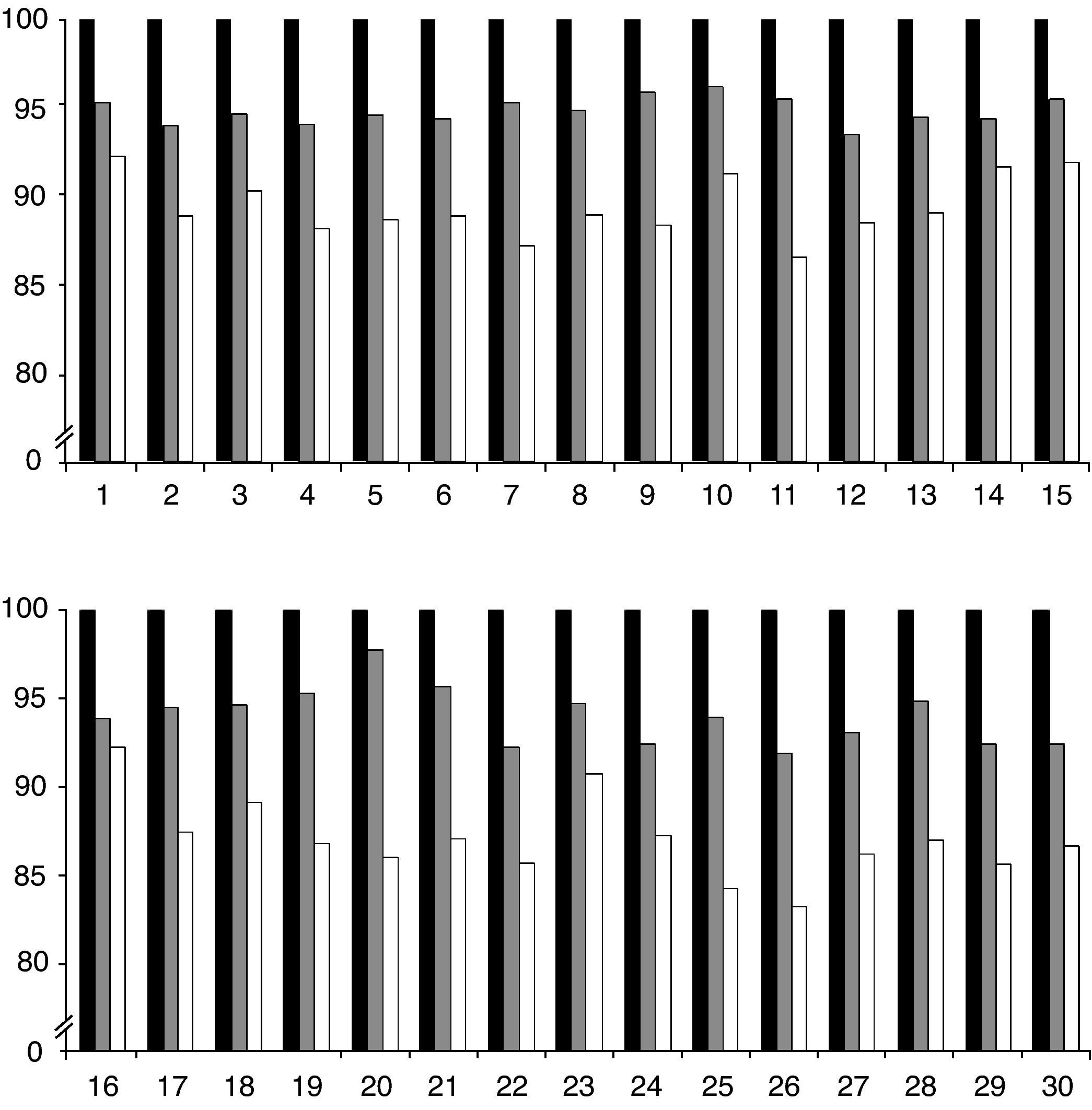
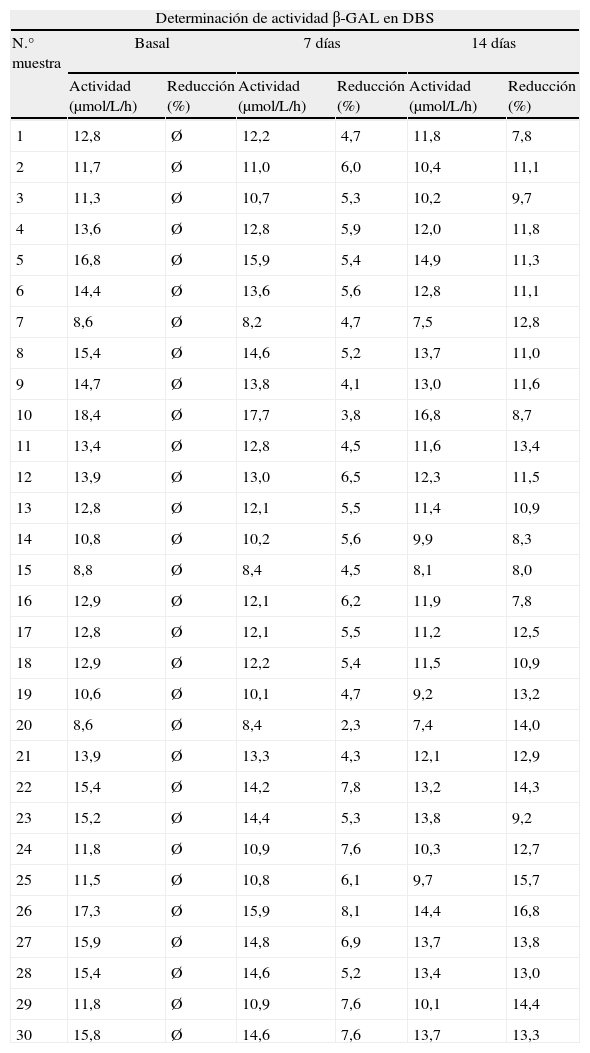
ResultadosLos resultados de las 30 muestras analizadas en las diferentes condiciones, con las consiguientes pérdidas de actividad se muestran en la tabla 1 y de modo más gráfico en la figura 1.
Actividad β-galactosidasa obtenida en el análisis de las 30 muestras estudiadas. Se muestra además el porcentaje de reducción de esta actividad que experimentaron las muestras tras 7 y 14 días mantenidas a temperatura ambiente (20-25°C) resguardadas de la luz y la humedad. Se indica también el valor medio de esta reducción
| Determinación de actividad β-GAL en DBS | ||||||
| N.° muestra | Basal | 7 días | 14 días | |||
| Actividad (μmol/L/h) | Reducción (%) | Actividad (μmol/L/h) | Reducción (%) | Actividad (μmol/L/h) | Reducción (%) | |
| 1 | 12,8 | Ø | 12,2 | 4,7 | 11,8 | 7,8 |
| 2 | 11,7 | Ø | 11,0 | 6,0 | 10,4 | 11,1 |
| 3 | 11,3 | Ø | 10,7 | 5,3 | 10,2 | 9,7 |
| 4 | 13,6 | Ø | 12,8 | 5,9 | 12,0 | 11,8 |
| 5 | 16,8 | Ø | 15,9 | 5,4 | 14,9 | 11,3 |
| 6 | 14,4 | Ø | 13,6 | 5,6 | 12,8 | 11,1 |
| 7 | 8,6 | Ø | 8,2 | 4,7 | 7,5 | 12,8 |
| 8 | 15,4 | Ø | 14,6 | 5,2 | 13,7 | 11,0 |
| 9 | 14,7 | Ø | 13,8 | 4,1 | 13,0 | 11,6 |
| 10 | 18,4 | Ø | 17,7 | 3,8 | 16,8 | 8,7 |
| 11 | 13,4 | Ø | 12,8 | 4,5 | 11,6 | 13,4 |
| 12 | 13,9 | Ø | 13,0 | 6,5 | 12,3 | 11,5 |
| 13 | 12,8 | Ø | 12,1 | 5,5 | 11,4 | 10,9 |
| 14 | 10,8 | Ø | 10,2 | 5,6 | 9,9 | 8,3 |
| 15 | 8,8 | Ø | 8,4 | 4,5 | 8,1 | 8,0 |
| 16 | 12,9 | Ø | 12,1 | 6,2 | 11,9 | 7,8 |
| 17 | 12,8 | Ø | 12,1 | 5,5 | 11,2 | 12,5 |
| 18 | 12,9 | Ø | 12,2 | 5,4 | 11,5 | 10,9 |
| 19 | 10,6 | Ø | 10,1 | 4,7 | 9,2 | 13,2 |
| 20 | 8,6 | Ø | 8,4 | 2,3 | 7,4 | 14,0 |
| 21 | 13,9 | Ø | 13,3 | 4,3 | 12,1 | 12,9 |
| 22 | 15,4 | Ø | 14,2 | 7,8 | 13,2 | 14,3 |
| 23 | 15,2 | Ø | 14,4 | 5,3 | 13,8 | 9,2 |
| 24 | 11,8 | Ø | 10,9 | 7,6 | 10,3 | 12,7 |
| 25 | 11,5 | Ø | 10,8 | 6,1 | 9,7 | 15,7 |
| 26 | 17,3 | Ø | 15,9 | 8,1 | 14,4 | 16,8 |
| 27 | 15,9 | Ø | 14,8 | 6,9 | 13,7 | 13,8 |
| 28 | 15,4 | Ø | 14,6 | 5,2 | 13,4 | 13,0 |
| 29 | 11,8 | Ø | 10,9 | 7,6 | 10,1 | 14,4 |
| 30 | 15,8 | Ø | 14,6 | 7,6 | 13,7 | 13,3 |
Valor medio de reducción tras 7 días: 5,59%.
Valor medio de reducción tras 14 días: 11,79%.
Porcentaje de reducción de la actividad β-galactosidasa de las muestras durante su almacenamiento.
Los gráficos representan la reducción de actividad enzimática que experimentaron las muestras a los 7 y 14 días de almacenamiento a temperatura ambiente (20-25°C) resguardadas de la luz y la humedad. En negro se representa la actividad basal (100%) y en gris y blanco el porcentaje de actividad residual que permanece presente a los 7 y 14 días de almacenamiento respectivamente.
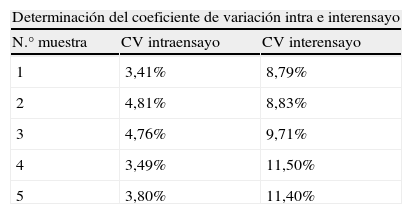
En la tabla 2 se expresan los coeficientes de variación intra e interensayo obtenidos.
Cálculo de los coeficientes de variación intra e interensayo a partir de la variabilidad de los resultados obtenidos en 5 muestras. Para el CV intraensayo se realizó el análisis de cada una de las 5 muestras por triplicado y para el CV interensayo se analizaron las 5 muestras en 3 días consecutivos estudiándose en cada caso la variabilidad de los resultados
| Determinación del coeficiente de variación intra e interensayo | ||
| N.° muestra | CV intraensayo | CV interensayo |
| 1 | 3,41% | 8,79% |
| 2 | 4,81% | 8,83% |
| 3 | 4,76% | 9,71% |
| 4 | 3,49% | 11,50% |
| 5 | 3,80% | 11,40% |
Valor medio del CV intraensayo: 4,05%.
Valor medio del CV interensayo: 10,05%.
Los resultados obtenidos son indicativos de que se trataba de 27 muestras recogidas en condiciones adecuadas (sus valores se encontraban dentro del rango de normalidad para esta enzima), y tres de ellas (números: 7, 15 y 20) o bien eran muestras no idóneas o se trataba de pacientes que presentaban leucopenia.
La actividad enzimática en las muestras de sangre seca recogida sobre papel proviene fundamentalmente los leucocitos existentes en ella (del orden de 20.000 en los 3,2μl de sangre existente en el disco de 3mm en pacientes con un valor hematocrito normal), así como el plasma embebido en el papel fruto de la lisis leucocitaria.
En estos casos, y una vez comprobado que no se trata de pacientes con GM1-gangliosidosis ni con enfermedad de Morquio B, es protocolario pedir una nueva muestra para repetir la determinación analítica o bien pasar directamente a realizar la determinación intraleucocitaria.
Con respecto a las variaciones observadas en los valores de actividad enzimática con el paso del tiempo, observamos que se produce una pérdida de actividad media del 5,59% a los 7 días y del 11,79% a los 14 días respectivamente. Estos datos son concordantes con estudios pilotos realizados en otros centros de seguimiento del control de calidad en enfermedades lisosomales existentes en Europa10.
En relación a los coeficientes de variación intra e interensayo, obtuvimos valores similares a los publicados en un estudio piloto realizado en varios laboratorios11, inferiores al 5% (4,05%) en el primer caso y cercanos al 10% (10,05%) en el segundo. Estos datos son aceptables para el uso de esta técnica con el propósito que se persigue.
Así pues hemos de concluir, que la actividad β-galactosidasa en sangre seca recogida sobre papel es un indicador del estado de la muestra reforzando el valor diagnóstico de la determinación enzimática específica para la deficiencia buscada. Este hecho, no obstante, debe confirmarse con posterioridad mediante la determinación de la citada actividad en leucocitos u otro tipo celular adecuado, que constituye el método «gold standard» para estas determinaciones.